L’échocardiographie est particulièrement utile pour mettre en évidence les principales complications de l’infarctus : dysfonction ventriculaire systolique et diastolique, insuffisance mitrale, anévrysme, rupture de paroi, tamponnade. Leur diagnostic précoce est capital car seul un traitement agressif permet de diminuer leur mortalité très élevée (> 50%). L’insuffisance ventriculaire gauche et la régurgitation mitrale sont des prédicteurs indépendants de la survie après infarctus [10].
Insuffisance mitrale ischémique
La présence d’une insuffisance mitrale (IM) modérée ou sévère sans lésion significative des feuillets aggrave significativement le pronostic de l’infarctus parce qu’elle traduit une atteinte majeure du ventricule gauche [5]. En effet, la dilatation du VG ou l’akinésie d’une paroi exercent une traction sur les cordages qui empêche les feuillets mitraux de rejoindre leur point de coaptation en systole et les maintient en dessous du plan de l’anneau mitral ; cette retenue au déplacement systolique des feuillets est la cause d’une IM restrictive, dont l’importance est définie par la surface contenue entre les feuillets et le plan de l’anneau (tenting area) (Vidéo et Figure 9.20).
Vidéo: Insuffisance mitrale restrictive modérée avec un jet central, liée à la dilatation du VG; le point de coaptation des feuillets est situé en-dessous du plan de l'anneau mitral.
Vidéo: Insuffisance mitrale restrictive modérée avec un jet central, liée à la dilatation du VG; le point de coaptation des feuillets est situé en-dessous du plan de l'anneau mitral.
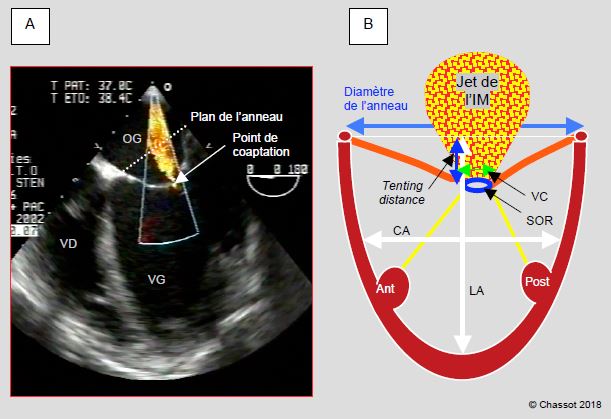
Figure 9.20 : Insuffisance mitrale (IM) restrictive d’origine ischémique. A : vue 4-cavités d’une IM d’importance II/IV chez un patient souffrant d’ischémie coronarienne et d’une dilatation importante du VG (FE = 0.25). En systole, les feuillets sont retenus en dessous du plan de coaptation par la dilatation du ventricule, ce qui empêche la valve d’être étanche. B : l’importance de l’IM est définie par le diamètre du jet à son origine (vena contracta VC) et par la surface de l’orifice de régurgitation (SOR). La distance entre le point de coaptation et le plan de l’anneau mitral (double flèche bleue) est la tenting distance ; la surface triangulaire comprise entre les feuillets et le plan de l’anneau est la tenting area. Le degré de sphéricité du VG est défini par le rapport entre le court axe (CA), ou diamètre transverse, et le long axe (LA) du VG ; normalement, le court axe est inférieur à la moitié du long axe ; la dilatation du VG se traduit par un rapport > 0.7. Lorsqu’il se dilate, le VG devient plus sphérique et la restriction aux mouvements de la mitrale augmente, donc l’IM s’aggrave.
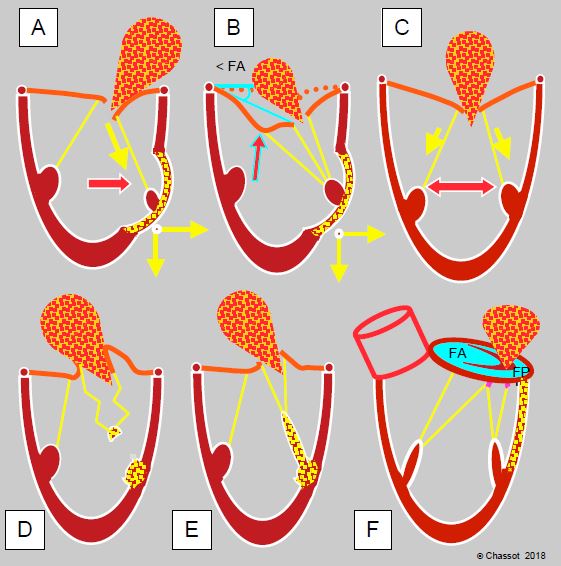
Figure 9.21 : Insuffisance mitrale ischémique. L’IM peut être de type IIIb restrictif (A, B et C), de type II prolapsus (D et E) ou de type I fonctionnel (F). A : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur et vers l’apex en systole ; le feuillet correspondant est restrictif ; l’IM est excentrique. B : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur avec une traction excessive sur les codages de 2ème ordre ; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. C : cardiomyopathie ischémique avec dilatation homogène du VG ; l’IM restrictive est centrale. D : la rupture complète d’un pilier provoque un bascule total de la commissure dans l’OG en systole ; on voit un morceau du pilier rompu oscillant au bout des cordages. E : ischémie d’un pilier occasionnant un prolapsus de la commissure correspondante parce que le pilier s’allonge au lieu de se contracter en systole. F : ischémie basale causant une dilatation postérieure de l’anneau mitral
L’IM ischémique, qui est traitée plus en détail dans le Chapitre 26 (IM ischémique), peut avoir plusieurs origines (Figure 9.21 ci-dessus).
- Restriction symétrique sur cardiomyopathie dilatative d'origine ischémique (IM restritive type IIIb) avec dilatation importante du VG.
- Restriction asymétrique de la course systolique des feuillets (IM restritive type IIIb) sur akinésie ou dyskinésie segmentaire de la paroi ventriculaire, entraînant un déplacement latéral et/ou apical d'un muscle papillaire. Une restriction du feuillet postérieur est plutôt liée à un infarctus inférieur. Ne se contractant pas en systole, cette paroi tire sur les cordages correspondants et maintient un feuillet sur le versant ventriculaire ; ce mécanisme occasionne une IM plus ou moins excentrique par restriction d’un feuillet (Vidéo) [2].
Vidéo: Insuffisance mitrale majeure sur akinésie antérieure et excès de postcharge en vue mi-oesophagienne 2-cavités 90°.
- Ischémie d’un muscle papillaire (MP) ; un muscle non-contractile tend à s’allonger en systole ; si elle est associée à une akinésie de la paroi correspondante, l’ischémie d’un MP donne davantage de course aux cordages et tend à réduire la restriction au mouvement des feuillets et l’importance de l’IM [7]. Si la paroi se contracte normalement, l’ischémie d’un MP occasionne le basculement d’une commissure mitrale dans l’OG et une fuite mitrale excentrique (Vidéos et Figure 9.22) [6].
Vidéo: Insuffisance mitrale excentrique majeure due à un prolapsus du feuillet postérieur sur maladie dégénérative de la valve (vue mi-oesophagienne 4-cavités 0°); le jet de l'IM est dirigé vers le septum interauriculaire.
Vidéo: Insuffisance mitrale excentrique majeure sur prolapsus de la commissure antérieure de la valve due à une ischémie papillaire.; le jet de l'IM est dirigé vers la paroi postéro-latérale de l'OG.
- Rupture partielle ou complète d’un muscle papillaire ; la commissure mitrale correspondante bascule dans l’OG ; un morceau de muscle papillaire oscille librement dans le ventricule ou entre le VG et l’OG au cours du cycle cardiaque (Vidéo et Figure 9.23).
Vidéo: rupture totale du muscle papillaire antérieur; un fragment de ce dernier fait des va-et-vient entre le VG et l'OG.
- Dilatation de l’anneau mitral ; lors de dilatation du VG ou d’infarctus basal, l’anneau mitral s’agrandit ; les feuillets sont normaux mais ne peuvent pas se rejoindre en systole. L’IM est proportionnelle au degré de dysfonction ventriculaire et à celui de la postcharge [3].
- Déplacement systolique antérieur de la valve mitrale ; l’hyperdynamisme compensatoire de la paroi postérieure lors d’un infarctus antérieur et/ou latéral amène celle-ci trop à l’intérieur du VG en systole, ce qui translate le point de coaptation de la valve mitrale en avant en direction de la chambre de chasse du VG ; le long feuillet antérieur peut alors être aspiré dans la CCVG par effet Venturi au cours de l’éjection (SAM : systolic anterior motion) (SAM). Il en résulte une IM méso-télésystolique (Vidéo et Figure 11.56).
Vidéo: subobstruction de la chambre de chasse et réouverture de la valve mitrale en mésosystole dues au déplacement du feuillet mitral antérieur (SAM, systolic anterior motion).
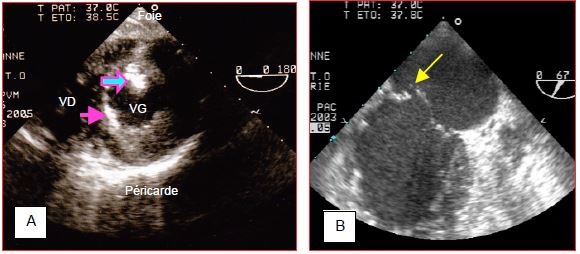
Figure 9.22 : Ischémie papillaire. A: Embolisation d’air dans le muscle papillaire postérieur (territoire de la CD) après chirurgie cardiaque (grande flèche). On voit également une accumulation d’air intraventriculaire dans les trabéculations de la région antéro-septale (petite flèche). L’air apparaît comme un granulé très brillant. Cette embolisation cause une ischémie du muscle papillaire, qui provoque une bascule de la commissure postérieure et une fuite mitrale. B : exemple de bascule dans l'OG de la commissure postérieure, due dans ce cas à une rupture partielle du muscle papillaire postérieur (vue bicommissurale 60°).
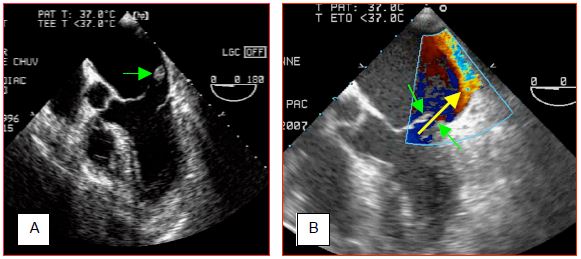
Figure 9.23 : Rupture de muscle papillaire. A : rupture totale. On aperçoit un fragment de pilier à l’extrémité de cordages, flottant dans l’OG en systole et dans le VG en diastole. L’orifice de régurgitation est si grand et la dysfonction du VG si profonde que la Vmax de l’IM est basse (1-2 m/s) ; le flux Doppler couleur est laminaire en diastole et en systole, seule sa couleur change. B : rupture partielle du muscle papillaire antérieur ; la commissure antérieure est basculée dans l’OG en systole (flèches vertes) et provoque une fuite mitrale excentrique (flèche jaune et tourbillon contre la paroi latérale de l'OG).
Dans les IM aiguës, l’OG est en général normale et peu compliante ; de ce fait, le reflux systolique dans les veines pulmonaires est bien visible au Doppler pulsé (voir Figure 26.20). Lorsqu’elle est très excentrique, la régurgitation peut être dirigée vers les veines pulmonaires d’un seul côté et donner lieu à un oedème pulmonaire unilatéral.
La découverte par l’anesthésiste échocardiographeur d'une IM modérée-à-sévère ou sévère en cours de pontages aorto-coronariens pose un difficile problème d'indication opératoire, parce que l'intervention valvulaire augmente de 3-5 fois la mortalité des PAC, qui peut alors s'élever jusqu'à 15% dans les mauvais cas. Son analyse des images ETO est cruciale pour la décision opératoire [4]. Les recommandations actuelles pour la chirurgie mitrale d'accompagnement lors de revascularisation coronarienne sont plutôt restrictives (voir Chapitre 11, IM secondaire ischémique) [1,8,9].
- IM secondaire ischémique modérée ou modérée-à-sévère: bénéfice incertain, en général pas d'indication opératoire.
- IM secondaire ischémique sévère et symptomatique: indication selon la situation.
- Indication de classe IIa si la plastie est aisée, la FE > 30%, le risque opératoire faible et la survie à long terme du malade hautement probable.
- Indication de classe IIa si l'IM se péjore au test d'effort; une réduction de l'IM sous dobutamine signe au contraire une réserve contractile du VG qui incite à une revascularisation seule, sans intervention mitrale d'accompagnement.
- IM sévère sur rupture d'un muscle papillaire: indication à une réparation en urgence (le plus souvent remplacement valvulaire par une prothèse).
La détermination du degré d'IM ischémique en peropératoire doit tenir compte de trois facteurs importants.
- L'IM ischémique est un phénomène très dynamique qui se modifie en fonction de la postcharge, de la taille et de la contractilité du VG.
- L'anesthésie et la ventilation en pression positive altèrent les conditions de charge et diminuent l'importance de l'IM; il faut rétablir une hémodynamique normale (PAM ≥ 80 mmHg), au besoin avec des vasopresseurs, avant de porter un jugement quantitatif.
- L'échelle de quantification de l'IM ischémique est plus restrictive que celle de l'IM organique (Tableau 11.10); l'IM ischémique est considérée comme sévère si le diamètre de la vena contracta est ≥ 40 mm (au lieu de 70 mm pour l'IM organique), si la surface de l'orifice de régurgitation est ≥ 20 mm2 (au lieu de 40 mm2) et si le volume régurgité est ≥ 30 mL (au lieu de 60 mL) [6,11].
La situation est différente si l'IM concomitante à des pontages aorto-coronariens (PAC) est de nature structurelle (IM primaire) et non secondaire à l'ischémie. Lors d'IM sévère sur pathologie des feuillets (dégénérescence, RAA, etc), la plastie ou le remplacement mitral est indiqué selon les critères habituels de la maladie mitrale. Dans ces conditions, la combinaison PAC + PVM ou RVM a une mortalité opératoire voisine de la somme de celle de chacune des deux opérations électives.
Ruptures myocardiques
Les ruptures de structures myocardiques (paroi libre, septum interventriculaire, muscle papillaire) sont dues à l’obstruction aiguë d’un vaisseau terminal non collatéralisé. Elles surviennent typiquement dans les premiers jours qui suivent un infarctus inaugural de petite taille chez des malades souffrant en général d’une maladie monotronculaire. Elles se caractérisent par la survenue brutale d’un choc cardiogène accompagnée d’un souffle systolique. Sans traitement chirurgical d’urgence, leur pronostic est catastrophique. Ces lésions sont souvent inféro-postérieures et ne sont pas visibles dans les vues mi-oesophagiennes, en particulier en 4-cavités ; on ne les met en évidence que dans des vues transgastriques, en balayant le coeur de 0° à 120° et en les recherchant en 2D et avec le Doppler couleur.
- Rupture de paroi libre ; elle apparaît souvent par une tamponnade et des caillots péricardiques, plus ou moins cloisonnés ; l’image 2D montre la rupture et le flux couleur met en évidence un va-et-vient systolo-diastolique. La survie n’est possible que si la rupture est cloisonnée par la réaction péricardique (Vidéo et Figure 9.24).
Vidéo: rupture de la paroi inférieure du VG formant une poche cloisonnée dans le péricarde (même cas que dans la Figure 9.24).
- Pseudo-anévrysme ; rupture de paroi partielle sous forme d’une poche contenue par l’épicarde ; plus fréquent dans la paroi postérieure, son collet est en général étroit (voir ci-dessous). Le pseudo-anévrysme contient du contraste spontané mis en mouvement en systole et fréquemment des thrombi muraux.
- Communication interventriculaire (CIV) ; due à une obstruction de la CD, elle apparaît sur la partie postérieure du septum et n’est visible qu’en vue transgastrique 0°; due à une lésion de l’IVA, elle apparaît dans la partie moyenne et antérieure du septum. Une perforation de part en part est visible en imagerie 2D, mais lorsqu’elle est serpentigineuse à travers les trabéculations, elle n’est mise en évidence qu’au flux couleur (Vidéo et Figure 9.25). Le flux à travers la CIV est systolo-diastolique. La dimension de la zone d’accélération concentrique (PISA) sur le versant gauche est un bon indice de l’importance de la CIV. En alignant l’axe du Doppler continu avec celui du chenal, on peut en mesurer la vélocité maximale (VmaxCIV ≈ 3-4 m/s), donc le gradient de pression entre les deux ventricules (équation de Bernoulli : ΔP = 4 V2) ; en l’absence de lésion aortique, on peut calculer la pression systolique du VD de cette manière : PsystVD = PAsyst - ΔPCIV.
Vidéo: communication interventriculaire située au pied du septum, liée à un infarctus droit (vue court-axe transgastrique); le VD est surchargé et dilaté.
- Rupture de muscle papillaire ; plus fréquente dans le muscle papillaire postéro-médian qui est vascularisé uniquement par la CD que dans le muscle antéro-latéral qui est vascularisé conjointement par l’IVA et la CX. Les ruptures complètes se traduisent par le bascule total d’une commissure et une IM massive non compatible avec la survie, sauf si on l’opère en urgence (voir vidéo ci-dessus Rupture totale muscle papillaire antérieur). A cause de la défaillance ventriculaire et de la grande taille de l’orifice de régurgitation, la Vmax de l’IM est basse (1-3 m/s) ; il n’y a que peu de flux tourbillonnaire au Doppler couleur. On rencontre plus fréquemment des ruptures partielles caractérisées par le bascule systolique dans l’OG de la partie commissurale d’un ou des deux feuillets mitraux, accompagné d’un fragment de pilier qui oscille indépendamment de la paroi dans le VG ; le jet de l’IM est excentrique (Vidéo et Figure 9.23).
Vidéo: Rupture partielle du muscle papillaire postérieur entraînant un basculement de la commissure postérieure dans l'OG en systole (vue bicommissurale 60°); l'OG et le VG sont dilatés.
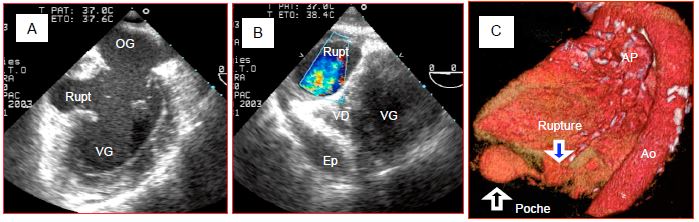
Figure 9.24 : Rupture ventriculaire inférieure. A : orifice de rupture dans la paroi inférieure en vue 2-cavités ; le collet est relativement étroit. B : poche située entre les ventricules et le diaphragme en vue transgastrique court axe du VG (0°) ; elle contient un flux couleur systolique turbulent ; le VD est écrasé par cette poche ; il existe par ailleurs un épanchement péricardique (Ep). C : reconstruction 3D du coeur ; la rupture inférieure du VG débouche dans une poche située sous le coeur, délimitée par des adhérences péricardiques fibreuses dues à une ancienne péricardite.
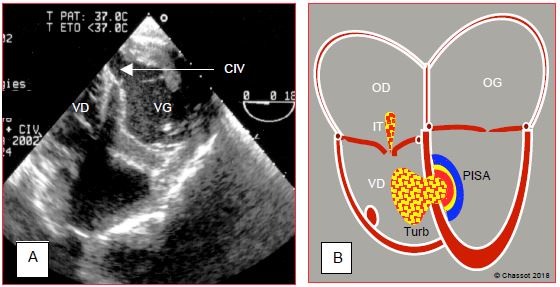
Figure 9.25 : Communication interventriculaire (CIV). A : vue court-axe transgastrique du VG (0°) montrant une CIV postérieure au pied du septum sur occlusion de la coronaire droite. B : schéma du flux Doppler couleur en cas de CIV, avec la zone d’accélération côté ventriculaire gauche (PISA), le flux trans-septal et la zone de turbulence (Turb) au sein du VD ; celle-ci est surtout visible en diastole, car le flux est emporté par l’éjection du VD en systole. Une insuffisance tricuspidienne est fréquente (IT) ; elle ne permet toutefois pas de calculer la PAPsyst parce que la pression systolique du VD est contaminée par celle du VG à travers la CIV.
Anévrysme et thrombus
L’anévrysme est un cas extrême de dyskinésie survenant après un infarctus transmural : le ou les segments non perfusés et cicatriciels sont amincis, inertes, et bombent vers l’extérieur en systole. A l’origine, l’anévrysme est constitué de toute l’épaisseur de la paroi ventriculaire ; son collet est large. Il contient fréquemment un thrombus mural et est à l’origine d’arythmies ventriculaires malignes. Le flux systolique tournoie à l’intérieur. Les deux endroits les plus fréquents sont l’apex du VG et la paroi inféro-basale (Vidéo et Figure 9.26).
Vidéo: anévrysme de la paroi latérale du VG en vue court-axe transgatsrique 0°; le ralentissement du flux intraventriculaire crée un contraste spontané.
Vidéo: anévrysme de la paroi latérale du VG en vue court-axe transgatsrique 0°; le ralentissement du flux intraventriculaire crée un contraste spontané.
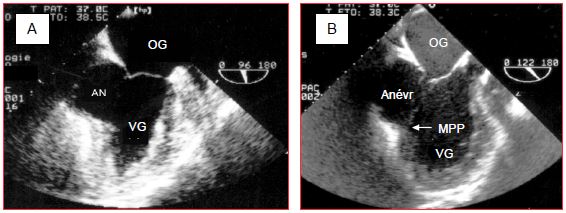
Figure 9.26 : Images d’anévrysme ventriculaire gauche. A : anévrysme postéro-basal (AN) en vue 2-cavités (90°) ; sur cette image, l’occlusion de la valve mitrale est satisfaisante. B : anévrysme postéro-latéral en vue long-axe du VG (120°) ; le collet englobe le pilier postérieur (MPP), la valve mitrale est incompétente.
Le faux-anévrysme représente une rupture pariétale couverte par les couches externes épicardiques. Sa paroi est mine et fragile, son collet étroit; lui aussi contient souvent un thrombus accolé à la paroi. La différence entre les deux entités est anatomo-pathologique, car elles sont difficiles à différencier à l'échocardiographie (Figures 9.27A et 27B).
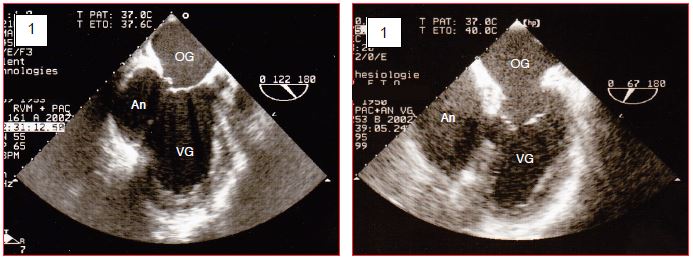
Figure 9.27A : Anévrysme et faux-anévrysme du VG en vues ETO mi-oesophagiennes. A : anévrysme postéro-basal avec un large collet. B : faux-anévrysme postérieur s’étendant vers le haut derrière l’OG ; le collet est étroit.

Figure 9.27B : Différence entre un anévrysme (1, dilatation de toute la paroi ventriculaire) et un pseudo-anévrysme (2, rupture partielle de la paroi avec contention par la couche épicardique). En général, le collet du pseudo-anévrysme est plus étroit et sa paroi plus mince ; il contient fréquemment un thrombus mural.
L’immobilité d’une zone akinétique et un bas débit ventriculaire peuvent créer les conditions pour la formation d’un thrombus mural, que l’on rencontre le plus fréquemment à l’apex du VG (Vidéo).
Vidéo: thrombus à l'apex du VG; l'apex est akinétique.
Un thrombus peut être laminaire et ancré dans les trabéculations, ou arrondi et mobile ; il est en général bien visible en vue mi-oesophagienne 2 cavités 90°, long axe 120° et transgastrique long axe 100-120° (Figure 9.28). Le diagnostic différentiel avec des trabéculations ou un muscle papillaire est parfois difficile : le thrombus est inhomogène, ne se contracte pas et apparaît identique dans plusieurs plans de coupe. Le thrombus laminaire est bien ancré dans les trabéculations et ne présente pas de risque embolique ; un thrombus arrondi et sessile est plus dangereux. Il est habituel de réséquer ce dernier par ventriculotomie en cours d’opération. Une résection n’est pas indiquée lorsque le thrombus est laminaire.
Vidéo: thrombus à l'apex du VG; l'apex est akinétique.
Un thrombus peut être laminaire et ancré dans les trabéculations, ou arrondi et mobile ; il est en général bien visible en vue mi-oesophagienne 2 cavités 90°, long axe 120° et transgastrique long axe 100-120° (Figure 9.28). Le diagnostic différentiel avec des trabéculations ou un muscle papillaire est parfois difficile : le thrombus est inhomogène, ne se contracte pas et apparaît identique dans plusieurs plans de coupe. Le thrombus laminaire est bien ancré dans les trabéculations et ne présente pas de risque embolique ; un thrombus arrondi et sessile est plus dangereux. Il est habituel de réséquer ce dernier par ventriculotomie en cours d’opération. Une résection n’est pas indiquée lorsque le thrombus est laminaire.
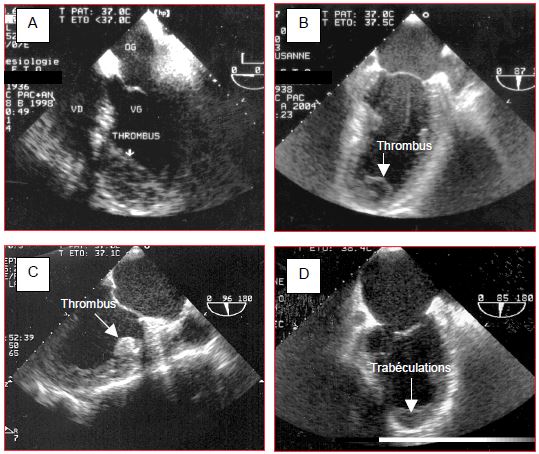
Figure 9.28 : Thrombus intraventriculaire gauche. A : thrombus antéro-apical laminaire en vue 4-cavités. B : thrombus apical mobile en vue 2-cavités (90°). C : thrombus localisé à la base de la paroi antérieure akinétique (vue 2-cavités 90°). D : image tronquée d’un apex normal en vue 2-cavités 90°, montrant simplement des trabéculations coupées tangentiellement. Pour poser le diagnostic de thrombus, il faut que la même image appa-raisse au même endroit dans au moins 2 vues différentes, si possible orthogonales.
| ETO et complications ischémiques |
|
L’échocardiographie est essentielle pour diagnostiquer les principales complications mécaniques de l’ischémie :
- Dysfonction ventriculaire systolique et diastolique
- Insuffisance mitrale
- Rupture pariétale et CIV
- Anévrysme
- Thrombus intracavitaire
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Octobre 2018
Références
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- GORMAN JH III, RYAN LP, GORMAN RC. Pathophysiology of ischemic mitral insufficiency: Does repair make a difference ? Heart Fail Rev 2006; 11:219-29
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GRIGIONI F, ENRIQUEZ-SARANO M, ZEHR KJ, et al. Ischemic mitral regurgitation: Long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation 2001; 103:1759-64
- MAGNE J, SENECHAL M, DUMESNIL JG, PIBAROT P. Ischemic mitral regurgitation: A complex multifaceted disease. Cardiology 2009; 112:244-59
- MESSAS E, GUERRERO JL, HANDSCHUMACHER MD, et al. Paradoxic decrease in ischemic mitral regurgitation with papillary muscle dysfunction. Circulation 2001; 104:1952-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- PICARD MH, DAVIDOFF R, SLEEPER LA, et al, SHOCK Registry Investigators. Echocardiographic predictors of survival and response to early revascularization in cardiogenic shock. Circulation 2003; 107:279-84
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developed in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71ETO des complications de l’ischémie
