La cardiomyopathie restrictive (CMR) est caractérisée par une insuffisance diastolique massive, mais une fonction systolique préservée. L'infiltration du myocarde par du tissu pathologique fibreux, non-contractile et rigide (amyloïdose, sclérodermie, endomyofibrose, lésion postactinique) effondre la compliance ventriculaire, mais altère peu la performance systolique (FE normale). La relaxation et la distensibilité du ventricule sont extrêmement basses ; la pression télédiastolique est élevée et s'accroît brusquement à la moindre augmentation de volume ou de débit. L'affection atteint presque exclusivement le VG. Le pronostic de la maladie est très sombre.
L’imagerie bidimensionnelle de la CMR est peu spécifique, à l’exception de zones granulaires mouchetées de l’amyloïdose ou de l’épaississement fibreux endocardique hyperéchogène de l’endomyofibrose. Le VG est de taille plutôt petite, d’épaisseur et de fonction systolique normales. L’OG est dilatée par l’élévation chronique des pressions de remplissage (> 34 mL/m2). Au flux Doppler, par contre, l’image est caractéristique de la physiologie restrictive (Figure 27.36) [1].
L’imagerie bidimensionnelle de la CMR est peu spécifique, à l’exception de zones granulaires mouchetées de l’amyloïdose ou de l’épaississement fibreux endocardique hyperéchogène de l’endomyofibrose. Le VG est de taille plutôt petite, d’épaisseur et de fonction systolique normales. L’OG est dilatée par l’élévation chronique des pressions de remplissage (> 34 mL/m2). Au flux Doppler, par contre, l’image est caractéristique de la physiologie restrictive (Figure 27.36) [1].
- Phase de relaxation isovolumétrique raccourcie à < 70 ms;
- Vmax E élevée à > 1.5 m/s à cause de la haute pression auriculaire gauche;
- Décélération du flux E très brève (< 120 ms);
- Flux A minime, parce que le VG n’est plus distensible en télédiastole (rapport E/A > 2);
- Composante systolique du flux veineux pulmonaire diminuée (flux de type “sD”);
- Rapport de la durée A/Ar (A antérograde à travers la mitrale / Ar rétrograde dans les VP): la durée de Ar est > 30 msec supérieure à celle de A;
- Vélocité du mouvement diastolique de l’anneau mitral très faible (E' < 5 cm/s) au Doppler tissulaire;
- Rapport E/E' > 15.
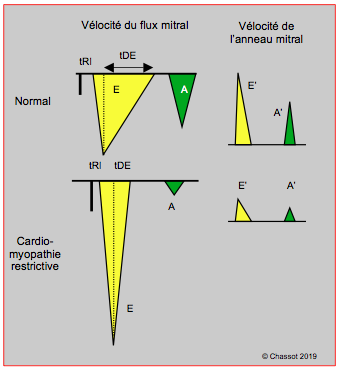
Figure 27.36: Vélocités du flux mitral et du déplacement de l’anneau mitral dans la cardiomyopathie restrictive (insuffisance diastolique majeure), comparées à la situation normale. E : flux mitral protodiastolique. A : flux de la contraction auriculaire. E’ : déplacement protodiastolique de l’anneau mitral au Doppler tissulaire. A’ : déplacement de l’anneau mitral simultané à la contraction auriculaire (Doppler tissulaire). tRI: temps de relaxation isovolumétrique. tDE: temps de décélération du flux E.
Au Doppler tissulaire, le déplacement diastolique de l’anneau mitral, qui reflète la relaxation active longitudinale du VG, montre une diminution de la vélocité protodiastolique E’. Dans la CMR, cette vélocité E’ est abaissée à < 5 cm/s [9]. Normalement, le mouvement E’ précède le flux E, puisqu’il le déclenche ; en cas de défaut de relaxation et de POG élevée, le flux E précède le mouvement E’. Comme E’ quantifie la relaxation alors que le flux E dépend de la relaxation et de la pression auriculaire gauche, le rapport E/E’ permet d’évaluer la POG : plus il augmente, plus cette dernière est élevée. Il est typiquement > 15 dans la CMR (POG > 18 mmHg) [6,7].
Cardiomyopathie restrictive et péricardite constrictive
L'importance du frein au remplissage ventriculaire dans la CMR est l'équivalent de celui que l'on rencontre dans une péricardite constrictive (PC). La présentation clinique de ces deux affections est très voisine, car toutes deux sont des défaillances diastoliques sévères: dyspnée, fatigabilité, hypotension artérielle, stase et oedème pulmonaire. Le diagnostic différentiel à l'échocardiographie est capital, car le comportement hémodynamique et la thérapeutique de ces deux entités sont très différents (Figure 27.37) [3,4,10].
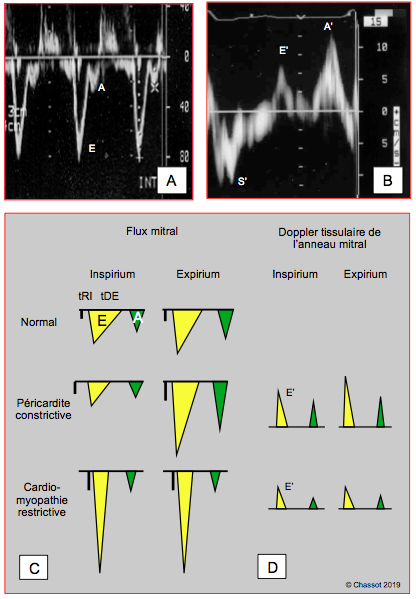
Figure 27.37 : Différentiation de la péricardite constrictive et de la cardiomyopathie restrictive en respiration spontanée à l'échocardiographie transoesophagienne. A : Flux mitral de péricardite constrictive ; E: flux mitral passif protodiastolique, A: flux mitral de la contraction auriculaire. B : Vélocité de l’anneau mitral au Doppler tissulaire en cas de dysfonction diastolique; E’: mouvement protodiastolique, A’: mouvement de la contraction auriculaire, S : mouvement systolique (descente de l’anneau mitral du à la contraction longitudinale du VG). C : Les variations respiratoires très marquées de la péricardite constrictive sont absentes en cas de cardiomyopathie restrictive. tRI: phase de relaxation isovolumétrique (n : 90 ms). tDE: temps de décélération du flux E (n : 160ms). D : La vélocité du mouvement de l’anneau mitral, normal dans la péricardite constrictive (12-15 cm/s), est très faible dans la cardiomyopathie restrictive (< 5 cm/s) et n’a pas de variations respiratoires [9].
- La vélocité du mouvement de l’anneau mitral examiné au Doppler tissulaire est très basse (E’ < 5 cm/s) dans la cardiomyopathie restrictive puisqu’il s’agit d’une maladie de la relaxation diastolique, alors qu’elle est normale dans la péricardite constrictive (E’ > 8 cm/s) où la relaxation est physiologique puisque la maladie concerne le péricarde et non le myocarde [8,9].
- Comme il n'y a pas de valve sur les veines centrales, la contraction auriculaire propulse un petit flux rétrograde (Ar) dans les veines caves et les veines pulmonaires, dont l'importance est proportionnelle à la résistance rencontrée par le flux antérograde (A) remplissant le ventricule. Lorsque ce dernier est rigide (CMR), le flux rétrograde devient proéminent, alors qu'il reste normal dans la PC.
- Comme les cavités cardiaques ne sont pas isolées des variations de pression intrathoracique et que la pression intraventriculaire diastolique est très élevée dans la CMR, la morphologie du flux mitral est peu sensible aux variations de pression endothoracique [5,12]. Au contraire, la PC est caractérisée par une variation respiratoire excessive du flux mitral (> 25%) et du flux tricuspide (> 40%) en respiration spontanée [8].
- L'interdépendance ventriculaire est accentuée dans la péricardite constrictive, car la constriction contraint les deux ventricules à un remplissage alterné au cours de la respiration et la coque fibreuse isole les cavités cardiaques des variations de pression endothoracique; le septum interventriculaire bascule dans le VG en inspirium et dans le VD en expirium. Ce phénomène est absent dans la cardiomyopathie restrictive [2].
- Au CT scan et à l'IRM, l'épaississement péricardique (≥ 4 mm) est bien visible dans la péricardite constrictive; dans la PC d'origine tuberculeuse, on voit fréquemment des calcifications. Le péricarde est normal dans la CMR, mais l'IRM met en évidence des infiltrations intramyocardiques.
- Bien que les deux affections se traduisent par une élévation des pressions de remplissage, la CMR conduit à une dilatation massive de l'OG et/ou de l'OD. La constriction externe par le péricarde prévient ce phénomène dans la PC.
Il n'y a pas de thérapeutique curative pour la cardiomyopathie restrictive en-dehors de la transplantation cardiaque, alors que la péricardectomie résout la situation dans 90% des cas de péricardite constrictive. La réponse hémodynamique à une manoeuvre de Valsalva ou à la ventilation en pression positive est également une manière de différencier les deux affections (voir Péricardite).
Endofibroélastose
L'endofibrose myocardique, ou endofibroélastose, consiste en un envahissement du sous-endocarde par du tissu fibreux et des dépôts calciques qui affecte des millions de personnes dans les régions tropicales de l'Afrique sub-saharienne, de l'Asie et de l'Amérique du Sud [11]. La maladie débute par des épisodes fébriles récurrents accompagnés d'un infiltrat myocardique inflammatoire (endocardite de Loeffler) et d'épanchement péricardique, puis évolue vers la chronicité avec la prolifération de tissu fibreux sous-endocardique qui rétrécit la cavité des deux ventricules et cause une restriction massive; les oreillettes sont dilatées et les thrombus muraux sont fréquents (Figure 27.38).
Endofibroélastose
L'endofibrose myocardique, ou endofibroélastose, consiste en un envahissement du sous-endocarde par du tissu fibreux et des dépôts calciques qui affecte des millions de personnes dans les régions tropicales de l'Afrique sub-saharienne, de l'Asie et de l'Amérique du Sud [11]. La maladie débute par des épisodes fébriles récurrents accompagnés d'un infiltrat myocardique inflammatoire (endocardite de Loeffler) et d'épanchement péricardique, puis évolue vers la chronicité avec la prolifération de tissu fibreux sous-endocardique qui rétrécit la cavité des deux ventricules et cause une restriction massive; les oreillettes sont dilatées et les thrombus muraux sont fréquents (Figure 27.38).
- Epaississement fibreux hyperéchogène sous-endocardique biventriculaire;
- Cavités ventriculaires rétrécies;
- Dilatation bi-auriculaire;
- Thrombus endo-ventriculaire;
- Insuffisance diastolique de type restrictif.
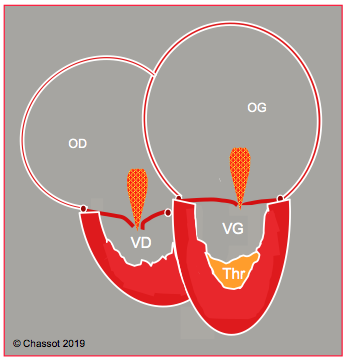
Figure 27.38 : Silhouette des 4 cavités dans l'endofibroélastose. Les 2 ventricules sont massivement épaissis et rigides, les cavités ventriculaires minuscules et les oreillettes dilatées. Lorsque le tissu fibreux envahit l'appareil sous-valvulaire et la jonction auriculo-ventriculaire, l'insuffisance des valves mitrale et tricuspide devient majeure. Un thrombus mural (Thr) est fréquent.
| Cardiomyopathie restrictive |
| Insuffisance diastolique massive du VG, avec élévation des pressions de remplissage (POG > 18 mmHg), mais préservation de la performance systolique. - Vmax E > 1.5 m/s - Rapport E/A > 2 - Relaxation isovolumétrique < 70 ms - Durée de la décélération du flux E < 120 ms - Durée Ar (flux veine pulmonaire) > durée A (flux mitral) - Vmax anneau mitral E' < 5 cm/s - Rapport E/E' > 15 |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- APPLETON CP, HATLE LK, POPP RL. Demonstration of restrictive ventricular physiology by Doppler echocardiography. J Am Coll Cardiol 1988; 11:757-68
- DAL-BIANCO JP, SENGUPTA PP, MOOKADAM F, et al. Role of echocardiography in the diagnosis of constrictive pericarditis. J Am Soc Echocardiogr 2009; 22:24-33
- GARCIA MJ. Constrictive pericarditis versus restrictive cardiomyopathy? J Am Coll Cardiol 2016; 67:2061-76
- GESKE JB, ANAVEKAR NS, NISHIMURA RA, et al. Differentiation of constriction and restriction: complex cardiovascular hemodynamics. J Am Coll Cardiol 2016; 68:2329-47
- HATLE LK, APPLETON CP, POPP RL. Differentiation of constrictive pericarditis and restrictive cardiomyopathy by Doppler Echocardiography. Circulation 1989; 79:357-70
- NAGUEH SF, SMISETH OA, APPLETON CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2016; 29:277-314
- PAULUS WJ, TSCHÖPE C, SANDERSON JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007; 28:2539-50
- RAJAGOPALAN N, GARCIA MJ, RODRIGUEZ L, et al. Comparison of new Doppler echocardiographic methods to differentiate constrictive pericardial heart disease and restrictive cardiomyopathy. Am J Cardiol 2001; 87:86-94
- SOHN DW, KIM YJ, KIM HS, et al. Unique features of early diastolic mitral annulus velocity in constrictive pericarditis. J Am Soc Echocardiogr 2004; 17:222-6
- WELCH TD, LING LH, ESPINOSA RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 2014; 7:526-34
- YACOUB MH. Cardiomyopathy on the move. Nat Rev Cardiol 2014; 11:628-9
- ZHANG S, KERINS DM, BYRD BF. Doppler echocardiography in cardiac tamponade and constrictive pericarditis. Echocardiography 1994; 11:507-21
