Coarctation de l’aorte
La coarctation de l'aorte survient dans 0.2‰ des naissances et représente 8% des cardiopathies congénitales [3]; elle consiste en un rétrécissement qui obstrue la lumière de l’aorte au niveau de l’isthme et du canal artériel, engendrant un gradient de pression > 20 mmHg. Elle est subdivisée en préductale, juxtaductale ou postductale selon sa position par rapport au ligament artériel, mais peut concerner un long segment d'aorte. Chez les jeunes enfants, elle est associée dans la moitié des cas à une bicuspidie aortique, à une CIV, à un canal AV et/ou à un canal artériel. La coarctation impose une très forte postcharge au VG, qui s'hypertrophie de manière concentrique comme dans une sténose aortique. Un réseau collatéral très important par les artères périscapulaires, mammaires internes, cervicales et intercostales assure une perfusion en dessous de la lésion; les intercostales dilatées sont à l'origine des entailles qui sont visibles à la radio du thorax sur le bord inférieur des côtes depuis l’âge de 5-8 ans. Si les collatérales sont très développées, le gradient mesuré au niveau de la coarctation sous-estime le degré réel de la sténose. Même corrigée dans l’enfance, une coarctation peut récidiver à l’âge adulte.
A l’ETO, la coarctation est visible en vue long-axe de l’aorte descendante 90° au niveau de l’isthme, juste après le départ de l’artère sous-clavière gauche. Elle se présente comme une zone plus ou moins longue où la lumière interne de l’aorte est mal définie ; chez les jeunes, on voit en général une crête fibreuse qui obstrue partiellement la lumière (Figure 27.196). La coarctation est sévère lorsque le rapport entre le diamètre de la zone sténosée et celui de l’aorte descendante est 0.4 ou moins. Au-dessus de la lésion, l’aorte est dilatée et très pulsatile (variation de diamètre de 30%), alors qu’en dessous, elle est plus étroite et peu pulsatile (variation de diamètre < 5%) (Vidéos) ; cette perte de pulsatilité est proportionnelle au degré de sténose. Au Doppler couleur, on aperçoit une zone d'accélération concentrique (PISA) systolo-diastolique en amont du rétrécissement, un étroit passage au niveau de la coarctation et un flux turbulent en aval (Vidéo). Il n’est pas possible de mesurer le gradient de pression à l’ETO parce que l’oesophage reste parallèle à l’aorte descendante sur toute sa longueur.
Vidéo: vue court-axe de l'aorte thoracique en amont de la coarctation; la pulsatilité est augmentée.
Vidéo: vue court-axe de l'aorte thoracique en aval de la coarctation; la pulsatilité est diminuée.
Vidéo: flux Doppler couleur en long-axe de l'isthme de l'aorte au niveau de la coarctation; présence d'une zone d'accélération concentrique (PISA) en amont de la sténose et de flux troubillonnaire accéléré en aval.
Vidéo: vue court-axe de l'aorte thoracique en amont de la coarctation; la pulsatilité est augmentée.
Vidéo: vue court-axe de l'aorte thoracique en aval de la coarctation; la pulsatilité est diminuée.
Vidéo: flux Doppler couleur en long-axe de l'isthme de l'aorte au niveau de la coarctation; présence d'une zone d'accélération concentrique (PISA) en amont de la sténose et de flux troubillonnaire accéléré en aval.
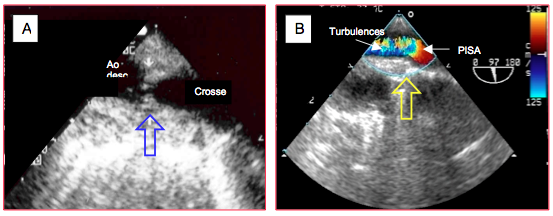
Figure 27.196 : Coarctation de l’aorte. A : membrane au niveau de l’isthme. B : flux Doppler couleur avec une zone d'accélération concentrique (PISA) en amont et des turbulences en aval de la membrane (flèche). Ao desc: aorte descendante.
Canal artériel
Le canal artériel (ductus arteriosus) relie l’isthme aortique (en face de la sous-clavière gauche) à la bifurcation pulmonaire (près de l'AP gauche). Il se ferme normalement dans les premières heures après la naissance. Il peut rester perméable à cause de la prématurité ou de l’hypoxémie. Dans certaines malformations, il est la seule source de flux pour l’artère pulmonaire (atrésie pulmonaire) ou l’aorte (arc aortique interrompu). Il est responsable d'un shunt G→D qui surcharge le VG et peut induire sa défaillance. Le canal artériel est situé à la limite de visibilité de l’ETO, mais il est en général possible d’en poser le diagnostic par la présence de trois éléments [4].
- Un flux couleur systolo-diastolique turbulent entre l’aorte thoracique au niveau de l’isthme (vues long-axe 0° et court-axe 90° de la crosse) et l’artère pulmonaire ; même s’il n’est pas toujours possible de le suivre sur tout son trajet, on aperçoit en général la zone d'accélération concentrique systolo-diastolique à l’intérieur de la lumière aortique. Il faut souvent chercher le canal en vues oesophagiennes hautes sous différents angles autour du court-axe de la crosse. Le flux diastolique est inversé dans l'aorte thoracique (vue long-axe de l'aorte descendante).
- Un flux couleur tourbillonnant dans le tronc de l’AP descendant depuis l’artère pulmonaire gauche en vue court-axe de l’aorte ascendante 0° ou en long-axe de l’AP à 60-80°. Ce flux est visible en diastole, car il est entraîné par le courant en systole. Au Doppler pulsé, l’image spectrale est celle d’un reflux diastolique dans l’AP.
- Surcharge de volume du VG et signes d'hypertension pulmonaire.
La non-fermeture du canal artériel entraîne à long terme une hypertension pulmonaire. Le flux G→D ralentit parce que le ΔP diminue. En alignant l'axe du Doppler continu avec le flux, l'équation de Bernoulli permet de calculer le gradient de pression Ao-AP (ΔP); il suffit de soustraire ce dernier de la pression artérielle systolique systémique (PAs) pour obtenir la pression systolique pulmonaire:
PAPs = PAs - ΔP
Pour le calcul du shunt (Qp/Qs), le flux transpulmonaire représente le débit systémique alors que le flux transaortique représente le débit pulmonaire puisque le shunt est situé en aval de la valve pulmonaire.
Anomalies coronariennes
Il existe de multiples variantes anatomiques du branchement des troncs coronaires (Figure 27.197) ; elles sont souvent associées à d'autres malformations: truncus arteriosus, transposition des gros vaisseaux, atrésie plmonaire, ventricule droit à double issue (VDDI), ou tétralogie de Fallot. Elles peuvent occasionner des soucis lors de reconstruction chirurgicale au niveau des chambres de chasse. Elles sont habituellement repérables en vue court axe ou long axe de la valve aortique.

Figure 27.197 : Représentation schématique des anomalies coronariennes les plus fréquentes. A : situation normale, avec la position de la valve pulmonaire (AP). B à H : exemples d’anomalies. En B, C, E, F et H, un vaisseau contourne l’AP par devant et peut poser problème lors de chirurgie de la chambre de chasse droite. G : implantation intramurale [1].
Une coronaire peut avoir une origine anormale sur l'aorte, ou être branchée sur l’AP (syndrome ALCAPA : coronaire gauche issue de l’AP). Dans ce dernier cas, une ischémie myocardique apparaît précocement dès que la pression chute dans l’arbre pulmonaire. Si le vaisseau est bien collatéralisé, il peut réaliser un vol dans le réseau en provenance de l’aorte et fonctionner comme un shunt G→D en se déversant a retro dans l’AP. A l’ETO, l’implantation anormale de la coronaire gauche dans l’AP se voit en général en vue mi-œsophage 60-120°; le Doppler couleur démontre un flux turbulent diastolique dans l’AP à la hauteur de l’abouchement de la coronaire. La CD est dilatée et subvient seule aux besoins du VG, dont la fonction est diminuée [2].
La fistule coronaire concerne le plus souvent la coronaire droite et se déverse dans le VD, ce qui crée un shunt G→D, de l'ordre de 1.6 :1 [2]. Proximalement, la CD est dilatée et tortueuse; elle est parcourue par un flux systolo-diastolique de vélocité élevée qui donne des tourbillons dans le VD. Ce dernier est agrandi car il est la chambre de réception du shunt.
A l’ETO, l’implantation anormale de la coronaire gauche dans l’AP se voit en général en vue mi-œsophage 60-120° ; le Doppler couleur démontre un flux turbulent diastolique dans l’AP à la hauteur de l’abouchement de la coronaire. La CD est dilatée et subvient seule aux besoins du VG, dont la fonction est diminuée [2].
Les anomalies coronariennes représentent un risque particulier dans les opérations qui nécessitent une réimplantation des ostia, comme le switch artériel ou l’opération de Ross, et dans celles où leur trajet anormal empêche la reconstruction habituelle, comme l’élargissement de la CCVD dans la TdF lorsqu’une coronaire croise la face antérieure du cône d’éjection droit. Dans ces interventions, l’examen pré-CEC doit activement rechercher quelle est l’anatomie coronarienne du patient.
Shunt artériel G→D
Pour augmenter un flux pulmonaire insuffisant, on dérive fréquemment une artère systémique vers une artère pulmonaire. Le shunt de Blalock-Taussig consiste à anastomoser l’artère sous-clavière à l’artère pulmonaire ipsilatérale, soit par un montage termino-latéral soit au moyen d’un conduit prothétique. L’ETO permet de visualiser le flux du shunt. Alors que le flux est strictement systolique dans l’artère avant l’opération, il devient systolo-diastolique une fois le montage réalisé, puisque la diastolique pulmonaire est significativement plus basse que la diastolique sytsémique (Vidéos et Figure 27.198).
Vidéo: flux systolo-diastolique dans l'artère sous-clavière gauche après constitution d'un shunt de Blalock.
Vidéo: flux systolo-diastolique entre l'artère sous-clavière gauche et l'artère pulmonaire après constitution d'un shunt de Blalock (voir Figure 27.198A).
Vidéo: flux systolo-diastolique dans l'artère sous-clavière gauche après constitution d'un shunt de Blalock.
Vidéo: flux systolo-diastolique entre l'artère sous-clavière gauche et l'artère pulmonaire après constitution d'un shunt de Blalock (voir Figure 27.198A).
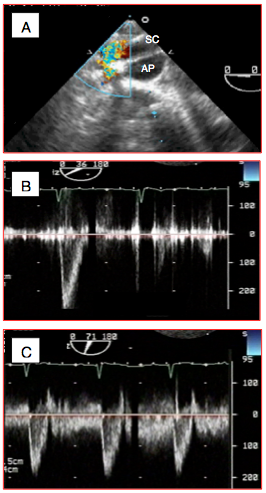
Figure 27.198 : Shunt de Blalock-Taussig. A : flux couleur dans le conduit passant en arc de cercle de l'artère sous-clavière à l'artère pulmonaire. B : flux dans l’artère sous-clavière avant la construction du shunt ; le flux est exclusivement systolique comme dans toute artère systémique. C: après connexion à l’artère pulmonaire, le flux devient systolo-diastolique comme dans un shunt G→D.
| Pathologies artérielles |
|
Coarctation de l’aorte:
- Membrane ou rétrécissement au niveau de l’isthme (long-axe aorte descendante 90°)
- Coarctation serrée: Ø sténose < 0.4 Ø aorte descendante
- Flux couleur: PISA en amont, turbulences en aval
- Pulsatilité de l’aorte augmentée en amont et diminuée en aval
- Association à la bicuspidie aortique
Canal artériel:
- Conduit aorto-pulmonaire entre isthme et bifurcation AP gauche
- Flux systolo-diastolique de shunt G→D dans médiastin supérieur et postérieur (vues court-axe 0° et long-axe 90° de l’aorte descendante)
- PISA dans l’aorte
- Flux tourbillonnaire diastolique dans le tronc de l’AP en provenance de l’AP gauche (vue court-axe de l’aorte ascendante 0° + CCVD 60°)
Anomalies coronaires:
- Trajets aberrants
- Fistule G-D
|
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- BETTEX D, CHASSOT PG. Transesophageal echocardiography in congenital heart disease. In: BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1186-1212
- BISHOP A. Coronary artery anomalies. In: REDINGTON A, et al. ed. Congenital heart disease in adults. A practical guide. London, WB Saunders Co Ltd, 1994, pp 153-60
- MARELLI AJ, MACKIE AS, IONESCU-ITTU R, et al. Congenital heart disease in the general population. Changing prevalence and age distribution. Circulation 2007; 115:163-72
- RUSSEL IA, ROUINE-RAPP K, STRATMANN G, MILLER-HANCE WC. Congenital heart disease in adult: A review with Internet-accessible transesophageal echocardiographic images. Anesth Analg 2006; 102:694-723
