La sténose mitrale (SM) est le plus souvent causée par le rhumatisme articulaire aigu (RAA), mais d'autres origines sont possibles: dégénérescence calcifiante, valvulopathie congénitale (valve en parachute), maladies infiltratives, syndrome carcinoïdien, ou toxicité médicamenteuse (anorexiants). Un myxome implanté au voisinage de la mitrale ou sur un de ses feuillets peut prolaber en diastole à travers la valve et occasionner une sténose hémodynamique. La sténose mitrale est une maladie progressive: la surface de la valve se rétrécit en moyenne de 0.1 cm2 par année [7]. Bloquant le flux diastolique entre l'OG et le VG, la SM donne une silhouette caractéristique au cœur en 4-cavités (Vidéo et Figures 26.54 et 26.55) [2,8].
Vidéo: vue 4-cavités dans un cas de sténose mitrale serrée; le VG est petit alors que l'OG est très agrandie, les feuillets mitraux sont retenus en diastole, l'ouverture est minime; le corps des feuillets est souple alors que leurs extrémités sont très remaniées.
Vidéo: vue 4-cavités dans un cas de sténose mitrale serrée; le VG est petit alors que l'OG est très agrandie, les feuillets mitraux sont retenus en diastole, l'ouverture est minime; le corps des feuillets est souple alors que leurs extrémités sont très remaniées.
- Immense OG (volume > 100 mL), souvent avec du contraste spontané à cause du bas débit; le septum interauriculaire bombe en permanence dans l'OD.
- Appendice auriculaire gauche (AAG) dilaté, avec flux de basse vélocité (< 0.2 m/s) (Contr spont AAG) ; éventuelle présence de thrombus.
Vidéo: présence de contraste spontané dans l'appendice auriculaire gauche dû à la stase en amont de la sténose mitrale.
- Ventricule gauche de petite taille, mais de fonction conservée.
- Valve mitrale épaissie, rétractée, et feuillets peu mobiles.
- RAA: fusion commissurale des deux feuillets limitant leur ouverture et leurs mouvements, bombement du corps du feuillet dans le VG en diastole et dans l'OG en systole (doming), épaississement et rétraction de l’appareil sous-valvulaire avec fusion de cordages. Le RAA donne souvent lieu à des cicatrices dans le myocarde sous-jacent (zone basale) et à une myocardite rhumatismale qui péjore la fonction ventriculaire.
- Dégénéresence calcifiante: calcification massive de l'anneau et de la base des feuillets, coulées calciques dans le corps des feuillets qui est immobilisé, mais extrémités libres (pas de fusion commissurale).
- La taille des cavités droites est fonction du degré d’hypertension pulmonaire secondaire, qui est très variable pour le même degré de rétrécissement mitral [5].
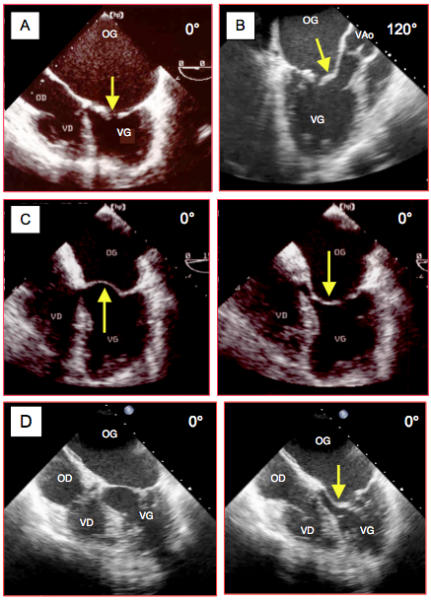
Figure 26.54 : Sténose mitrale (SM) lors de RAA. A : vue 4-cavités ; l’OG est gigantesque, le VG est petit ; la fusion commissurale retient les feuillets en diastole et l’ouverture (flèche) est minime. B : vue long-axe 120° montrant la déformation en canne de hockey (hockey stick) du feuillet antérieur en diastole. C : le corps du feuillet antérieur, resté souple mais retenu à la commissure, bombe dans l’OG en systole (doming) et dans le VG en diastole. D : bombement alterné du feuillet antérieur dans l'OG et dans le VG, avec une déformation typique (flèche) en diastole.
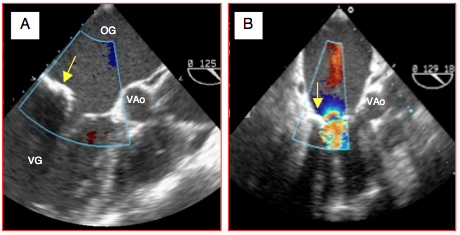
Figure 26.55 : Sténose mitrale (SM) lors de dégénérescence calcifiante, vue en diastole (vue long-axe). A : le feuillet postérieur (flèche) est calcifié et rigide; le feuillet antérieur est court et immobilisé; l'orifice d'ouverture est faible car seule l'extrémité des feuillets est encore mobile. B: même situation dans un autre cas; le flux couleur dévoile l'accélération à travers la valve.
Comme le RAA épargne le corps des feuillets, la partie centrale du feuillet antérieur reste souple ; elle bombe dans l’OG en systole et dans le VG en diastole, donnant une déformation caractéristique en "canne de hockey" (hockey stick) (Vidéo et Figure 26.54B). En échocardiographie tridimensionnelle, cette déformation prend l’allure d’un cône plongeant dans le VG (Vidéos et Figure 26.57B). Les hématies qui stagnent dans l’OG dilatée forment des rouleaux qui se déplacent lentement et donnent une image ressemblant à des volutes de fumée ; l’intensité de ce contraste spontané est fonction du ralentissement du flux mais aussi du réglage du gain et de la compression sur l’échographe. La dilatation de l’OG s’accompagne en général de fibrillation auriculaire (FA), ce qui augmente le risque de thrombose, particulièrement dans l’appendice auriculaire gauche (AAG). Ce dernier doit être exploré avec minutie à la recherche d’un éventuel thrombus (Figure 26.56). Au Doppler pulsé, le flux systolo-diastolique à l'entrée de l'AAG est de basse vélocité (≤ 0.2 cm/s), ce qui est un bon marqueur du risque de thrombose. La présence d’une IM associée assure un brassage systolique dans l’OG et diminue le risque thombotique ; la surcharge de volume qu’elle provoque maintient également une taille suffisante au VG [2].
Vidéo: fusion commissurale des feuillets mitraux en cas de sténose mitrale sur RAA.
Vidéo: vue en 3D depuis le VG, la sténose mitrale apparaît comme un cône plongeant dans le ventricule; son ouverture diastolique n'est qu'une fente.
Vidéo: vue en 3D depuis l'OG d'une sténose mitrale serrée; l'ouverture prend la forme d'un "8" horizontal.
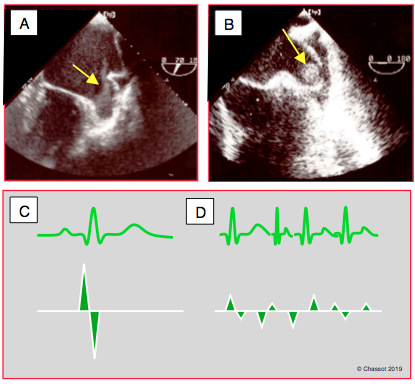
Figure 26.56 : Stase auriculaire gauche dans la sténose mitrale. A : contraste spontané dans l’appendice auriculaire gauche (état préthrombotique). B : présence d’un thrombus dans l’appendice auriculaire gauche. C: flux normal dans l'AAG; la Vmax est de 30-50 cm/s. D: flux dans l'AAG en cas de FA; la basse vélocité (≤ 20 cm/s) est un marqueur de risque pour la thrombose.
L'imagerie tridimensionnelle s'est imposée ces dernières années pour la représentation et la quantification de la sténose mitrale, car elle offre des vues exceptionnelles sur la valve et son altération: déformation des feuillets plongeant dans le VG et ouverture résiduelle en forme de fente (Figure 26.57). La planimétrie 3D fournit les données les plus fiables de la surface mitrale [3].
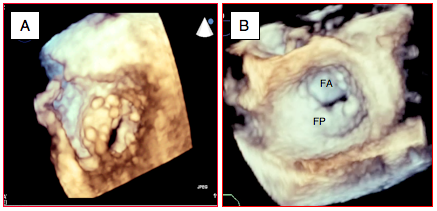
Figure 26.57 : Imagerie 3D: déformation en cône de la valve mitrale. A : vue ETO 3D depuis le VG; l'ouverture n'est qu'une fente. B: vue depuis l'OG d'une maladie mitrale; l'ouverture diastolique est très faible mais la valve fuit en systole. FA: feuillet antérieur. FP: feuillet postérieur.
Le degré de restriction, d’épaississement, de calcification et d’atteinte de l’appareil sous-valvulaire est quantifié dans plusieurs scores très utiles pour déterminer la faisabilité d’une commissurotomie percutanée (scores de Wilkins, de Cormier ou d'Anwar) [6]. L’atteinte est classée en 4 degrés [4].
- Degré I : restriction cantonnée à l’extrémité des feuillets, épaississement minime;
- Degré II : mobilité conservée dans le corps et la base des feuillets, épaississement des bords libres (5 mm), quelques calcifications;
- Degré III : seule la base des feuillets est mobile, épaississement du corps des feuillets (8 mm) et de l’appareil sous-valvulaire, calcifications s’étendant dans la partie moyenne des feuillets;
- Degré IV : perte totale de mobilité en diastole, épaississement de toutes les structures (≥ 10 mm) jusqu’aux muscles papillaires, calcification diffuse sur la plus grande partie des feuillets.
Le score de Wilkins attribue un certain nombre de points sur une échelle de 1 à 4 à quatre données échocardiographiques: mobilité des feuillets, épaississement de la valve, degré de calcification et remaniement de l'appareil sous-valvulaire. La situation est considérée comme favorable pour une commissurotomie au ballon si le nombre de points est ≤ 8 sur un maximum possible de 16 points [6]. Le calcium déposé aux commissure est également classé en 4 stades. Le score d'Anwar se base sur l'imagerie 3D pour déterminer le degré d'épaississement, de mobilité et de calcification des feuillets et de l'appareil sous-valvulaire [1]. Tous ces scores sont semi-quantitatifs; aucun n'est franchement supérieur aux autres [7].
Lorsqu'elle est liée à une fusion commissurale (RAA), ce qui est le cas le plus fréquent, la sténose peut être prise en charge par une dilatation percutanée au ballon (technique d'Inoue) (Vidéo et Figure 25.58). L'écho permet de relever un certain nombre de données qui sont considérées comme des contre-indications à cette technique [7].
Vidéo: fusion commissurale dans une sténose mitrale sur RAA; la taille du VG est réduite alors que l'OG est très grande.
Lorsqu'elle est liée à une fusion commissurale (RAA), ce qui est le cas le plus fréquent, la sténose peut être prise en charge par une dilatation percutanée au ballon (technique d'Inoue) (Vidéo et Figure 25.58). L'écho permet de relever un certain nombre de données qui sont considérées comme des contre-indications à cette technique [7].
Vidéo: fusion commissurale dans une sténose mitrale sur RAA; la taille du VG est réduite alors que l'OG est très grande.
- Surface mitrale > 1.5 cm2;
- Présence de thrombus auriculaire;
- Insuffisance mitrale > mineure;
- Calcifications commissurales;
- Rétrécissement sans fusion commissurale.
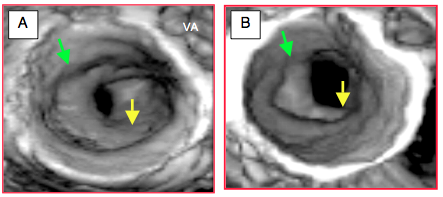
Figure 26.58 : Imagerie 3D d'une dilatation de la valve mitrale par ballonoplastie selon Inoue. A: status avant l'intervention; la surface est de 1.0 cm2. Flèche jaune: fusion commissurale. Flèche verte: position de l'anneau mitral. B: après dilatation, la surface est de 2.3 cm2; la zone fusionnée a été ouverte. VA: valve aortique.
| Sténose mitrale |
| Images bidimensionnelles typiques de la SM: - OG très dilatée avec contraste spontané (recherche de thrombus), petit VG - Feuillets valvulaires épaissis et peu mobiles - Fusion commissurale, bombement alterné de la partie centrale du feuillet antérieur (RAA) - Calcification massive de l'anneau envahissant les feuillets (dégénérescence calcifiante) Images 3D: feuillets déformés en cône plongeant dans le VG, ouverture en forme de fente |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- ANWAR AM, ATTIA WM, NOSIR YF, et al. Validation of a new score for the assessment of mitral stenosis using real-time three-dimensional echocardiography. J Am Soc Echocardiogr 2010; 23:13-22
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- KARAMNOV S, BURBANO-VERA N, HUANG CC, et al. Echocardiographic assessment of mitral stenosis orifice area: a comparison of a novel three-dimensional method versus conventional techniques. Anesth Anlg 2017; 125:774-80
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- WILKINS GT, WEYMAN AF, ABASCAL VM, et al. Percutaneous balloon dilatation of the mitral valve: en analysis of echocardiographic variables related to outcome and the mechanism dilatation. Br Heart J 1988; 60:299307
- WUNDERLICH NC, BEIGEL R, SIEGEL RJ. Management of mitral stenosis using 2D and 3D echo-Doppler imaging. JACC Cardiovasc Imaging 2013; 6:1191-205
- YAU TM, EL-GHONEIMI, ARMSTRONG S, et al. Mitral valve repair and replacement for rheumatic disease. J Thorac Cardiovasc Surg 2000; 119:53-60
