L’inflammation est une réaction de défense de l’organisme contre un envahisseur. C’est un système complexe et redondant, qui comprend de nombreux circuits de rétroaction amplificateurs, mais aussi des circuits inhibiteurs qui en limitent la portée. Dans une plaie, la barrière cutanée ou muqueuse est brisée. Le corps doit à la fois s’y protéger des toxines et y empêcher la perte de sang. C’est la raison pour laquelle la réaction inflammatoire est intimement liée à la coagulation. Normalement, le sang n’est en contact qu’avec l’endothélium vasculaire, avec lequel il entretient un équilibre constant. Lorsqu’il rencontre une surface non-endothélialisée comme une lésion ou un corps étranger, il déclenche toute une cascade de phénomènes protecteurs. Le processus inflammatoire est conçu pour rester localisé, mais il arrive que la réponse soit exagérée ou que l’agression soit systémique, comme c’est le cas lorsque le sang rentre en contact avec des surfaces étrangères dans une CEC. La réaction de défense de l’organisme se transforme alors en un syndrome inflammatoire systémique (Systemic Inflammatory Reaction Syndrome ou SIRS). Le tableau clinique est caractéristique : fièvre, tachycardie, hypotension, leucocytose, accumulation liquidienne et insuffisance poly-organique [4].
En chirurgie cardiaque, le SIRS est déclenché par une série de phénomènes : le contact avec les surfaces du circuit de CEC, le contact avec l’air dans les aspirations de cardiotomie, l'hypothermie, l'héparinisation et les complexes héparine-protamine, les lésions d'ischémie et de reperfusion, ou encore les toxines libérées dans le tube digestif. Environ 20% des patients à bas risque développent des complications liées au SIRS [3]: coagulopathie, accumulation liquidienne interstitielle, oedème cérébral, oedème pulmonaire (péjoration des échanges gazeux), dysfonction multiorganique (troubles neurologiques, insuffisance cardiaque, rénale et hépatique).
La réaction inflammatoire comprend deux phases distinctes liées à des déclencheurs différents [7,9].
- Phase précoce ; elle est mise en route par le contact du sang avec une lésion endothéliale ou une surface non-endothélialisée comme le circuit de CEC (voie de contact), et comprend deux composantes intimement imbriquées :
- La voie humorale, qui comprend 3 éléments, la coagulation, le complément et les cytokines ;
- La voie cellulaire, constituée par les globules blancs et l’endothélium.
- Phase tardive : elle est liée aux lésions d’ischémie et de reperfusion, et à la libération d’endotoxines, essentiellement par le tube digestif.
Voie humorale
La voie du complément est le plus ancien moyen de défense de l’organisme, puisqu’on le retrouve déjà chez les oursins. Il consiste en un ensemble de 35 molécules qui assistent la réaction antigène-anticorps ou la défense anti-bactérienne, et qui convergent vers des protéines particulièrement redoutables puisqu’elles sont capables de perforer les membranes cellulaires (MAC : membrane attack complex) (Figure 8.8) [8].
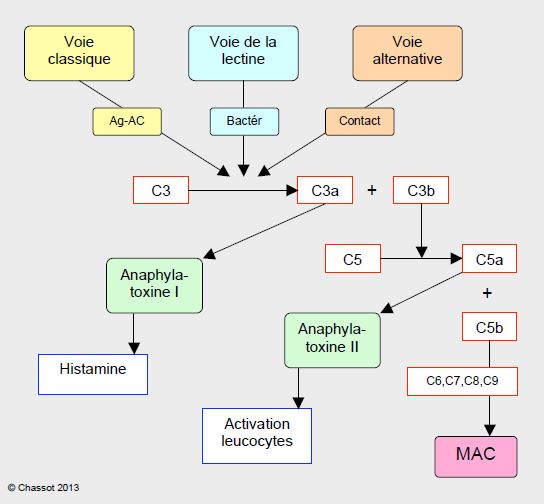
Figure 8.8 : Schéma simplifié de l’activation du complément. La chaîne du complément comprend 3 voies qui sont initiées par des déclencheurs distincts : la voie classique (réaction antigène-anticorps Ag-Ac), la voie alternative (activation directe par contact) et la voie de la lectine (site des membranes bactériennes). Par différentes étapes intermédiaires, elles convergent vers le clivage du facteur C3 en C3a (anaphylatoxine I, libération d’histamine) et C3b, lequel clive à sont tour le facteur C5 en C5a (anaphylatoxine II, activateur leucocytaire) et C5b qui est le premier composant du complexe MAC (MAC : membrane attack complex), complexe protéique qui attaque les membranes cellulaires et qui est le résultat ultime des voies du complément. Les nombreuses étapes intermédiaires ne sont pas représentées ici.
Très imbriquée avec la cascade de la coagulation, la chaîne du complément comprend 3 voies distinctes (classique, alternative et de la lectine) qui convergent vers le clivage du facteur C3 en C3a (anaphylatoxine I, libération d’histamine) et C3b, lequel clive à sont tour le facteur C5 en C5a (anaphylatoxine II, activateur leucocytaire) et C5b qui est le premier composant du complexe MAC.
Le système kinine-kallikréine comprend un groupe de protéines sériques impliquées dans la régulation du tonus et de la perméabilité vasculaires. Elles circulent sous forme de kininogènes inactives, qui sont activées par les kallikréines libérées dans les tissus lésés. Cette réaction donne naissance à la bradykinine qui est vasodilatatrice (sécrétion de NO et de prostacycline). Il existe une kallikréine plasmatique qui circule sous forme de prékallikréine inactive et qui est activée par le Facteur XIIa de la coagulation (voie intrinsèque). Comme la bradykinine formée est elle-même un activateur du Facteur XII, il se forme ici un système auto-amplificateur du lien avec la cascade de la coagulation.
Les cytokines sont des polypeptides qui assurent la communication entre cellules et déclenchent des activités spécifiques selon leurs cibles [7].
- TNF-alpha (Tumor necrosis factor) ; sécrété par les monocytes, les mastocytes et les lymphocytes-T en réponse aux endotoxines bactériennes, il active la chaîne inflammatoire. A haute concentration, il provoque une symptomatologie de choc septique avec des effets cardiodépresseur, vasodilatateur, thrombogène et perméabilisant capillaire.
- Interleukines pro-inflammatoires (IL-1, IL-6, IL-8) ; sécrétées par les leucocytes, elles activent la production de protéine C-réactive, de fibrinogène et de catécholamines ; elle provoquent une hyperglycémie, une leucocytose et de la fièvre.
- Interleukines anti-inflammatoires (IL-10) ; elles assurent un feed-back négatif qui empêche l’emballement de ces réactions en chaîne.
La cascade de la coagulation (voir Figure 8.1) est intimement connectée à la réaction inflammatoire. La thrombine, par exemple, en potentialise plusieurs effets : activation des polymorphonucléaires et des plaquettes, sécrétion l’IL-6 et d’IL-8, activation de C3. De leur côté, les plaquettes stimulent l’adhésion des leucocytes à la paroi vasculaire.
Voie cellulaire
Les neutrophiles polymorphonucléaires chargés de phagocyter les pathogènes contiennent des granules pouvant libérer des enzymes protéolytiques, des radicaux oxygénés et des médiateurs inflammatoires. Lorsque survient une lésion vasculaire, ils roulent d’abord à la surface de l’endothélium par l’accrochage de molécules appelées sélectines, puis ils adhèrent à l’endothélium lésé par l’ancrage de molécules appelées intégrines (molécules d’adhésion). En troisième lieu, ils migrent dans l’espace interstitiel par chimiotactisme pour y libérer leurs substances bactéricides [6].
Les basophiles, activés par la voie du complément, sécrètent essentiellement de l’histamine, qui augmente la perméabilité capillaire et facilite le passage des éléments figurés ; elle provoque aussi une vasodilatation et une bronchoconstriction. Les mastocytes ressemblent aux basophiles mais sont cantonnés dans l’espace périvasculaire des organes et ne circulent pas ; lorsqu’ils sont stimulés par le complément ou la thrombine, ils sécrètent différents médiateurs inflammatoires dont de nombreuses interleukines. Les monocytes, enfin, sont des macrophages qui libèrent une série de facteurs inflammatoires (interleukines, TNF-alpha) et phagocytent les éléments étrangers [7].
Les cellules endothéliales sont les régulatrices naturelles de la coagulation et de l’inflammation. Elles répondent à la présence de thrombine, de facteur C5a, de cytokines et d’interleukines par la sécrétion de sélectines et d’intégrines qui immobilisent les leucocytes. Elles gèrent le tonus vasculaires par la libération de substances vasodilatatrices comme le NO, l’histamine et la bradykinine ou de substances vasoconstrictrices comme l’endothéline-1 ou la noradrénaline ; par ailleurs, le NO inhibe la fonction plaquettaire.
Phase tardive
La phase tardive comprend deux composantes principales.
- Les lésions d’ischémie et de reperfusion. Après avoir été privée d’O2 pendant l’ischémie, la cellule en reçoit en masse au moment de la reperfusion, ce qui déclenche une cascade d'évènements pathologiques plus graves que ne l’étaient les dégâts de l’ischémie, notamment par la formation massive de radicaux libres (ROS reactive oxygen species) qui contiennent un nombre impair d'électrons sur leur orbite externe: peroxyde (O2•-), H2O2, hydroxyl (•OH) (voir Chapitre 24 Ischémie et reperfusion). Les ROS libérés dans le cytoplasme par les mitochondries sont normalement réduits par des antioxydants naturels (superoxide dismutase, catalase, glutathion, vitamine E), mais ces derniers sont débordés par l’abondance de peroxydes formés lors de la reperfusion. Les ROS peuvent alors attaquer les phospholipides des membranes, le DNA et diverses protéines [1,2,4]. Les mitochondries intoxiquées par l’excès d’O2 laissent également échapper des cytokines qui, de concert avec les peroxydes, activent de dangereux enzymes cytoplasmiques (caspases) impliqués dans l’apoptose et susceptibles de lyser les éléments de la cellule et de conduire à la nécrose.
- Les endotoxines stimulent massivement la production de complément, de TNF-alpha et d’interleukines. La libération d'endotoxines par les bactéries Gram-négatives qui hantent le tube digestif est liée à la baisse de débit splanchnique en CEC et en hypothermie; le flux dans la muqueuse gastrique, par exemple, est diminué jusqu'à 60% par le bas débit (< 2 L/min/m2) et par la vasoconstriction pendant la CEC [5].
| Inflammation et complément |
|
La réaction inflammatoire est un système rapide, complexe et redondant qui sert à la protection de l’organisme contre des agresseurs. Elle est très imbriquée avec la cascade de la coagulation. Si la réponse est exagérée ou l’agression systémique, l’inflammation donne lieu à un syndrome inflammatoire systémique (SIRS). Elle comprend trois aspects.
- Voie humorale : cascade du complément produisant des molécules capables de lyser les
cellules étrangères, cytokines (déclencheurs spécifiques), kinines (régulateurs du tonus et
de la perméabilité vasculaires)
- Voie cellulaire : neutrophiles (phagocytose), basophiles (libération d’histamine),
endothélium (facteurs régulateurs)
- Phase tardive : lésion d’ischémie-reperfusion, relargage d’endotoxines digestives
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- ELAHI MM, YII M, MATATA BM. Significance of oxidants and inflammatory mediators in blood of patients undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2008; 22:455-67
- FRÄSSDORF J, DE HERT S, SCHLACK W. Anaesthesia and myocardial ischaemia/reperfusion injury. Br J Anaesth 2009; 103:89-98
- GROVER FL. The Society of thoracic Surgeons national Database. Current status and future directions. Ann Thorac Surg 1999; 68:367-73
- HALL R. Identification of inflammatory mediators and their modulation by strategies for the management of the Systemic Inflammatory Response during cardiac surgery. J Cardiothorac Vasc Anesth 2013 ; 27 : 983-1033
- OPAL SM. The host response to endotoxin, antipolysaccharide strategies, and the management of severe sepsis. Int J Med Microbiol 2007; 297:365-77
- SHERWOOD ER, TOLIVER-KINSKY T. Mechanisms of the inflammatory response. Best Pract Res Clin Anaesthesiol 2004; 18:385-405
- SNIECINSKI RM, LEVY JH. The inflammatory response to cardiopulmnary bypass. In: MONGERO LB, BECK JR (eds). On bypass. Advanced perfusion techniques. Totowa (NJ, USA): Humana Press 2010, 125-140
- STAHL GL, SHERMAN SK, SMITH PK, LEVY JH. Complement activation and cardiac surgery : a novel target for improving outcomes. Anesth Analg 2012 ; 115 :759-71
- WARREN OJ, SMITH AJ, ALEXIOU C, et al. The inflammatory response to cardiopulmonary bypass: Part 1 - Mechanisms of pathogenesis. J Cardiothorac Vasc Anesth 2009; 23: 223-31
