Les trois inhibiteurs directs du facteur Xa actuellement sur le marché européen sont des substances orales réclamant 1 à 2 prises par jour, mais ne nécessitant aucun contrôle de la coagulation (voir Tableaux 8.1, 8.2 et 8.3). Toute une série de grandes études randomisées multicentriques ont permis de préciser quelles sont les indications cliniques de ces nouvelles substances [15,33]. Les délais d'interruption de ces médicaments avant une intervention chirurgicale sont exposés sous Gestion périopératoire (voir Tableau 8.7A, Tableau 8.7B, Tableaux 8.11 et 8.12).
Rivaroxaban (Xarelto®)
Le rivaroxaban est un inhibiteur compétitif direct du site actif du facteur Xa. Après ingestion orale, la biodisponibilité est de 80%, et le pic de concentration est atteint en 2.5-4 heures. La demi-vie est de 5-9 heures, mais de 11-13 heures > 75 ans et en cas d’insuffisance rénale. La liaison protéique est très forte (92-95% de la substance circulante). L’élimination se fait par métabolisation hépatique pour deux tiers et par excrétion rénale pour un tiers [5]. Les taux sériques obtenus avec une dose de 20 mg sont en moyenne de 250 ng/mL au pic de concentration (2-4 heures après la prise) et de 40-50 ng/mL au nadir (12-24 heures); elles sont respectivement de 45 et 16 ng/mL avec le dosage de 2 fois 2.5 mg/j [27,30]. Cependant, les valeurs obtenues avec le même dosage affichent une importante variabilité interindividuelle (47-93%) [30], entre autre liée à l’âge et à la fonction rénale (voir Figure 8.11A) [26].
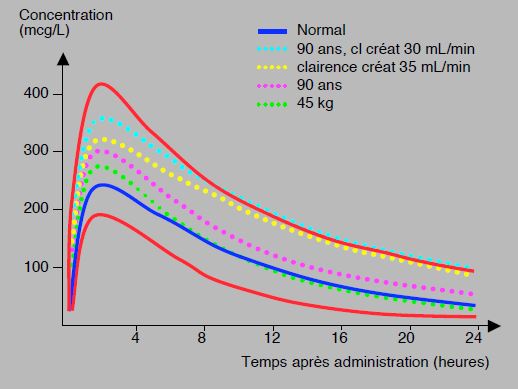
Figure 8.11A: Profils de concentration du rivaroxaban (20 mg 1 x/j) en fonction du temps dans différentes situations: patients de 90 ans en insuffisance rénale (pointillé turquoise), patients avec une clairance de la créatinine de 35 mL/kg (pointillé jaune), patients de 90 ans (pointillé violet), patients de 45 kg (pointillé vert). La courbe d’un individu standard est représentée en bleu. En rouge, courbes des 5ème et 95ème percentiles; la valeur supérieure représente environ 3 fois la valeur inférieure [modifié d’après réf 26].
Bien que l’inhibition du facteur Xa soit directement proportionnelle au taux plasmatique de la substance, on ne dispose pour l’instant d’aucune donnée concernant la relation entre ce taux et le risque hémorragique [27]. Il semble toutefois logique de penser qu’ils augmentent de manière parallèle. Comme pour tous les autres xabans, il peut exister des interférences médicamenteuses avec d’autres substances dont le métabolisme dépend aussi des cytochromes hépatiques CYP3A4 et du transport par la P-glycoprotéine. Ainsi les antifongiques azolés, les antiprotéases anti-VIH, certains antibiotiques (clarithromycine) et certains antiarythmiques (amiodarone, verapamil, dronédarone) augmentent de 2.5 fois les taux de rivaroxaban, alors que le phénobarbital, la carbamazépine, la phénytoïne, la rifampicine et le millepertuis les diminuent de 50% [34]. Il n’existe pas d’interaction avec les statines [18,19].
Le rivaroxaban prolonge significativement le TP et non-significativement l’aPTT. Le TP ne peut pas être utilisé pour quantifier l’effet. Un TP normal n'exclut nullement la prise de rivaroxaban; par contre, il indique que le malade ne présente probablement pas un taux élevé de la substance. Le test spécifique est l’activité anti-Xa calibrée pour le rivaroxaban (voir Tableau 8.4) [1,12,15]. La substance est contre-indiquée chez les femmes enceintes, pendant l’allaitement et chez les malades en insuffisance hépatique (Child-Pugh B et C) ou rénale (Cl créat < 30 mL/min) [1].
En préopératoire, le délai d'attente pour procéder à des interventions chirurgicales dépend de plusieurs facteurs (voir Tableau 8.12) [2,18,23,36].
- 24 heures pour opération simple chez patients sans comorbidités si le dosage est 5 ou 10 mg/j;
- 48 heures pour opération sans risque hémorragique si le dosage est 15-20 mg/j;
- 72 heures pour opération à haut risque hémorragique et pour ALR rachidienne;
- 72-120 heures si la clairance de la créatinine est < 50 mL/min (selon les autres facteurs de risque).
Si la Clcréat est < 30 mL/min, la substance est contre-indiquée. Pour procéder à une anesthésie loco-régionale rachidienne (péridurale, intrathécale) ou à des blocs profonds (inclus blocs périclaviculaires), il est recommandé d’attendre 72 heures par souci de sécurité [18]. Le retrait du cathéter épidural doit être reporté à 48 heures après la dernière dose. Un délai de 6 heures est à respecter entre la ponction ou le retrait du cathéter épidural et la reprise du médicament avec les dosages faibles; il est porté à 12 heures avec les dosages élevés [31].
En Europe, le rivaroxaban occupe le tiers du marché des anticoagulants et les trois quarts de celui des NACO. Il est accepté dans les indications suivantes:
- Prophylaxie de la thrombose veineuse profonde postopératoire (10 mg/j), débutée 6-12 heures après la chirurgie [37]; prophylaxie de la TVP chez les malades alités ou à haut risque médical [35].
- Traitement de la thrombose veineuse profonde aiguë (TVP) et de l’embolie pulmonaire (15 mg 2x/j pendant 3 semaines, puis 20 mg/j) [6].
- Prévention de l’embolie systémique (AVC) en cas de fibrillation auriculaire non-valvulaire (20 mg/j) [28].
- Traitement du syndrome coronarien aigu en appoint de l'aspirine et du clopidogrel (2.5 mg 2x/j) [25].
- Traitement de la coronaropathie stable en combinaison avec l'aspirine (2.5 mg 2x/j) [14].
- Anticoagulation pour FA chez les malades sous antiplaquettaire pour angioplastie et stent coronarien (15 mg/j + clopidogrel seul, ou 5 mg/j + aspirine + clopidogrel) [16,24].
Apixaban (Eliquis®)
L’apixaban est aussi un inhibiteur compétitif direct du facteur Xa. Sa demi-vie est de 8-15 heures; l’élimination se fait par métabolisation hépatique pour les trois quarts et par excrétion rénale pour un quart [5]. Comme pour le rivaroxaban, des interférences médicamenteuses sont possibles avec des substances dont le métabolisme dépend des cytochromes hépatiques CYP3A4. La substance est également à éviter chez les femmes enceintes et chez les malades en insuffisance hépatique ou rénale (Cl créat < 30 mL/min) [1]. L’apixaban (2.5-5 mg 2x/j) prolonge le TP de manière non-fiable et modifie peu l’aPTT [12,15]. Le test de choix est le dosage de l’activité anti-Xa. En préopératoire, il est recommandé d’attendre 48 heures après la dernière dose pour procéder à la chirurgie et, par sécurité, 72 heures pour une ALR rachidienne. Ce délai est porté à 3-4 jours si le patient est âgé de > 75 ans, si la chirurgie est très hémorragique ou si la clairance de la créatinine est < 50 mL/min.
En Europe, l’apixaban est accepté dans les indications suivantes:
- Prophylaxie de la thrombose veineuse profonde postopératoire (2.5 mg 2x/j) [20];
- Traitement de la thrombose veineuse profonde aiguë et de l’embolie pulmonaire (10 mg 2x/j pendant 7 jours, puis 5.0 mg 2x/j);
- Prévention d’embolie systémique en cas de fibrillation auriculaire non-valvulaire (5 mg 2x/j) [9].
Edoxaban (Savaysa®, Lixiana®)
L’edoxaban est introduit sur les marchés japonais, américain et européen depuis le printemps 2015 pour le traitement et la prévention de la TVP et pour la prévention de l’AVC dans la FA [7,8]. A la dose de 60 mg/j, il diminue significativement le risque hémorragique par rapport à la warfarine [17]. Sa demi-vie est de 10-14 heures et son élimination est pour moitié rénale. Son dosage est de 30-60 mg 1 x/jour (indépendamment des repas), mais il doit être diminué de moitié en cas d’insuffisance rénale (clairance créatinine 30-50 mL/min) [38]. Comme tous les xabans, il prolonge le TP de manière non-quantitative, mais ne modifie que partiellement le TT et le PTT ; le test de choix est le dosage de l’activité anti-Xa [11]. Il existe depuis décembre 2016 un test spécifique pour l'edoxaban (STA™-Edoxaban Control, Stago Inc) permettant un dosage quantitatif. N’ayant aucune donnée sur sa gestion en périopératoire, il est pour l’instant suggéré de l’arrêter 48 heures avant l’opération dans les cas standard, 72 heures avant une ALR rachidienne et 3-4 jours en cas d’insuffisance rénale (Tableaux 8.11, 8.12). Les concentrés de complexe prothrombinique 4-facteurs (50 UI/kg) antagonisent l’effet de l’edoxaban [39].
Contre-indications
D’une manière générale, les différents NACO (nouveaux anticoagulants oraux : dabigatran, rivaroxaban, apixaban, edoxaban) partagent les mêmes contre-indications. Elles sont liées essentiellement au risque hémorragique et à l’élimination rénale (totale ou partielle) de ces substances (Figure 8.11B).
- Hémorragie évolutive cliniquement significative, diathèse hémorragique, coagulopathie;
- Maladie gastro-intestinale ulcéreuse;
- Insuffisance rénale (clairance créatinine < 30 mL/min ou nécessitant une dialyse);
- Hépatopathie sévère;
- Grossesse et allaitement;
- Prothèse valvulaire cardiaque (indication aux AVK).
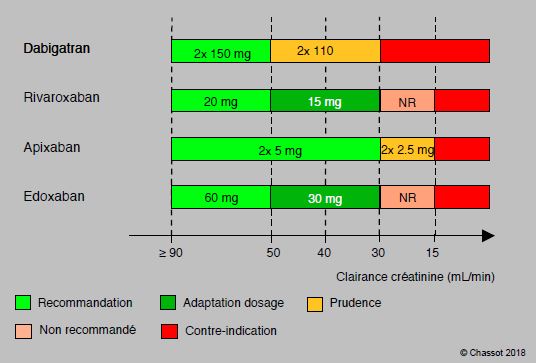
Figure 8.11B: Adaptation des dosages et contre-indication aux NOAC en fonction de la clairance de la créatinine. La part de l'élimination par voie rénale est variable selon les substances: dabigatran > 80%, edoxaban 45%, rivaroxaban 35%, apixaban 25% [d'après 13].
Antidote
Contrairement au dabigatran, les agents anti-Xa n’ont pas d’antagoniste disponible en cas d'urgence. Toutefois, deux agents sont actuellement en cours d'essai clinique et devraient arriver sur le marché dans un proche avenir (voir Antagonisme) [4,22,29].
- Andexanet alfa (Andexxa®); fonctionne comme un leurre du facteur Xa et séquestre les inhibiteurs de ce facteur (xabans). L'activité anti-Xa est réduite de 92-94% en 5 minutes et l'effet dure 2 heures [32] et l'hémostase est effective dans 79% des cas [10]. La durée d'action de l'andexanet étant plus courte que celle des xabans, il y a un risque d'effet rebond de l'anticoagulation. La substance est en voie de commercialisation pour renverser l'effet du rivaroxaban, de l'apixaban et de l'edoxaban; elle a été approuvée par la FDA en avril 2018, mais pas encore par l'EMA.
- Ciraparantag (aripazine, PER977); molécule polyvalente contenant 8 sites de fixation covalente par l'H+, efficace pour renverser l'effet des xabans, de l'argatroban, du fondaparinux, du dabigatran et des héparines. Le temps de coagulation est normalisé en 10 minutes [2,3], et l'hémorragie diminuée de 90% chez l'animal [21]. Les essais cliniques n'étant pas encore terminés, la substance ne sera pas sur le marché avant 1-2 ans.
| Agents anti-Xa |
|
Inhibiteurs directs du facteur Xa, administrés par voir orale 1 fois par jour (2x pour l'apixaban). Le test spécifique est l’activité anti-Xa calibrée pour le médicament, car les tests habituels sont modifiés de manière non-quantitative; seul le TP est prolongé. Des interférences médicamenteuses sont possibles avec des substances dont le métabolisme dépend aussi des cytochromes hépatiques CYP3A4 et de la protéine de transport P-gp.
- Rivaroxaban (Xarelto®, 10-20 mg/j), demi-vie : 10 heures, 12 heures > 75 ans et en cas d’insuffisance rénale.
Délai d’interruption préopératoire : minimum 24 heures (5-10 mg/j) avant intervention mineure;
48 heures avant opération majeure, si dosage 15-20 mg/j, ou si âge > 75 ans;
2-4 jours en cas d’insuffisance rénale (élimination rénale pour moitié).
- Apixaban (Eliquis®, 2.5-5.0 mg 2x/j), demi-vie 12 heures, élimination principalement par métabolisation hépatique;
Délai d’interruption préopératoire : 48 heures.
- Edoxaban (Lixiana® 60 mg/j), demi-vie 10-14 heures, élimination pour moitié par voie rénale.
Délai d’interruption préopératoire : 48 heures, 72 heures si risque hémorragique ou ALR rachidienne.
En règle générale : interruption de 3 demi-vies avant la chirurgie (48 h) et de 5 demi-vies avant une ALR rachidienne (72 h).
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2019
Références
- AGENO WA, GALLUS AS, WITTKOWSKY A, et al. Oral anticoagulant therapy: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e44S-e88S
- ALBALADEJO P, BONHOMME F, BLAIS N, et al. Management of direct oral anticoagulants in patients undergoing elective surgeries and invasive procedures: update guidelines from the French Working Group on Perioperative Hemostasis. Anaesth Crit Care Pain Med 2017; 36:73-6
- ANSEL JE, BAKHRU SH, LAULICHT BE, et al. Use of PER977 to reverse the antocoagulant effet of edoxaban. N Engl J Med 2014; 371:2141-2
- ARBIT B, NISHIMURA M, HSU JC. Reversal agents for direct oral anticoagulants: a focused review. Int J Cardiol 2016; 223:244-50
- BAUER KA. Recent progress in anticoagulant therapy: oral direct inhibitors of thrombin and factor Xa. J Thromb Haemost 2011; 9(suppl 1):12-19
- BAUERSACHS R, BERKOWITZ SD, BRENNER B, et al, EINSTEIN investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010; 363:2499-510
- BOUNAMEAUX H, CAMM AJ. Edoxaban : An update on the new oral direct factor Xa inhibitor. Drugs 2014 ; 74 :1209-31
- CAMM AJ, BOUNAMEAUX H. Edoxaban. A new oral direct factor Xa inhibitor. Drugs 2011; 71:1503-26
- CONNOLLY SJ, EIKELBOOM J, JOYNER C, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364:806-17
- CONOLLY SJ, MILLING TJ, EIKELBOOM JW, et al. Andexanet alfa for acute major bleeding associated with factor Xa inhibitors. N Engl J Med 2016; 375:1131-41
- CUKER A, HUSSEINZADEH H. Laboratory measurement of the anticoagulant activity of edoxaban : a systematic review. J Thromb Thrombolysis 2015 ; 39 :288-94
- CUKER A, SIEGAL DM, CROWTHER MA, et al. Laboratory measurement of the anticoagulant activity of the non-vitamin K oral anticoagulants. J Am Coll Cardiol 2014; 64:1128-39
- EHRA – European Heart Rhythm Association. EHRA practical guide on the use of non-vitamin K antagonistst oral anticoagulants in patients with atrial fibrillation. www.escardio.org/EHRA, 2018
- EIKELBOOM JW, CONNOLLY SJ, BOSCH J, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017; 377:1319-30
- GALANIS T, THOMSON L, PALLADINO M, et al. New oral anticoagulants. J Thromb Thrombolysis 2011; 31:310-20
- GIBSON CM, MEHRAN R, BODE C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375:2423-34
- GIUGLIANO RP, RUFF CT, BRAUNWALD E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013 ; 369 :2093-104
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015 ; 17:1467-507
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. Updated European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Executive summary. Eur Heart J 2017; 38:2137-49
- LASSEN MR, GALLUS A, RASKOB GE, et al, ADVANCE-3 investigators. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med 2010; 363:2487-98
- LAULICHT B, BAKHRU S, JIANG X. Antidote for new oral anticoaulants: mechanism of action and binding specificity of PER977. J Thromb Haemost 2013; 11:75
- LU G, DEGUZMMAN FR, HOLLENBACH SJ, et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med 2013; 19:446-53
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- MEGA JL, BRAUNWALD E, MOHANAVELU S, et al. Rivaroxaban versus placebo in patients with acute coronary syndrome (ATLAS ACS-TIMI 46): a randomised, double-blind, phase II trial. Lancet 2009; 374:29-38
- MEGA JL, BRAUNWALD E, WIWIOTT SD, ET AL. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366:9-19
- MUECK W, LENSING AWA, AGNELLI G, et al. Rivaroxaban. Population pharmacokinetic analyses in patients treated for acute deep-vein thrombosis and exposure simulations in patients with atrial fibrillation treated for stroke prevention. Clin Pharmacokinet 2011; 50:675-86
- MUECK W, STAMPFUSS J, KUBITZA D, BECKA M. Clinical pharmacokinetic and pharmacodynamic profile of rivaroxaban. Clin Pharmacokinet 2014 ; 53:1-16
- PATEL MR, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365:883-81
- RUFF CT, GIUGLIANO RP, ANTMAN EM. Management of bleeding with non-vitamin K antagonist oral anticoagulants in the era of specific reversal agents. Circulation 2016; 134:248-61
- SAMAMA MM, CONTANT G, SPIRO TE, et al. Laboratory assessment of rivaroxaban : a review. Thrombosis Journal 2013; 11:11
- SIÉ P, SAMAMA CM, GODIER A, et al. Chirurgies et actes invasifs chez les patients traités au long cours par un anticoagulant oral anti-IIa ou anti-Xa direct. Propositions du Groupe d’intérêt en hémostase périopératoire (GIHP) et du Groupe d’études sur l’hémostase et la thrombose (GEHT). Ann Fr Anesth Réanim 2011 ; 30 : 645-50
- SIEGAL DM, CURNUTTE JT, CONNOLLY SJ, et al. Andexanet alfa for reversal of factor Xa inhibitor activity. N Engl J Med 2015; 373:2413-24
- SINAURIDZE EI, PANTELEEV MA, ATAULLAKHANOV FI. Anticoagulant therapy: basic principles, classic approaches and recent developments. Blood Coag Fibrinol 2012; 23:482-93
- SPAHN DR, BEER JH, BORGEAT A, CHASSOT PG, et al. New oral anticoagulants in anesthesiology. Transf Med Hemother 2019; 46:282-93
- SPYROPOULOS AC, AGENO W, ALBERS GW, et al. Rivaroxaban for thromboprophylaxis after hospitalization for medical illness. N Engl J Med 2018; 379:1118-27
- TURPIE AG, KREUTZ R, LLAU J, et al. Management consensus guidance for the use of rivaroxaban - an oral, direct factor Xa inhibitor. Thromb Haemost 2012; 108:876-86
- TURPIE AG, LASSEN MR, DAVIDSON BL, et al, RECORD4 investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty: a randomised trial. Lancet 2009; 373:1673-80
- WEITZ JI, EIKELBOOM JW, SAMAMA MM. New antithrombotic drugs. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e120S-e151S
- ZAHIR H, BROWN KS, VANDELL AG, et al. Edoxaban effects on bleeding following punch biopsy and reversal by 4-factor prothrombin complex concentrate. Circulation 2015 ; 131:82-90
