Une pathologie cardiovasculaire est fréquemment associée à celle de l'aorte descendante: hypertension artérielle (70%), coronaropathie (44%), anévrisme préexistant déjà opéré (34%) [8,9]. Un tiers des patients souffre de bronchopathie chronique. De ce fait, la mortalité opératoire est dans 75% des cas d'origine cardiaque. Hormis les cas d’urgence, une investigation préopératoire poussée est nécessaire: échocardiographie, aortographie, coronarographie, artériographie périphérique, fonctions pulmonaires. A l'exception des ruptures traumatiques au niveau de l'isthme, la chirurgie de l'aorte descendante est le plus souvent élective.
La mortalité chirurgicale de l'anévrisme thoracique reste d'environ 6% dans les cas électifs et 15% dans les urgences [3,4,9,11]. Elle est la plus élevée dans le type II (voir Figure 18.38). La paraplégie survient en moyenne dans 3% des cas, avec des extrêmes allant de 0.4 à 10% des cas [1,3,6]. L'incidence de complications cardiaques est de 25%, celle de SDRA de 30% et celle d'insuffisance rénale de 10-20% [9,10]. Dans une série de 1'773 cas, la mortalité périopératoire est de 7.4%, le taux de paraplégie de 4.5% et celui d'insuffisance rénale de 6% ; la survie à cinq ans est de 74% [5]. Plus récemment, on a obtenu les résultats suivants avec une CEC partielle systématique : mortalité opératoire 5.3%, taux de paraplégie 2.7%, taux d’AVC 7.1%, survie à 5 ans 70% [7].
Une fois l'aorte préparée par une thoracotomie gauche ou une thoraco-phréno-lombotomie, l'intervention consiste à interposer une prothèse tubulaire pour ponter l'anévrysme, en y réimplantant les éventuelles grosses artères intercostales visibles dans le champ opératoire (Figure 18.42).
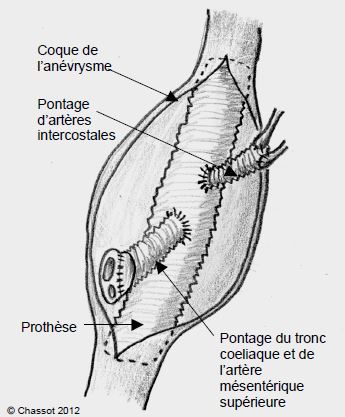
Figure 18.42 : Schéma opératoire d'un remplacement de l'aorte thoraco-abdominale sus-rénale par un greffon prosthétique tubulaire, avec réimplantation de deux artères intercostales et de l'ensemble du tronc coeliaque et de l'artère mésentérique supérieure.
Pour éviter une trop longue durée d'ischémie pour les organes dans les anévrysmes thoraco-abdominaux, la stratégie consiste à déplacer progressivement le clamp proximal et le clamp distal en partant de l'isthme, dans la mesure où la taille de l'anévrysme le permet. La partie amont est perfusée par le cœur et la partie aval par la CEC partielle. Dès que l'anastomose proximale est terminée, le clamp proximal est placé sur la prothèse de manière à ce que la perfusion soit rétablie dans la sous-clavière gauche. Les artères intercostales visibles sont réimplantées dans la prothèse. Lorsqu'on aborde la partie abdominale de l'anévrysme, le clamp distal est déplacé plus bas; le tronc coeliaque, l'artère mésentérique supérieure et l'artère rénale droite sont réimplantée dans le même patch de paroi; l'artère rénale gauche est réimplantée séparément. La technique consistant à suturer sur la prothèse un patch de paroi contenant les artères à revasculariser est actuellement remplacée par l'interposition d'une petite prothèse tubulaire, car la dilatation anévrysmale récidive sur la zone de paroi aortique utilisée pour le patch. Au fur et à mesure de ces anastomoses, le clamp est déplacé distalement de manière à reperfuser au plus vite les organes avec le flux pulsatile du cœur. L'anastomose distale est réalisée en dernier, en général après avoir stoppé la CEC partielle et déclampé les vaisseaux (open distal technique) [2]. La coque de l'anévrysme est refermée sur la prothèse et contribue à en assurer l'étanchéité.
| Chirurgie de l'aorte descendante |
| Après avoir réalisé l'anastomose proximale, on déplace le clamp distalement au fur et à mesure que les branches artérielles de l'aorte sont réimplantées dans la prothèse. Le territoire perfusé par la CEC fémoro-fémorale se réduit progressivement et celui perfusé par le cœur (perfusion pulsatile) s'étend aux différents organes. |
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- ACHER C, WYNN MM. Outcomes in open repair of the thoracic and thoracoabdominal aorta. J Vasc Surg 2010; 52:3S-9S
- BASSIN L, BELL D. Temporary extracorporeal bypass modalities during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:341-57
- COADY MA, IKONOMIDIS JS, CHEUNG AT, et al. Surgical management of descending thoracic aortic disease: open and endovascular approaches. Circulation 2010; 121:2780-804
- COSELLI JS, BOZINOVSKI J, LEMAIRE SA; et al. Open surgical repair of 2286 thoracoabdominal aneurysms. Ann Thorac Surg 2007; 83:S862-4
- COSELLI JS, CONKLIN LD, LEMAIRE SA. Thoracoabdominal aneurysm repair: review and update of current strategies. Ann Thorac Surg 2002; 74:S1881-4
- GREENBERG RK, LU Q, ROSELLI EE, et al. Contemporary analysis of descending thoracic and thoracoabdominal aneurysm repair: A comparison of endovascular and open techniques. Circulation 2008; 118:808-17
- MINATOYA K, OGINO H, MATSUDA H, et al. Replacement of the descending aorta: recent outcomes of open surgery performed with partial cardiopulmonary bypass. J Thorac Cardiovasc Surg 2008; 136:431-5
- SIMPSON JI. Anesthesia for descending thoracic aortic surgery. In: SIMPSON JI. Anesthesia for aortic surgery. Boston: Butterworth-Heinemann, 1997, 175-98
- SVENSSON LG, CRAWFORD ES, HESS KR, et al. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J Vasc Surg 1993; 17:357-70
- VAUGHN SB, LEMAIRE SA, COLLARD CD. Case scenario: anesthetic considerations for thoracoabdominal aortic aneurysm repair. Anesthesiology 2011; 115:1093-102
- WONG DR, PARENTI JL, GREEN SY, et al. Open repair of thoracoabdominal aortic aneurysm in the modern surgical era: contemporary outcomes in 509 patients. J Am Coll Surg 2011; 212:569-81
