La baisse du métabolisme cellulaire par le froid offre un certain degré de protection des organes et permet de prolonger le temps d'ischémie d'une durée variable selon la température. Cette réduction des besoins autorise une diminution du débit de perfusion, ce qui offre des avantages incontestables.
- Diminution du traumatisme hématologique;
- Diminution du flux collatéral et du retour veineux pulmonaire dans le champ opératoire;
- Possibilité d’interrompre la CEC pendant une courte durée, voire de retirer certaines canules, ce qui permet une amélioration de la qualité des reconstructions chirurgicales dans un champ opératoire immobile et exsangue;
- Diminution du réchauffement myocardique après la cardioplégie froide (4°C);
- Marge de sécurité en cas d'incident nécessitant une réduction ou un arrêt soudain de la CEC.
L’hémodilution importante nécessaire à freiner l’augmentation de la viscosité sanguine avec le froid entraîne un œdème cellulaire marqué dans le cœur et les poumons immatures: leur compliance diminue. L'hypothermie, qui peut être mineure (30-34°C), modérée (23-30°C) ou profonde (15-22°C), a des répercussions sur de nombreux systèmes (Tableau 14.13) (voir Chapitre 18 Effets cérébraux de l’hypothermie). Elle offre davantage de sécurité dans la correction des cardiopathies complexes, mais elle fait jeu égal avec la normothermie (≥ 34°C) dans les cardiopathies simples [36].

Hypothermie profonde
Le métabolisme cellulaire diminue exponentiellement avec la température: il baisse de 7% par degré C. A 18°C, la consommation d'O2 du cerveau (CMRO2) est de 40% par rapport à sa valeur en normothermie [24]. Le coefficient d'abaissement du métabolisme par tranche de 10° C (Q10) est en moyenne de 2.5 chez l'adulte et de 3.65 chez le nouveau-né [25]. Outre la baisse de la VO2, l’hypothermie préserve les phosphates à haute énergie et freine l’entrée de Ca2+ dans la cellule, mais elle cause une libération de Ca2+ à partir du reticulum sarcoplasmique; cette augmentation de la [Ca2+]i peut conduire à une contracture (stone heart) à l'origine d'une défaillance ventriculaire post-CEC. La vasoconstriction induite est la plus marquée dans les muscles des membres; elle est un peu moins prononcée dans les reins et le réseau splanchnique (voir Chapitre 7 Hypothermie). La baisse du métabolisme permet de diminuer le flux sanguin de la CEC en fonction de la température du sang, tout en tenant compte du métabolisme de base plus élevé du nourrisson par rapport à l'adulte (8-9 mL O2/kg/min versus 4 mL O2/kg/min à 37°) et de la baisse de VO2 liée à l'anesthésie [34].
- ≥ 34°C 2.5 L/min/m2
- 32° 2.2 L/min/m2
- 30° 2.0 L/min/m2
- 28° 1.8 L/min/m2
- 26° 1.6 L/min/m2
- 24° 1.4 L/min/m2
- 22° 1.2 L/min/m2
- 20° 1.0 L/min/m2
- 18° 0.7 L/min/m2
L'adéquation du flux par rapport aux besoins de l'organisme est contrôlée en continu par la la SvO2 et la ScO2, complétées par la gazométrie et le taux de lactate toutes les 30 minutes.
Le couplage entre le flux sanguin (FSC) et le métabolisme cérébral (rapport normal FSC/CMRO2: 15/1) se modifie à froid: à basse température, le FSC devient luxuriant (rapport 60/1) [31]. En normocapnie, l'autorégulation du flux sanguin cérébral est conservée en hypothermie modérée (25-30° C) pour des régimes de pression artérielle moyenne de 50 mmHg. Elle est perdue en hypothermie profonde (< 23°C). Dans ce cas, la perfusion cérébrale devient pression-dépendante [12], mais le débit de CEC peut baisser jusqu’à 10 mL/kg/min à 18°C avant que les besoins métaboliques soient déficitaires [20,21]. La limite inférieure de température tolérée par le cerveau est probablement 12°C, à la condition que l'hypothermie soit uniforme [20,22]. En dessous de cette valeur, l'inhibition des transferts membranaires actifs (pompes Na+/K+ et Na+/Ca2+) permet aux ions de diffuser selon leurs gradients électrochimiques, ce qui induit un oedème intracellulaire progressif et irréversible [30]. Cliniquement, la mesure la plus fiable de la température cérébrale est une sonde tympanique ou nasale (placée contre les cellules éthmoïdales).
Arrêt circulatoire
Lors d'opération de malformations complexes comme une hypoplasie du cœur gauche nécessitant un champ opératoire exsangue, l'ablation des canules et une correction de la crosse aortique, on utilise des températures basses (15-18°C) permettant de travailler en arrêt circulatoire. L'abaissement du métabolisme autorise à interrompre la circulation cérébrale pendant un certain laps de temps. Cependant, aucune température ni durée n’est dénuée de risque de séquelles neurologiques; seule la probabilité de lésions irréversibles est quantifiable. C'est ce qu'illustre la Figure 14.26, qui résume les durées dites "sûres" d'arrêt complet en fonction de la température [22,23] :
- 3-5 min à 37°C;
- 12-15 min à 28°C;
- 35-40 min à 18°C.
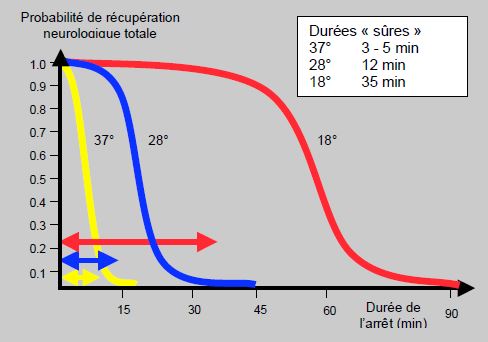
Figure 14.26 : Nomogramme d'une estimation de la probabilité de récupération neurologique complète après un arrêt circulatoire total à trois différentes températures du cerveau [20,23].
Ces durées correspondent au point d'inflexion de la courbe, auquel correspond une augmentation significative de la probabilité de séquelles neurologiques. Mais il ne s'agit que d'une probabilité: elle n'est jamais nulle, et tout allongement de la durée augmente le risque. Les interventions au cours desquelles il est habituel de recourir à une hypothermie profonde et à un arrêt circulatoire sont principalement : retour veineux pulmonaire anormal complet, Norwood, hémi-Fontan, switch artériel avec CIV et interruption de l’arc aortique [29].
Perfusion cérébrale
Le bas débit continu en hypothermie profonde est un compromis visant à maintenir l'apport nécessaire au fonctionnement minimal des cellules, à empêcher l'accumulation de métabolites acides et à supprimer les lésions de reperfusion. Comparé à l’arrêt circulatoire total, le bas débit cérébral en hypothermie profonde garantirait moins de troubles neurologiques immédiats (OR 11.4) [26] et un meilleur développement intellectuel ultérieur [2,5]. Toutefois, de nombreuses études comparatives n'arrivent pas à trancher l'alternative entre bas débit continu en hypothermie modérée et arrêt total en hypothermie profonde [11,16]. Il est difficile de savoir quelle est la meilleure stratégie, parce que les attitudes diffèrent d'un centre à l'autre [34]. Or tout protocole est efficace lorsqu'il est appliqué avec rigueur par une équipe cohérente qui en est coutumière.
Les besoins métaboliques sont théoriquement assurés par un débit cérébral de 10-12 mL/kg/min à 15°C [8]. Pour maintenir une protection cérébrale par un bas débit continu pendant la phase d’arrêt circulatoire imposée par la reconstruction cardiaque, on peut perfuser sélectivement le cerveau par une canulation dans le tronc brachio-céphalique; la carotide droite est directement perfusée, et les anastomoses du réseau carotidien externe et du cercle de Willis assurent la perfusion de l’hémisphère gauche [28]. On utilise des débits de 20-50 mL/kg/min selon la température sous des pressions moyennes de 20-40 mmHg. L'autorégulation cérébrale étant perdue en-dessous de 20°C, le débit sanguin cérébral y devient linéairement dépendant de la pression; cependant, il tombe brusquement à zéro lorsque la pression descend à des valeurs de 11-15 mmHg [32]. Il est donc important de rester au-dessus de ces valeurs. De plus, la pression veineuse jugulaire doit être nulle, sinon elle compromet le débit sanguin cérébral [13].
Aspects techniques
Le refroidissement par la CEC est très progressif. Il doit être lent pour être homogène: la durée optimale est d’au moins 20 minutes pour atteindre 20°C [3]. Le blocage neuro-musculaire et la profondeur de l'anesthésie doivent être adéquats pour éviter les frissons et diminuer au maximum toute consommation d'oxygène (VO2) périphérique. En CEC, la curarisation est susceptible de baisser la VO2 globale de 10-30% [19]. L'utilisation d'agents vasodilatateurs et la régulation pH-stat favorisent un refroidissement harmonieux et évitent l'apparition de gradients de température. L'hématocrite optimal est de 24%. La gestion de la température pendant la CEC répond à un certain nombre de recommandations [10].
- Le gradient de température entre l'eau de l'échangeur thermique et le sang ne doit jamais dépasser 10°C, et la température de l'eau ne doit pas aller au-delà de 38° ni en dessous de 12°C.
- Pendant le refroidissement, le gradient de température entre l'entrée et la sortie de l'échangeur thermique de doit jamais excéder 10°C.
- Pendant le réchauffement lorsque la température est < 30°C, le gradient de température entre l'entrée et la sortie de l'échangeur thermique ne doit jamais excéder 10°C.
- Pendant le réchauffement lorsque la température est > 30°C:
- Le gradient de température entre l'entrée et la sortie de l'échangeur thermique doit rester ≤ 4°C;
- La vitesse de réchauffement doit rester ≤ 0.5°C/min.
- La température du sang à la sortie de l'échangeur thermique ne doit jamais dépasser 37°C pour éviter l'hyperthermie cérébrale.
- Le gradient entre la température rectale/vésicale et la température oesophagienne doit rester inférieur à 10°C; la T° rectale ou vésicale est inférieure de 2-4°C à la température cérébrale pendant le réchauffement.
A l’hypothermie s’associent un certain nombre de mesures de protection cérébrale en cas d'arrêt circulatoire (voir Protection cérébrale).
- Refroidissement externe au moyen de glace pilée dont on emmaillote la tête et le cou de l’enfant. La température de la salle d'opération est abaissée à 16°C jusqu'au réchauffement.
- La position de Trendelenburg évite les embolisations d'air lorsque les vaisseaux sont ouverts ou manipulés, mais elle augmente la pression veineuse et peut diminuer la pression de perfusion cérébrale effective (Partère – Pveine) si elle est trop accentuée.
- Normoglycémie: le petit enfant court plus de risque par hypoglycémie. Il est conseillé de régler la glycémie à 6-10 mmoles/L avant l’arrêt.
- Stéroïdes: par son effet stabilisateur sur les membranes cellulaires, la méthylprednisolone diminue l'oedème périfocal [1]. Bien que son efficacité soit peu probable dans le contexte de l'ischémie, l'innocuité d'une dose isolée, même massive, justifie son utilisation prophylactique qui diminue l’intensité du syndrome inflammatoire [35]. La dose est de 10-20 mg/kg, administrée 45 minutes avant l'arrêt.
- Mannitol: il diminue l'oedème cérébral et contribue à une amélioration de la perfusion parenchymateuse; sa capacité à capter les radicaux libres offre la possibilité de diminuer les lésions de reperfusion [37]. Il s'administre 20 – 30 minutes avant l'arrêt à la dose de 0.5 g/kg.
- Magnésium: sous forme de sulfate ou de chlorure, il a une activité anticalcique prononcée et améliore la récupération neurologique dans certaines études [33]. La dose est 5 – 10 mmoles 5 minutes avant l'arrêt.
- Régulation selon le mode pH-stat pendant les phases de refroidissement et de réchauffement [4,9,18].
- Maintien d’un hématocrite relativement élevé (> 24%) [16].
Les barbiturés diminuent la CMRO2 de 30% et améliorent la récupération des lésions focales, mais non celle de l'ischémie cérébrale globale [27]. Or, chez le petit enfant, les lésions focales emboliques sont plus rares que les séquelles de l’ischémie globale; d’autre part les effets hémodynamiques des barbiturés sont prohibitifs. De ce fait, ils ne sont pas utilisés pour la protection cérébrale chez l’enfant.
On n’a pas de preuve évidente que les différents éléments prophylactiques mentionnés puissent modifier significativement la récupération cérébrale. Seules l'hypothermie et la brièveté de l'arrêt ont une incidence prouvée sur les résultats neurologiques à long terme.
Réchauffement
Pendant le réchauffement, le gradient de température entre l'entrée et la sortie de l'échangeur thermique ne doit jamais excéder 10°C tant que la température est < 30°C. Dès que celle-ci est > 30°C, le gradient thermique doit rester ≤ 4°C et la vitesse de réchauffement doit rester ≤ 0.5°C/min. D'autre part, la température du sang à la sortie de l'échangeur thermique ne doit jamais dépasser 37°C [10]. Le gradient thermique artère-oesophage doit garder une valeur de 2-3°C [7]; mais ce réchauffement progressif présente l’inconvénient de prolonger la durée de CEC [15].
Lors d'un réchauffement rapide, le cerveau devient dangereusement hypertherme (38-39°) pour plusieurs heures [6]. En effet, il est l’un des organes les mieux perfusés; de ce fait, sa température se modifie plus rapidement que celle de l’organisme. Ce phénomène aggrave profondément la susceptibilité des neurones à l'ischémie et agrandit l'étendue des lésions focales. Il diminue l'efficacité de l'autorégulation et rend le flux sanguin cérébral davantage pression-dépendant. Les séquelles neurologiques sont d'ailleurs proportionnelles à la rapidité du réchauffement et à la chute de la saturation veineuse jugulaire pendant ce dernier [14,15]. Une chute de la saturation cérébrale en O2 (ScO2) signe le déséquilibre entre la consommation d'O2 et le flux sanguin du cerveau. L’hyperthermie cérébrale est responsable de 50-75% des altérations neuro-psychologiques, dont l’importance est directement liée à la vitesse de réchauffement [17].
| Hypothermie |
|
L’hypothermie diminue les besoins métaboliques des tissus (baisse de 7%/°C pour le cerveau), permet de diminuer le débit de CEC et de l’interrompre momentanément. Durée de l’arrêt circulatoire considérée comme sûre :
- 3-5 minutes à 37°C
- 15 minutes à 28°C
- 40 minutes à 18°C
Au réchauffement, un effet rebond cause une hyperthermie cérébrale très néfaste. Vitesse de réchauffement maximale: 1°/2-4 min; gradient entre échangeur thermique et T° rectale : < 10°C; T° du sang: ≤ 37°C.
Mesures de protection cérébrale :
- Perfusion sélective continue
- Hypothermie à 18-20°C, refroidissement et réchauffement homogènes et lents (1°/3-4 min), risque d’hyperthermie cérébrale au réchauffement
- Hypothermie modérée (28-30°C), perfusions cérébrale + viscérale continues par canulations sous-clavière droite et fémorale
- Position de Trendelenburg
- Normoglycémie, mannitol (↓ œdème cérébral)
- Anesthésie profonde (curarisation)
- Non-prouvés : Mg2+, thiopental, nimodipine, méthylprednisolone
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- ALTMAN DI, YOUNG RSK, YAGEL SK. Effects of dexamethasone in hypoxic ischemic brain injury in the neonatal rat. Biol Neonate 1984:46:149
- BELLINGER DC, NEWBURGER JW, WYPIJ D, et al. Behavior at eight years in children with surgically corrected transposition: the Boston Circulatory Arrest Trial. Cardiol Young 2009; 19:86-9
- BELLINGER DC, WERNOWSKY G, RAPPAPORT LA, et al. Cognitive developpment of children following early repair of transposition of the great arteries using deep hypothermic circulatory arrest. Pediatrics 1991 ; 87:701-7
- BELLINGER DC, WYPIJ D, DU PLESSIS AJ, et al. Developmental and neurologic effects of alpha-stat versus pH-stat strategies for deep hypothermic cardiopulmonary bypass in infants. J Thorac Cardiovasc Surg 2001; 121:374-83
- BELLINGER DC, WYPIJ D, KUBAN KC, et al. Developmental and neurologic status of children at 4 years of age after heart surgery with hypothermic circulatory arrest or low-flow cardiopulmonary bypass. Circulation 1999; 100: 526-32
- BISSONNETTE B, HOLTBY HM, PUA DAJ, et al. Cerebral hyperthermia in children after cardiopulmonary bypass. Anesthesiology 2000; 93:611-8
- BORGER MA, RAO V. Temperature management during cardiopulmonary bypass: Effect of rewarming rate on cognitive dysfunction. Semin Cardiothorac Vasc Anesth 2002; 6:17-20
- CROUGHWELL N, SMITH LR, QUILL T, et al. The effect of temperature on cerebral metabolism and blood flow in adults during cardiopulmonary bypass. J Thor Cardiovasc Surg 1992; 103:549-54
- DU PLESSIS AJ, JONAS RA, WYPIJ D. Perioperative effects of -stat versus pH-stat strategies for deep hypothermic cardiopulmonary bypass in infants. J Thorac Cardiovasc Surg 1997; 114:991-1000
- ENGELMAN R, BAKER RA, LIKOSKY DS, et al. The Society of Thoracic Surgeons, the Society of Cardiovascilar Anesthesiologists, and the American Society of Extracorporeal Technology: clinical practice guidelines for cardiopulmonary bypass – Temperature management during cardioplmonary bypass. J Cardiothorac Vasc Anesth 2015; 29:1104-13
- GOLDBERG CS, BOVE EL; DEVANEY EJ, et al. A randomized clinical trial of regional cerebral perfusion versus deep hypothermic circulatory arrest; outcomes for infants with functional single ventricle. J Thorac Cardiovasc Surg 2007; 133:880-7
- GREELEY WJ, KERN FH, UNGERLEIDER RM, ET AL. The effect of hypothermic cardiopulmonary bypass and total circulatory arrest on cerebral metabolism in neonates, infants and children. J Thorac Cardiovasc Surg 1991 ; 101 :783-94
- GREELEY WJ, UNGERLEIDER RM, SMITH LR, et al. The effects of deep hypothermic cardiopulmonary bypass and total circulatory arrest on cerebral blood flow in infants and children. J Thorac Cardiovasc Surg 1989; 97(5):737-45
- GRIGORE AM, GROCOTT HP, MATHEW JP, et al. The rewarming rate and increased peak temperature alter neurocognitive outcome after cardiac surgery. Anesth Analg 2002; 94:4-10
- GRIGORE AM, MURRAY CF, RAMAKRISHNA H, et al. A core review of temperature regimens and neuroprotection during cardiopulmonary bypass : does rewarming rate matter ? Anesth Analg 2009 ; 109 :1741-51
- HIRSCH JC, JACOBS ML, ANDROPOULOS D, et al. Protecting the infant brain during cardiac surgery: a systematic review. Ann Thorac Surg 2012; 94:1365-73
- HOGUE CW, PALIN CA, ARROWSMITH JE. Cardiopulmonary bypass management and neurologic outcomes: an evidence- based appraisal of current practices. Anesth Analg 2006; 103:21-37
- HOOVER LR, DINAVAHI R, CHENG WP, et al. Jugular venous oxygenation during hypothermic cardiopulmonary bypass in patients at risk for abnormal cerebral autoregulation: influence of -stat versus pH-stat blood gas management. Anesth Analg 2009; 108:1389-93
- IRISH CL, MURKIN JM, CLELAND A, et al. Neuromuscular blocked significantly decreases systemic oxygen consumption during hypothermic cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1991; 5:132-4
- KERN FH, GIESER WG, FARRELL DM. Extracorporeal circulation and circulatory assist devices in the pediatric patient. In: Lake CL. Pediatric cardiac anesthesia, 2nd edition. Norwalk : Appleton & Lange, 1993, pp 151-79
- KERN FH, UNGERLEIDER RM, QUILL TJ, et al. Cerebral blood flow response to changes in arterial carbon dioxide tension during hypothermic cardiopulmonary bypass in children. J Thorac Cardiovasc Surg 1991 ; 101 :618-22
- KERN FH, UNGERLEIDER RM, REVES JG, et al. The effect of altering pump flow rate on cerebral blood flow and cerebral metabolism in neonates, infants and children. Ann Thorac Surg 1993; 56:1366-72
- KIRKLIN JW, BARRAT-BOYES BG. Cardiac Surgery, 2nd edition, New-York: Churchill-Livingstone 1993, p 74
- MITCHENFELDER JD. The hypothermic brain. In: Anesthesia and the brain. New-York: Churchill-Livingstone, 1988, 23-34
- MITCHENFELDER JD, MILDE JH. The relationship among canine brain temperature, metabolism and function during hypothermia. Anesthesiology 1991; 75:130-6
- NEWBURGER JW, JONAS RA, WERNOVSKY G, et al. A comparison of the perioperative neurologic effects of hypothermic circulatory arrest versus low-flow cardiopulmonary bypass in infant heart surgery. N Engl J Med 1993; 329:1057-64
- NUSSMEIER NA, ARLUNG C, SLOGOFF S. Neuropsychological dysfunction after cardio-pulmonary bypass: cerebral protectiono by a barbiturate. J Cardiothorac Vasc Anesth 1991; 5:584-9
- PIGULA FA, KHALIL PN, MAYER JE, et al. Repair of tetralogy of Fallot in neonates and young infants. Circulation 1999; 100(Suppl II):157-61
- POUARD P, MAURIAT P, LABORDE N, BOURDARIAS B. Cicrulation extracorporelle en chirurgie cardiaque pédiatrique chez le nouveau-né, le nourrisson et l’enfant. In: JANVIER G, LEHOT JJ, eds. Circulation extracorporelle: principes et pratique, 2ème édition. Paris: Arnette (Groupe Liaison SA) 2004, 481-506
- REBEYKA I. Hypothermia. In: Jonas RA, Elliott MJ. Cardiopulmonary bypass in neonates, infants and young children. Oxford: Butterworth, 1994, 54-66
- SWAIN JA, McDONALD TJ, ROBBINS RC, et al. Relationship of cerebral and myocardial intracellular pH to blood pH during hypothermia. Am J Physiol 1991 ; 260 :H1640-4
- TAYLOR RH, BURROWS FA, BISSONNETTE B. Cerebral pressure-flow velocity relationship during hypothermic cardiopulmonary bypass in neonates and infants. Anesth Analg 1992; 74:636-42
- WESTERMAIER T, HUNGERHUBER E, ZAUSINGER S, et al. Neuroprotective efficacy of intra-arterial and intravenous magnesium sulfate in a rat model of transient focal cerebral ischemia. Acta Neurochir 2003; 145:393-9
- WHITING D, YUKI K, DINARDO JA. Cardiopulmonary bypass in the pediatric population. Best Pract Res Clin Anaesthesiol 2015; 29:241-56
- WHITLOCK RP, CHAN S, DEVEREAUX PJ, et al. Clinical benefit of steroid use in patients undergoing cardiopulmonary bypass : a meta-analysis of randomized trials. Eur Heart J 2008 ; 29 :2592-600
- XIONG Y, SUN Y, JI B, et al. Systematic review and meta-analysis of benefits and risks between normothermia and hypothermia during cardiopulmonary bypass in pediatric cardiac surgery. Paediatr Anaesth 2015; 25:135-42
- YOSIUMOTO T, SAKAMOTO T, WATANABE T, et al. Experimental cerebral infarction, part 3: Protective effect of mannitol in thalamic infarction in dogs. Stroke 1978; 9:217-22
