La relation entre le flux et le gradient de pression à travers une sténose est exponentielle; en effet, la résistance au fluide dans un tube est fonction de la quatrième puissance de son rayon (loi de Poiseuille) (voir Figure 5.139). L'augmentation de la résistance au flux est négligeable lorsque le rétrécissement de surface est inférieur à 50%, et faible jusqu'à 70% ; elle ne devient significative qu'à 75% et au-delà; une sténose doit donc être sévère pour devenir symptomatique. Comme la résistance varie avec la puissance 3 de la surface et que le rétrécissement progresse à raison de 0.1 cm2 par an en moyenne, l'évolution clinique se précipite dès que la sténose est serrée. En cas de sténose aortique, par exemple, la survie est inférieure à 2 ans lorsque la dyspnée apparaît.
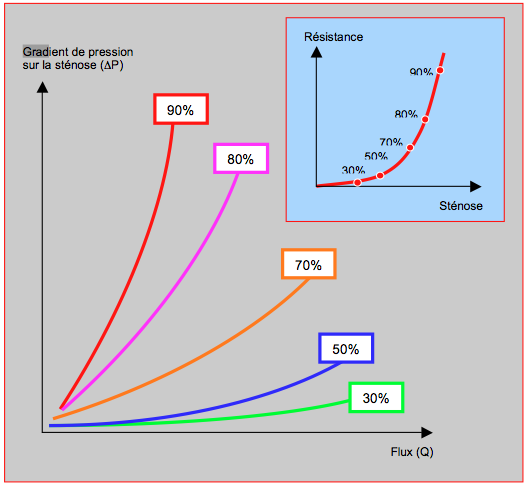
Figure 5.139 : Relation entre le flux et le gradient de pression à travers une sténose. Les courbes illustrent la relation pour différents degrés de rétrécissement dans un vaisseau de 3 mm de diamètre. En cartouche, la courbe démontre la variation de la résistance créée par la sténose en fonction du degré de rétrécissement de celle-ci. Les courbes sont exponentielles. En effet, la résistance au fluide dans un tube est fonction de la quatrième puissance de son rayon (loi de Poiseuille) [d'après: Klocke FJ. Measurements of coronary blood flow and degree of stenosis: Current clinical implications and continuing uncertainties. Newsl Council Clin Cardiol AHA 1982].
Le gradient de pression à travers une sténose s'élève avec le carré de la vélocité (loi de Bernoulli); la résistance augmente donc de manière exponentielle avec l'accroissement du flux sanguin. C'est la raison pour laquelle une épreuve d'effort, qui accélère le flux, peut démasquer de manière objective l'apparition de symptômes chez un patient qui dit n'en pas ressentir. D’une manière générale, les symptômes surviennent avant la décompensation ventriculaire dans les sténoses valvulaires, alors que les insuffisances se caractérisent par une dégradation fonctionnelle du VG qui s’installe avant la survenue de la symptomatologie clinique.
L'amélioration des résultats chirurgicaux ces vingt dernières années et la possibilité de réaliser des plasties plutôt que des remplacements valvulaires a poussé à intervenir plus tôt dans l'évolution de la maladie, alors que les patients sont encore paucisymptomatiques et que la fonction ventriculaire est peu modifiée. Dans ces conditions, une épreuve d'effort démasque souvent la souffrance du myocarde qui reste silencieuse au repos. En cas de sténose aortique, par exemple, l'ergométrie ou l'écho de stress à la dobutamine permettent d'objectiver l'indication opératoire dans trois circonstances différentes [6,8].
- Hibernation myocardique ischémique;
- Valvulopathie paucisymptomatique;
- Sténose serrée mais faible gradient de pression (≤ 30 mmHg).
Dans le premier cas, l'hypokinésie ou l'akinésie sont réversibles et bénéficieront d'une revascularisation coronarienne. Dans le deuxième cas, la survenue de dyspnée, d'angor ou d'hypotension en cours d'effort pose l'indication au remplacement valvulaire. En effet, un test anormal (symptômes, modification ST, augmentation du gradient > 18 mmHg ou augmentation de la pression artérielle de < 20 mmHg) sont des facteurs indépendants de morbidité et de mortalité à 2 ans [3]. Dans le troisième cas, le problème est de déterminer laquelle des deux possibilités est présente:
- Sténose aortique organique serrée accompagnée d'une défaillance ventriculaire gauche secondaire ou aggravée par l'excès de postcharge;
- Sténose aortique fonctionnelle due à une incapacité du VG défaillant à ouvrir correctement une valve simplement sclérosée.
L'examen au repos, que ce soit une échocardiographie, un CT-scan ou une IRM, ne permet pas de différencier les deux situations, qui ont pourtant des sanctions thérapeutiques très différentes. En effet, le remplacement valvulaire aortique (RVA) est bénéfique dans le premier cas (survie à 5 ans 65%, versus 11% pour le traitement médical), mais non dans le second, où le traitement est celui de l'insuffisance ventriculaire [10]. La situation s’éclaircit en examinant le rapport entre la vélocité dans la chambre de chasse du VG (VCCVG) et celle à travers la valve aortique (VVAo) pendant un écho de stress à la dobutamine (perfusion 5-10 mcg/kg/min) (Figure 11.30) [1,2,5,7].
- Si la sténose est organique et fixe, l’ouverture reste inchangée mais la Vmax et le gradient augmentent à travers la valve sous l’effet de la dobutamine (≥ 4 m/s et > 30-40 mmHg, respectivement). Sous stress, le rapport VCCVG / VVAo se creuse encore dans la sténose serrée parce que la VTIAo augmente davantage que la VTICCVG; il devient < 0.2.
- Si la sténose est fonctionnelle, l’ouverture valvulaire devient plus grande mais le gradient transvalvulaire ne se modifie pas. L’augmentation de contractilité du VG se traduit par une élévation de la Vmax dans la CCVG (de 0.6 à 1.0 m/s) mais non à travers la valve aortique (3 m/s), car celle-ci s’ouvre davantage sous l’effet du plus grand volume systolique sans que son gradient s’élève ; le rapport VCCVG / VVAo va donc augmenter (> 0.3).
- Le test, qui peut être réalisé en salle d’opération, permet également d’évaluer la réserve contractile du VG ; le pronostic est amélioré si le volume systolique augmente de > 20%.
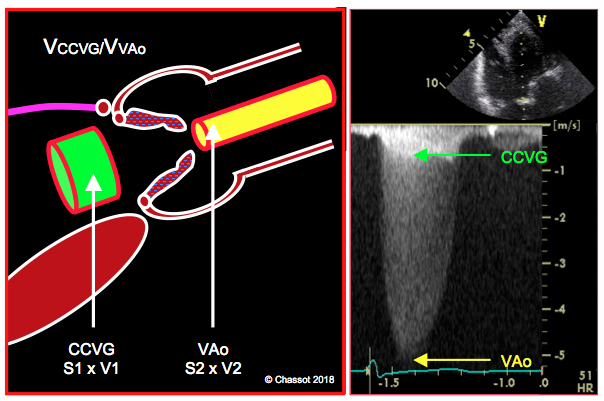
Figure 11.30: Rapport des vélocités entre la chambre de chasse du VG et la valve aortique (VCCVG/VAo). Le volume qui traverse la CCVG à chaque systole est le même que celui qui traverse la valve aortique; le rétrécissement de la valve impose une acélération au flux; le produit de la surface (S) et de la vélocité (V) reste constant. La vélocité du flux augmente donc proportionnellement au degré de rétrécissement. Dans une sténose aortique serrée, le rapport VCCVG/VAo est < 0.25, comme on le voit dans l’enregistrement Doppler continu à droite; dans ce cas, la VCCVG est 0.8 m/s et la VAo est 5.1 m/s; le rapport est 0.16, signant une sténose très serrée.
Une augmentation de pression de < 20 mmHg et de volume éjecté de < 20% pendant le test à la dobutamine sont de mauvais pronostic. Cette réponse inotrope insuffisante stigmatise une défaillance ventriculaire irréversible qui élève significativement la mortalité d’une intervention chirurgicale [3]. L’écho de stress est également utile pour démasquer les symptômes chez les porteurs de sténose serrée qui sont asymptomatiques ou qui se dissimulent la réalité en restreignant leur activité. Par contre, il est contre-indiqué chez les malades symptomatiques à gradient élevé [11].
Dans une sténose mitrale, l'épreuve de stress à la dobutamine différencie les patients dont le gradient transvalvulaire dépasse 15 mmHg ou dont la PAP augmente au-delà de 60 mmHg, même s'ils sont encore asymptomatiques au repos [8]. Ces cas sont de bons candidats pour un remplacement valvulaire mitral (RVM).
Lors d'insuffisance mitrale (IM) sévère asymptomatique, ou lors d'IM modérée peu symptomatique au repos, une échocardiographie de stress permet de distinguer les patients dont la PAP dépasse 60 mmHg à l'effort, car ils bénéficient d'une plastie mitrale précoce [4,7]. Dans l'IM ischémique, la pathologie est située dans le ventricule; le pronostic est nettement moins favorable que dans les maladies valvulaires proprement dites, aussi bien pour la reconstruction chirurgicale et la revascularisation que pour le traitement médical. L'écho de stress est utile pour définir la ligne thérapeutique dans essentiellement trois circonstances [9].
- Dyspnée d'effort hors de proportion avec l'importance de l'IM au repos;
- Episodes d'OAP sans cause évidente;
- IM modérée avant revascularisation chirurgicale.
| Epreuve d'effort |
|
Dans le cadre des valvulopathies, l'écho de stress à la dobutamine est très utile pour poser l'indication opératoire dans 3 circonstances:
- Patient paucisymptomatique
- Sténose serrée mais faible gradient transvalvulaire
- Hibernation myocardique
L'indication opératoire est confirmée lorsque le test d'effort révèle que:
- La PAP systolique augmente à > 60 mmHg dans la sténose ou l'insuffisance mitrale; le gradient augmente à > 15 mmHg dans la sténose mitrale
- Le gradient augmente à travers la valve aortique; si la sténose est fonctionnelle, le ventriculegauche ouvre davantage la valve sous dobutamine
et le gradient reste inchangé - L'hypokinésie/akinésie est réversible sous dobutamine
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- GRAYBURN PA. Assessment of low-gradient aortic stenosis with dobutamine. Circulation 2006; 113:604-6
- LANCELLOTTI P, LEBOIS F, SIMON M, et al. Prognostic importance of quantitative exercise Doppler echocardiography in asymptomatic aortic valvular stenosis. Circulation 2005; 112 Suppl I:I1377-82
- LANCELLOTTI P, TROISFONTAINES P, TOUSSAINT AC, et al. Prognostic importance of exercise-induced changes in mitral regurgitation in patients with chronic ischemic left ventricular dysfunction. Circulation 2003; 108:1713-7
- LASKEY WK, KUSSMAUL WG, NOORDEGRAAF A. Systemic arterial response to exercise in patients with aortic valve stenosis. Circulation 2009, 119:996-1004
- LIN SS, ROGER VL, PASCOE R, et al. Dobutamine stress Doppler hemodynamics in patients with aortic stenosis: feasibility, safety, and surgical correlations. Am Heart J 1998; 136:1010-6
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- PICANO E, PIBAROT P, LANCELLOTTI P, et al. The emerging role of exercise testing and stress echocardiography in valvular heart disease. J Am Coll Cardiol 2009; 54:2251-60
- PIERARD LA, LANCELLOTTI P. Stress testing in valve disease. Heart 2007; 93:766-72
- TRIBOUILLOY C, LEVY F, RUSINARU D, et al. Outcome after aortic valve replacement for low-flow/low-gradient aortic stenosis without contractile reserve on dobutamine stress echocardiography. J Am Coll Cardiol 2009; 53:1865-73
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
