La coarctation de l'aorte se présente comme un rétrécissement en sablier plus ou moins étendu ou comme une sténose sous forme de membrane située après le départ de l’artère sous-clavière gauche, juste en amont du canal artériel et du ligamentum arteriosum (Figures 14.71 et 14.72) (Vidéo).
Vidéo: Vue long-axe 90° de l'aorte descendante dans un cas de coarctation; le flux couleur montre une zone d'accélération présténotique (à droite à l'écran) et un flux accéléré tourbillonnaire distalement (en direction de la gauche de l'écran).
Vidéo: Vue long-axe 90° de l'aorte descendante dans un cas de coarctation; le flux couleur montre une zone d'accélération présténotique (à droite à l'écran) et un flux accéléré tourbillonnaire distalement (en direction de la gauche de l'écran).
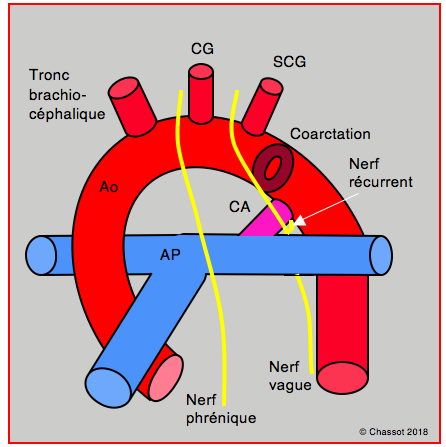
Figure 14.71 : Schéma anatomique de la coarctation de l’aorte. CA: canal artériel (violet). CG: carotide gauche. SCG: artère sous-clavière gauche. La boucle du nerf récurrent est dans le champ opératoire.
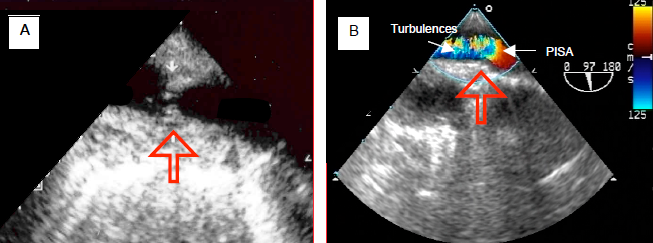
Figure 14.72 : Images échocardiographiques transoesophagiennes de la coarctation de l’aorte. A : membrane au niveau de l’isthme. B : flux Doppler couleur avec une zone d’accélération concentrique (PISA) en amont et des turbulences en aval de la membrane (flèche). Le flux aortique s'écoule de la droite vers la gauche.
La coarctation survient dans 0.3‰ des naissances et dans 5-7% des cardiopathies congénitales [2]. Chez les jeunes enfants, elle est associée dans la moitié des cas à une bicuspidie aortique, à une CIV, à un canal AV, à une hypoplasie de l’arc aortique ou à un canal artériel. Elle est caractérisée par une hypertension aux membres supérieurs et une hypotension aux membres inférieurs.
Lorsque la coarctation est très serrée à la naissance, la perfusion infra-ductale n’est assurée que par le canal artériel à partir du flux pulmonaire (shunt D-G); une perfusion de prostaglandine est requise pour y maintenir un débit suffisant (PGE1 0.01-0.05 mcg/kg/min). Dans ces conditions, le VD est connecté à la pression systémique inférieure. La partie inférieure du corps est hypoperfusée et cyanosée; il s’installe une ischémie splanchnique et une acidose métabolique. La correction doit avoir lieu pendant les premiers jours de vie, avant que le VG ne dysfonctionne à cause de l’excès de postcharge et avant que le canal ne se referme.
Dans les cas simples, le gradient de pression est supérieur à 35 mmHg. La coarctation impose une très forte postcharge au VG, qui s'hypertrophie de manière concentrique comme dans une sténose aortique et peut défaillir dans les premières années de vie. Un réseau collatéral très important par les artères périscapulaires, mammaires internes, cervicales et intercostales assure une perfusion en dessous de la lésion; il est visible à l'angiographie dès l'âge de 2 mois. Les intercostales dilatées sont à l'origine des entailles qui sont décelables à la radio du thorax sur le bord inférieur des côtes depuis l’âge de 5-8 ans. Un souffle systolique râpeux est audible le long du bord sternal gauche et dans le dos.
L'indication opératoire est posée lorsque le rétrécissement représente > 50% de la lumière ou que le gradient de pression est > 20 mmHg. Lorsque l’anatomie est favorable, la dilatation percutanée est le traitement de choix chez l'enfant; elle est moins invasive et évite le risque du clampage aortique et de l’ischémie médullaire [8]. Chez les nouveau-nés, par contre, le devenir est meilleur après résection chirurgicale [7]. Par voie chirurgicale, le risque opératoire principal est le clampage de l'aorte. Le danger est fonction de la densité des collatérales intercostales qui "pontent" la sténose. Il est plus grand lorsque le gradient de pression entre le bras droit et les membres inférieurs est faible, car la collatéralisation est alors peu développée. La sténose est habituellement courte et l'anastomose peut se réaliser bout-à-bout. Un un patch avec l'artère sous-clavière gauche ou préférentiellement avec un tissu synthétique évite une sténose résiduelle. Lorsque la lésion est longue, elle nécessite une résection et un pontage tubulaire, le plus souvent avec le soutien d'une CEC. Quelle que soit la technique, le risque de récidive est de 5-8% [7].
Pendant le clampage (< 20 minutes), la pression d’amont est mesurée au bras droit (cathéter radial) et la pression d’aval au membre inférieur (manchette à pression ou cathéter fémoral). La pression distale en dessous du clamp doit être maintenue à ≥ 30 mmHg chez le nouveau-né et à ≥ 50 mmHg chez l'enfant avec des vasoconstricteurs artériels (noradrénaline, néosynéphrine) de manière à faciliter le débit par les collatérales, où le flux est pression-dépendant, et à réduire les risques d’ischémie médullaire. Une poussée hypertensive au-dessus du clamp (160-200 mmHg) est moins dangereuse qu'une hypotension distale. Après l'opération, la chute de la pression diastolique et l’augmentation soudaine de la PetCO2 sont de bons marqueurs de la disparition du gradient de pression. Le taux de paraplégie postopératoire secondaire à l'ischémie médullaire est de 0.1-0.4% des patients [3,7].
Anesthésie
La prise en charge est différente selon qu’il s’agit d’une coarctation extrême chez un nouveau-né ou d’une lésion paucisymptomatique chez un grand enfant [4].
- Le nouveau-né est en défaillance gauche, en général sous perfusion de PGE1 pour maintenir un flux distal par le canal artériel. Il est menacé par l'acidose métabolique et l'ischémie digestive. Une technique basée sur des opiacés (fentanyl-midazolam) avec un support inotrope est la plus adéquate. L’extubation est tardive.
- Le grand enfant présente une hypertension artérielle aux membres supérieurs, une HVG importante et une dysfonction diastolique. L'isoflurane et la phentolamine permettent en général de contrôler la pression artérielle en-dehors de la période du clampage. Bien qu’elle assure le confort postopératoire, la péridurale thoracique (D4-D6) présente un danger certain à cause du risque d’hématome compressif dans une situation où il existe déjà un risque d’ischémie médullaire. L’extubation est rapide.
L’intervention a lieu par thoracotomie gauche. Le monitorage comporte deux SpO2 (bras droit et pied), un cathéter artériel dans l’artère radiale droite et une manchette à pression ou un cathéter fémoral au membre inférieur. La radiale gauche n'est pas utilisable car la sous-clavière gauche est en général prise dans le clamp aortique proximal. L'anesthésie est de type balancée conventionnelle (par exemple fentanyl-sevoflurane-rocuronium). Lorsque l'âge le permet, un tube à double lumière permet de maintenir le poumon gauche dégonflé. Une infiltration intercostale d'anesthésique local (bupivacaïne 0.25%) améliore l'antalgie postopératoire, bien que la péridurale thoracique soit plus efficace. Un cathéter intrathoracique pour l’administration d’anesthésiques locaux est une alternative élégante. Bien analgésié, l'enfant peut être extubé sur table.
Les complications sont nombreuses.
- Au déclampage de l'aorte, l'hypotension est importante car le réseau vasculaire distal est vasodilaté. A cause de l'ischémie, la partie inférieure du corps relâche beaucoup de valences acides; la PetCO2 s'élève.
- La paraplégie postopératoire secondaire à l'ischémie médullaire est rare chez le nouveau-né; son taux est de 0.1-0.4% chez l'enfant > 1 an [3]. Le principal facteur de risque est une durée de clampage qui dépasse 90 minutes [9].
- L'hypertension artérielle est fréquente, y compris après correction. Cette hypertension postopératoire présente un pic à 12-24 heures, probablement dû aux décharges des barorécepteurs réglés pour l'hypertension sus-lésionnelle, et une seconde phase après 2 à 3 jours liée à un taux excessif de rénine et d'angiotensine. Elle persiste chez 20-50% des enfants, de même que l'hypertrophie du VG [5].
- Dans les premiers jours postopératoires, une artérite mésentérique est fréquente; elle est due à l'hyperactivité sympathique et se traduit par des douleurs abdominales [1]. Elle peut se doubler d’une entérocolite nécrosante [6].
- La coarctation peut récidiver plusieurs années après résection chirurgicale; d'autre part, 20-30% des malades opérés présentent une hypertension artérielle persistante alors même que l'obstacle à été levé; ils ont aussi un risque augmenté d’hémorragie cérébrale sur rupture d’anévrysme [5].
- Autres complications : chylothorax, syndrome de Claude-Bernard-Horner, paralysie récurrentielle ou phrénique (voir ci-dessus Figure 14.71).
| Coarctation de l’aorte |
|
Caractéristiques :
- Lésion serrée du nouveau-né : la perfusion distale est assurée par le canal artériel
- HTA aux membres supérieurs, hypoTA aux membres inférieurs (ΔP > 20 mmHg)
- HVG concentrique
- Réseau collatéral thoracique
Recommandations pour l’anesthésie :
- SpO2 au bras droit et au membre inférieur
- Pression artérielle préductale mesurée au bras droit (cathéter radial), pression post-ductale
au membre inférieur (manchette à pression, cathéter fémoral)
- Pendant le clampage : maintenir la PA post-ductale > 60 mmHg (vasoconstricteur alpha)
- Post-clampage : poussée hypertensive, artérite mésentérique, risque de paraplégie
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- FISCHER A, BENEDICT CR. Adult coarctation of the aorta: anesthesia and postoperative management. Anaesthesia 1977; 32:533-8
- KAEMMERER H. Aortic coarctation and interrupted aortic arch. In GATZOULIS MA, et al, Eds. Diagnosis and management of adult congenital heart disase. Edinburgh, Churchill-Livingstone 2003, 253-64
- KEEN G. Spinal cord damage and operations for coarctation of the aorta: aetiology, practice and propects. Thorax 1987; 42:11-8
- LANZMAN IS, DAVIS PJ. Aortic coarctation: anesthetic considerations. Semin Cardiothor Vasc Anesth 2001; 5:91-7
- MALAN JE, BENATAR A, LEVIN SE. Long-term follow-up of coarctation of the aorta repaired by patch angioplasty. Int J Cardiol 1991; 30:23-9
- McELHINNEY DB, HEDRICK HL, BUSH DM, et al. Necrotizing enterocolitis in neonates with congenital heart disease: Risk factors and outcomes. Pediatrics 2000; 106:1080-7
- McCRINDLE BW. Coarctation of the aorta. Curr Opin Cardiol 1999; 14:448-52
- SILVERSIDES CK, KIESS M, BEAUCHESNE L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Outflow tract obstruction, coarctation of the aorta, tetralogy of Fallot, Ebstein anomaly and Marfan’s syndrome. Can J Cardiol 2010; 26:e80-e97
- VON OPPELL UO, DUNNE TT, DE GROOT MK, et al. Traumatic aortic rupture: twenty-year meta-analysis of mortality and risk of paraplegia. Ann Thorac Surg 1994; 58:585-93
