La place de l'ETO en chirurgie cardiaque est bien établie. Elle poursuit plusieurs buts.
- Evaluation de la fonction systolique et diastolique de chaque ventricule;
- Evaluation de la volémie;
- Diagnostic de l'ischémie;
- Diagnostic différentiel de l'hypotension réfractaire;
- Evaluation de la pathologie cardiaque avant la CEC;
- Evaluation de la correction chirurgicale après la CEC;
- Aide technique aux gestes chirurgicaux.
Des modifications thérapeutiques pharmacologiques basées sur l'interprétation de l'ETO surviennent dans 10-21% des cas, des modifications chirurgicales dans 7-11% des cas, et des décisions vitales immédiates dans 4-21% des situations d'urgence [2,3,4,8]. L'examen de routine pratiqué avant la CEC apporte de nouveaux diagnostics chez 10-15% des patients, ce qui modifie l'opération prévue dans 7-11% des cas; après la CEC, l’ETO justifie une reprise dans 2-3% des opérations [6,13]. Dans notre série lausannoise (12’986 examens), le taux de modifications dans la stratégie chirurgicale est de 6% avant CEC et de 3% après CEC [5].
A côté de ces données générales, l'ETO est très utile dans une série de situations en rapport direct avec la CEC. Ce sont notamment:
- Placement de guides et de canules;
- Placement d’endoprothèses;
- Evaluation de l'athéromatose de l'aorte;
- Dissection de l'aorte;
- Diagnostic de malformations anatomiques: FOP, VCSG;
- Dilatation du VG en cas d'insuffisance aortique;
- Débullage en fin de CEC;
- Découverte de thrombus intracardiaque;
- Sevrage de pompe.
Les différents plans de coupe et l'imagerie ETO sont décrits dans le Chapitre 25 et dans plusieurs excellents textes de recommandations [7,15].
Positionnement de cathéters et de canules
L'anesthésiste a pris l'habitude d'utiliser les ultrasons pour le repérage de la veine lors de ponction veineuse centrale. L'ETO permet en plus de contrôler la localisation du mandrin dans l'OD (Figure 7.33).
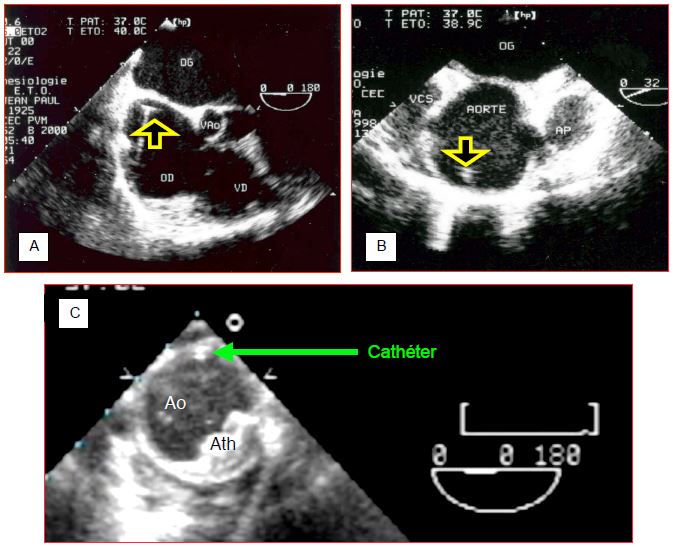
Figure 7.33 : Localisation du mandrin de voie centrale à l'ETO. A: Mandrin en bonne position dans l'oreillette droite. B: Mandrin malencontreusement situé dans l'aorte ascendante. C: Cathéter positionné dans l'aorte descendante. APD: artère pulmonaire droite. VCS: veine cave supérieure. AP: tronc de l'artère pulmonaire. Ao: aorte. Ath: athérome aortique.
Si le mandrin est invisible dans l'OD alors qu'il est introduit de plus de 20 cm dans la veine centrale, la recherche doit se porter sur l'aorte ascendante, où il est repérable au-dessus de la valve aortique. Si ce n'est pas le cas, il faut encore le rechercher à la jonction entre la crosse et l'aorte descendante, car le "J" de son extrémité peut le diriger distalement dans l'aorte, selon l'angle avec lequel il bute contre la paroi. Pour pouvoir ensuite visualiser correctement la canule ou le cathéter, il faut retirer le mandrin métallique, qui est très échogène. Outre la vérification de ses propres cathéters, l'anesthésiste peut guider le placement de canules particulières dont la position doit être précise. Par exemple, les canules veineuses placées dans l'OD et la veine cave supérieure (VCS) depuis une insertion fémorale vont facilement buter contre la membrane de la fosse ovale, ou passer dans l'OG par un foramen ovale perméable (FOP); les ultrasons permettent de guider l'opérateur dans ses manoeuvres pour viser la VCS (Figure 7.34).
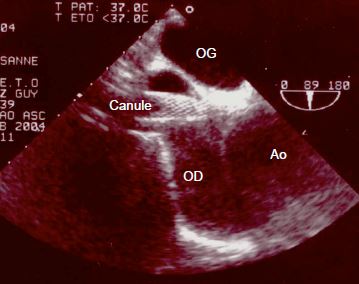
Figure 7.34 : Canule veineuse montée depuis la veine fémorale jusque dans l'OD où l'ETO découvre qu'elle butte dans l'angle entre le septum interauriculaire et la racine de l'aorte au lieu de s'enfiler dans la veine cave supérieure.
Il est possible de visualiser la canule dans le sinus coronaire lors de cardioplégie rétrograde [10]. Certaines canules artérielles souples sont introduites sur un guide dans l’aorte ascendante ou la sous-clavière droite; l’ETO permet de contrôler la position de leur extrémité distale dans la crosse. Lors de la mise en place d'une assistance ventriculaire, on peut contrôler la position des canules artérielles et veineuses et y mesurer le flux (Figure 7.35) [17].
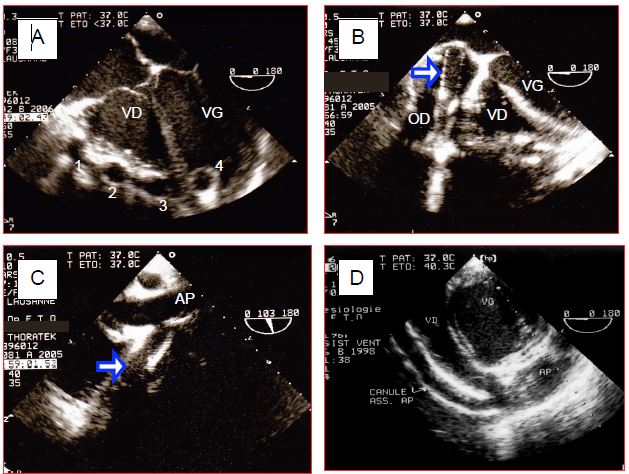
Figure 7.35 : Canules d’assistance bi-ventriculaire (Thoratek™). A : les 4 canules sur la face antérieure du cœur ; 1 : canule venant de l’OD ; 2 : canule allant dans l’aorte ; 3 : canule allant dans l’AP ; 4 : canule apicale dans le VG. B : canule dans l’OD ; cette canule est trop profonde et appuie fortement contre le septum interauriculaire. C : canule anastomosée à l’artère pulmonaire (AP). D : en vue transgastrique, on suit la canule d'assistance du VD jusque dans la chambre de chasse droite.
D'une manière générale, on repère plus facilement un cathéter dans un vaisseau lorsqu'on utilise un plan de coupe perpendiculaire à l'axe de ce dernier. En effet, l'ETO est une imagerie bidimensionnelle qui correspond à une tomographie; un cathéter peut être parallèle au plan longitudinal (long axe du vaisseau), et donc échapper à l'observateur parce que le champ de vision de l'ultrason passe en avant ou en arrière mais ne le coupe jamais. Pour contrôler le positionnement exact d'un objet, il faut utiliser deux plans de coupe perpendiculaires.
Athéromatose de l'aorte
L'examen de l'aorte descendante permet de décider si l'athéromatose est telle qu'elle contre-indique le placement d'une contre-pulsion intra-aortique (CPIA) avant la sortie de CEC (Figure 7.36) (Vidéo).
Vidéo: Vue court-axe de l'aorte descendante avec la présence d'un athérome mobile.
Vidéo: Vue court-axe de l'aorte descendante avec la présence d'un athérome mobile.
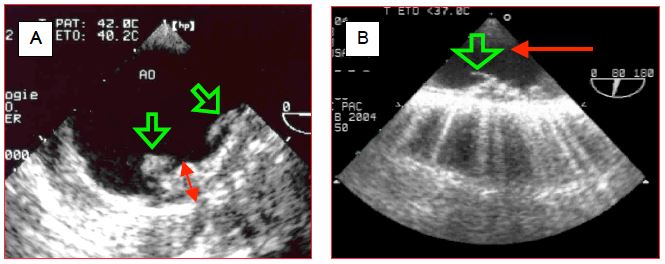
Figure 7.36 : Deux images ETO d'athéromatose de l'aorte descendante. A: Les masses athéromateuses sont protubérantes dans la lumière et la surface endovasculaire complètement irrégulière; la double flèche rouge en indique l’épaisseur (environ 1 cm). B: Un athérome pédiculé flotte dans la lumière comme un grelot; cette situation est hautement emboligène. La flèche rouge indique le sens du flux.
Le cas échéant, l'ETO offre la possibilité de positionner la CPIA à la bonne hauteur sans l'interruption opératoire que nécessite un contrôle radiologique: l'extrémité du cathéter doit se trouver 1 cm en dessous du départ de la sous-clavière gauche. Si le guide n'est pas visible dans l'aorte descendante, il faut se méfier d'un problème grave sur le trajet depuis l'artère fémorale: dissection, enroulement dans un anévrysme abdominal, fausse-route.
Comme l'oesophage et l'aorte descendante cheminent côte à côte dans le thorax, l'ETO est un examen privilégié de cette partie de l'aorte. Par contre, l'interposition de la bronche-souche droite entre l'oesophage et l'aorte ascendante limite la visibilité aux 5-6 premiers centimètres de cette dernière (Figure 7.37) et à la partie distale de la crosse [19].
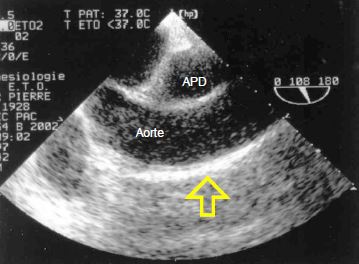
Figure 7.37: Athéromatose de l'aorte ascendante; présence d'une longue plaque d'athéromatose sur la face antérieure de l'aorte en vue longitudinale, dans la zone utilisée pour la canulation de CEC.
La palpation chirurgicale étant peu fiable, l'échographie épi-aortique est le seul moyen d'investiguer la totalité de l'aorte ascendante, de choisir le site de canulation, et de diminuer l'incidence d'embolies cérébrales (voir Chapitre 27 Echographie épi-aortique et Figure 27.70) [14,16]. L'ETO permet de poser l'indication à un examen épi-aortique en fonction du degré d'atteinte de l'aorte descendante, car il existe une bonne corrélation entre les lésions athéromateuses des deux segments de l'aorte thoracique [9]. En cas de lésions étendues et épaissies (stade III), protubérantes (stade IV) ou friables (stade V, lésions pendulaires, aorte "porcelaine") dans l'ascendante, il est recommandé de changer de stratégie chirurgicale pour la canulation artérielle de CEC [11].
- Canulation par l’artère sous-clavière droite.
- Canulation par une artère fémorale; cette option présente deux risques majeurs:
- Embolisation cérébrale par du matériel athéromateux de l’aorte descendante puisque le flux est rétrograde;
- Dissection aiguë par infiltration du flux au travers des plaques.
- Utilisation d'une canule aortique avec filtre déployable (Embol-X™).
- Occlusion avec un ballon intravasculaire monté depuis la fémorale (Heartport™).
- Pas de canulation de cardioplégie ni de clampage aortique: opération à coeur battant ou en fibrillation ventriculaire si cela est concevable.
- Pour les pontages aorto-coronariens: greffes artérielles multiples à partir des artères mammaires ou de l’aorte descendante.
- Dans les cas extrêmes, remplacement de l’aorte ascendante par une prothèse.
Ballon intra-aortique
Pour éviter de de clamper une aorte trop fragile, il arrive que l'on utilise un ballon gonflé dans l'aorte ascendante en guise de clampage. Cette technique implique la surveillance échocardiographique de certains phénomènes, parce que ce ballon a tendance à se déplacer soit distalement vers la valve aortique soit proximalement vers les vaisseaux de la crosse [21].
- Position du ballon au niveau de la jonction sino-tubulaire;
- Eventuelle protrusion du ballon entre les valvules aortiques;
- Eventuel déplacement distal du ballon (disparition de la vue ETO sur la racine de l’aorte);
- Présence d'insuffisance aortique;
- Débit de la cardioplégie dans la partie proximale de l'aorte.
Dissection iatrogène de l'aorte
La dissection de la paroi aortique par la canule artérielle est une complication iatrogène dramatique qui survient en début de CEC; le même phénomène peut arriver avec la canule de cardioplégie ou lors de canulation périphérique fémorale ou sous-clavière. L'évènement se caractérise par une hypotension soudaine et par une surpression dans la ligne artérielle. L'ETO permet de poser le diagnostic immédiatement [12]. En cas de dissection aortique A ou B, l'analyse du flux au Doppler couleur donne l'assurance que la canule perfuse la vraie lumière. De même lors de la mise en place d'endoprothèses, l'image échocardiographique permet de contrôler que le guide va acheminer la prothèse dans la vraie lumière et non dans le cul-de-sac de la dissection ou de l'anévrysme.
Une image trompeuse peut survenir en début de CEC lors de canulation artérielle fémorale et faire croire à une dissection rétrograde de l'aorte descendante [22]. Le perfusat de CEC, qui est plus froid et plus fluide que le sang, ne se mélange pas immédiatement avec ce dernier; il se forme momentanément deux couches parallèles dans l'aorte qui peuvent donner l'impression qu'elles sont séparées en une vraie et une fausse lumière. Cet effet se résout en 30-40 secondes. La canulation artérielle de CEC en position fémorale peut causer une dissection rétrograde de l'aorte abdominale et de l'aorte descendante, qui apparaît à l'ETO comme une membrane (flap) flottant dans la lumière aortique.
Diagnostic de malformations anatomiques
Certaines malformations congénitales bénignes passent inaperçues au cours de l'existence, mais peuvent causer des problèmes dans la situation particulière de la chirurgie cardiaque. C'est le fait par exemple du foramen ovale perméable (FOP), de la communication interauriculaire (CIA), ou de la veine cave supérieure gauche (VCSG). La présence d'une communication transatriale n'est pas dangereuse tant que la pression dans l'OG reste supérieure à celle de l'OD et que les oreillettes sont étanches. Si la POD augmente (PEEP, hypertension pulmonaire, défaillance droite), le shunt s'inverse et crée une hypoxémie par shunt droit-gauche. Lorsqu'une des deux oreillettes est ouverte à l'air ambiant par l'opérateur, des bulles peuvent pénétrer dans l'autre. Lors d’intervention dans le cœur gauche (opération sur la valve mitrale, par exemple), le FOP ou la CIA sont une source d’hémorragie continue depuis l’OD qui noye le champ opératoire. La chirurgie du coeur droit (plastie tricuspidienne, résection de chambre de chasse droite, par exemple) est possible à coeur battant pour autant que le septum interauriculaire soit étanche, sans quoi de l'air peut s'intoduire dans l'OG et emboliser dans le circuit artériel (embolie paradoxale). Il est donc important d'explorer le septum interauriculaire à l'ETO et, si nécessaire, de pratiquer un test aux microbulles (Figure 7.38) (Vidéo). La même remarque s'applique lors de la mise en place d'une assistance ventriculaire gauche.
Vidéo: Test aux microbulles; passage droit - gauche par bouffée lorsque la POD est supérieure à la POG au cours du cycle cardiaque.
Vidéo: Test aux microbulles; passage droit - gauche par bouffée lorsque la POD est supérieure à la POG au cours du cycle cardiaque.
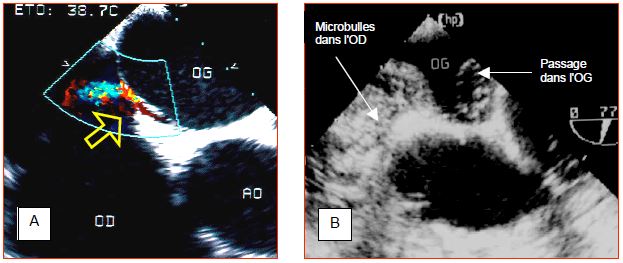
Figure 7.38 : Foramen ovale perméable (FOP). A : flux gauche-droit à travers le FOP tel qu'on le voit au Dopper couleur. B : Test aux microbulles. L'injection par voie centrale de 10 ml NaCl 0.9% au préalablement agité pour créer des microbulles par cavitation remplit toute l'OD et met en évidence le passage de bulles dans l'OG. La première image démontre le passage G-D, alors que la seconde illustre le passage D-G, dans la mesure où il existe. Chacune des deux suffit à poser le diagnostic de FOP.
Un FOP est une découverte courante dans la population normale; son incidence varie de 5-10% à l'échocardiographie bidimensionnelle, à 24% lors d'autopsie ou 27% à l'inspection directe peropératoire, où il se présente comme une fente d’environ 20 mm [1,5,18]. La découverte d'une CIA inconnue est plus rare.
La veine cave supérieure gauche (VCSG) se jette dans la grande majorité des cas dans le sinus coronaire; ce dernier est dilaté à cause de l'augmentation de débit. En l'absence d'insuffisance ventriculaire droite et d'insuffisance tricuspidienne majeure, la découverte d'une dilatation du sinus coronaire doit faire suspecter le diagnostic (Figure 7.39) (Vidéo). La veine cave supérieure droite peut être présente ou absente, ce qui pose évidemment un problème d'abord vasculaire pour la voie centrale.
Vidéo: Dilatation majeure du sinus coronaire dans un cas de veine cave supérieure gauche; le sinus coronaire apparaît comme un tube vertical en haut de l'écran, qui se draine dans l'OD; le VD est hypertrophié dans le cadre d'une tétralogie de Fallot.
Vidéo: Dilatation majeure du sinus coronaire dans un cas de veine cave supérieure gauche; le sinus coronaire apparaît comme un tube vertical en haut de l'écran, qui se draine dans l'OD; le VD est hypertrophié dans le cadre d'une tétralogie de Fallot.
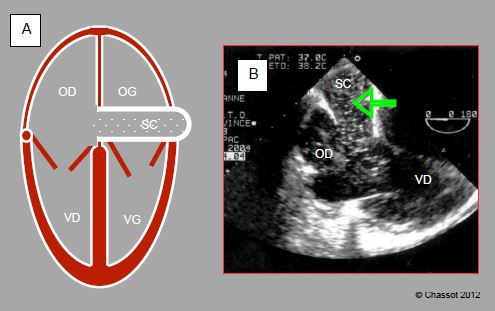
Figure 7.39 : Veine cave supérieure gauche (VCSG). A : représentation schématique de la dilatation du sinus coronaire (SC) (≥ 1.5 cm) en vue 4-cavités. B : injection de microbulles dans une veine du membre supérieur gauche; elles apparaissent dans le sinus coronaire (flèche) avant d’arriver dans l’OD.
La présence d'une VCSG pose deux problèmes au chirurgien.
- La cardioplégie rétrograde est impossible parce que le perfusat fuit dans la circulation systémique sans perfuser le cœur;
- Le débit de la VCSG alimente l'OD en permanence lors de canulations caves séparées et met l’OD sous tension.
La VCSG pose aussi deux problèmes à l'anesthésiste: le risque de thrombose du sinus coronaire contre-indique l'utilisation d'une PVC à long terme, et l'introduction de Swan-Ganz est impossible par voie jugulaire ou sous-clavière gauches.
Insuffisance aortique
Même sans traduction clinique, une insuffisance aortique (IA) est potentiellement dangereuse dans le contexte de la CEC. En effet, dès que la fréquence cardiaque se ralentit pendant le refroidissement, la valve aortique fuit dans le VG sous la pression que génère la pompe et le dilate. D'autre part, la cardioplégie administrée par la racine de l'aorte après le clampage de celle-ci s'écoule en bonne partie dans le ventricule par la fuite aortique; le VG est mis sous tension et se dilate puisqu’il ne se contracte plus et ne peut plus éjecter ce qu’il reçoit. Le taux de découverte fortuite d'IA par l'ETO avant la CEC est de 5% (Figure 7.40) (Vidéo) [5].
Vidéo: Insuffisance aortique modérée en vue long-axe 130° de la racine aortique.
Vidéo: Insuffisance aortique modérée en vue long-axe 130° de la racine aortique.
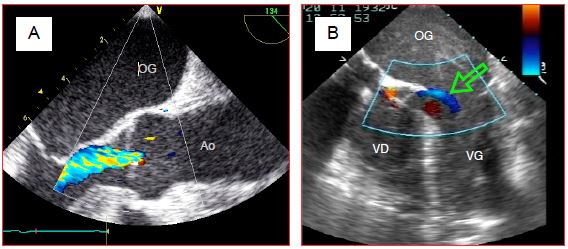
Figure 7.40 : Insuffisance aortique (IA). A : vue long-axe de la racine de l’aorte ; le jet couleur dans la chambre de chasse du VG indique la présence d’une IA. B : en cours de cardioplégie, la valve aortique fuit en permanence dans le VG, comme en témoigne le flux bleu (flèche) qui s’écoule dans la chambre de chasse gauche (vue 4-cavités).
Il est capital de surveiller le VG en début de CEC et pendant la cardioplégie pour signaler toute dilatation à l'opérateur qui peut interrompre la perfusion, comprimer le ventricule à la main, ou le drainer (Vidéo). On porte la même attention au VG lorsqu'on réalise une opération en fibrillation ventriculaire continue ou lorsqu'on implante une assistance ventriculaire gauche.
Vidéo: Fuite intraventriculaire de la cardioplégie en cas d'insuffisance aortique, même mineure, lorsque le VG s'arrête et n'éjecte plus; ce flux conduit à une dilatation dangereuse du ventricule.
Vidéo: Fuite intraventriculaire de la cardioplégie en cas d'insuffisance aortique, même mineure, lorsque le VG s'arrête et n'éjecte plus; ce flux conduit à une dilatation dangereuse du ventricule.
Thrombus intracavitaire
La présence d'un thrombus est suspectée dans l'appendice auriculaire gauche en cas de stase ou de fibrillation auriculaire (sténose mitrale, insuffisance ventriculaire gauche) lorsqu'on remarque du contraste spontané dans l'OG à l'examen de routine (Figure 7.41) (Vidéo).
Vidéo: Thrombus dans l'appendice auriculaire gauche; présence d'une prothèse mécanique en position mitrale.
Vidéo: Thrombus dans l'appendice auriculaire gauche; présence d'une prothèse mécanique en position mitrale.
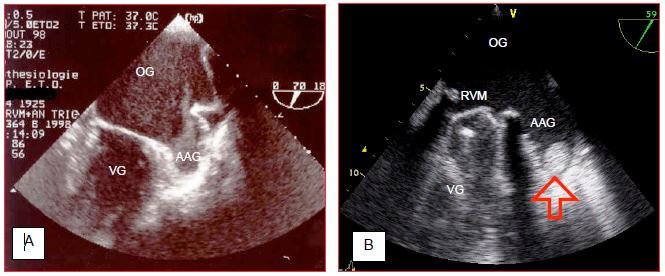
Figure 7.41 : Stase et thrombus dans l'appendice auriculaire gauche (AAG). A: contraste spontané dans l'AAG. B: Petit thrombus découvert fortuitement dans l'AAG chez un malade dont la prothèse valvulaire mitrale (valve mécanique, RVM) est dysfonctionnelle.
En cas d'akinésie apicale et de dysfonction ventriculaire gauche (FE < 0.35), on peut trouver un thrombus à l'apex du VG (Figure 7.42) (Vidéo).
Vidéo: Thrombus étendu à l'apex du VG.
Vidéo: Thrombus étendu à l'apex du VG.
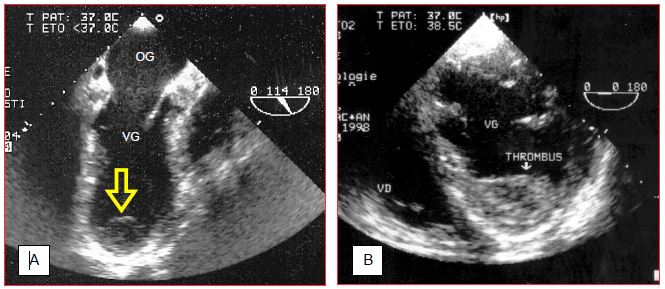
Figure 7.42 : Thrombus pariétal dans le VG. A : thombus apical dans un cas d'akinésie apicale 10 jours après infarctus; ce thrombus est faiblement implanté et peut facilement emboliser. B : thrombus mural laminaire recouvrant une zone akinétique antéro-septale. Ce type de thrombus est solidement ancré dans les trabéculations; il est préférable de le laisser en place, car son extraction va le fragmenter et augmenter les risques emboliques.
Ces informations sont capitales pour le chirurgien, qui doit éviter de déloger ces thrombi en manipulant le cœur, vu le risque d’embolisation. La décision d'explorer la cavité concernée pour en extraire le thrombus est fonction de sa mobilité; elle le fruit d'un consilium entre l'anesthésiste, le chirurgien et éventuellement le cardiologue. On peut aussi découvrir un thrombus dans une cavité gauche en fin d'opération, lorsque l'anticoagulation peropératoire a été insuffisante. Dans ce cas, la mobilité et le risque embolique commandent un retour immédiat en CEC pour extraire le thrombus (Figure 7.43) (Vidéo).
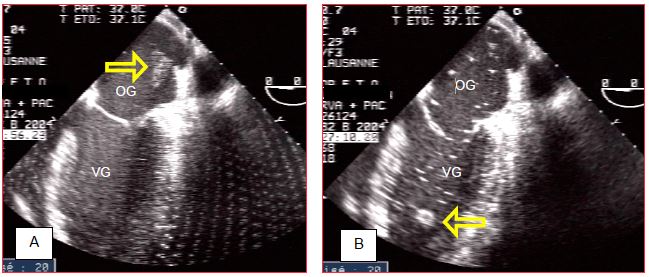
Figure 7.43 : Thrombus dans l'OG en fin de CEC (découverte fortuite). A: le thrombus flotte vers l'abouchement de la veine pulmonaire supérieure gauche. B: le thrombus flotte dans le VG. Un retour immédiat en CEC est impératif pour le récupérer avant qu'il n'embolise en périphérie. Sa taille en fait un bon candidat pour obstruer une carotide. De nombreuses bulles flottent dans l'OG et le VG.
L'invagination accidentelle de l'appendice auriculaire gauche au cours de la chirurgie peut ressembler à un thrombus dans l'OG.
Débullage en fin de CEC
L'air s'introduit dans les cavités gauches lors de cardiotomie et s'accumule dans les endroits qui se trouvent au zénith des chambres cardiaques en décubitus dorsal: la veine pulmonaire supérieure droite, le haut du septum interauriculaire dans l'OG, l'angle mitro-aortique, le septum antéro-apical dans le VG, et le sinus de Valsalva droit. Le 75% des malades opérés pour des valvulopathies gauches présente des embolies gazeuses [20]. L'air peut également s'introduire dans les pontages aorto-coronariens et la coronaire droite, parce qu'ils s'implantent sur la face antérieure de l'aorte. Les bulles d'air apparaissent à l'ETO comme des particules blanches et brillantes qui suivent le flux sanguin ou s'accumulent dans les tissus reperfusés (Figure 7.44).
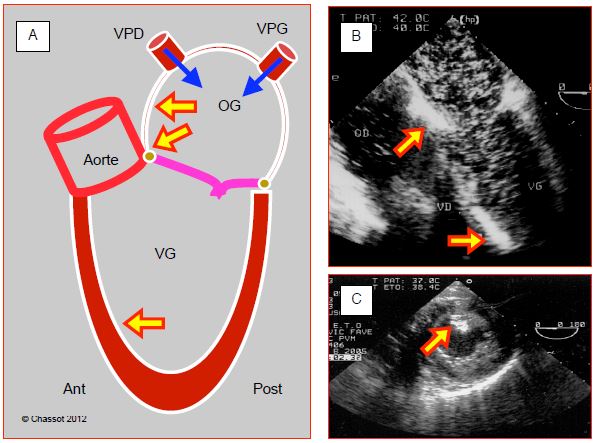
Figure 7.44 : Accumulation d’air dans le cœur gauche en fin de CEC. A : l’air provient de la cardiotomie gauche et des veines pulmonaires droite (VPD) et gauches (VPG); il a tendance à s’accumuler aux endroits les plus surélevés: angle entre le septum interauriculaire et le toit de l’OG, angle mitro-aortique, septum interventriculaire antéro-apical (en position de Trendelenburg). B : vue 4 cavités avec d’innonbrables bulles dans l’OG et le VG, ainsi que deux zones d’accumulation contre le septum interauriculaire et dans les trabéculations du septum interventriculaire antéro-apical. C : embolisation d’air dans le muscle papillaire postérieur (territoire de la coronaire droite).
Les bulles d'air sont très échogènes et prennent deux formes différentes [5].
- Miliaire de microbulles, minuscules et peu contrastées; elles sont sans incidence sur le status neurologique postopératoire.
- Petites navettes brillantes qui dansent dans les chambres cardiaques (Vidéo) et s’accumulent en larges nappes dans les endroits en surplomb. Leur identification et leur localisation à l'ETO permettent une vidange plus adéquate, et, de ce fait, peuvent améliorer le pronostic neurologique des patients.
Vidéo: Accumulation de microbulles dans le VG et l'OG en fin de CEC, avant la mise en charge.
Noyer la cavité péricardique sous un flux constant de CO2 (1-2 L/min) pendant l'opération permet de remplacer l’air par un gaz plus soluble dans le sang et de diminuer ainsi la taille et le nombre des bulles.
Sevrage de la pompe
Enfin, l'ETO est un outil indispensable pour élucider les problèmes qui se posent en sortant de CEC: hypovolémie, dysfonction du VG ou du VD, ischémie aiguë d'un territoire coronarien, dysfonction d'une valve prosthétique, problème sur une correction chirurgicale, évaluation du débit cardiaque, etc.
| ETO pendant la CEC |
|
L’échocardiographie transoesophagienne (ETO) a plusieurs points d’impact en rapport avec la CEC:
- Identification de risques (athérome aortique, insuffisance aortique, thrombus
intracardiaque)
- Identification de lésions iatrogènes (dissection aortique, CIV)
- Anomalie anatomique (FOP, CIA, veine cave supérieur gauche)
- Positionnement de canules (canule veineuse cave, cathéter dans le sinus coronaire, CPIA)
- Débullage de l’air
- Evaluation de la volémie et de la fonction ventriculaire avant la mise en charge
- Evaluation de la contractilité segmentaire (réfection de pontage)
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- AGOUSTIDES JGT, WEISS SJ, WEINER J, et al: Diagnosis of patent foramen ovale with multiplane transesophageal echocardiography in adult cardiac surgical patients. J Cardiothorac Vasc Anesth 2004; 18:725-30
- BETTEX DA, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie réanimation. Paris, Pradel-Masson, 1997
- BETTEX DA, SCHMIDLIN D, BERNATH MA, PRETRE R, HURNI M, CHASSOT PG. Intraoperative transesophageal echocardiography in pediatric congenital cardiac surgery: A two-center observational study. Anesth Analg 2003; 97:1275-82
- BRANDT RR, OH JK, ABEL MD, et al. Role of emergency intraoperative transesophageal echocardiography. J Am Soc Echocardiogr 1998; 11:972-7
- CHASSOT PG. Analyse rétrospective et prospective de 12’986 échocardiographies transoesophagiennes peropératoires. CHUV, 2008. Données non-publiées
- ELTZSCHIG HK, ROSENBERGER P, LÖFFLER M, et al. Impact of intraoperative transesophageal echocardiography on surgical decisions in 12,566 patients undergoing cardiac surgery. Ann Thorac Surg 2008;85 :845-53
- HAHN RT, ABRAHAM T, ADAMS MS; et al Guidelines for performing a comprehensive transesophageal echocardiography examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular anesthesiologists. J Am Soc Echocardiogr 2013; 26:921-64
- KALLMEYER IJ, COLLARD CD, FOX JA, et al. The safety of intraoperative transesophageal echocardiography. Anesth Analg 2001; 92:1126-30
- KONSTADT SN, REICH DL, KAHN R, et al. Transesophageal echocardiography can be used to screen for ascending aortic atherosclerosis. Anesth Analg 1995; 81:225-33
- LICINA MG, SAVAGE RM, HEARN CH, KRAENZLER EJ. The role of transesophageal echocardiographhy in perfusion management. Semin Cardiothorac Vasc Anesth 2001; 5:321-34
- MENKIS AH. Management of the ascending aorrta in routine cardiac surgery. Semin Cardiothorac Vasc Anesth 2004; 8:19-24
- MICHAELS IK, NEUSTEIN SM. Sudden hypotension before cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1998; 12:231
- MICHEL-CHERQUI M, CEDDAHA A, LIU N, et al. Assessment of systematic use of intraoperative trasesophageal echocardiography during cardiac surgery in adults: A prospective study of 203 patients. J Cardiothorac Vasc Anesth 2000; 14:45-50
- MURKIN JM, MENKIS AH, DOWNEY D, et al. Epiaortic scanning decreases cerebral emboli during aortic canulation and application of partial occlusion clamp. Ann Thorac Surg 1999; 68:1461-7
- REEVES ST, FINLEY AC, SKIBAS NJ, et al. Basic perioperative transesophageal echocardiography examination: a consensus stetement of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. Anesth Analg 20113; 117:543-58
- REEVES ST, GLAS KE, ELTZSCHIG H, et al. Guidelines for performing a comprehensive epicardial echocardiographic examination: Recommendations of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2007; 20:427-37
- SCALIA GM, McCARTHY PM, SAVAGE RM, et al. Clinical utility of echocardiography in the management of implantable ventricular assist devices. J Am Soc Echocardiogr 2000; 13:754-63
- SCHNEIDER B, ZIENKIEWICZ T, JANSEN V, et al. Diagnosis of patent foramen ovale by transesophageal echocardiography and correlation with autopsy findings. Am J Cardiol 1996; 77:1202-9
- SYLVIRIS S, CALAFIORE P, MATALANIS G, et al. The intraoperative assessment of ascending aortic atheroma: epiaortic imaging is superior to both transesophageal echocardiography and direct palpation. J Cardiothorac Vasc Anesth 1997; 11:704-10
- TINGLEFF J, JOYCE FS, PETTERSON G. Intraoperative echocardiography study of air embolism during cardiac operations . Ann Thorac Surg 1995; 60:673-7
- VISTARINI N, AIELLO M; MATTIUCCI G, et al. Port-access minimally invasive surgery for atrial septal defects: a 10-year single-center experience in 166 patients. J Thorac Cardiovasc Surg 2010; 139:139-45
- WALKE CM, CLEMENTS F, GLOWER DD, et al. False-positive diagnosis of aortic dissection associated with femoral cardiopulmonary bypass. Anesthesiology 1998; 88:1119-21
