La cardiomyopathie hypertrophique (CMH), ou cardiomyopathie obstructive (CMO), ou sténose sous-aortique dynamique de l'adulte, est une maladie primaire du sarcomère [3,5,20,23]. Les zones hypertrophiques contiennent un excès de cellules myocardiques aux formes bizarres et désorganisées; la matrix collagène y est anormalement développée; les canaux calciques lents y dysfonctionnent, comme le prouve leur rétablissement par la ranolazine (Ranexa©) [1]; la contraction myocardique longitudinale y est réduite [23]. Les artérioles coronaires intramyocardiques ont une paroi épaissie et leur lumière est rétrécie. Ces zones, qui représentent environ 30% du myocarde, s'étendent sur un plus ou moins grand volume du septum interventriculaire à partir de la partie supérieure de celui-ci (chambre de chasse) ; elles se continuent dans la paroi antéro-latérale du VG dans 70% des cas [17]. Elles représentent probablement le substrat anatomique à l'arythmogénicité de la maladie en réalisant des circuits de réentrée. L'épaisseur du septum est au moins 1.5 fois celle de la paroi postérieure du VG (≥ 15 mm, en moyenne 22 mm) [23]. L'obstruction à l'éjection du VG induit une hypertrophie secondaire du ventricule, mais les cellules des autres parois sont en général normales. La dysfonction diastolique due à l'épaississement de la paroi du VG élève les pressions de remplissage et provoque une dilatation de l'OG. Il s'agit d'une maladie familiale à caractère autosomal dominant à pénétrance variable liée à une douzaine de gènes codant des protéines sarcoplasmiques [13,16,20]. Elle n'est pas rare, puisque sa prévalence est de 0.2% (1:500) chez le jeune adulte [12,22].
La première manifestation de la maladie est souvent une syncope à l'effort ou une mort subite. La CMH est la cause la plus fréquente de mort subite chez le jeune et chez l'athlète [12]. Les principaux facteurs de risque pour les arythmies sévères sont une anamnèse familiale de mort subite, une anamnèse personnelle de syncopes, une épaisseur extrême du septum interventriculaire (> 30 mm) et des épisodes de tachycardie ventriculaire non-soutenue [2].
Obstruction dynamique de la CCVG
L'hypertrophie du septum interventriculaire empiète sur la lumière de la chambre de chasse du VG (CCVG) lorsque le muscle se contracte, et y provoque une obstruction systolique dynamique. Ce rétrécissement est la cause d'une accélération majeure du flux systolique. La vélocité devient telle que le feuillet antérieur de la valve mitrale est aspiré dans la CCVG par effet Venturi ; c'est le Systolic Anterior Motion (SAM) (Vidéo).
Vidéo: Sub-obstruction dynamique de la chambre de chasse gauche par le déplacement du feuillet mitral antérieur (SAM) en mésosystole; le feuillet se coude et vient au contact du septum interventriculaire en cours de systole (vue long-axe 140°).
Le feuillet antérieur contribue encore à l'obstruction de la chambre de chasse. Un gradient de pression important (> 30 mmHg au repos) apparaît alors dans la deuxième moitié de la systole, lorsque le ventricule est contracté ; ce gradient peut s'élever jusqu'à 170 mm Hg. L'aspiration du feuillet antérieur de la mitrale (SAM) ouvre la valve à mi-systole et provoque une insuffisance mitrale méso-télésystolique. Cette obstruction dynamique de la chambre de chasse gauche survient chez 30-44% des malades souffrant de cardiomyopathie hypertrophique [15,17].
Vidéo: Sub-obstruction dynamique de la chambre de chasse gauche par le déplacement du feuillet mitral antérieur (SAM) en mésosystole; le feuillet se coude et vient au contact du septum interventriculaire en cours de systole (vue long-axe 140°).
Le feuillet antérieur contribue encore à l'obstruction de la chambre de chasse. Un gradient de pression important (> 30 mmHg au repos) apparaît alors dans la deuxième moitié de la systole, lorsque le ventricule est contracté ; ce gradient peut s'élever jusqu'à 170 mm Hg. L'aspiration du feuillet antérieur de la mitrale (SAM) ouvre la valve à mi-systole et provoque une insuffisance mitrale méso-télésystolique. Cette obstruction dynamique de la chambre de chasse gauche survient chez 30-44% des malades souffrant de cardiomyopathie hypertrophique [15,17].
Cependant, l'effet Venturi n'explique pas le SAM à lui seul, car le SAM débute avant l'accélération du flux aortique [25]. D'autres mécanismes structurels jouent un rôle capital [4,9,10,18,21]. Normalement, le point de coaptation entre les deux feuillets de la valve mitrale est maintenu éloigné postérieurement de la chambre de chasse par plusieurs éléments (Figure 13.9).
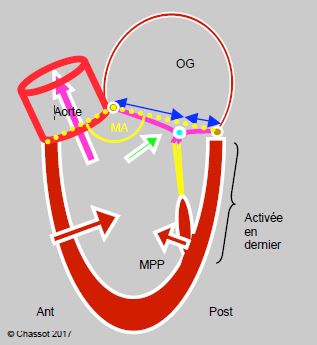
Figure 13.9: Schématisation du rapport normal entre la valve mitrale et la chambre de chasse du VG (CCVG). L'angle mitro-aortique (MA, en jaune) est ouvert. Le point de coaptation de la valve mitrale est situé au quart postérieur du diamètre de la valve. La paroi postérieure a moins de course que la paroi antérieure; elle est activée en dernier. La pression intraventriculaire maintient l’occlusion de la mitrale (flèche verte) en appuyant les deux feuillets l'un contre l'autre. Le système est construit pour maintenir le point de coaptation de la mitrale aussi éloigné que possible de la CCVG en systole.
- L'angle mitro-aortique est assez ouvert pour éloigner la chambre d'admission de la chambre de chasse ; le flux de remplissage diastolique et le flux d'éjection systolique sont presque parallèles.
- Le feuillet mitral antérieur est plus long que le postérieur.
- Le déplacement radiaire vers l’intérieur de la paroi postérieure est plus faible que celui de la paroi antérieure et de la paroi latérale.
- La paroi postéro-basale est activée électriquement en dernier.
- La pression intraventriculaire assure l'étanchéité de la valve mitrale en appuyant les deux feuillets l'un contre l'autre.
Plusieurs phénomènes structurels contribuent au déplacement antérieur du point de coaptation de la valve mitrale (Figure 13.10) [7,25,27].
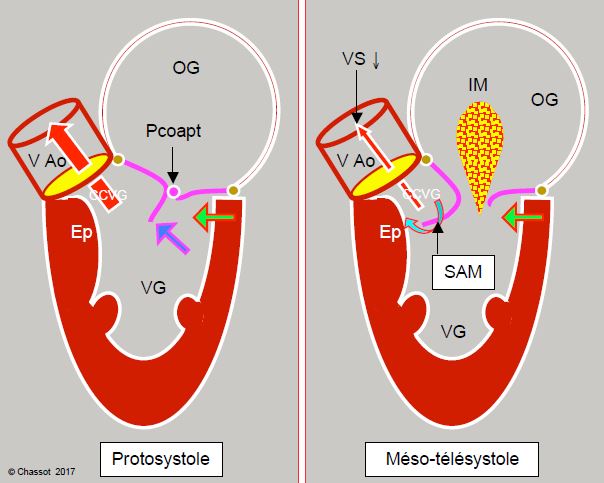
Figure 13.10 : Sténose sous-aortique dynamique dans la cardiomyopathie hypertrophique. L’hypertrophie concentrique et le rétrécissement de la cavité ventriculaire (souvent agravé par l'hypovolémie, par la baisse de postcharge ou par la surstimulation inotrope béta) déplacent la partie postérobasale du VG vers l'avant (flèche verte). En protosystole, le feuillet antérieur et le point de coaptation (Pcoapt) de la valve mitrale sont déplacés vers la chambre de chasse (CCVG), l’angle entre le plan de la valve aortique et celui de la valve mitrale se referme (angle mitro-aortique : pointillé vert). Le point de coaptation est situé entre le bord du feuillet postérieur et le corps du feuillet antérieur, la partie distale de ce dernier flottant à l'intérieur du VG (flèche bleue). En début de systole, la pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. L’accélération du flux dans la CCVG crée ensuite un effet Venturi qui aspire secondairement le feuillet antérieur de la mitrale (SAM). En mésotélésystole, le feuillet mitral contribue à l’obstruction dynamique de la CCVG. Comme la valve mitrale n’est plus occluse, une régurgitation mitrale (IM) apparaît dans la deuxième moitié de la systole. Ep : éperon septal hypertrophié. HVG: hypertrophie ventriculaire gauche. SAM : systolic anterior motion. VAo: valve aortique.
- Lors d’hypertrophie concentrique du VG, la cavité ventriculaire diminue de taille, la paroi postérieure se rapproche de la chambre de chasse, car la jonction antérieure entre l'aorte et la mitrale est un point fixe ancré sur le trigone, qui forme le squelette fibreux reliant entre elles les valve mitrale, aortique et tricuspide. Seule la partie postéro-latérale peut se déplacer vers l'intérieur lorsque le VG se rétrécit.
- L'angle mitro-aortique est plus fermé à cause de l’hypertrophie septale asymétrique et du déplacement vers l’avant de la paroi postérieure.
- La majorité des patients présente une élongation des feuillets mitraux; en systole, l'excès de tissus du feuillet antérieur (FA) flotte à l'intérieur du VG. Le jeu des pressions pousse la partie distale du FA vers la CCVG qu'elle tend à occlure.
- Une anomalie des muscles papillaires (positionnement très antérieur, extrémité bifide) déplace le plan de coaptation mitral vers l'avant. Outre la CMH, ceci survient également dans la maladie de Barlow ou après plastie mitrale.
- L’hypovolémie et la vasoplégie diminuent le volume ventriculaire au point que le diamètre antéro-postérieur se réduit trop au cours de la systole.
- Une stimulation β excessive augmente la course systolique radiaire de la paroi postérieure qui vient trop en avant.
Ces phénomènes rapprochent le point de coaptation mitral de la chambre de chasse au cours de la systole. La pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. Comme cela survient en cours de systole, le flux est déjà accéléré dans la chambre de chasse et le feuillet antérieur peut alors être aspiré par effet Venturi. La vélocité maximale atteinte dans la CCVG est > 2.5 m/s; le gradient est > 30 mmHg au repos et > 50 mmHg à l'effort [5,6]. Le rétrécissement mésosystolique de la CCVG diminue le volume systolique, ce qui se traduit par un collapsus partiel des feuillets de la valve aortique (voir Figure 13.13). Lorsque la maladie affecte tout le ventricule, il peut arriver que l'obstruction se situe dans le corps du ventricule ; l'oblitération de la cavité en télésystole isole la zone apicale qui ne se vide pas normalement et donne une fausse impression de dyskinésie apicale [18,19].
Le phénomène du SAM se prépare déjà en diastole. Normalement, la grande ouverture de l'angle mitro-aortique dirige le flux mitral diastolique légèrement vers l'arrière et non en droite ligne vers l'apex. Il se forme un large vortex dans le corps du VG qui dirige le flux sanguin vers la chambre de chasse, prêt à être éjecté à la systole suivante. Lorsque la pression monte dans le ventricule, cette masse sanguine située en avant du feuillet antérieur de la mitrale (FAM) pousse ce dernier à l'occlusion contre le feuillet postérieur (Figure 13.11).
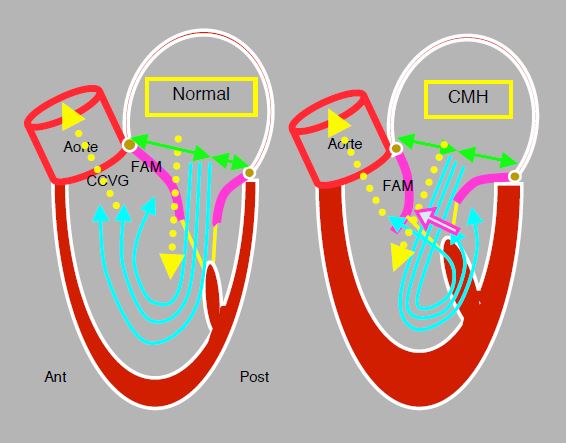
Figure 13.11: Schéma du remplissage diastolique du VG. Normalement, la direction de la chambre d'admission et celle de la chambre de chasse sont presque parallèles, parce que l'angle mitro-aortique est très ouvert. Le flux mitral diastolique est dirigé légèrement vers l'arrière et non en droite ligne vers l'apex. Le sang fait donc un large vortex dans la cavité du VG, qui l'amène en regard de la chambre de chasse et en avant du feuillet antérieur de la mitrale (FAM). Lorsque la pression monte en protosystole, cette masse sanguine pousse le FAM vers l'occlusion contre le feuillet postérieur. Dans le cas d'une cardiomyopathie hypertrophique (CMH), le rétrécissement de la cavité ventriculaire modifie l'angle mitro-aortique et le flux diastolique mitral se retrouve dirigé davantage vers l'avant. Le vortex tourne alors en sens opposé et amène la masse sanguine en arrière du FAM. En conséquence, celui-ci va être poussé en direction de la chambre de chasse en protosystole.
Lorsque l'angle mitro-aortique se resserre dans la cardiomyopathie hypertrophique (CMH), le flux mitral diastolique change de direction et se trouve orienté plus antérieurement. Le vortex intraventriculaire amène alors une grande partie de la masse sanguine en arrière du feuillet antérieur. En protosystole, elle va pousser le FAM en direction de la chambre de chasse. En effet, la valve aortique et la valve mitrale se jouxtent, et le feuillet antérieur est la seule séparation entre la chambre d'admission, sous la valve mitrale, et la chambre de chasse, sous la valve aortique (Vidéo).
Vidéo: Vue tridimensionnelle depuis le VG de la valve mitrale (en bas) et de la valve aortique (en haut) en situation normale; seul le feuillet mitral antérieur, qui flotte librement dans la cavité ventriculaire en diastole, sépare la chambre d'admission de la chambre de chasse. Cette proximité menace de faire basculer ce feuillet dans la CCVG en systole si la cavité ventriculaire se rétrécit (hypertrophie concentrique, hypovolémie, stimulation sympathique).
Vidéo: Vue tridimensionnelle depuis le VG de la valve mitrale (en bas) et de la valve aortique (en haut) en situation normale; seul le feuillet mitral antérieur, qui flotte librement dans la cavité ventriculaire en diastole, sépare la chambre d'admission de la chambre de chasse. Cette proximité menace de faire basculer ce feuillet dans la CCVG en systole si la cavité ventriculaire se rétrécit (hypertrophie concentrique, hypovolémie, stimulation sympathique).
Dans la CMH, fonction systolique est normale, voire hyperdynamique ; la fraction d'éjection tend à être supranormale à cause du rétrécissement de la cavité ventriculaire (diminution du Vts). Toutefois, les zones hypertrophiées présentent un défaut de contraction longitudinale au Doppler tissulaire (strain et strain rate) [26]. La fonction diastolique est altérée par défaut de relaxation (diminution de la reprise du Ca2+ par le reticulum sarcoplasmique) secondaire à l'hypertrophie musculaire, et se traduit par des pressions de remplissage télédiastoliques élevées et une dilatation de l'OG [14]. Vu ce défaut de relaxation protodiastolique, le remplissage ventriculaire devient très dépendant de la contraction auriculaire : sa contribution est > 30%.
L'effet CMO
Un patient ne souffrant pas de cardiomyopathie hypertrophique obstructive (CMO) peut reproduire une sténose sous-aortique dynamique lorsque certaines conditions sont remplies [24].
- Hypertrophie ventriculaire gauche concentrique avec petite cavité ventriculaire, telle qu'elle se rencontre fréquemment chez les hypertendus chroniques et les porteurs de sténose aortique.
- Baisse du remplissage ventriculaire par hypovolémie.
- Augmentation de la contractilité par β-stimulation.
- Hyperdynamisme secondaire à une anémie aiguë.
- Baisse de l'impédance aortique et des résistances artérielles systémiques ; elle augmente le gradient trans-aortique. Ceci survient aussi après un remplacement valvulaire aortique (RVA) pour sténose, parce que l'obstacle à l'éjection du VG a disparu.
- Rapprochement du point de coaptation mitral de la chambre de chasse après plastie mitrale pour quatre raisons différentes (incidence 4-11%) [11].
- L’anneau de valvuloplastie est trop restrictif ; le SAM est plus fréquent après pose d'un anneau rigide complet et restrictif qu'après celle d'un anneau ouvert semi-rigide.
- La longueur du feuillet postérieur est excessive (excès de tissu).
- La cavité ventriculaire est trop petite : hypovolémie, HVG concentrique.
- La course radiaire de la paroi postérieure en systole est trop grande : sur-stimulation β, vasoplégie.
Le résultat de cet "effet CMO" est un bas débit cardiaque caractérisé par une pression artérielle systémique basse et une tachycardie, mais des pressions de remplissage conservées, voire élevées. Le diagnostic ne peut être posé qu'à l'échocardiographie. Cette situation est particulièrement fréquente en sortant de CEC après un RVA pour sténose car toutes les conditions sont présentes, et la prise en charge habituelle du bas débit ne fait qu'aggraver le problème. On parle à ce propos de "ventricule suicidaire" [8]. La seule thérapeutique est l'arrêt des catécholamines β, le remplissage et l'augmentation des résistances artérielles systémiques (vasoconstricteur α) ; dans les cas rebelles, le β-blocage est nécessaire.
| Cardiomyopathie hypertrophique (CMH) |
|
Hypertrophie prédominant dans le septum interventriculaire et déplaçant antérieurement la zone de coaptation mitrale, entraînant une obstruction dynamique de la chambre de chasse du VG (CCVG) en systole. Les zones hypertrophiques contiennent un excès de cellules myocardiques aux formes bizarres et désorganisées ; la matrix collagène y est anormalement développée. Cette sténose sous-aortique dynamique peut se retrouver en-dehors de la cardiomyopathie proprement dite (effet CMO) en cas de :
- Hypertrophie ventriculaire gauche concentrique avec rétrécissement de la cavité du VG
- Hypovolémie et vasoplégie (vidange excessive du VG en systole)
- Déplacement antérieur de la zone de coaptation mitrale par rétrécissement de la cavité du VG, par contraction excessive de la paroi postérieure
(stimulation β ) ou par plastie mitrale trop restrictive Le point de coaptation mitral est déplacé antérieurement en direction de la CCVG ; en cours de systole, la partie distale du feuillet antérieur est poussée en avant puis aspirée par effet Venturi et bloque plus ou moins complètement l’éjection dans la CCVG (SAM : systolic anterior motion) ; le débit systolique chute en cours d’éjection. La vélocité du flux sanguin dépasse 2.5 m/s dans la CCVG et le gradient est > 30 mmHg au repos (> 50 mmHg à l'effort).
|
© CHASSOT PG Septembre 2007 Dernière mise à jour Octobre 2018
Références
- COPPINI R, et al. Late sodium current inhibition reverses electromechanical dysfunction in human hypertrophic cardiomyopathy. Circulation 2013; 127:575-84
- DAVIES MR, COUSINS J. Cardiomyopathy and anaesthesia. Contin Educ Anaesth Crit Care Pain 2009; 9:189-93
- ELLIOTT PM, ANASTASAKIS A, BORGER MA, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology. Eur Heart J 2014; 35:2733-79
- ERIKSSON H, MIDGLEY FM, KARR SS, et al. Role of echocardiography in the diagnosis and surgical management of accessory mitral valve tissue causing left ventricular outflow tract obstruction. J Am Soc Echocardiogr 1995; 8:105-7
- GERSH BJ, MARON BJ, BONOW RO, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: Executive summary. Circulation 2011; 124:2761-96
- HENSLEY N, DIETRICH J, NYHAN D, et al. Hypertrophic cardiomyopathy: a review. Anesth Analg 2015; 120:554-69
- HREYBE H, ZAHID M, SONEL A, et al. Noncardiac surgery and the risk of death and other cardiovascular events in patients with hypertrophic cardiomyopathy. Clin Cardiol 2006; 29:65-8
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- LEE KS, STEWART WJ, LEVER HM, et al. Mechanism of outflow tract obstruction causing failed mitral valve repair. Circulation 1993; 88:24-9
- LEFEBVRE XP, HE S, LEVINE RA, et al. Systolic anterior motion of the mitral valve in hypertrophic cardoimyopathy: an in vitro pulsatile flow study. J Heart Valve Dis 1995; 4:422-38
- LOULMET DF, YAFFEE DW, URSOMANNO PA, et al. Systolic anterior motion of the mitral valve: a 30-year perspective. J Thorac Cardiovasc Surg 2014; 148:2787-94
- MARON BJ. Hypertrophic cardiomyopathy: A systematic review. JAMA 2002; 287:1308-20
- MARON BJ. Clinical course and management of hypertrophic cardiomyopathy. N Engl J Med 2018; 379:655-68
- MARON BJ, CASEY SA, POLIAC LC, et al. Clinical course of hypertrophic cardiomyopathy in a regional United States cohort. JAMA 1999; 281:650-5
- MARON BJ, MARON M; WIGLE E, et al. The 50-year history, controversy, and clinical implications of left ventricular outflow tract obstruction in hypertrophic cardiomyopathy: from idiopathic hypertrophic subaortic stenosis to hypertrophic cardiomyopathy. J Am Coll Cardiol 2009; 54:191-200
- MARON BJ, SEIDMAN JG, SEIDMAN CE. Proposal for contemporary screening strategies in families with hypertrophic caediomyopathy. J Am Coll Cardiol 2004; 44:2125-32
- MEYER MR, EBERLI FR. Cardiomyopathie hypertrophique et dilatée. Forum Méd Suisse 2018; 18: 168-77
- OH JK. Cardiomyopathies. In OH JK, SEWARD JB, TAJIK AJ. The echo manual. Lippincott Williams & Wilkins, Philadelphia 1999, pp 153-67
- PETSAS AA, ANASTASSIADES LC, CONSTANTINOU EC, et al. Familial discrete subaortic stenosis. Clin Cardiol 1998; 21:63-5
- RICHARDSON P, MCKENNA W, BRISTOW M, et al. Report of the 1995 WHO / International Society and Federation of Cardiology Task Force on the definition and classification of cardiomyopathies. Circulation 1996; 93:841-2
- SCHWAMMENTHAL E, NAKATANI S, HE S, et al. Mechanism of mitral regurgitation in hypertrophic cardiomyopathy: mismatch of posterior to anterior leaflet length and motility. Circulation 1998; 98:856-62
- SEMSARIAN C, INGLES J, MARON M, et al. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol 2015; 65:1249-54
- SEN-CHOWDHRY A, JACOBY D, MOON JC, et al. Update on hypertrophic cardiomyopathy and a guide to the guidelines. Nat Rev Cardiol 2016; 13:651-75
- SGRECCIA A, MORABITO G, GURGO DI CASTELMENARDO A, et al. Congestive heart failure in hypertensive patients with normal systolic function and dynamic left ventricular outflow obstruction. Minerva Cardioangiol 2001; 49:99-106
- SHERRID MV, GUNSBURG DZ, MOLDENHAUER S, et al. Systolic anterior motion begins at low left ventricular outflow tract velocity in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2000; 36:1344-54
- TURER AT, SAMAD Z, VALENTE AM, et al. Anatomic and clinical correlates of septal morphology in hypertrophic cardiomyopathy. Eur J Echocardiogr 2011; 12:131-9
- VARGHESE R, ANYANWU AC, ITAGAKI S, et al. Management of systolic anterior motion after mitral valve repair: an algorithm. J Thorac Cardiovasc Surg 2012; 143:S2-7
