La plupart de ces indices est basée sur l’évaluation bidimensionnelle du VG en télédiastole (td) et en télésystole (ts) selon la formule:
(Dtd – Dts) / Dtd
La dimension D télédiastolique est la plus grande dimension du VG, correspondant à l’onde R de l’ECG et à la dernière image avant la fermeture de la valve mitrale sur un enregistrement en boucle. La dimension en télésystole (Dts) est la valeur la plus petite, qui est la dernière image avant l’ouverture de la valve mitrale. On utilise les valeurs de la diastole qui précède la systole mesurée, parce qu’elles conditionnent la performance de cette systole selon le principe de Frank-Starling (tension de paroi en télédiastole).
Fraction d’éjection
La fraction d’éjection (FE) est certainement l'indice le plus populaire et le plus parlant. Elle est le rapport entre le volume éjecté et le volume télédiastolique; elle s'exprime en fraction ou en pourcent:
FE = (Vtd – Vts) / Vtd
Valeur normale : 0.55 - 0.7 (55-70%)
Des milliers d'études ont démontré sa valeur pronostique, aussi bien en cardiologie qu'en chirurgie. Néanmoins, il ne faut pas lui faire dire ce qu'elle ne dit pas. La FE n'est pas un indice de contractilité proprement dite, car elle dépend étroitement de la précharge, de la postcharge et de la géométrie du VG. Le volume télédiastolique est modifié par la précharge et le volume télésystolique est influencé par l'impédance à l'éjection. Elle n'est équivalente ni au volume systolique ni au débit cardiaque; elle correspond à une mesure de travail et non à une mesure de puissance, car elle ne tient pas compte de la vitesse de contraction [15,21]. Une bonne manière de comprendre sa signification physiopathologique est de se baser sur la boucle pression-volume (voir Chapitre 5, Relation pression-volume). La boucle pression-volume (PV) est une représentation graphique du cycle cardiaque figurant l'évolution conjointe de la pression et du volume ventriculaire. Elle est définie par la courbe de compliance et par l'élastance télésystolique ou élastance maximale (Ets ou Emax). Sa surface est équivalente au travail ventriculaire. L'élastance systolique est une droite construite à partir des points télésystoliques d'une série de boucles à divers degrés de remplissage; sa pente est un indice de contractilité indépendant de la précharge et de la postcharge (Figure 25.171) [22,24,25]. Cette pente s'abaisse en cas de dysfonction du VG et se redresse par stimulation inotrope. En miroir de l'Ets, l'élastance artérielle (Ea) est une droite reliant le point télésystolique au point télédiastolique; sa pente traduit la postcharge du VG. Dans ce cadre, on voit que la FE, qui est le rapport entre le volume éjecté (VS, volume systolique) et le volume télédiastolique, se modifie selon les circonstances, alors que la pente de l'Ets ne change pas: la FE augmente en hypovolémie parce que le volume télésystolique tend vers zéro, et diminue lors d’une dilatation parce que le volume télédiastolique (au dénominateur de la fraction) est plus grand ou lors d'une élévation de postcharge parce que le volume systolique est plus petit.
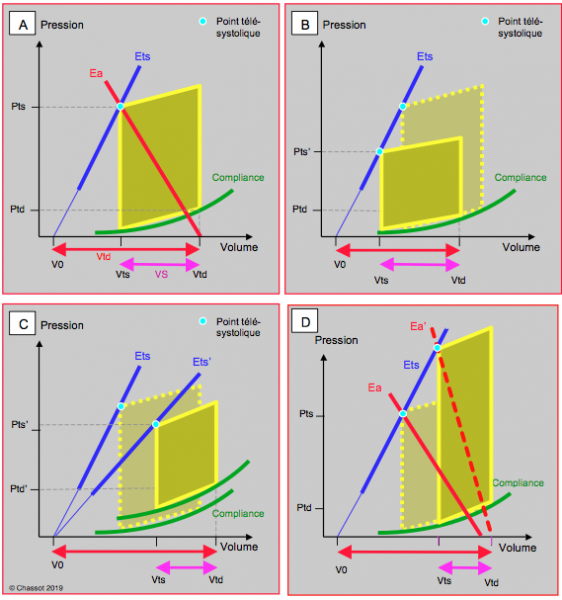
Figure 25.171 : Boucle pression-volume. A: situation normale; la boucle PV est définie par la courbe de compliance (en vert), la pente de la droite d'élastance télésystolique (Ets, en bleu) et celle de l'élastance artérielle (Ea en rouge). La FE est le rapport entre le VS et le Vtd. Les pentes respectives de l'Ets et de l'Ea font que la FE physiologique est de 0.63. B: en hypovolémie, la boucle diminue de surface et le point télésystolique est situé plus bas sur la pente Ets, qui n'est pas modifiée. C'est précisément en variant le volume de remplissage que se construit la pente Ets. La FE augmente parce que le Vtd et le Vts diminuent, bien que la pente Ets, qui représente la contractilité, soit identique à la situation normale. C: lors de dysfonction ventriculaire, la pente de l'Ets s'abaisse, la compliance est anormale et la surface de la boucle PV est très rétrécie. La FE est abaissée parce que le VS est plus petit et le Vtd agrandi (dilatation du VG). D: lors d'augmentation de postcharge, la pente Ea est redressée, mais la pente Ets est stable. La boucle PV est déplacée à de plus hautes pressions, mais sa surface reste identique à la surface normale; par contre, la FE s'abaisse parce que le VS diminue.
La FE est un rapport de volume. Or les mesures échocardiographiques habituelles sont bidimensionnelles. Plusieurs approximations mathématiques permettent d’extrapoler le volume du VG à partir d’une mesure mono- ou bi-dimensionnelle (voir Examen des ventricules et Figure 25.119) [10].
(Dtd – Dts) / Dtd
La dimension D télédiastolique est la plus grande dimension du VG, correspondant à l’onde R de l’ECG et à la dernière image avant la fermeture de la valve mitrale sur un enregistrement en boucle. La dimension en télésystole (Dts) est la valeur la plus petite, qui est la dernière image avant l’ouverture de la valve mitrale. On utilise les valeurs de la diastole qui précède la systole mesurée, parce qu’elles conditionnent la performance de cette systole selon le principe de Frank-Starling (tension de paroi en télédiastole).
Fraction d’éjection
La fraction d’éjection (FE) est certainement l'indice le plus populaire et le plus parlant. Elle est le rapport entre le volume éjecté et le volume télédiastolique; elle s'exprime en fraction ou en pourcent:
FE = (Vtd – Vts) / Vtd
Valeur normale : 0.55 - 0.7 (55-70%)
Des milliers d'études ont démontré sa valeur pronostique, aussi bien en cardiologie qu'en chirurgie. Néanmoins, il ne faut pas lui faire dire ce qu'elle ne dit pas. La FE n'est pas un indice de contractilité proprement dite, car elle dépend étroitement de la précharge, de la postcharge et de la géométrie du VG. Le volume télédiastolique est modifié par la précharge et le volume télésystolique est influencé par l'impédance à l'éjection. Elle n'est équivalente ni au volume systolique ni au débit cardiaque; elle correspond à une mesure de travail et non à une mesure de puissance, car elle ne tient pas compte de la vitesse de contraction [15,21]. Une bonne manière de comprendre sa signification physiopathologique est de se baser sur la boucle pression-volume (voir Chapitre 5, Relation pression-volume). La boucle pression-volume (PV) est une représentation graphique du cycle cardiaque figurant l'évolution conjointe de la pression et du volume ventriculaire. Elle est définie par la courbe de compliance et par l'élastance télésystolique ou élastance maximale (Ets ou Emax). Sa surface est équivalente au travail ventriculaire. L'élastance systolique est une droite construite à partir des points télésystoliques d'une série de boucles à divers degrés de remplissage; sa pente est un indice de contractilité indépendant de la précharge et de la postcharge (Figure 25.171) [22,24,25]. Cette pente s'abaisse en cas de dysfonction du VG et se redresse par stimulation inotrope. En miroir de l'Ets, l'élastance artérielle (Ea) est une droite reliant le point télésystolique au point télédiastolique; sa pente traduit la postcharge du VG. Dans ce cadre, on voit que la FE, qui est le rapport entre le volume éjecté (VS, volume systolique) et le volume télédiastolique, se modifie selon les circonstances, alors que la pente de l'Ets ne change pas: la FE augmente en hypovolémie parce que le volume télésystolique tend vers zéro, et diminue lors d’une dilatation parce que le volume télédiastolique (au dénominateur de la fraction) est plus grand ou lors d'une élévation de postcharge parce que le volume systolique est plus petit.

Figure 25.171 : Boucle pression-volume. A: situation normale; la boucle PV est définie par la courbe de compliance (en vert), la pente de la droite d'élastance télésystolique (Ets, en bleu) et celle de l'élastance artérielle (Ea en rouge). La FE est le rapport entre le VS et le Vtd. Les pentes respectives de l'Ets et de l'Ea font que la FE physiologique est de 0.63. B: en hypovolémie, la boucle diminue de surface et le point télésystolique est situé plus bas sur la pente Ets, qui n'est pas modifiée. C'est précisément en variant le volume de remplissage que se construit la pente Ets. La FE augmente parce que le Vtd et le Vts diminuent, bien que la pente Ets, qui représente la contractilité, soit identique à la situation normale. C: lors de dysfonction ventriculaire, la pente de l'Ets s'abaisse, la compliance est anormale et la surface de la boucle PV est très rétrécie. La FE est abaissée parce que le VS est plus petit et le Vtd agrandi (dilatation du VG). D: lors d'augmentation de postcharge, la pente Ea est redressée, mais la pente Ets est stable. La boucle PV est déplacée à de plus hautes pressions, mais sa surface reste identique à la surface normale; par contre, la FE s'abaisse parce que le VS diminue.
La FE est un rapport de volume. Or les mesures échocardiographiques habituelles sont bidimensionnelles. Plusieurs approximations mathématiques permettent d’extrapoler le volume du VG à partir d’une mesure mono- ou bi-dimensionnelle (voir Examen des ventricules et Figure 25.119) [10].
- Formule de Teichholz ; elle reconstitue le volume du VG en lui attribuant la forme d’un ellipsoïde régulier, ou d'un œuf symétrique, dont le long axe est le double du court axe et dont la section est circulaire; elle permet le calcul simple et rapide du volume à partir du seul diamètre (D) de la cavité ventriculaire en court axe : V = 7 D3 / (2.4 + D). Cette simplification est justifiée par le fait que 75% du volume systolique est dû à la contraction radiaire du VG. Cette approximation est sans doute suffisante pour suivre la fraction d'éjection d'un malade en cours d'intervention, mais elle est inadéquate en cas de remodelage du VG (défaillance, valvulopathie, cardiomyopathie) ou d'anomalies de la contraction segmentaire. Sa précision, qui est insuffisante pour une évaluation cardiologique, est tributaire de celles des mesures en mode TM (Figure 25.172).
- Le mode TM est utilisé en court-axe transgastrique 0° du VG au niveau médio-ventriculaire, qui se reconnaît à la présence du corps des muscles papillaires. Une échancrure dans la région inféro-septale est due à la présence de la chambre de chasse, donc à une position trop basale.
- La section du VG doit être strictement perpendiculaire à son long-axe et doit apparaître circulaire à l'écran. La présence du muscle papaillaire d'un côté et de cordages de l'autre indique que la coupe est oblique.
- La contraction de la paroi inférieure et celle de la paroi antérieure doivent être synchrones; si ce n'est pas le cas, la section est probablement oblique et la mesure sera erronée. Autres cause d'asynchronie: bloc de branche, électro-entraînement, altération de la cinétique segmentaire.
- Le diamètre télédiastolique est mesuré sur la dernière et la plus large section de la cavité ventriculaire, après la contraction auriculaire et au moment de l'onde R de l'ECG.
- Le diamètre télésystolique est mesuré sur la section la plus étroite de la cavité pendant la systole suivante.
- Le calcul de la FE selon Teichholz n'est pas fiable et n'est plus recommandé; il est remplacé par la règle de Simpson ou par la mesure tridimensionnelle des volumes [14,15].
- Les mêmes remarques s'appliquent à la formule de Quinones; dans ce calcul, la moyenne de 4 mesures de court-axe du VG est ajustée pour la contraction en long-axe par une attribution de + 15% si l'apex est normal, 0% s'il est akinétique et – 15% en cas de dyskinésie [20].
- Méthode surface – longueur (area-length) ; en ramenant la forme du VG à un hémi-ellipsoïde cyclindrique on peut facilement calculer son volume : V = (5 • S • L) / 6, où S est la surface en 4-cavités ou en 2-cavités et L le long axe; le plan choisi est celui qui englobe la plus grande dimension du VG. Cette technique suppose que le ventricule est symétrique dans le plan orthogonal.
- Modèle de l'ellipsoïde tronquée (prolate ellipse, forme d’un obus); il mesure la surface de deux plans orthogonaux dans lesquels la longueur du VG est identique; calcul du volume: V = 8/3 π (S1 • S2 • L)/2, où S1 et S2 sont les surfaces en vues 4-cavités et 2-cavités et L la plus grande longueur du VG.
- Règle de Simpson ; l'endocarde est dessiné au traceur ou par détection automatique des contours avec correction manuelle; la base est déterminée par le plan de l'anneau mitral, les trabéculations et les piliers sont inclus dans la cavité. La cavité est divisée en 20 disques selon le long-axe du VG par le processeur, qui calcule le volume à partir de la somme de celui de chacun des 20 disques circulaires: V = (π / 4) • (Σ D1 + Σ D2) • (L / n), où n est le nombre de disques (20) et D1-D2 sont les diamètres des disques dans le plan 4-cavités 0° et dans le plan 2-cavités 90°. En réalisant la mesure dans deux plans orthogonaux, on tient compte des asymétries de contraction (altérations de la cinétique segmentaire, anévrysme, etc). La technique est fastidieuse (2 mesures en diastole et 2 en systole, puis calcul de la FE) et dépend de la bonne définition du contour endocavitaire (Figure 25.173). Bien qu'elle tende à sous-estimer le volume du VG à cause de l'amputation de l'apex et du risque de coupe tangentielle en 2-cavités, cette méthode est la mesure bidimensionnelle la plus appropriée pour le calcul du volume à partir d'une image 2D [5].
- Ces mesures ont tendance à sous-estimer le volume ventriculaire parce que le long axe est souvent tronqué en ETO ; cela porte peu à conséquence lorsqu’on fait le rapport entre le volume télésystolique et le volume télédiastolique, mais invalide cette technique pour l’évaluation du volume systolique et du débit cardiaque.
- La précision de ces mesures dépend de la visibilité du pourtour endocavitaire, dont la définition 2D est souvent médiocre dans les zones où l’endocarde est parallèle à l’axe des ultrasons (paroi latérale). Comme on le repère plus aisément sur l’image en mouvement, il est judicieux d’en garder l’image mentale pour le reconstituer lors de son tracé sur l’image immobile.
- Les approximations géométriques comme la formule de Teichholz supposent que le VG a une forme oblongue et que la contraction est homogène; elles ne traduisent plus la réalité en cas de remodelage - le VG devient sphérique en cas de défaillance ou de surcharge de volume – ni en cas d'altération segmentaire de la contraction (akinésie, anévrysme).
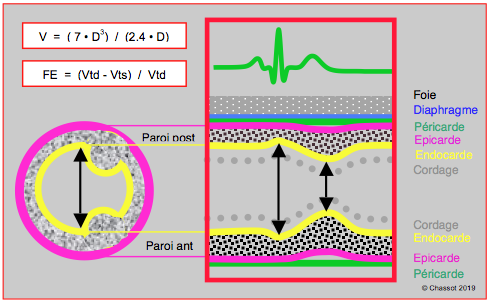
Figure 25.172 : Calculs de la fraction d'éjection (FE) du VG selon la formule de Teichholz, qui assimile le VG à un ellipsoïde régulier dont le volume peut être calculé à partir du diamètre en court-axe transgastrique et en mode TM; ce calcul n'est valable que si le VG est symétrique et régulier. L'ordinateur de l'ETO effectue le calcul automatiquement à partir des deux diamètres ventriculaires en télésystole et en télédiastole. Le premier est mesuré au moment de l'onde R de l'ECG sur le plus large diamètre du VG; le deuxième est mesuré à l'endroit le plus rétréci de la cavité au cours de la systole suivante.
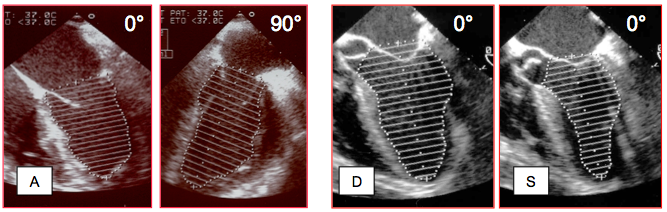
Figure 25.173 : Calculs de la fraction d'éjection (FE) par la règle de Simpson. A : l’opérateur dessine le pourtour de la surface endocavitaire en diastole et en systole, et l'ordinateur calcule le volume en supposant le VG symétrique autour du long-axe et en découpant la surface dessinée en 20 disques circulaires dont il additionne les volumes. Mesure en deux plans orthogonaux: 4-cavités à 0° et 2-cavités à 90°. D : mesure en diastole. S : mesure en systole. Bien que plus longue, cette mesure est plus précise, car elle tient compte des anomalies anatomiques et fonctionnelles du VG. Techniquement, il est recommandé de commencer le dessin du pourtour endocavitaire par l’angle mitro-aortique, de couper la chambre de chasse à angle droit, de dessiner l’endocarde ventriculaire jusqu’à l’anneau mitral latéral et de laisser l’appareil tirer un trait rectiligne à travers l’orifice mitral ; le long axe sera déterminé par le centre de cette ligne de base et l’apex. Pour bien dessiner l’endocarde latéral, souvent mal visible parce que parallèle au faisceau d’ultrasons, il est bon de le repérer au préalable sur l’image en mouvement. Les processeurs modernes disposent d'algorithmes dédiés à la définition automatique des contours et peuvent tracer directement l'endocarde une fois la zone d'intérêt définie par l'opérateur.
Pour que la FE échocardiographique puisse avoir une corrélation acceptable avec la mesure par cinéangiographie isotopique ou par résonance magnétique nucléaire, plusieurs conditions sont requises [8].
- La mesure des diamètres endocavitaires doit être strictement perpendiculaire au long axe du ventricule (surface circulaire). Elle doit être réalisée à mi-longueur du VG (présence du corps des piliers) en mode TM (Vidéo).
- La mesure est précise : toute erreur sur la mesure d’un diamètre est élevée au cube dans le calcul du volume.
- Les mesures de long axe doivent être faites en vue 2-cavités à 90° ou long-axe à 120°, dans le plan où le ventricule apparaît le plus long. La vue 4-cavités tronque l’apex du VG. La différence de long axe entre les différents plans de doit pas dépasser 20%.
- Les mesures de volume sont réalisées sur la plus grande surface obtenue de la cavité ventriculaire ; elles doivent être moyennées sur deux plans perpendiculaires (0° et 90° mi-oesophage).
- Lorsque l’endocarde est un trait épais, la mesure est faite sur sa partie la plus externe par rapport à l’ensemble de la paroi (la plus interne par rapport à la cavité ventriculaire).
- La contraction est homogène et symétrique (absence d’ACS, d’anévrysme, de remodelage) et la forme générale du ventricule est normale (rapport court-axe / long-axe ≤ 0.6), sans quoi les représentations géométriques utilisées pour reconstruire le volume à partir d’une image plane sont inaplicables. La règle de Simpson échappe en partie à cette remarque.
- Seule une mesure faite sur une acquisition tridimensionnelle (3-D) peut représenter la FE réelle indépendamment de la forme et des ACS du VG, mais les mesures 3D actuelles ont encore tendance à sous-estimer le volume du VG par rapport à l'IRM, qui est la méthode la plus fiable [16].
Vidéo: déroulement dans le temps de la contraction-relaxation des la paroi postérieure (en-haut) et de la paroi antérieure (en bas) du VG dans le plan court-axe trangastrique 0° médioventriculaire; les diamètres télésystolique et télédiastolique utilisés pour le calcul de la fraction de raccourcissement sont mesurés aux endroits respectivement le plus étroit et le plus large de la cavité ventriculaire.
Bien que très répandu, le calcul de la fraction d'éjection est une mesure limitée par plusieurs phénomènes.
- Taille du ventricule; lorsque le volume télésystolique tend vers zéro (hypovolémie, vasoplégie, hypertrophie concentrique), la FE tend vers 100%: (Vtd – 0) / Vtd = 1. A l'inverse, lorsque le volume télédiastolique augmente (surcharge de volume), la FE diminue parce que le grand Vtd est au dénominateur de la fraction. Les variations de postcharge ont un effet identique: une élévation des RAS diminue la FE alors qu'une vasoplégie l'augmente. Ces modifications de la FE surviennent sans qu'il n’y ait de variation de la contractilité myocardique.
- Epaisseur de paroi : à raccourcissement myocardique constant, la FE augmente avec l’épaisseur télédiastolique de la paroi ventriculaire, parce que la course radiaire en systole est plus grande lorsque la paroi est plus épaisse.
- Approximations géométriques; elles sont nécessaires pour passer d'une image mono- (diamètre) ou bi- (surface) dimensionnelle à un volume, mais elles présupposent que la forme du VG correspond à cette figure géométrique. Ceci est inexact lorsque le ventricule se dilate et devient sphérique ou lorsque certaines parois sont akinétiques ou anévrysmales.
- Extrapolation; les figures géométriques extrapolent à tout le ventricule la contraction mesurée dans un seul plan de coupe; cette hypothèse ne se confirme que si la contraction est parfaitement symétrique et homogène.
- Inhomogénéité de la contraction; la systole n'est pas toujours une reproduction de la configuration diastolique en plus petit; le ventricule change de forme lorsqu'il se contracte en cas d'altérations de la cinétique segmentaire, de retards de conduction (bloc de branche), d'hypertrophie asymétrique ou de rigidité mitrale (prothèse, calcifications).
- Valvulopathies : la FE est inadaptée à l’évaluation fonctionnelle du VG en cas de valvulopathie à cause des modifications de précharge, de postcharge, de forme et d’épaisseur du ventricule. L'insuffisance mitrale, par exemple, maintient une postcharge basse et une précharge élevée qui favorisent l'éjection; une FE normale dans cette situation ne signifie nullement que la performance du VG est normale. Dans ces conditions, le volume systolique est un meilleur descripteur de la fonction gauche.
- La FE n’est pas une mesure de contractilité, mais reflète la réserve fonctionnelle du ventricule. Elle est le produit de l’équilibre ventriculo-artériel entre la précharge, la postcharge et la fonction ventriculaire [21]. Elle n’est pas applicable lorsque le remodelage ventriculaire est important ni lorsque les conditions de charge sont modifiées, comme c’est le cas dans les valvulopathies ou les cardiopathies congénitales. Dans ces circonstances, la taille du VG et son degré de dilatation sont une mesure plus adéquate de sa fonction.
- La FE doit être appréciée dans le contexte hémodynamique, notamment celui de la pression artérielle qui représente approximativement la postcharge du VG. Une FE de 0.6 ne correspond pas à la même force de contraction si la PAM est de 100 mmHg ou de 50 mmHg. [15].
- La FE peut rester normale alors que des mesures plus fines de la contractilité comme la vitesse de raccourcissement, l'accélération protosystolique ou la déformation longitudinale globale sont significativement altérées. Elle n'a de valeur pronostique que lorsqu'elle est < 0.4 [15].
- La variation la plus faible de la FE mesurable dans un intervalle de confiance de 95% par l'échocardiographie 2D est 0.11; la précision de la mesure est donc limitée à ± 5% [18].
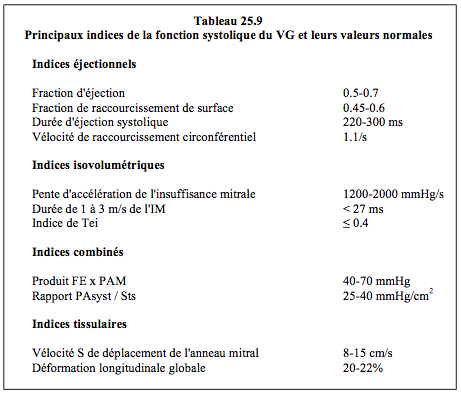
La technologie tridimensionnelle a introduit davantage de précision dans l'évaluation des volumes ventriculaires en les mesurant directement et non plus par le biais d'approximations géométriques. Grâce à une définition semi-automatique des contours endocavitaires, les mesures présentent une bonne corrélation avec celles de l'IRM, bien que le 3D tende encore à sous-estimer les volumes [7]. Les valeurs normales moyennes sont 98 mL pour le volume télédiastolique et 37 mL pour le volume télésystolique, ce qui donne une FE de 0.63 [6]. Malgré des limites d'agrément assez larges, le 3D est nettement plus performant que le 2D pour le calcul des volumes et de la FE [11]. La mesure de la fraction d'éjection et de la masse ventriculaire est également plus précise que celle faite en 2D. Cependant, les différents algorithmes propres à chaque fabriquant, les méthodologies de calcul variant d'un processeur à un autre, et l'expérience inégale des échocardiographeurs rendent difficile l'établissement d'une norme pour ces valeurs. D'autre part, le volume et la masse du VG sont plus faibles d'environ 20% chez la femme par rapport à l'homme; le volume télédiastolique et le volume télésystolique diminuent de près de 10% entre 30 et 65 ans. De ce fait, la normalité tient davantage à la cohérence d'une série de valeurs plutôt qu'à une seule donnée univoque (Tableau 25.9) [17]. De plus, la valeur limite inférieure de la FE normale varie selon la technique utilisée: 0.52 à l'échocardiographie 2D, 0.50 à l'échocardiographie 3D, 0.57 à l'IRM, et 0.47 au CT-scan [15].
Récemment introduit en clinique, l'indice de déformation longitudinale globale (global longitudinal strain, GLS) permet d'affiner l'évaluation de la fonction ventriculaire en complément de la FE lorsque celle-ci est inadéquate (valvulopathies, arythmies, etc) (voir Doppler tissulaire et speckle-tracking) [1,9,19]. La valeur normale est 20% ± 2% [9,19,29]. Une faible déformation longitudinale (< 15%) est associée à un taux de dysfonction ventriculaire et de morbi-mortalité plus élevé après remplacement valvulaire aortique, chirurgie valvulaire mitrale ou pontage aorto-coronarien, indépendamment de la valeur de la FE [1,12,13]. Une valeur < 8% traduit une dysfonction sévère de mauvais pronostic [23]. La classification de l'insuffisance cardiaque en fonction de la FE est remise en question au vu de ses imprécisions et du recouvrement entre les différentes catégories, que l'analyse de la déformation tissulaire peut au moins partiellement corriger [27].
| La fraction d’éjection (FE) |
| La FE traduit la position d’équilibre du VG entre son volume télédiastolique, sa performance systolique et son impédance éjectionnelle. Elle n’est pas une mesure de contractilité et dépend de la précharge, de la postcharge et de la géométrie du VG. A l’exception de la règle de Simpson et de l'écho 3D, son calcul repose sur des approximations géométriques en échocardiographie bidimensionnelle, lesquelles invalident la méthodes dans de nombreuses circonstances (remodelage, dilatation, asynchronie, etc). La FE n’est pas une mesure valide de la performance systolique en cas de valvulopathie (utiliser les dimensions télédiastoliques et télésystoliques), de cardiopathie congénitale, de sphéricisation du VG, de désynchronisation et d'altérations ischémiques de la cinétique segmentaire. La FE est un marqueur peu discriminant de la fonction ventriculaire, qui n'a de valeur pronostique que lorsqu'elle est inférieure à 40%. Elle n'est pas suffisante à elle seule pour déterminer la performance systolique du VG. |
Fractions de raccourcissement
Ces mesures sont effectuées dans un plan 2D et ne représentent la fonction systolique du VG que si celle-ci est homogène ; comme la FE, elles sont invalides en cas d’altérations de la contractilité segmentaire (ACS) ou de déformation géométrique du ventricule (remodelage, anévrysme, dilatation, sphéricisation). Elles sont effectuées en court-axe mi-ventriculaire et ne mesurent la fonction qu’à cet endroit ; cette approximation se justifie par le fait que les trois quarts du volume systolique sont éjectés par la contraction radiaire du VG, mais elle ignore la performance des régions basale et apicale et ne tient pas compte du raccourcissement longitudinal.
- Fraction de raccourcissement (FR) de diamètre (D) mesurés en télésystole et en télédiastole : FR = (Dtd – Dts) / Dtd; la mesure se fait en court-axe par voie transgastrique en mode TM (0° ou 90°); normal: 0.3 - 0.45 (ou 30-45%). La valeur limite inférieure est 25% chez l'homme et 27% chez la femme (valeur normale: 25-45%) [14].
- Fraction de raccourcissement de la surface (S) endocavitaire (FAC : fractional area change) mesurée en court-axe transgastrique en excluant les piliers : FAC = (Std – Sts) / Std (voir Figure 25.174). Sa valeur normale est ≥ 45% dans la région médio-ventriculaire; elle est plus élevée à l'apex et plus faible à la base, car sa valeur est inversement proportionnelle à la surface télédiastolique, puisque celle-ci est au dénominateur de la fraction. Cette mesure tient compte des éventuelles ACS dans ce plan de coupe, mais non dans le reste du VG. Cependant, elle est une mesure directe de l’image bidimensionnelle, et ne comporte aucune reconstruction géométrique. Elle est une mesure plus rigoureuse que la FE, parce qu'elle n'est basée sur aucune extrapolation; elle n'exprime que ce qu'elle mesure effectivement dans un plan de coupe donné (court-axe médioventriculaire).
Epaississement systolique
La fraction d’épaississement (Hts – Htd) / Hts, où H est l’épaisseur, varie selon l’endroit de mesure sur la paroi ventriculaire. Elle se réalise en général en court axe ventriculaire transgastrique sur la paroi postéro-inférieure et le septum. Pour intégrer la valeur des différentes parois, on peut utiliser l’épaisseur moyenne (Hmoy), qui est obtenue à partir de la surface de la couronne ventriculaire (Sépi : surface mesurée par la circonférence épicardique, Sendo : surface endocavitaire) : Hmoy = Sépi/π - Sendo/π. Toutefois, la définition du pourtour de l’épicarde manque généralement de précision.
Vélocité circonférentielle de raccourcissement (Vcf, velocity of circumferential shortening)
La mesure du raccourcissement de la circonférence (C) en court axe peut être indexée à la durée de la systole (temps d'éjection téj) :
Vcf = (Ctd – Cts) / Ctd • téj.
La valeur normale est 1.1/s. La durée d’éjection se mesure par la durée de l’ouverture de la valve aortique en mode TM à 40° ou 120°; sa durée normale est de 200-300 ms (Figure 25.174). On peut remplacer le raccourcissement circonférentiel par le raccourcissement de surface, ce qui donne : FAC / téj (normal : 1.5-2.5/s). L’introduction du temps dans la formule fait de cette mesure l’équivalent d’une évaluation de la puissance ventriculaire (puissance = travail / temps), ce qui la rapproche d’une mesure de contractilité, bien qu’elle reste tributaire des conditions de charge [28]. Le problème méthodologique est la non-simultanéité de la mesure de circonférence et de celle de la durée d’éjection, puisqu’elles se font dans des vues et des cycles cardiaques différents.
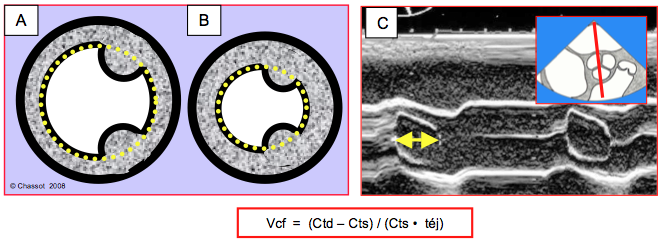
Figure 25.174 : Vélocité de raccourcissement circonférentiel (Vcf). A: mesure de la circonférence diastolique (Ctd) du VG en court-axe (pointillé jaune). B : mesure de la circonférence systolique (Cts) du VG en court-axe. C : mesure de la durée d'éjection (téj) par le temps d'ouverture de la valve aortique (flèche jaune); pour ce faire, on coupe la valve aortique en court-axe par le mode TM (trait rouge illustré dans la cartouche).
Mouvements mitraux
Les mouvements de la valve mitrale et de son anneau sont modifiés par la performance ventriculaire (Vidéos).
- Abaissement de l’anneau mitral: le raccourcissement systolique longitudinal du VG vers l'apex entraîne un mouvement de descente de l’anneau mitral dont la course et la vélocité sont proportionnelles à la fonction des fibres myocardique sous-endocardiques qui sont les plus sensibles au stress et à l’ischémie. La course normale de ce déplacement est de > 1 cm et sa vélocité au Doppler tissulaire de 8 – 12 cm/s. Cette mesure est bien corrélée aux autres mesures d’éjection (voir Figure 25.178) [3,26].
- Angle d’ouverture de la valve mitrale: meilleure est la vidange systolique précédente, plus grand est le débattement du feuillet antérieur de la mitrale lors de la diastole suivante. L’angle entre les positions diastolique et systolique du feuillet antérieur (normal: > 60°) reste faible en cas de dysfonction gauche. Normalement, la distance entre l'extrémité du feuillet et le septum est < 0.5 cm lorsque la mitrale est ouverte. Malheureusement, la quantification de cette mesure n'est pas un indice bien établi (voir Figure 25.170C) [2].
Vidéo: normalement, les feuillets mitraux ont un ample mouvement d'ouverture et de fermeture (70-90°).
Vidéo: dysfonction et dilatation du VG avec une insuffisance mitrale restrictive. L'amplitude des mouvements mitraux est très limitée. La dilatation ventriculaire exerce une traction sur les cordages qui maintient les feuillets en-dessous de leur point de coaptation en systole; la valve fuite.
En vue transgastrique profonde à 0° ou 120°, la Vmax normale du flux aortique est 0.8 – 1.7 m/s et sa durée 200 – 300 ms. Etant fonction du gradient de pression entre le VG et l’aorte, la vélocité est directement proportionnelle à la fonction systolique, pour autant que la valve aortique soit normale. La Vmax aortique est influencée par le volume systolique et par les résistances artérielles. L’accélération protosystolique (normal : 10 m/s2) est une mesure de puissance du VG ; elle est illustrée par la pente ascensionnelle du flux aortique et représente le dP/dt intraventriculaire de l’éjection. Comme cette pente est très raide, sa mesure est difficile et imprécise. Pour y remédier, on peut mesurer la durée de la phase d'accélération (Dac, durée entre V0 et Vmax); elle représente normalement moins de 30% de la durée totale de l'éjection. Le rapport Vmax / Dac est un bon indice de la puissance du VG ; il représente l’accélération moyenne du flux (Figure 25.175). Expérimentalement, il est peu dépendant des conditions de charge et affiche une bonne corrélation avec l’élastance maximale du VG (r = 0.85), qui est le meilleur indice de contractilité [4]. Sa valeur normale est 8-15 m/s2.
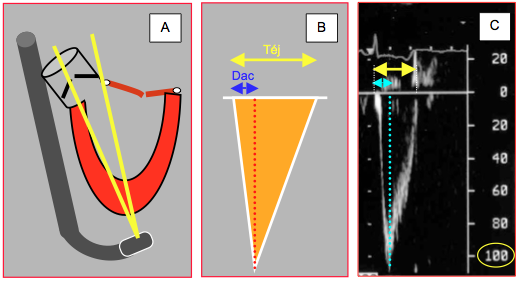
Figure 25.175 : Fonction ventriculaire et flux éjectionnels. A: Mesure du flux à travers la valve aortique en position transgastrique rétrofléchie permettant de se placer dans l'axe de la valve. B: Silhouette du flux à travers la chambre de chasse gauche (Doppler pulsé) ou la valve aortique (Doppler continu) ; normalement, la durée d’accéléraion (Dac) représente ≤ 30% de la durée totale de l’éjection (téj). C : flux à travers la valve aortique (Doppler pulsé) ; on peut calculer le temps d'éjection (double flèche jaune, 240 msec), la vélocité maximale (cercle jaune, 100 cm/s), et la durée pour atteindre le pic de vélocité (Dac, double flèche bleue).
La durée d'éjection est un indice fonctionnel plus fin que la FE. Son allongement signe une perte de puissance du VG, qui n'apparaît pas d'emblée dans les marqueurs échocardiographiques ou hémodynamiques habituels. On la rencontre par exemple lors d'une augmentation brusque de la postcharge comme le clampage aortique face à un ventricule incapable d'augmenter sa force de contraction. Bien que les mesures de pression ou de FE ne soient pas significativement modifiées, l'allongement soudain de la durée d'éjection et la baisse de la Vmax du flux aortique signent une souffrance ventriculaire occulte qui réclame un soutien inotrope, quand bien même la clinique ne le fait pas suspecter (Figure 25.176).
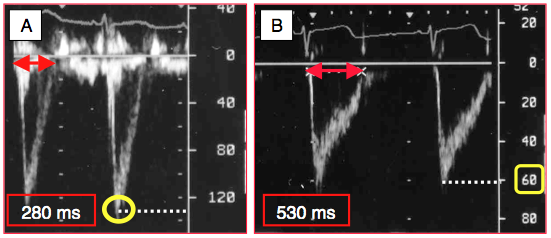
Figure 25.176 : Flux aortique au cours d'un clampage aortique (cure d’anévrysme de l’aorte thoraco-abdominale). A: avant clampage, la Vmax et la durée d'éjection sont normales. B: après clampage de l'aorte, la pression artérielle systolique est passée de 140 à 160 mmHg et la FE de 0.71 à 0.68; ceci représent des variations négligeables. Par contre, la Vmax du flux aortique a chuté de moitié et la durée d'éjection a presque doublé. Le calcul de la Vcf montre qu'elle a baissé à 0.55 (moitié de la norme). Malgré la stabilité apparente de la pression et de la FE, le clampage est mal supporté par ce ventricule.
Le volume systolique (VS) est le produit de la surface de la valve aortique et de l’intégrale des vélocités (ITV) du flux aortique. Comme la surface de la valve ne se modifie guère au cours d’une période d’examen ou d'une opération, on peut estimer les variations du VS simplement par l’évolution de l’ITV (normal : 20-25 cm).
| Indices éjectionnels |
| Les principaux indices éjectionels sont la fraction d'éjection (FE, 0.55 – 0.7), la fraction de raccourcissement de surface (FAC, 0.4 – 0.6) et la vélocité de raccourcissement circonférentielle (Vcf, 1.1 s-1). Les indices éjectionnels sont dépendants de la précharge et de la postcharge. Bien que très parlante, la FE est limitée par l'utilisation d'approximations géométriques en échocardiographie bidimensionnelle. Elle n'est pas une mesure de contractilité, mais exprime la réserve fonctionnelle de l'ensemble ventriculo-artériel. Elle n'est pas valable en cas de valvulopathie ou de cardiopathie congénitale. La fraction de raccourcissement de surface est la mesure éjectionnelle la plus rigoureuse parce qu'elle n'est basée sur aucune extrapolation et n'exprime que ce qu'elle mesure dans le plan choisi (court-axe du VG). Avec l'introduction de la durée d'éjection dans son calcul, la Vcf est une mesure de puissance qui se rapporche davantage de la contractilité du myocarde que les autres indices. L’introduction de la durée d’éjection dans le calcul donne accès à des mesures de puissance (Vcf, flux aortique), qui sont plus sensibles aux altérations fonctionnelles que les mesures de travail (FE). |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- ABUELKASEM E, WANG DW, OMER MA; et al. Perioperative clinical utility of myocardial deformation imaging: a narrative review. Br J Anaesth 2019; 123:408-20
- AHMADPOUR H, SHAH AA, ALLEN JW, et al. Mitral E point septal separation: a reliable index of left ventricular performance in coronary artery disease. Am Heart J 1983; 106:21-8
- ALAM M, WARDELL J, ANDERSON E, et al. Characteristics of mitral and tricuspid annular velocities determined by pulse waved Doppler tissue imaging in healthy subjects. J Am Soc Echocardiogr 1999; 12:618-28
- BAUER F, JONES M, SHIOTA T, et al. Left ventricular outflow tract mean systolic acceleration as a surrogate for the slope of left ventricular end-systolic pressure-volume relationship. J Am Coll Cardiol 2002; 40:1230-7
- BELLENGER N, BURGESS M, RAY S; et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance. Are they interchangeable? Eur Heart J 2000; 21:1387-96
- BUCCHERI S, COSTANZO L, TAMBURINO C, et al. Reference values for real-time three-dimensional echocardiography-derived left ventricular volumes and ejection fraction: review and meta-analysis of currently available studies. Echocardiography 2015; 32: 1841-50
- CHANG SA, LEE SC, KIM EY, et al. Feasibility of single-beat full-volume capture real-time three-dimensional echocardiography and auto-contouring algorithm for quantification of left ventricular volume: validation with cardiac magnetic resonance imaging. J Am Soc Echocardiogr 2011; 24:853-9
- CLEMENTS F, HARPOLE D, QUILL T, et al. Estimation of left ventricular volume by two-dimensional transesophageal echocardiography: comparison of short axis imaging and simultaneous radionuclide angiography. Brit J Anaesth 1990; 64:331-6
- COLLIER P, PHELAN D, KLEIN A. A test in context: myocardial strain measured by speckle-tracking echocardiography. J Am Coll Cardiol 2017; 69:1043-56
- COSYNS B, EDVARDSEN T, HRISTOVA K, KIM HK. Left ventricle: systolic function. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 131-46
- DOROSZ JL, LEZOTTE DC, WELTZENKAMP DA, et al. Performance of 3-dimensional echocardiography in measuring left ventricular volumes and ejection fraction: a systematic review and analysis. J Am Coll Cardiol 2012; 59:1799-808
- KIM HM, CHO GY, HWANG IC, et al. Myocardial strain in prediction of outcomes after surgery for severe mitral regurgitation. JACC Cardiovasc Imaging 2018; 11:1235-44
- KUMAR A, PURI GD, BAHL A. Transesophageal echocardiography, 3-dimensional and speckle-tracking together as sensitive markers for early outcome in patients with left ventricular dysfunction undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2017; 31:1695-701
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- MARWICK TH. Ejection fraction pros and cons. JACC state-of-the-art review. J Am Coll Cardiol 2018; 72:2360-79
- MOR-AVI V. Real-time 3-dimensional echocardiographic quantification of left ventricular volumes: multicenter study for validation with magnetic resonance imaging and investigation of sources of error. JACC Cardiovasc Imaging 2008; 1:413-23
- MURARU D, BADANO LP, PELUSO D, et al. Comprehensive analysis of left ventricular geometry and function by three-dimensional echocardiography in healthy individuals. J Am Soc Echocardiogr 2013; 26:618-28
- OTTERSTAD JE, FROELAND G, ST JOHN SUTTON M, et al. Accuracy and reproducibility of biplane two-dimensional echocardiographic measurements of left ventricular dimensions and function. Eur Heart J 1997; 18:507-13
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography. The case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11:260-74
- QUINONES MA, WAGOONER AD, REDUTO LA, et al. A new, simplified and accurate method for determining ejection fraction with tow-dimensional echocardiography. Circulation 1981; 64:744-53
- ROBOTHAM JL, TAKATA M, BERMAN M, et al. Ejection fraction revisited. Anesthesiology 1991; 74:172-83
- SAGAWA K, MAUGHAN L, SUGA H, et al. Cardiac contraction and the pressure-volume relationship. New York, Oxford University Press, 1988
- SENGELOV M, JORGENSEN PG, JENSEN JS, et al. Global longitudinal strain is superior predictor of all-cause mortality in heart failure with reduced ejection fraction. JACC Cardiovasc Imaging 2015; 8:1351-9
- SUNAGAWA K, MAUGHAN WL, BURKHOFF D, SAGAWA K. Left ventricular interaction with arterial load studied in isolated canine ventricle. Am J Physiol 1983; 56:586-95
- SUNAGAWA K, SAGAWA K, MAUCHAN WL. Ventricular interaction with the vascular system in terms of pressure-volume relationships. In: YIN FCP, ed. Ventricular/vascular coupling. Clinical, physiological and engineering aspects. New York: Springer Verlag, 1987, 210-39
- SVEÄLV BG, OLOFSSON EL, ANDERSSON B. Ventricular long-axis function is of major importance for long-term survival in patients with heart failure. Heart 2008; 94:284-9
- TRIPOSKIADIS F, BUTLER J, ABBOUD FM, et al. The continuous heart failure spectrum: moving beyond an ejection fraction classification. Eur Heart J 2019; 40:2155-63
- VUILLE C, WEYMAN AE. Left ventricle I: General considerations, assessment of chamber size and function. In: WEYMAN AE, ed. Principles and practice of echocardiography. Philadelphia: Lea & Febiger, 1994, 575-624
- YINGCHONCHAROEN T, AGARWAL S, POPOVIC ZB, et al. Normal ranges of left ventricular strain: a meta-analysis. J Am Soc Echocardiogr 2013; 26:185-91
