De nouvelles technologies permettent de quantifier la contraction myocardique au niveau tissulaire, telles le Doppler tissulaire (Vidéo et Figure 25.29) et le speckle-tracking (Vidéo et Figure 25.31) (voir Doppler tissulaire et speckle-tracking).
Vidéo: Doppler tissulaire du septum interventriculaire et de la paroi du VD; le mouvement des parois myocardiques est coloré en bleu lorsque celle-ci s'éloigne du transducteur oesophagien (systole) et en orange lorsqu'elle s'en rapproche (diastole).
Vidéo: vue court-axe du VG en speckle-tracking; la couleur du bleu au rouge traduit l'intensité de la déformation systolo-diastolique. On voit l'inhomogénéité de la contraction et le mouvement de rotation du VG.
Il est ainsi possible de mesurer le raccourcissement systolique de chaque segment indépendamment des mouvements de rotation et de translation de la paroi ventriculaire. Le Doppler tissulaire (DT) observe la vélocité de déplacement de segments de paroi. L’analyse du mouvement myocardique n’est possible que dans l’axe des ultrasons, comme tout effet Doppler : en position rétrocardiaque on observe la contraction – relaxation de la musculature longitudinale latérale (4-cavités), septale (4-cavités) ou antérieure (2-cavités). La contraction radiaire n’est mesurable qu’en voie transgastrique (paroi antérieure et postérieure). La technique de speckle-tracking a l'avantage d'être indépendante de l'angle d'observation, puisqu'elle repose sur le suivi des petits granules (speckles) qui forment la texture des nuances de gris du myocarde à l'imagerie bidimensionnelle. La contraction longitudinale globale (long-axe du VG en vues 4-cavités 0°, 2-cavités 60-90° et long-axe 120°) est particulièrement intéressante à analyser, car elle est dominée par celle des fibres sous-endocardiques qui sont les plus vulnérables à l’ischémie et à la compression. Globalement, le raccourcissement longitudinal de la base vers l'apex est de 20% ± 2%, alors que le raccourcissement radiaire est de 40%; le premier est le plus précis et le mieux reproductible [8,31].
Ces technologies permettent d'observer trois données différentes (voir Figures 25.28 et 25.29).
- La vélocité des mouvements de structures tissulaires comme l'anneau mitral ou un segment myocardique. La systole est caractérisée par un déplacement S' de vélocité 10-15 cm/s, bien corrélé à la FE [27]. La diastole est marquée par deux évènements sur la courbe de vélocité tissulaire: la relaxation protodiastolique E' et la contraction auriculaire A' (Figure 25.182). Après réglage de la machine sur la fonction Doppler tissulaire (DT) et sur une émission de basse fréquence (≤ 4 MHz), la fenêtre du Doppler pulsé est ajustée au niveau de l’anneau mitral avec une ouverture de 5-10 mm ; l’échelle des vélocités est de 15-20 cm/s. L’axe du Doppler est positionné aussi parallèle que possible au déplacement mitral, parfois en modifiant légèrement l’angle du capteur. La position la plus habituelle est la partie latérale de l'anneau en vue 4-cavités 0-20° (8-12 cm/s). La vélocité S' est un peu plus basse au niveau septal. La routine est de moyenner ces deux valeurs sur 3 échantillons successifs.
- La déformation par rapport à la forme initiale ou strain (ε): ε = (L – L0) / L0 = ΔL / L0 (en %). Un segment de 2 cm qui s’allonge de 0.4 cm présente une déformation de 0.4/2 = 20% ; cette déformation est positive en cas d’allongement (diastole) et négative en cas de raccourcissement (systole) (voir Figure 25.27). La déformation systolique longitudinale normale est de -20% à -22% (raccourcissement); la déformation radiale est de 30% à 45% (épaississement) [13]. La paroi ventriculaire est divisée en trois segments (basal, médian et apical), dont la courbe de déformation longitudinale peut être suivie individuellement (Figure 25.183). Celle-ci augmente d'environ 2% de la base à l'apex [7]. Elle tend à diminuer avec l'âge, avec l'obésité et avec le diabète; elle est augmentée chez les athlètes [7,25]. La déformation longitudinale gobale est une mesure très performante et très sensible de la fonction systolique du ventricule, particulièrement utile dans les situations où le VG est déformé et la fraction d'éjection peu pertinente ou encore normale, comme les cardiomyopathies ou les valvulopathies [7].
- La vitesse de déformation ou strain rate (SR): SR = ε / Δt (s-1). Si la déformation précédente a lieu en 2 secondes, la SR est de 20%/2 = 0.1 s-1. En échocardiographie, la SR est mesurée par la différence de vélocité (V) aux extrémités du segment de longueur L: ΔV/ΔL (en s-1). (Figure 25.184).
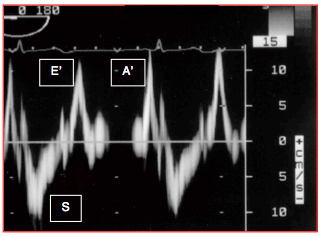
Figure 25.182 : Courbe des vélocités de l'anneau mitral latéral au Doppler tissulaire traduisant la contraction-relaxation longitudinale du VG. S: contraction systolique. E': relaxation protodiastolique. A': contraction auriculaire. Pour les trois mouvements, la Vmax normale est de 10-15 cm/s.
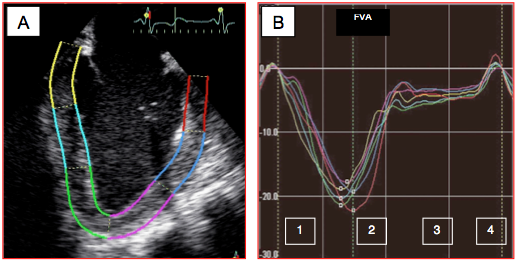
Figure 25.183 : Déformation (strain) longitudinale du VG répartie sur plusieurs segments identifiés individuellement par des couleurs différentes. A: vue 2-cavités du VG en télédiastole avec identification et colorisation des segments des parois antérieure et inférieure; chaque paroi est divisée en 3 zones: basale, médiane et apicale. B: courbes de déformation de chaque segment. 1: contraction systolique. 2: relaxation protodiastolique. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique. La déformation systolique normale est de – 20% [6].
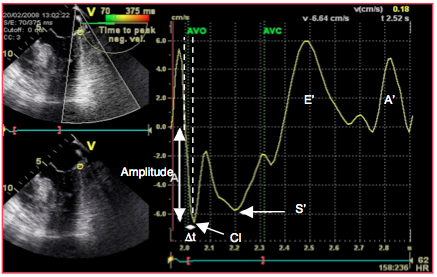
Figure 25.184 : Courbe de vitesse de déformation (strain rate) au cours d’un cycle cardiaque. CI : contraction isovolumétrique. S : éjection systolique. E’ et A’ : vélocités tissulaires diastoliques. L'amplitude représente la Vmax de la contraction isovolumétrique. Δt: durée de la phase d'accélération de la CI. Le rapport Vmax/Δt donne la pente de l'accélération isovolumétrique (valeur normale 3.0 m/s2) [29].
En regardant attentivement le mouvement systolique S', on voit qu'il est précédé de deux brefs déplacements liés à la contraction isovolumétrique (Figure 25.185) [4,26].
- Un premier pic négatif (raccourcissement) dû à la contraction isovolumétrique de la couche des fibres myocardiques sous-endocardiques longitudinales (hélice dextrogyre) et de la couche des fibres médianes circulaires.
- Un deuxième pic positif dû à l'étirement de la couche des fibres sous-épicardiques (hélice lévogyre), qui sont distendues par l'épaississement de la paroi sous-jacente et qui se contractent avec un retard de 50-60 msec sur le reste de la paroi; cette couche est essentielle pour assurer la torsion du ventricule (voir Figure 5.23).
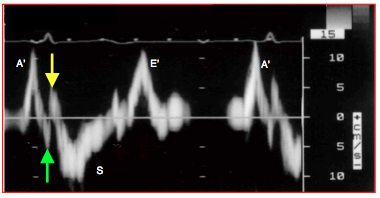
Figure 25.185 : Courbe de vélocité de l'anneau mitral latéral au Doppler tissulaire. S: contraction systolique longitudinale. E': relaxation protodiastolique. A': contraction auriculaire. Les Vmax sont normales (10-12 cm/s). La vélocité S est précédée de deux déflections: la première représente la contraction isovolumétrique des deux couches sous-épicardique longitudinale et circulaire médiane (flèche verte), la deuxième l'étirement de la couche longitudinale sous-épicardique qui se contracte ultérieurement (flèche jaune).
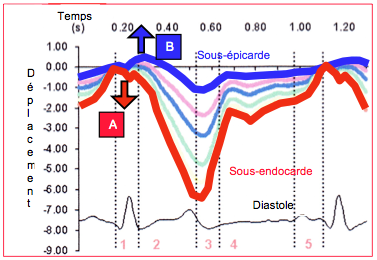
Figure 5.23 : Déplacements respectifs de la musculature sous-endocardique (trait rouge) et sous-épicardique (trait bleu) de la paroi antérieure du VG. Pendant la phase de contraction isovolumétrique (1), les fibres sous-endocardiques se contractent (A) alors que les fibres sous-épicardiques sont distendues (B) et ne se contractent que plus tardivement pendant la phase d’éjection (2) ; d’autre part, l’importance de leur déplacement (en mm) est plus faible que celui des fibres sous-endocardiques [D'après: Sengupta PP et al. Left ventricular form and function revisited: Applied translational science to cardiovascular ultrasound imaging. J Am Soc Echocardiogr 2007; 20:539-51].
La Vmax de la contraction isovolumétrique divisée par la durée pour atteindre le pic de vélocité (Δt) donne la pente d’accélération de cette contraction isovolumétrique (normal : 3.0 m/s2); elle est un excellent indice de la contractilité myocardique, car elle est indépendante de la fréquence et de la postcharge, puisqu'elle survient avant l'ouverture de la valve aortique (voir Figure 25.184). Elle est très bien corrélée à l'élastance télésystolique qui est le meilleur marqueur de la contractilité intrinsèque du myocarde [1,10,29].
Une baisse de la Vmax S' < 6 cm/s est un bon marqueur d'insuffisance systolique. Toutefois, cette mesure reste dépendante de la précharge et de la postcharge lorsqu'elle est effectuée au Doppler tissulaire. La déformation et la vitesse de déformation (strain et strain rate) au speckle-tracking sont moins dépendantes de la précharge puisqu'elles prennent comme base de départ la longueur d'origine du segment observé, qui est réglée par la tension de paroi télésystolique (principe de Frank-Starling); elles restent par contre très influencée par la postcharge [7]. Actuellement, la technique du speckle-tracking tend à supplanter celle du Doppler tissulaire [25].
Ces mesures de déformation tissulaire tiennent compte de l’hétérogénéité physiologique de la contraction du VG, dont les parois antérieure et latérale ont une contraction radiale plus importante que les parois postérieure et septale. La contraction longitudinale est un peu plus importante à l'apex qu'à la base (+ 2%), mais la Vmax est la plus élevée dans les segments basaux du VG. Ces techniques permettent aussi d’identifier et de quantifier les altérations de la cinétique segmentaire et les désynchronisations. Dans une zone hypokinétique, la Vmax des différentes vélocités tissulaires est baissée en-dessous de 5 cm/s (Figure 25.186).
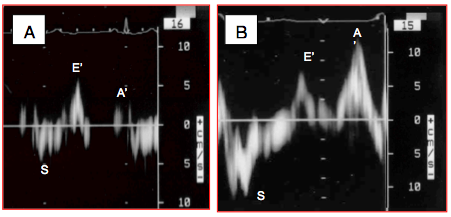
Figure 25.186 : Courbe des vélocités longitudinales de l'anneau mitral latéral au Doppler tissulaire en cas d'ischémie de la paroi latérale. A: dans un segment sévèrement hypokinétique, la Vmax est abaissée < 5 cm/s en systole (S) et en diastole (E' et A'). B: en cas d'ischémie mineure, le premier élément touché est la relaxation diastolique. Dans ce cas, la vélocité E' est diminuée (E' < A').
L'observation de la courbe de déformation dans une zone en ischémie active montre une triple modification: 1) un allongement protosystolique, 2) une baisse de vélocité systolique S', et 3) un raccourcissement post-systolique (tardokinésie) (Figure 25.187) [6,11]. Mais l'évaluation par segments de la totalité du VG au moyen du Doppler tissulaire ou du speckle-tracking est complexe, entachée d'artéfacts, et souvent difficile à analyser, particulièrement en salle d'opération. On estime qu'au moins un segment par vue est inanalysable chez 20% des patients [7]. D'où l'intérêt pour une mesure plus commode, qui est la déformation longitudinale globale (global longitudinal strain, GLS), ou déformation moyenne de toute la longueur de la paroi ventriculaire [30].
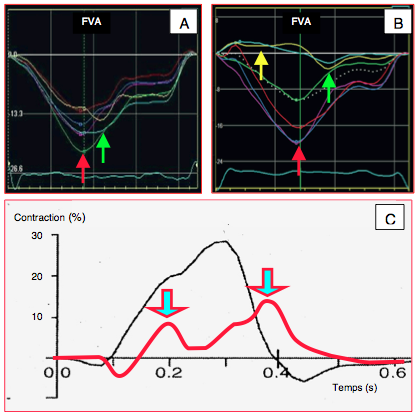
Figure 25.187 : Courbes de déformation longitudinale globale en cas d'ischémie myocardique aiguë. A: contraction post-systolique (flèche verte) dans la zone ischémiée survenant après le pic systolique (flèche rouge) de la paroi ventriculaire normale. Le degré de déformation est nettement diminué dans la zone ischémiée. B: étirement protosystolique (flèche jaune) et contraction postsystolique (flèche verte) dans la zone ischémiée (paroi latérale). Le degré de déformation est quasi-nul dans la zone infarcie (courbes jaune et bleue claire). C: effet d’une occlusion de 5 minutes de l’artère interventriculaire antérieure sur la contraction myocardique locale (courbe rouge) par rapport à la contraction normale (courbe noire). Non seulement le déplacement radiaire de l’endocarde passe de 28% à 13%, mais il change de configuration : la contraction est retardée de 200 ms, et il apparaît un raccourcissement post-systolique qui survient pendant la phase de relaxation isovolumétrique normale [6]. FVA: fermeture de la valve aortique.
Global longitudinal strain (GLS)
Alors que la FE peut rester normale en cas de dysfonction du VG lorsque la cavité gauche est petite (hypertrophie concentrique, sténose aortique) ou la postcharge basse (insuffisance mitrale), le raccourcissement longitudinal global (Global longitudinal strain, GLS) est un marqueur pronostique beaucoup plus sensible dans l'insuffisance ventriculaire, la coronaropathie, les valvulopathies et les arythmies, parce que les fibres longitudinales sous-endocardiques sont les plus vulnérables à l'ischémie et au stress [12]. Cet indice compense l'imprécision de la FE, particulièrement lorsque celle-ci se situe entre 35% et 55%. Sa valeur normale est 20% ± 2% pour le VG [31]. Une baisse du raccourcissement longitudinal à ≤ 15% est un signe précoce de dysfonction ventriculaire, quelle que soit la FE [5,24].
Le GLS détecte précocement la cardiopathie liée à l'obésité, au diabète ou à l'hypertension, bien que la FE soit encore normale (insuffisance cardiaque stade I) [15]. Dans la cardiomyopathie hypertrophique, un GLS < 10% présente un risque de morbi-mortalité quatre fois supérieur à un GLS > 16% [19]. Une baisse de la Vmax S' de l'anneau mitral à ≤ 6 cm/s prédit une augmentation de mortalité dans la population générale (hasard ratio 2.5) [21]. Dans l'insuffisance cardiaque, la valeur pronostique de la chute de la déformation longitudinale du VG pour la mortalité à 5 ans est nettement supérieure à celle de la FE: un GLS de 13%, 10% ou < 8% prédit une mortalité de 34%, 38% et 49%, respectivement, alors que la FE n'est pas discriminante [23]. Bien que la coronaropathie soit une maladie segmentaire, la déformation longitudinale globale du VG est un indice fonctionnel sensible et un prédicteur de risque significatif en cas de N-STEMI [18]. Dans les valvulopathies asymptomatiques comme peuvent l'être la sténose aortique, l'insuffisance mitrale et l'insuffisance aortique, la diminution du GLS à < -15% est un prédicteur indépendant de défaillance ventriculaire et de mortalité; c'est un critère précieux de souffrance ventriculaire pour justifier l'indication opératoire, alors que sa normalité (≥ 20%) a une valeur prédictive négative de 100% pour la décompensation ventriculaire [9,20,25,32]. La déformation longitudinale montre que 50-60% des cas d'insuffisance diastolique à fraction d'éjection préservée souffrent aussi d'une dysfonction systolique infraclinique, et qu'un GLS < 15% agrave le pronostic [16]. En chirurgie cardiaque, une diminution de la déformation longitudinale globale à < 10% est un prédicteur indépendant de bas débit cardiaque postopératoire, de la durée d'hospitalisation, des complications cardiaques et de la mortalité à une année [3,13,14,17,28]. La valeur limite pour le pronostic est une baisse de 3-5 points par rapport à la norme (20%).
L'acquisition des vues bi-dimensionnelles pour le calcul de la déformation longitudinale globale demande un certain savoir-faire. L'enregistrement d'une boucle de 3-4 cycles cardiaque est réalisé en apnée; l'analyse est conduite en différé sur le meilleur enregistrement. L'analyse porte sur les trois vues mi-oesophagiennes 4-cavités (0°), 2-cavités (60-90°) et long-axe (120°) en respectant certaines conditions (Vidéo) [1,7,13,22,25,30].
- Le rythme cardiaque doit être régulier (variation < 10 batt/min) et l'ECG de bonne qualité, car l'onde R détermine la synchronisation avec la télédiastole. La fermeture de la valve aortique, qui définit la télésystole, est contrôlée en mode TM à travers la valve aortique.
- La cadence (frame rate) est de 60-90 image/s, ce qui est trop lent pour des évènements brefs comme la contraction isovolumétrique, mais ce qui permet d'analyser la totalité du VG.
- Le réglage du gain et de la compression doit être très précis et la qualité des images 2D parfaite; on utilise souvent l’imagerie en deuxième harmonique lors d'examen transthoracique.
- L'image doit comprendre la totalité du VG sans amputation de l'apex et être d'excellente qualité pour que le processeur puisse l'analyser (contraste suffisant entre le tissu et le sang, absence de "trous" et d'ombres).
- Le marquage de 3 points, sur la face ventriculaire de l'anneau mitral (2 points) et à l'apex (1 point), permet au logiciel de reconnaissance de l'endocarde de définir la zone d'intérêt (region of interest, ROI). Celle-ci doit inclure l'apex mais non l'anneau mitral, ni la chambre de chasse, ni le péricarde, car ils induiraient une sous-estimation de la contraction. Une correction manuelle permet de rectifier le tracé si nécessaire.
- Le trait interne qui définit la zone d'intérêt est situé au niveau de l'endocarde; les trabéculations et les muscles papillaires sont inclus dans la cavité ventriculaire. Le trait externe doit passer au milieu de l'épaisseur de paroi du VG, côté ventriculaire de l'anneau mitral et s'arrêter à l'entrée de la CCVG; il se tient à distance du péricarde. L'épaisseur de la zone doit permettre une analyse du mouvement longitudinal de la paroi sous-endocardique. Le mouvement radiaire et l'épaississement de paroi ne sont pas concernés.
- Dans le cycle cardiaque choisi au sein de la boucle, on marque l'image correspondant à la fermeture de la valve aortique.
Vidéo: enregistrement de la déformation (strain) du VG au cours du cycle cardiaque en vues 4-cavités, 2-cavités, long-axe et en carte polaire.
Malgré ses avantages, la technologie du speckle-tracking bi-dimensionnel présente des limitations intrinsèques. Dans 20% des cas, au moins un segment est ininterprétable par le processeur [7]. Or les boucles comprenant plus d'un segment illisible doivent être éliminées de l'analyse [30]. Les mouvements enregistrés dans le plan d'examen ne sont pas toujours dus à des structures parallèles ou perpendiculaires à l'endocarde, mais à des éléments spiralés obliques ayant une direction différente et coupant le plan avec un certain angle. L'utilisation du 3D peut corriger cette source d'erreur, mais au détriment rédibitoire de la résolution spatiale et de la fréquence d'image. Le bruit de fond enregistré par les ultrasons peut rendre difficile l'identification des structures tissulaires composant les tachetures des parois (speckles); le réglage du gain et de la compression peut être ardu. Enfin, les microstructures identifiées comme speckles par les algorithmes de reconnaissance de forme ne sont pas stables et se déforment avec le temps, ce qui occasionne des erreurs aléatoires dont l'accumulation peut perturber l'examen [30].
Ces quelques exemples démontrent que la déformation longitudinale globale mesurée avec la technique de speckle-tracking apporte un supplément d'information considérable sur la fonction du VG dans les situations où la clinique et la fraction d'éjection ne sont pas discriminantes; c'est le cas chez les patients paucisymptomatiques et chez ceux dont la FE est ≥ 45%, car cette dernière n'est liée au pronostic que lorsqu'elle est < 40% [25]. Bien qu'elle soit influencée par les conditions de charge et par l'âge (baisse de 2% > 60 ans), la déformation longitudinale globale est en passe de devenir un élément routinier dans l'évaluation fonctionnelle des ventricules, particulièrement depuis que les algorithmes d'analyse se sont simplifiés et que les modes d'affichage ont été codifiés.
Malgré ses avantages, la technologie du speckle-tracking bi-dimensionnel présente des limitations intrinsèques. Dans 20% des cas, au moins un segment est ininterprétable par le processeur [7]. Or les boucles comprenant plus d'un segment illisible doivent être éliminées de l'analyse [30]. Les mouvements enregistrés dans le plan d'examen ne sont pas toujours dus à des structures parallèles ou perpendiculaires à l'endocarde, mais à des éléments spiralés obliques ayant une direction différente et coupant le plan avec un certain angle. L'utilisation du 3D peut corriger cette source d'erreur, mais au détriment rédibitoire de la résolution spatiale et de la fréquence d'image. Le bruit de fond enregistré par les ultrasons peut rendre difficile l'identification des structures tissulaires composant les tachetures des parois (speckles); le réglage du gain et de la compression peut être ardu. Enfin, les microstructures identifiées comme speckles par les algorithmes de reconnaissance de forme ne sont pas stables et se déforment avec le temps, ce qui occasionne des erreurs aléatoires dont l'accumulation peut perturber l'examen [30].
Ces quelques exemples démontrent que la déformation longitudinale globale mesurée avec la technique de speckle-tracking apporte un supplément d'information considérable sur la fonction du VG dans les situations où la clinique et la fraction d'éjection ne sont pas discriminantes; c'est le cas chez les patients paucisymptomatiques et chez ceux dont la FE est ≥ 45%, car cette dernière n'est liée au pronostic que lorsqu'elle est < 40% [25]. Bien qu'elle soit influencée par les conditions de charge et par l'âge (baisse de 2% > 60 ans), la déformation longitudinale globale est en passe de devenir un élément routinier dans l'évaluation fonctionnelle des ventricules, particulièrement depuis que les algorithmes d'analyse se sont simplifiés et que les modes d'affichage ont été codifiés.
| Déformation systolique tissulaire |
| La vélocité tissulaire, la déformation (strain) et la vitesse de déformation (strain rate) sont de robustes indicateurs de la fonction myocardique; ils détectent des altérations subtiles de la performance systolique qui échappent aux mesures conventionnelles. - Vmax S du déplacement tissulaire longitudinal (Doppler tissulaire); normal: 8-12 cm/s - Déformation longitudinale; normal: -20 à -25%; déformation radiale: -30 à -35% - Vitesse de déformation: différence de Vmax S aux extrémités d'un segment de longueur L; normal: 0.1/s Une baisse de la Vmax S < 6 cm/s est un bon marqueur d'insuffisance systolique. Une baisse de la déformation systolique en-dessous de -17% est un facteur de mauvais pronostic en chirurgie cardiaque quelle que soit la valeur des autres critères de fonction systolique. La déformation longitudinale globale mesurée avec la technique de speckle-tracking est une mesure sensible et robuste pour l'évaluation fonctionnelle du VG; elle compense les défaillances de la fraction d'éjection dans les situations où celle-ci n'est pas clairement pathologique. |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
Références
- ABUELKASEM E, WANG DW, OMER MA; et al. Perioperative clinical utility of myocardial deformation imaging: a narrative review. Br J Anaesth 2019; 123:408-20
- ALAM M, WARDELL J, ANDERSSON E, et al. Assessment of left ventricular function using mitral annular velocities in patients with congestive heart failure with or without the presence of significant mitral regurgitation. J Am Soc Echocardiogr 2003; 16:240-5
- AMABILI P, BENBOUCHTA S, ROEDIGER L, et al. Low cardiac output syndrome after adult cardiac surgery: predictive value of peak systolic global longitudinal strain. Anesth Analg 2018; 126:1476-83
- ASHIKAGA H, VAN DER SPOEL TI, COPPOLA BA, OMENS JH. Transmural myocardial mechanics during isovolumic contraction. JACC Cardiovasc Imaging 2009; 2:202-11
- CARDIM N, GALDERISI M, EDVARDSEN T, et al. Role of multiimodality cardiac imaging in the management of patients with hypertrophic cardiomyopathy: an expert consensus of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015; 16:280 a-hh
- CARR-WHITE GS, LIM E, KOH TW, et al. Regional ventricular dynamics during acute coronary occlusion: A comparison of invasive with non-invasive echocardiographic markers to detect and quantify myocardial ischaemia – observations made during off-pump coronary surgery. Int J Cardiol 2006; 113:376-84
- COLLIER P, PHELAN D, KLEIN A. A test in context: myocardial strain measured by speckle-tracking echocardiography. J Am Coll Cardiol 2017; 69:1043-56
- EDVARDSEN T, HAUGAA TH. Imaging assessment of ventricular mechanics. Heart 2011; 97:1349-56
- EWE SH, HAECK MLA, NG ACT, et al. Detection of subtle left ventricular systolic dysfunction in patients with significant aortic regurgitation and preserved left ventricular ejection fraction: speckle-tracking echocardiographic analysis. Eur Heart J Cardiovasc Imaging 2015; 16:992-9
- GREENBERG NL, FIRSTENBERG MS, CASTRO PL, et al. Doppler-derived myocardial systolic strain rate is a strong index of left ventricular contractility. Circulation 2002; 105:99-105
- GRENNE B, EEK C, SJØLI B, et al. Acute coronary occlusion in non-ST-elevation acute coronary syndrome: outcome and early identification by strain echocardiography. Heart 2010; 96:1550-6
- HAUGAA KH, GRENNE BL, EEK CH, et al. Strain echocardiography improves risk prediction of ventricular arrhythmias after myocardial infarction. JACC Cardiovasc Imaging 2013; 6:841-50
- HOWARD-QUIJANO K, SALEM A, BARKULIS C, et al. Preoperative three-dimensional strain imaging identifies reduction in left ventricular function and predicts outcomes after cardiac surgery. Anesth Analg 2017; 124:419-28
- JHA AK, MALIK V, GHARDE P, et al. Echocardiographic predictors of immediate postoperative outcomes in patients with severe left ventricular systolic dysfunction undergoing on-pump coronary artery bypass grafting. J Cardiothorac Vasc Anesth 2017; 31:184-90
- KOSMALA W, SANDERS P, MARWICK TH. Subclinical myocardial impairment in metabolic disease. JACC Cardiovasc Imaging 2017; 10:692-703
- KRAIGHER-KRAINER E, SHAH AM, GUPTA DK, et al. Impaired systolic function by strain imaging in heart failure with preserved ejection fraction. J Am Coll Cardiol 2014; 63:447-56
- KUMAR A, PURI GD, BAHL A. Transesophageal echocardiography, 3-dimensional and speckle-tracking together as sensitive markers for early outcome in patients with left ventricular dysfunction undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2017; 31:1695-701
- LIOU K, NEGISHI K, HO S, et al. Detection of obstructive coronary artery disease using peak systolic global longitudinal strain derived by two-dimensional speckle-tracking: a systematic review and meta-analysis. J Am Soc Echovcardiogr 2016; 29:724-35.e4
- LIU H, POZIOS I, HAILESELASSIE B, et al. Role of global longitudinal strain in predicting outcomes in hypertrophic cardiomyopathy. Am J Cardiol 2017; 120:670-5
- MASCLE S, SCHNELL F, THEBAULT C, et al. Predictive value of global longitudinal strain in a surgical population of organic mitral regurgitation. J Am Soc Echocardiogr 2012; 25:766-72
- MOGELVANG R, SOGAARD P, PEDERSEN SA, et al. Cardiac dysfunction assessed by echocardiographic tissue Doppler imaging is an independent predictor of mortality in the general population. Circulation 2009; 119:2679-85
- NEGISHI K, NEGISHI T, KUROSAWA K, et al. Practical guidance in echocardiographic assessment of global longitudinal strain. JACC Cardiovasc Imaging 2015; 8:489-92
- PARK JJ, PARK JB, PARK JH, et al. Global longitudinal strain to predict mortality in patients with acute heart failure. J Am Coll Cardiol 2018; 71:1947-57
- PLANA JC, GALDERISI M, BARAC A, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2014; 15:1063-93
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography. The case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11:260-74
- SENGUPTA PP. Exploring left ventricular isovolumic shortening and stretch mechanics. JACC Cardiovasc Imaging 2009; 2:212-15
- SKUBAS N. Intraoperative Doppler Tissue imaging is a valuable addition to cardiac anesthesiologist’s armamentarium: A core review. Anesth Analg 2009; 108:48-66
- SONNY A, ALFIREVIC A, SALE S, et al. Reduced left ventricular global longitudinal strain predicts prolonged hospitalization: a cohort analysis of patients having aortic valve replacement surgery. Anesth Analg 2018; 126:1484-93
- VOGEL M, SCHMIDT R, KRISTIANSEN S, et al. Validation of myocardial acceleration during isovolumic contraction as a novel non-invasive index of right ventricular contractility. Circulation 2002; 105:1693—9
- VOIGT JU, PEDRIZZETTI G, LYSYANSKY P, et al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging 2015; 16:1-11
- YINGCHONCHAROEN T, AGARWAL S, POPOVIC ZB, et al. Normal ranges of left ventricular strain: a meta-analysis. J Am Soc Echocardiogr 2013; 26:185-91
- YINGCHONCHAROEN T, GIBBY C, RODRIGUEZ LL, et al. Association of myocardial deformation with outcome in asymptomatic aortic stenosis with normal ejection fraction. Circ Cardiovasc Imaging 2012; 5:719-25
