La contraction systolique du VG comprend quatre mouvements distincts (Figure 5.18) (Vidéo) [20]:
Vidéo: Vue mi-oeosophagienne des 4 cavités d'un coeur normal au cours d'un cycle cardiaque.
- Epaississement de paroi de 30-40%.
- Raccourcissement radial concentrique de 20-35%.
- Raccourcissement longitudinal de 15-20% ; la base (jonction atrio-ventriculaire) se déplace vers l’apex, qui reste immobile ; ce mouvement contribue au remplissage de l’OG pendant la systole du VG, comme si le plancher auriculaire descendait brusquement à la manière d’un piston.
- Torsion de 15-20° autour du long-axe [13].
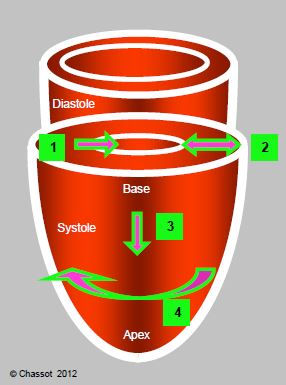
Figure 5.18 : La contraction du VG comprend 4 mouvements distincts. 1 : raccourcissement radiaire (concentrique, selon le court-axe). 2 : épaississement de paroi. 3 : raccourcissement longitudinal (selon le long-axe). 4 : rotation globale anti-horaire. La contraction commence dans le sous-endocarde et à l’apex ; elle se propage du sous-endocarde vers le sous-épicarde et de l’apex vers la base. L’apex reste immobile, car c’est la base du VG qui se déplace en direction de l’apex ; ce mouvement est visible à l’échocardiographie par la descente systolique de l’anneau mitral (environ 1 cm).
Le résultat est une fraction d’éjection en volume de 65%. A noter que le raccourcissement de chaque sarcomère individuel n’est que de 15%.
Le raccourcissement circulaire du myocarde (selon le court-axe du VG) est responsable de plus de 75% de la pression d'éjection; le raccourcissement longitudinal (long-axe du VG) contribue davantage à l'éjection qu'à la pression. L'apex restant immobile, c'est essentiellement la descente de l'anneau mitral qui joue le rôle de piston. La contraction du VG n’est pas anatomiquement uniforme. Si l’on divise la paroi ventriculaire en quatre quadrants (latéral, antérieur, postérieur et septal), on voit que le degré de torsion et le déplacement concentrique de chacun des quadrants est différent (Figure 5.19) [13,14]:
- Paroi latérale : torsion 20-34°, raccourcissement concentrique 45%.
- Paroi antérieure : torsion 17-23°, raccourcissement concentrique 38%.
- Paroi postérieure : torsion 9-15°, raccourcissement concentrique 25%.
- Paroi septale : torsion < 5°, raccourcissement concentrique 18%.
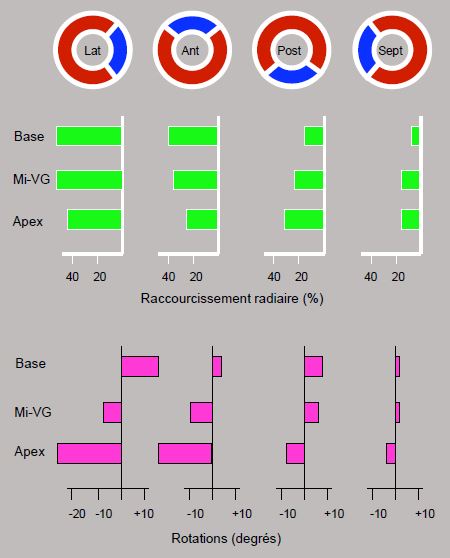
Figure 5.19 : Raccourcissement radiaire et rotation selon les quadrants du VG. On divise habituellement le VG en 4 quadrants selon le court-axe du ventricule : latéral, antérieur, postérieur et septal. Le degré de contraction est le plus important dans le quadrant latéral, un peu moins marqué dans le quadrant antérieur, et nettement plus faible dans les quadrants postérieur et septal. En particulier, le degré de raccourcissement de la paroi postéro-basale (cercle bleu) est plus faible que le reste du VG, raison pour laquelle elle paraît souvent hypokinétique à l’échocardiographie. Le degré de rotation suit le même dégradé que le raccourcissement ; il est plus important à l’apex qu’à la base et presque nul au niveau du septum [13,14].
La contribution de chaque quadrant à l’éjection du volume systolique est donc inégale : la participation de la paroi latérale est maximale, suivie de celle de la paroi antérieure ; celle de la paroi postérieure est moins importante, et le septum contribue peu à l’éjection gauche. De plus, la rotation et le raccourcissement radial de la paroi postérieure sont plus marqués à l’apex qu’à la base ; la partie postéro-basale est donc relativement hypokinétique par rapport au reste du ventricule. Ce moindre déplacement physiologique de la paroi postérieure est une garantie contre l’effet CMO (subobstruction dynamique de la CCVG analogue à la cardiomyopathie obstructive, dite CMO), parce que le feuillet antérieur de la valve mitrale est ainsi maintenu éloigné de la CCVG pendant la systole (voir Figure 5.25). Enfin, la déformation systolique est toujours plus marquée dans le sous-endocarde que dans le sous-épicarde. On voit donc que la perte de fonctionnalité par un infarctus ou une ischémie aiguë n’aura pas le même retentissement hémodynamique selon la localisation de la lésion. Il en est de même pendant les pontages aorto-coronariens à cœur battant : l’immobilisation et la compression de la paroi latérale compromettent davantage le débit cardiaque que celles de la paroi postérieure [6,15].
Torsion du VG
La torsion du VG sur lui-même est due à l’obliquité des fibres longitudinales sous-endocardiques et sous-épicardiques. Elle consiste en une rotation globale anti-horaire de 15-20° en regardant le VG depuis l’apex (Vidéos). C’est un mécanisme qui comprend plusieurs éléments (Figure 5.20) [2,8,13,17,21].
Vidéo: La torsion du VG sur lui-même en systole est bien visible lorsque le coeur est dressé dans le péricarde lors de pontages aorto-coronariens à coeur battant (OPCAB).
Vidéo: Verticalisation du coeur et immobilisation de la zone opératoire au cours d'une anastomose sur l'artère circonflexe (paroi latérale); on voit particulièrement bien le mouvement de torsion systolique du ventricule gauche.
Vidéo: Analyse par speckle-tracking de la déformation complexe du VG au cours du cycle cardiaque (vue court-axe transgastrique): épaississement pariétal, raccourcissement circonférentiel et contraction radiale; la rotation du ventricule sur lui-même est bien visible.
Vidéo: La torsion du VG sur lui-même en systole est bien visible lorsque le coeur est dressé dans le péricarde lors de pontages aorto-coronariens à coeur battant (OPCAB).
Vidéo: Verticalisation du coeur et immobilisation de la zone opératoire au cours d'une anastomose sur l'artère circonflexe (paroi latérale); on voit particulièrement bien le mouvement de torsion systolique du ventricule gauche.
Vidéo: Analyse par speckle-tracking de la déformation complexe du VG au cours du cycle cardiaque (vue court-axe transgastrique): épaississement pariétal, raccourcissement circonférentiel et contraction radiale; la rotation du ventricule sur lui-même est bien visible.
- Légère rotation horaire pendant la contraction isovolumétrique, due à la contraction initiale des fibres sous-endocardiques.
- Torsion globale anti-horaire due à la contraction de la musculature sous-épicardique ; celle-ci est plus oblique, plus longue et offre davantage de couple que la musculature sous-endocardique, raison pour laquelle elle est dominante, quoique tardive.
- Rotation horaire de la base (+ 5°) pendant l’éjection.
- Rotation anti-horaire de l’apex (- 12°) pendant l’éjection.
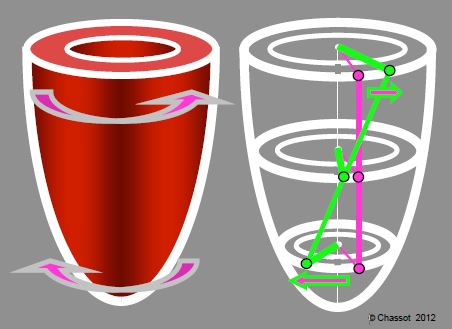
Figure 5.20 : Rotation du VG. Pendant l’éjection, le VG subit une torsion sur son long axe (angle α) : rotation horaire de la base (+ 5°) et rotation anti-horaire de l’apex (- 12°) par le jeu des contractions sous-épicardique (en jaune) et sous-endocardique (en bleu). En observant 3 points alignés en télédiastole (en violet), on voit que leur position a changé en télésystole (en vert) mais qu’ils sont toujours alignés sur une droite. Plus on se déplace de la base vers l’apex, plus la rotation augmente. Celle-ci est proportionnelle à la taille du VG, car l’angle de torsion est de 2.3° par cm de long axe ventriculaire [11]. Chez l’homme, où le long-axe mesure 8-9 cm, la rotation globale est effectivement de 15-20°.
L’obliquité des fibres sous-épicardiques et sous-endocardiques les rend pratiquement perpendiculaires entre elles ; de ce fait, leur effet sur la torsion du VG est opposé et la contration sous-endocardique diminue le degré de rotation imposé par la contraction sous-épicardique plus puissante [22]. Cette torsion est plus marquée à l’apex qu’à la base, et plus accentuée dans la zone sous-endocardique (19°) que dans la zone sous-épicardique (10°). Entre la télédiastole et la télésystole, un point situé sur l’endocarde a parcouru un angle double de celui parcouru par un point épicardique, vu que le rayon du premier est la moitié du second. De ce fait, le cisaillement reste identique sur toute l’épaisseur de paroi, ce qui minimise les forces de friction entre fibres myocardiques (Figure 5.21) [3,21]. La torsion contribue ainsi à l’homogénéité des déformations systolo-diastoliques au sein de la paroi ventriculaire [3,22]. Plus on se déplace de la base vers l’apex, plus la rotation augmente. Celle-ci est proportionnelle à la taille du VG, car l’angle de torsion est de 2.3° par cm de long axe ventriculaire (Figure 5.20) [11]. Cette valeur est la même pour les cœurs de tous les mammifères ; les grands cœurs ont donc davantage de rotation que les petits. Le degré de torsion est fonction de la contractilité myocardique, dont elle est un indice plus fin que la fraction d’éjection. Elle augmente avec la précharge (effet Starling) et la stimulation β, diminue avec la dysfonction et l’ischémie [10]. En cas d’ischémie transmurale la rotation cesse dans le segment concerné, mais en cas d’ischémie sous-endocardique, la torsion sous-épicardique anti-horaire n’est plus contrebalancée par la torsion sous-endocardique dans le sens horaire et la rotation globale augmente [19]. Cette dysfonction sous-endocardique avec torsion accentuée se retrouve dans l’hypertrophie ventriculaire concentrique, le diabète et le vieillissement. La torsion est au contraire diminuée dans l’insuffisance ventriculaire, dans la dysfonction diastolique restrictive et lors de rejet dans la transplantation [22].
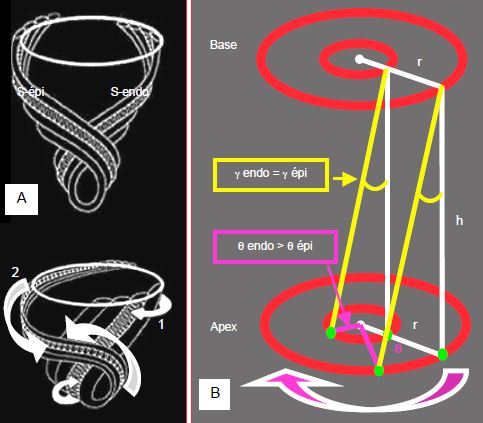
Figure 5.21 : Rotation du VG pendant la systole à partir de la position télédiastolique. A : Pendant la contraction isovolumétrique, le VG subit une légère rotation horaire due à la contraction initiale des fibres sous-endocardiques (1). Pendant l’éjection, il affiche une torsion globale anti-horaire due à la contraction sous-épicardique (2) ; cette dernière musculature est plus oblique, plus longue et offre davantage de couple que la musculature sous-endocardique, raison pour laquelle elle est dominante, quoique tardive [4]. B : Entre la télédiastole et la télésystole, un point situé sur l’endocarde a parcouru un angle θ double de celui parcouru par un point épicardique, vu que le rayon (r) du premier est la moitié du second. De ce fait, l’angle γ qui représente le cisaillement reste identique sur toute l’épaisseur de paroi, ce qui minimise les forces de friction entre fibres myocardiques [3].
Le résultat hémodynamique de cette torsion est une propagation spiralée du flux sanguin bien visible dans l’aorte thoracique : le volume sanguin avance selon un mouvement tournant en sens anti-horaire (Figure 5.22) [7,12]. Ce flux hélicoïdal présente 3 avantages.
- Diminution des forces de cisaillement et de friction lors de virages, donc diminution des pertes d’énergie hydraulique ; si le front d’onde était fixe, les couches de sang devraient ralentir le long de la petite courbure de la crosse aortique et accélérer le long de la grande courbure, d’où partent les vaisseaux de la gerbe.
- Amélioration du flux dans les vaisseaux de la gerbe, dont l’axe est toujours en regard du flux tournoyant ; le risque de perte de pression de perfusion en cas d’accélération du flux aortique est supprimé.
- Diminution de stress sur les parois aortiques.
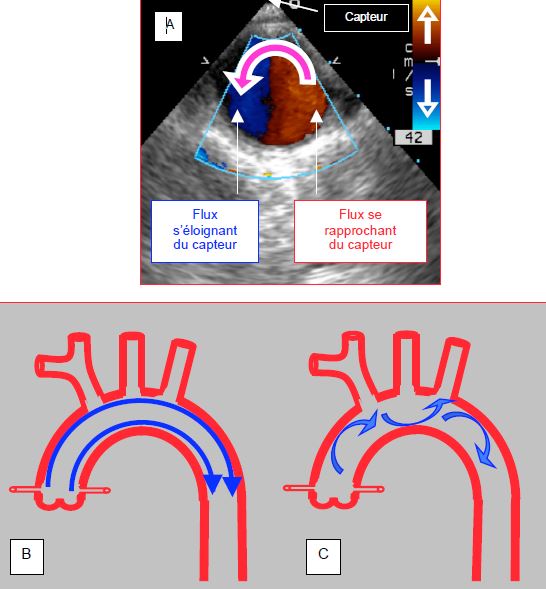
Figure 5.22 : Flux spiralé dans l’aorte descendante. A : vue transoesophagienne court-axe de l’aorte descendante. En tournant sur lui-même dans le sens anti-horaire, le flux change de couleur à l’imagerie Doppler : il est rouge dans la partie où il se rapproche du capteur et bleu dans celle où il s’en éloigne. B : si le front du flux était fixe, les couches de sang situées à l’intérieur de la crosse devraient ralentir et celles de l’extérieur accélérer ; ceci occasionnerait des cisaillements et une perte d’énergie hydraulique. C : un flux spiralé, au contraire, évite ces déperditions d’énergie dans les virages et augmente le flux dans les vaisseaux de la gerbe puisque à tout instant une partie du flux se dirige vers leurs abouchements.
Séquence contractile du VG
Le déroulement de la contraction du VG suit plus ou moins celui de la bande musculaire [4]. Pendant la contraction isovolumétrique (80-100 msec), la pression augmente sans raccourcissement des parois ; la valve mitrale se ferme, et la valve aortique reste occluse. Les fibres longitudinales sous-endocardiques et les fibres circulaires commencent à se contracter mais pas encore les fibres sous-épicardiques. Comme la paroi se contracte sans diminution du volume sanguin, lequel est incompressible, l’épaississement ne peut se faire que vers l’extérieur (Figure 5.23). Les fibres sous-épicardiques sont donc étirées et subissent un effet Starling proportionnel à l’intensité de la contraction sous-endocardique et circulaire ; ce phénomène de mise sous tension permet d’ajuster la contraction sous-épicardique ultérieure à l’intensité de la contraction isovolumétrique des couches profondes du myocarde [5]. Il est bien illustré par une image Doppler tissulaire de l’anneau mitral, où l’on voit clairement que la contraction isovolumétrique s’accompagne d’un raccourcissement et d’un allongement simultané selon la localisation des fibres (Figure 5.24) [1,19]. L’augmentation de pression intraventriculaire (dP/dt) est de 1’200-2'000 mmHg/s.
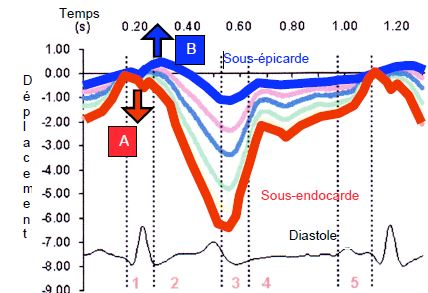
Figure 5.23 : Déplacements respectifs de la musculature sous-endocardique (trait rouge) et sous-épicardique (trait bleu) de la paroi antérieure du VG. Pendant la phase de contraction isovolumétrique (1), les fibres sous-endocardiques se contractent (A) alors que les fibres sous-épicardiques sont distendues (B) et ne se contractent que plus tardivement pendant la phase d’éjection (2) ; d’autre part, l’importance de leur déplacement (en mm) est plus faible que celui des fibres sous-endocardiques [18].
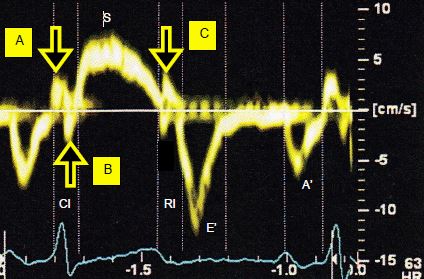
Figure 5.24 : Vélocité des déplacement de l’anneau mitral au Doppler tissulaire, avec la composante systolique S (descente de l’anneau mitral), et les deux composantes diastoliques E’ et A’. Pendant la phase de contraction isovolumétrique (CI), on aperçoit deux mouvements distincts : la contraction sous-endocardique précoce (A) et la dilatation sous-épicardique (B). Pendant la phase de relaxation isovolumétrique (RI), on remarque la contraction post-systolique de la musculature sous-épicardique (C) [16].
La dépolarisation électrique et la contraction des fibres myocardiques suivent deux parcours simultanés:
- Elles se propagent du sous-endocarde vers le sous-épicarde;
- Elles se propagent de l’apex vers la base, se terminant dans la CCVG.
Le raccourcissement longitudinal du VG débute au cours de la phase de contraction isovolumétrique parce que les fibres longitudinales sous-endocardiques se contractent avant les fibres circulaires, ce qui rend le VG plus sphérique au moment où l’éjection commence [10]. Le raccourcissement des fibres longitudinales est de 20% et celui des fibres circulaires de 25-35% [4]. D’autre part, les muscles papillaires se contractent après la paroi sur laquelle ils sont implantés, de manière à permettre le déplacement des feuillets mitraux jusqu’à l’occlusion avant de tendre les cordages [1].
Pendant l’éjection (de l’ouverture à la fermeture de la valve aortique, 220-300 msec), la contraction du VG n’est pas homogène [16,18].
- La déformation est plus importante dans le sous-endocarde que dans le sous-épicarde;
- La déformation est plus marquée à l’apex qu’à la base;
- La déformation circulaire est plus importante que la déformation longitudinale;
- Les fibres sous-épicardiques commencent à se contracter 80-100 msec après les fibres sous-endocardiques et les fibres circulaires ; leur contraction perdure en début de diastole;
- Le raccourcissement s’accompagne d’une torsion due à l’obliquité des fibres longitudinales.
La contraction n’est donc pas un simple épaississement, mais un effet du cisaillement des fibres perpendiculaires les unes par rapport aux autres. Le volume systolique est propulsé comme on essore un linge mouillé, en le comprimant et en le torsadant [9].
| Contraction du VG |
|
La contraction ventriculaire gauche est constituée de 4 mouvements différents:
- Epaississement de paroi (30-40%)
- Raccourcissement radiaire (20-35%); il génère 75% de la pression systolique
- Raccourcissement longitudinal (15-20%) par descente de l'anneau mitral (l'apex reste immobile)
- Rotation 15-20° autour du long-axe; elle est responsable du flux spiralé dans l'aorte
- Le raccourcissement longitudinal est plus important pour la propulsion du volume systolique que pour la pression La course radiaire et la rotation sont plus importantes dans les parois latérale et antérieure que dans les parois postérieure et septale, et dans les couches sous-endocardiques que dans les couches sous-épicardiques. La participation à l'éjection du volume systolique est par ordre décroissant d'importance: paroi latérale, antérieure, postérieure, septale.
Contraction isovolumétrique (80-100 msec): contraction des fibres sous-endocardiques et circulaires, distension des fibres sous-épicardiques;
Ejection: contraction des fibres sous-épicardiques, raccourcissement de toutes les fibres; contraction radiaire, longitudinale et rotation; le VG se contracte comme on essore un linge mouillé.
Persistance de la contraction sous-épicardique en protodiastole.
La contraction se propage de l'endocarde vers l'épicarde et de l'apex vers la base.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- ASHIKAGA H, VAN DER SPOEL TIG, COPPOLA BA, OMENS JH. Transmural myocardial mechanics during isovolumic contraction. J Am Coll Cardiol Imag 2009; 2:202-11
- BERTINI M, SENGUPTA PP, NUCIFORA G, et al. Role of left ventricular twist mechanics in the assessment of cardiac dyssynchrony in heart failure. J Am Coll Cardiol Img 2009; 2:1425-35
- BUCHALTER MB, WEISS JL, ROGERS WG, et al. Noninvasive quantification of left ventricular rotational deformation in normal humans using magnetic resonance imaging myocardial tagging. Circulation 1990; 81:1236-44
- BUCKBERG GD, CASTELLA M, GHARIB M, SALEH S. Structure/function interface with sequential shortening of basal and apical components of myocardial band. Eur J Cardiothor Surg 2006; 29S:S75-S97
- CAMPBELL KB, CHANDRA M. Functions of stretch activation in heart muscle. J Gen Physiol 2006; 127:89-94
- CHASSOT PG, VAN DER LINDEN P, ZAUGG M, MUELLER XM, SPAHN DR. Off-pump coronary artery bypass surgery: Physiology and anaesthetic management. Brit J Anaesth 2004; 92:400-13
- FRAZIN LJ, McPHERSON DD, MEHLMAN DJ, CHANDRAN KB. Functional chiral asymmetry in the descending thoracic aorta. Circulation 1990; 82:1985-94
- FUCHS E MÜLLER MF, OSWALD H, et al. Cardiac rotation and relaxation in patients with chronic heart failure. Eur J Heart Fail 2004; 6:715-22
- GEYER H, CARACCIOLO G, ABE H, et al. Assessment of myocardial mechanics using speckle tracking echocardiography: Fundamentals and clinical applications. J Am Soc Echocardiogr 2010; 23:351-69
- HELLE-VALLE T, CROSBY J, EDVARDSEN T, et al. New noninvasive method for assessment of left ventricular rotation. Speckle tracking echocardiography. Circulation 2005; 112:3149-56
- HENSON RE, SONG SK, PASTOREK JS, et al. Left ventricular torsion is equal in mice and humans. Am J Physiol Heart Cric Physiol 2000; 278:H1117-H1123
- KILNER PJ, YANG GZ, MOHIADDIN RH, et al. Helical and retrograde secondary flow patterns in the aortic arch studied by three-directional magnetic resonance velocity mapping. Circulation 1993; 88:2235-47
- LORENZ CH, PASTOREK JS, BUNDY JM. Delineation of normal human left ventricular twist throughout systole by tagged cine magnetic resonance imaging. J Cardiovasc Magn Reson 2000; 2:97-108
- MAIER SE, FISCHER SE, McKINNON GC, et al. Evaluation of left ventricular segmental wall motion in hypertrophic cardiomyopathy with myocardial tagging. Circulation 1992; 86:1919-28
- MUELLER XM, CHASSOT PG, ZHOU J, et al. Hemodynamics optimization during off-pump coronary artery bypass: the “no compression” technique. Eur J Cardiothorac Surg 2002; 22:249-54
- SENGUPTA PP. Exploring left ventricular isovolumic shortening and stretch mechanics : « The heart has its reasons… » J Am Coll Cardiol Img 2009; 2:212-5
- SENGUPTA PP, KORINEK J, BELOHLAVEK M, et al. Left ventricular structure and function. Basic science for cardiac imaging. J Am Coll Cardiol 2006; 48:1988-2001
- SENGUPTA PP, KRISHNAMOORTHY VK, KORINEK J, et al. Left ventricular form and function revisited: Applied translational science to cardiovascular ultrasound imaging. J Am Soc Echocardiogr 2007; 20:539-51
- SENGUPTA PP, TAJIK AJ, CHANDRASEKARAN K, KHANDHEIRIA BK. Twist mechanics of the left ventricle. Principles and application. J Am Coll Cardiol Img 2008; 1:366-76
- SPOTNITZ HM. Macro design, structure and mechanics of the left ventricle. J Thorac Cardiuovasc Surg 2000; 119:1053-77
- STUBER M SCHEIDEGGER MB, FISCHER SE, et al. Alterations in the local myocardial motion pattern in patients suffering from pressure overload due to aortic stenosis. Circulation 1999; 100:361-8
- YOUNG AA, COWAN BR. Evaluation of left ventricular torsion by cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2012; 14:49
