Les canules
Après le tuyau de 3/8 pouce qui la relie à la pompe, l'extrémité de la canule artérielle est l'endroit le plus étroit de tout le circuit (diamètre interne: 7-8 mm). C'est donc le lieu du gradient de pression le plus élevé. Normalement, ce gradient ne doit pas dépasser 100 mmHg à un débit de 2.5 L/min/m2; au-delà, le risque d'hémolyse et de dénaturation protéique est excessif. La canule artérielle est dotée d’un système de fixation à la paroi vasculaire et d’un robinet 3-voies pour purger l’air et, accessoirement, y mesurer la pression. Lorsque la canule aortique est en place et fixée, on laisse refluer le sang artériel pour éliminer les débris et les bulles d'air par le robinet de purge. Le contrôle de la pulsatilité du sang dans la canule assure que la position est correcte dans la lumière de l'aorte; si la canule est intrapariétale (dissection), le sang qui reflue n'est pas pulsatile. La pression affichée dans la canule au niveau de la machine de CEC doit être identique à celle du cathéter artériel; toute discordance doit faire craindre une dissection intrapariétale.
Plusieurs sites anatomiques sont disponibles pour la canulation artérielle (Figure 7.10).
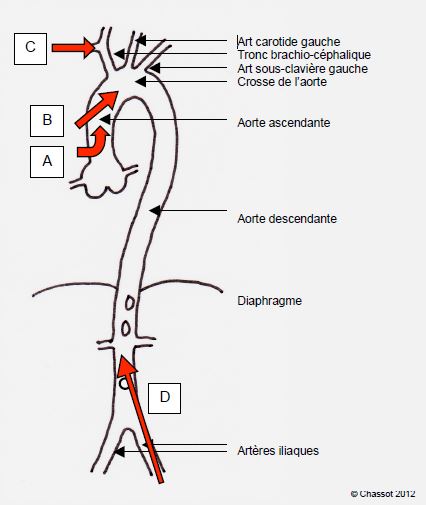
Figure 7.10 : Sites de canulation artérielle. A : canule coudée à la racine de l’aorte. B : canule type Bardic™ dans l’aorte ascendante. C : canule dans l’artère sous-clavière droite. D : canule fémorale ; dans ce cas, le flux est rétrograde dans l’aorte.
Par sternotomie, la canule artérielle est implantée le plus souvent dans l'aorte ascendante. Il en existe deux types.
- Canule à embout rigide coudé à angle droit; introduite perpendiculairement à la paroi aortique antérieure, elle débit dans l’axe au niveau de la racine aortique.
- Canule souple de type Bardic™ : introduite tangentiellement, elle débite plus distalement dans la crosse ; sa position peut être vérifiée à l’ETO.
La canulation de l’aorte ascendante présente plusieurs risques majeurs. A elle seulle, elle est responsable d'une grande partie de la morbidité liée à la CEC.
- Embolies artérielles: l'athéromatose de l'aorte ascendante est présente chez 38% des patients âgés de plus de 50 ans [2]; les principaux facteurs de risque sont l'âge avancé, l'anamnèse d'AVC, le diabète et la maladie vasculaire périphérique, particulièremet carotidienne [7]. Lors de la canulation, des fragments d'athérome peuvent emboliser en périphérie, particulièrement dans le cerveau; le risque est le plus grand lorsque les plaques sont ulcérées ou pendulaires. Le taux d'embolies cérébrales au Doppler transcrânien, qui est de 5-17%, présente deux pics très significatifs lors de la canulation et de la décanulation aortique (voir Figure 7.26) [10]. Cette embolisation est un des facteurs responsables des AVC postopératoires.
- Effet de "sablage" (sandblasting): le jet de sang sort à haute vélocité de la canule et souffle au passage des débris athéromateux s'il est dirigé vers la paroi et non vers le centre du vaisseaux. Cet effet, très marqué avec les canules fines qui engendrent de hautes vélocités, est constant tout au long de la CEC.
- Malposition de la canule: elle peut être dirigée vers ou dans le tronc brachiocéphalique, qui reçoit ainsi tout le débit de la pompe; suivant où elle est mesurée, la pression artérielle peut être élevée (radiale droite) ou basse (radiale gauche et fémorale). La coloration de la face est asymétrique, de même que le pouls carotidien et les saturations cérébrales (ScO2).
- Déchirures: la paroi aortique est fragile chez les personnes âgées, les diabétiques, les athéromateux; les risques de déchirure en étoile autour de la canule sont d'autant plus grands que la paroi est tendue par une hypertension. Il est donc habituel de baisser la pression artérielle lors de la canulation et de la décanulation de l'aorte en visant une PAM momentanée ≤ 50 mmHg.
- Dissection: l'introduction de la canule artérielle à l'intérieur de la paroi aortique peut disséquer cette dernière au niveau de la média; c'est une complication dramatique qui survient dans 0.1 – 1‰ des cas [8]. Elle se diagnostique en début de CEC par une hypertension sur la ligne artérielle alors que la pression systémique est effondrée et que la paroi aortique devient violacée, boursoufflée et tendue. Les vaisseaux de la crosse aortique peuvent être obstrués par le faux passage.
L'ETO, qui est très performant pour évaluer l'aorte descendante, ne permet de visualiser que la partie proximale de l'aorte ascendante jusqu'à son croisement avec l'artère pulmonaire droite. Elle n'est pas un moyen sûr pour mettre en évidence les lésions athéromateuses sévères de l'aorte ascendante, parce que l'interposition de la bronche souche droite entre l'oesophage et l'aorte restreint la visibilité aux 4-5 premiers centimètres de l’ascendante et parce que la majeure partie des athéromes sont situés au-delà de cette limite [11]. Toutefois, l'ETO permet de poser l'indication à une échographie épiaortique en fonction du degré d'atteinte de l'aorte descendante [6]. Comme la palpation chirurgicale est peu fiable, seule l’échographie épiaortique pratiquée avant de canuler l’aorte permet de choisir le site de ponction le moins dangereux ou de modifier la canulation (voie fémorale ou sous-clavière droite), afin d’éviter un accident embolique si l’athéromatose est trop importante dans l’aorte ascendante [3,9].
En cas d’athéromatose dangereuse (athéromes de degré III à V) ou de lésions étendues et friables (aorte porcelaine) (voir Chapitre 27 Athéromatose aortique), il est recommandé d’éviter toute manipulation de l’aorte ascendante et de changer de stratégie chirurgicale [1,5,7].
- Canulation artérielle sous-clavière droite.
- Canulation artérielle fémorale.
- Occlusion avec un ballon intravasculaire monté depuis la fémorale (système Heartport™).
- Pas de canulation de cardioplégie ni de clampage aortique: opération à coeur battant ou en fibrillation ventriculaire si cela est concevable; pose d’endoprothèse par voie transapicale en cas de RVA.
- Pour les pontages aorto-coronariens: greffes artérielles multiples à partir des artères mammaires à cœur battant (OPCAB no-touch).
Une canulation fémoro-iliaque est possible si l'on veut éviter l'aorte ascendante ou si l'on doit installer la CEC sous sédation et anesthésie locale, parce que le malade est trop instable pour supporter l'induction sans cette sécurité. La canulation fémorale est également utilisée lors des réopérations où l'on craint de léser l'OD, le VD ou l'aorte avec la scie sternale. Malheureusement, le débit par la fémorale est souvent limité. Comme le flux dans l'aorte est rétrograde, il existe un double risque, que la surveillance ETO permet de diagnostiquer.
- Embolie cérébrale en cas d'athéromatose étendue de l'aorte thoracique descendante;
- Dissection rétrograde par infiltration du flux sous des plaques athéromateuses, qui sont disposées comme les tuiles d’un toit dans le sens du flux sanguin normal.
La canule fémorale est occlusive. Le membre inférieur concerné est donc ischémié pendant toute la durée de la CEC. Cette situation est tolérable pour 3-4 heures. Si la canulation se prolonge, il est prudent d’assurer la perfusion du membre par une canule pédiatrique montée en Y sur la ligne principale et insérée dans la partie distale de la fémorale.
Une bonne alternative est l'artère sous-clavière droite. On peut cannuler ce vaisseau en le ponctionnant à ciel ouvert ou en y anastomosant une prothèse de 8 mm (GoreTex™) en position termino-latérale. La position de la canule dans l’arc aortique est contrôlée à l’ETO. Ce système est fréquemment utilisé pour la chirurgie de la crosse aortique, car il permet de maintenir une perfusion cérébrale continue (Figure 7.11 et Figure 18.27).
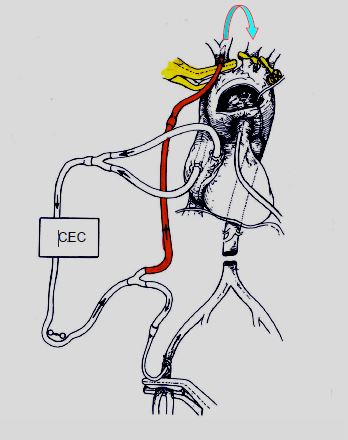
Figure 7.11 : Perfusion cérébrale semi-sélective par la canule artérielle de CEC en sous-clavière droite. Le tronc brachio-céphalique, la carotide gauche et la sous-clavière gauche sont clampées à leur origine (en jaune). Le sang circule d'une carotide à l'autre par les anastomoses du polygone de Willis (flèche).
Le tronc brachio-céphalique, la carotide gauche et la sous-clavière gauche étant clampés à leur départ de la crosse, le flux perfuse la carotide droite, puis la carotide gauche par l'intermédiaire du cercle de Willis et des anastomoses entre carotides externes. La pression de perfusion (idéalement 60 mmHg) est mesurée dans l'artère radiale gauche, perfusée par l’intermédiaire des collatérales entre la vertébrale et la sous-clavière gauches. Le débit est de 10-20 mL/kg/min (1.0-1.5 L/min). La température de perfusion varie de 20° à 32°C selon les techniques. Si l’on opte pour une hypothermie modérée (28-32°C) ou pour la normothermie, la perfusion cérébrale doit être complétée par une perfusion sous-diaphragmatique continue au moyen d’une canule fémorale pour éviter l’ischémie des viscères abdominaux, des reins et de la moëlle.
Les filtres
Un filtre micropore (40 microns) couplé à un "piège à bulles" est installé sur le circuit artériel, comme dernière étape avant l'aorte du malade. Il a pour but d'éliminer les particules qui pourraient emboliser, et de supprimer tout risque d'embolie gazeuse artérielle. La trappe à bulle peut être ouverte à l'air ambiant pour éviter que le système ne se mette sous pression, ou purgée en continu (200 mL/min), le sang étant renvoyé dans le réservoir veineux. On monte également un filtre du côté veineux (20-40 microns), parce que les aspirations que l'on utilise dans le champ opératoire une fois le malade hépariné ramènent le sang dans le réservoir veineux. Ce sang contient des cellules, des débris et des procoagulants qu'il faut éliminer (Figure 7.12).

Figure 7.12 : Les filtres. A: filtre du réservoir veineux. B: circuit de retour du sang en provenance du patient. C: filtre artériel contenant la trappe à bulles; il dispose d'un orifice de vidange à sa partie supérieure par lequel une pompe aspire le sang à bas débit et le renvoie dans le réservoir veineux. D: circuit artériel conduisant le sang vers le patient. E: circuit veineux ramenant le sang du patient. On note bien la différence de couleur entre D et E. F: saturomètre sur le circuit veineux. G: saturomètre sur le circuit artériel.
Les sources d'embols gazeux sont multiples: oxygénateur, réservoir, siphon dans le circuit, aspiration par les pompes, cardiotomie, cavitation. Les variations de température du sang sont toujours une source potentielle de microembolie gazeuse, puisque les gaz dissous à froid passent en phase gazeuse lorsque la température monte [4]. La cavitation est un phénomène qui consiste en la création de microbulles lorsque la pression locale diminue, comme dans un vortex ou en amont d'une pompe occlusive. Bien que la preuve n'en soit pas formelle, l'accumulation de microembols dans les organes est probablement responsable d'une partie des lésions fonctionnelles postopératoires, particulièrement neurologiques. C'est la raison pour laquelle on utilise des filtres micropore sur le circuit artériel.
Les shunts
On doit prévoir des systèmes de shunt pour court-circuiter certains éléments en cas de défaillance. Un shunt est aussi nécessaire pour faire circuler le liquide d'amorçage avant que la machine soit connectée au malade ou éviter une stagnation du sang lorsque la CEC n'assiste plus le malade.
- Shunt du filtre artériel: maintien la perfusion artérielle au cas où le filtre se boucherait, ce qui est rarissime;
- Shunt distal entre la canule artérielle et la canule veineuse: il sert à faire circuler le liquide d'amorçage. Il est obligatoire dans les circuits pré-héparinés qui fonctionnent avec des ACT de 300-350 secondes; on ne peut pas arrêter le sang dans ces circuits, car il risque de coaguler dans les filtres et dans l'oxygénateur.
| Circuit artériel |
|
La canule artérielle est insérée en général dans l’aorte ascendante, mais il existe plusieurs voies d’abord possibles:
- Partie tubulaire proximale de l’aorte ascendante
- Artère fémorale
- Artère sous-clavière droite
La canule artérielle peut être à l’orgine de plusieurs complications: - Embolisation de plaques athéromateuses
- Effet de sablage
- Déchirures
- Dissection
L’ETO et l’échographie épiaortique permettent de localiser les plaques et de choisir la technique de canulation la plus sûre. La ligne artérielle est munie d’un filtre à particules et d’une trappe à bulle. Elle est surveillée par un moniteur de pression et de saturation (SaO2).
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour Avril 2018
Références
- CALAFIORE AM, DI MAURO M, TEODORI G, et al. Impact of aortic manipulation on incidence of cerebrovascular accidents after surgical myocardial revascularization. Ann Thorac Surg 2002; 73: 1387-93
- DAVILA-ROMAN VG, BARZILAI B, WAREING TH, et al. Atherosclerosis of the ascending aorta. Stroke 1994; 25:2010-16
- DAVILA-ROMAN VG, BARZILAI B, WAREING TH, et al. Intraoperative ultrasonographic evaluation of the ascending aorta in 100 consecutive patients undergoing cardiac surgery. Circulation 1991; 84(Suppl III):47-53
- GEISSLER HJ, ALLEN JS, MEHLHORN U, et al. Cooling gradients and formation of gazeous microemboli with cardiopulmonary bypass: an echocardiographic study. Ann Thorac Surg 1997; 64:100-8
- KIM KB, KANG CH, CHANG WI, et al. Off-pump coronary artery bypass with complete avoidance of aortic manipulation. Ann Thorac Surg 2002; 74:S1377-82
- KONSTADT SN, REICH DL, KAHN R, et al. Transesophageal echocardiography can be used to screen for ascending aortic atherosclerosis. Anesth Analg 1995; 81:225-33
- MENKIS AH. Management of the ascending aorrta in routine cardiac surgery. Semin Cardiothorac Vasc Anesth 2004; 8:19-24
- MURPHY DA. Recognition and management of ascending aortic dissection complicating cardiac surgical operations. J Thorac Cardiovasc Surg 1983; 85:247-53
- REEVES ST, GLAS KE, ELTZSCHIG H, et al. Guidelines for performing a comprehensive epicardial echocardiographic examination: Recommendations of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2007; 20:427-37
- STUMP DA, JONES TJJ, RORIE KD. Neurophysiologic monitoring and outcomes in cardiovascular surgery. J Cardiothorac Vasc Anesth 1999; 13:600-13
- SYLVIRIS S, CALAFIORE P, MATALANIS G, et al. The intraoperative assessment of ascending aortic atheroma: epiaortic imaging is superior to both transesophageal echocardiography and direct palpation. J Cardiothorac Vasc Anesth 1997; 11:704-10
