La cardiomyopathie hypertrophique (CMH), ou cardiomyopathie obstructive (CMO ou HOCM, hypertrophic obstructive cardiomyopathy), ou sténose sous-aortique dynamique de l'adulte (HISS, hypertrophic idiopathic subaortic stenosis), est une maladie primaire du sarcomère [3,23]. Les zones hypertrophiques contiennent un excès de cellules myocardiques aux formes bizarres et désorganisées, où la matrice collagène est anormalement développée; la contraction myocardique longitudinale y est réduite [23]. Ces zones, qui représentent environ 30% du myocarde, s'étendent sur un plus ou moins grand volume du septum interventriculaire à partir de la partie supérieure de celui-ci (chambre de chasse) ; elles se continuent dans la paroi antéro-latérale du VG dans 70% des cas et présentent souvent un aspect hyperéchogène [15]. L'épaisseur de paroi est ≥ 15 mm dans tous les segments du VG et celle du septum est au moins 1.3 fois celle de la paroi postérieure (en moyenne 22 mm) (Vidéos et Figure 27.39) [4]. L'obstruction à l'éjection du VG induit une hypertrophie secondaire du ventricule, mais les cellules des autres parois sont en général normales. La CMH n'est pas rare, puisque sa prévalence est de 0.2% (1:500) chez le jeune adulte [10,22].
Vidéo: vue 4-cavités d'une cardiomyopathie hypertrophique sévère chez un jeune patient; le septum interventriculaire mesure 2.8 cm d'épaisseur.
Vidéo: vue transgastrique 2-cavités du même cas; la paroi postérieure mesure 3 cm d'épaisseur. En systole, les muscles papillaires se touchent et peuvent créer une accélération du flux intraventriculaire.
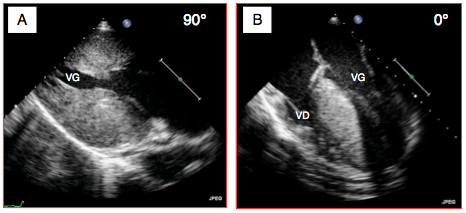
Figure 27.39 : Images ETO d'une cardiomyopathie hypertrophique sévère. A: vue 2-cavités transgastrique 90°. B: vue 4-cavités mi-œsophage qui met en évidence l'épaississement massif du septum interventriculaire.
Lorsque la maladie affecte tout le ventricule, il peut arriver que l'obstruction se situe dans le corps du ventricule ; l'oblitération de la cavité en télésystole isole la zone apicale qui ne se vide pas normalement et donne une fausse impression de dyskinésie apicale [18]. Ce rétrécissement de la cavité ventriculaire "en sablier" survient dans 8-13% des cas d'HCM; il est associé à une diminution des dimensions télésystoliques (diamètre < 2.5 cm) et à une accélération des flux intracavitaires (> 1.4 m/s) avec un flux tourbillonnaire au niveau des muscles papillaires [2].
La fonction systolique est normale, voire hyperdynamique ; la fraction d'éjection tend à être supranormale à cause du rétrécissement de la cavité ventriculaire (diminution du Vts). Toutefois, les zones hypertrophiées présentent un défaut de contraction longitudinale au Doppler tissulaire (strain et strain rate) avec une déformation systolique < 10% [29]. La vélocité de la descente de l'anneau mitral en systole (S') est < 4 cm/s chez les malades qui ont un mauvais pronostic [1]. Ces altérations tissulaires différencient la CMH de la simple hypertrophie ventriculaire de l'hypertendu, où ces valeurs restent normales. La dysfonction diastolique due à l'épaississement de la paroi du VG élève les pressions de remplissage et provoque une dilatation de l'OG, alors que la cavité ventriculaire est plutôt petite [19]. La fonction diastolique est altérée par défaut de relaxation (diminution de la reprise du Ca2+ par le reticulum sarcoplasmique) secondaire à l'hypertrophie musculaire, et se traduit par des pressions de remplissage télédiastoliques supérieures à la norme et une dilatation de l'OG: rapport E/E' > 12, volume OG > 34 mL/m2 [11]. Vu ce défaut de relaxation protodiastolique, le remplissage ventriculaire devient très dépendant de la contraction auriculaire : sa contribution est > 30%.
La valve mitrale mérite une attention particulière, car la moitié des patients souffrant de CMH présente une élongation des feuillets, un excès de tissu, un prolapsus ou un allongement des cordages [13]. Cette dysplasie n'est pas étrangère au phénomène de subobstruction de la chambre de chasse par le feuillet mitral antérieur. D'autre part, des anomalies de l'appareil sous-valvulaire mitral sont retrouvées dans 45-70% lors d'investigations 3D en échocardiographie: déplacement antéro-apical du muscle papillaire antérieur, muscle papillaire hypertrophié (diamètre > 1.1 cm), pluri-céphale ou doté d'un muscle accessoire, insertion directe du muscle papillaire sur le feuillet antérieur, bande musculaire traversant la chambre de chasse entre le muscle papillaire antérieur et le septum sous-aortique [26].
Sténose sous-aortique dynamique
Une obstruction dynamique de la chambre de chasse gauche survient chez 30-44% des malades souffrant de cardiomyopathie hypertrophique [12,15]. Pour en arriver à cette obstruction mésosystolique de la chambre de chasse, il faut une combinaison de deux facteurs.
Vidéo: vue 4-cavités d'une cardiomyopathie hypertrophique sévère chez un jeune patient; le septum interventriculaire mesure 2.8 cm d'épaisseur.
Vidéo: vue transgastrique 2-cavités du même cas; la paroi postérieure mesure 3 cm d'épaisseur. En systole, les muscles papillaires se touchent et peuvent créer une accélération du flux intraventriculaire.

Figure 27.39 : Images ETO d'une cardiomyopathie hypertrophique sévère. A: vue 2-cavités transgastrique 90°. B: vue 4-cavités mi-œsophage qui met en évidence l'épaississement massif du septum interventriculaire.
Lorsque la maladie affecte tout le ventricule, il peut arriver que l'obstruction se situe dans le corps du ventricule ; l'oblitération de la cavité en télésystole isole la zone apicale qui ne se vide pas normalement et donne une fausse impression de dyskinésie apicale [18]. Ce rétrécissement de la cavité ventriculaire "en sablier" survient dans 8-13% des cas d'HCM; il est associé à une diminution des dimensions télésystoliques (diamètre < 2.5 cm) et à une accélération des flux intracavitaires (> 1.4 m/s) avec un flux tourbillonnaire au niveau des muscles papillaires [2].
La fonction systolique est normale, voire hyperdynamique ; la fraction d'éjection tend à être supranormale à cause du rétrécissement de la cavité ventriculaire (diminution du Vts). Toutefois, les zones hypertrophiées présentent un défaut de contraction longitudinale au Doppler tissulaire (strain et strain rate) avec une déformation systolique < 10% [29]. La vélocité de la descente de l'anneau mitral en systole (S') est < 4 cm/s chez les malades qui ont un mauvais pronostic [1]. Ces altérations tissulaires différencient la CMH de la simple hypertrophie ventriculaire de l'hypertendu, où ces valeurs restent normales. La dysfonction diastolique due à l'épaississement de la paroi du VG élève les pressions de remplissage et provoque une dilatation de l'OG, alors que la cavité ventriculaire est plutôt petite [19]. La fonction diastolique est altérée par défaut de relaxation (diminution de la reprise du Ca2+ par le reticulum sarcoplasmique) secondaire à l'hypertrophie musculaire, et se traduit par des pressions de remplissage télédiastoliques supérieures à la norme et une dilatation de l'OG: rapport E/E' > 12, volume OG > 34 mL/m2 [11]. Vu ce défaut de relaxation protodiastolique, le remplissage ventriculaire devient très dépendant de la contraction auriculaire : sa contribution est > 30%.
La valve mitrale mérite une attention particulière, car la moitié des patients souffrant de CMH présente une élongation des feuillets, un excès de tissu, un prolapsus ou un allongement des cordages [13]. Cette dysplasie n'est pas étrangère au phénomène de subobstruction de la chambre de chasse par le feuillet mitral antérieur. D'autre part, des anomalies de l'appareil sous-valvulaire mitral sont retrouvées dans 45-70% lors d'investigations 3D en échocardiographie: déplacement antéro-apical du muscle papillaire antérieur, muscle papillaire hypertrophié (diamètre > 1.1 cm), pluri-céphale ou doté d'un muscle accessoire, insertion directe du muscle papillaire sur le feuillet antérieur, bande musculaire traversant la chambre de chasse entre le muscle papillaire antérieur et le septum sous-aortique [26].
Sténose sous-aortique dynamique
Une obstruction dynamique de la chambre de chasse gauche survient chez 30-44% des malades souffrant de cardiomyopathie hypertrophique [12,15]. Pour en arriver à cette obstruction mésosystolique de la chambre de chasse, il faut une combinaison de deux facteurs.
- Rétrécissement de la CCVG par l’hypertrophie septale, dont la contraction systolique rétrécit le conduit et accélère la vélocité du flux.
- Déplacement antérieur de la zone de coaptation des feuillets mitraux dû à un rétrécissement de la cavité et/ou à une anomalie des feuillets, de l’anneau ou de l’appareil sous-valvulaire.
Normalement, le point de coaptation entre les deux feuillets de la valve mitrale est maintenu éloigné postérieurement de la chambre de chasse par plusieurs éléments (Vidéo et Figure 27.40A) [8,9].
- L'angle mitro-aortique (angle entre le plan de la valve aortique et celui de la valve mitrale) est assez ouvert pour éloigner la chambre d'admission de la chambre de chasse ; le flux de remplissage diastolique et le flux d'éjection systolique sont presque parallèles (angle < 30°).
- Le feuillet mitral antérieur est plus long que le postérieur.
- En systole, la déformation physiologique en selle de l’anneau mitral fait reculer postérieurement le point de coaptation.
- Le déplacement radiaire vers l’intérieur de la paroi postérieure est plus faible que celui de la paroi antérieure et de la paroi latérale.
- La paroi postéro-basale est activée électriquement en dernier.
- La pression intraventriculaire assure l'étanchéité de la valve mitrale en appuyant l’extrémité des deux feuillets l'une contre l'autre.
Vidéo: reconstruction 3D d'une vue depuis le VG de la chambre d'admission avec la valve mitrale et de la chambre de chasse avec la valve aortique; en diastole, le feuillet antérieur pend dans le VG et représente la seule limite entre les deux chambres. Si le VG devient excessivement petit, il peut facilement être aspiré dans la CCVG en systole.
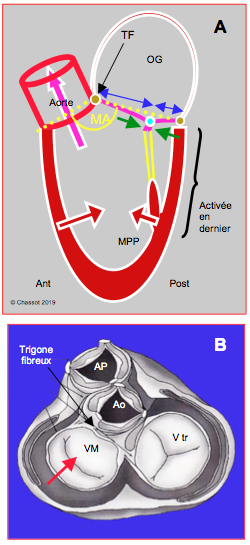
Figure 27.40A: Occlusion normale de la valve mitrale. A: le point de coaptation de la valve mitrale est situé au tiers postérieur du diamètre de la valve (flèches bleues); la paroi postérieure a moins de course que la paroi antérieure et est activée en dernier; la pression intraventriculaire maintient l’occlusion de la mitrale (flèches vertes). MA: angle mitro-aortique (normal: ≥ 150°). MPP: muscle papillaire postérieur. TF: trigone fibreux. B: représentation des quatre valves après résection des oreillettes, de l'aorte et de l'artère pulmonaire. La base du feuillet mitral antérieur est accolée au trigone fibreux, qui est le squelette central du coeur, liant entre elles la valve mitrale, la valve aortique et la valve tricuspide. Lorsque l'anneau mitral se rétrécit, la partie postérieure se déplace vers l'avant (flèche rouge), parce que la partie antérieure est immobile.
Plusieurs phénomènes contribuent au déplacement antérieur du point de coaptation de la valve mitrale [6,7,14,17].
- Lors d’hypertrophie concentrique du VG, la cavité ventriculaire diminue de taille; dans ce cas, la paroi postérieure se déplace vers l'avant et se rapproche de la chambre de chasse, parce que la partie antérieure est immobile. En effet, la base du feuillet mitral antérieur est accolée au trigone fibreux, qui est le squelette central du coeur, liant entre elles la valve mitrale, la valve aortique et la valve tricuspide.
- Le flux mitral diastolique normal est dirigé vers la paroi postérieure et tournoie dans le VG pour se diriger vers la CCVG; lorsque la pression monte dans le ventricule, cette masse sanguine située en avant du feuillet antérieur de la mitrale pousse ce dernier à l'occlusion contre le feuillet postérieur. Mais si l’appareil valvulaire mitral est déplacé vers l’avant ou si la longueur du feuillet postérieur est excessive, le flux diastolique est dirigé antérieurement et tourne en sens inverse dans le VG. Lorsque la systole commence, le flux qui vient normalement pousser le feuillet antérieur en arrière vers l’occlusion le repousse alors en avant en direction de la CCVG (Figure 27.40B).
- L’hypovolémie et la vasoplégie diminuent le volume ventriculaire au point que le diamètre antéro-postérieur se réduit trop au cours de la systole.
- Une stimulation béta excessive augmente la course systolique radiaire de la paroi postérieure qui vient trop en avant.
- Un excès de tissu mitral modifie le rapport de longueur entre les deux feuillets et déplace le point de coaptation vers l’avant en direction de la CCVG; le feuillet antérieur mesure > 2 cm, le feuillet postérieur > 1.5 cm, et le rapport longueur du feuillet antérieur / longueur du feuillet postérieur est < 1.3 [14]. Ceci survient dans la moitié des cas de CMH et fréquemment après plastie mitrale [13].
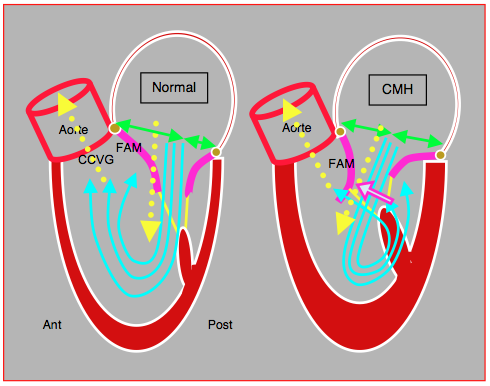
Figure 27.40B : Schéma du remplissage diastolique du VG. Normalement, la direction de la chambre d'admission et celle de la chambre de chasse sont presque parallèles, parce que l'angle mitro-aortique est très ouvert (> 150°). Le flux mitral diastolique est dirigé légèrement vers l'arrière et non en droite ligne vers l'apex. Le sang fait donc un large vortex dans la cavité du VG, qui l'amène en regard de la chambre de chasse et en avant du feuillet antérieur de la mitrale (FAM). Lorsque la pression monte en protosystole, cette masse sanguine pousse le FAM en arrière vers l'occlusion contre le feuillet postérieur. Dans le cas d'une cardiomyopathie hypertrophique (CMH), le rétrécissement de la cavité ventriculaire modifie l'angle mitro-aortique et le flux diastolique mitral se retrouve dirigé davantage vers l'avant. Le vortex tourne alors en sens opposé et amène la masse sanguine en arrière du FAM. En conséquence, celui-ci va être poussé en direction de la chambre de chasse en protosystole. [7]. Normalement, l’angle fait par la direction du flux diastolique et celle du flux systolique (flèches jaunes pointillées) est faible (< 25°). Dans le deuxième cas, il est > 35°.
Ces phénomènes rapprochent le point de coaptation mitral de la chambre de chasse au cours de la systole. La zone de coaptation des feuillets devient alors asymétrique: l'occlusion a lieu entre l'extrémité distale du feuillet postérieur et le corps du feuillet antérieur. L’extrémité distale de ce dernier est basculée dans la cavité ventriculaire où elle flotte librement. Lorsque la pression intraventriculaire s'élève et que l'éjection commence, le feuillet antérieur est poussé dans la CCVG au lieu d'être plaqué contre le feuillet postérieur. Il y est ensuite aspiré par effet Venturi lorsque le flux accélère dans la CCVG. Il faut donc l'enchaînement de quatre éléments pour provoquer une CMO (cardiomyopathie obstrictive) (Figure 27.41) [6,9,10,16,20].
- Hypertrophie du septum interventriculaire qui empiète sur la lumière de la CCVG lorsque le muscle se contracte (accélération de la Vmax);
- Déplacement antérieur (en direction de la CCVG) de la coaptation mitrale;
- Bascule du feuillet mitral antérieur dans la CCVG en mésosystole;
- Aspiration de l'extrémité du feuillet antérieur dans la CCVG par effet Venturi.
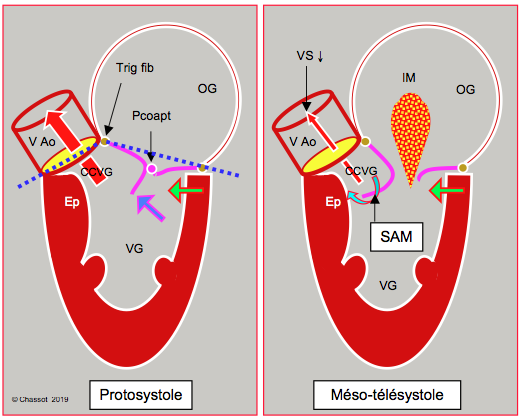
Figure 27.41 : Sténose sous-aortique dynamique dans la cardiomyopathie hypertrophique. L’hypertrophie concentrique et le rétrécissement de la cavité ventriculaire (souvent aggravé par l'hypovolémie, par la baisse de postcharge ou par la surstimulation inotrope béta) déplacent la partie postérobasale du VG vers l'avant (flèche verte). En protosystole, le feuillet antérieur et le point de coaptation (Pcoapt) de la valve mitrale sont déplacés vers la chambre de chasse (CCVG), l’angle entre le plan de la valve aortique et celui de la valve mitrale se referme (angle mitro-aortique : pointillé bleu). Le point de coaptation est situé entre le bord du feuillet postérieur et le corps du feuillet antérieur, la partie distale de ce dernier flottant à l'intérieur du VG (flèche bleue). En début de systole, la pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. L’accélération du flux dans la CCVG crée ensuite un effet Venturi qui aspire secondairement le feuillet antérieur de la mitrale (SAM, systolic anterior motion). En mésotélésystole, le feuillet mitral contribue à l’obstruction dynamique de la CCVG. Comme la valve mitrale n’est plus occluse, une régurgitation mitrale (IM) apparaît dans la deuxième moitié de la systole. Ep : éperon septal hypertrophié. Trig fib: trigone fibreux. HVG: hypertrophie ventriculaire gauche. VAo: valve aortique.
Ces éléments conduisent à la subobstruction méso-télésystolique de la CCVG: c'est le SAM, ou Systolic Anterior Motion (SAM). Le feuillet antérieur contribue encore à l'obstruction de la chambre de chasse (Vidéo et Figure 27.42) [9]. La vélocité maximale atteinte dans la CCVG est > 2.5 m/s (ΔP > 25 mmHg au repos, > 50 mmHg à la provocation). Le gradient de pression peut s'élever jusqu'à 170 mm Hg. L'aspiration du feuillet antérieur de la mitrale (SAM) ouvre la valve à mi-systole et provoque une insuffisance mitrale méso-télésystolique (Vidéo et Figure 27.43). Il existe une relation directe entre la Vmax dans la CCVG et l’importance de l’IM ; le jet de cette dernière présente une direction typiquement postéro-latérale [20].
Vidéo: subobstruction de la CCVG par la partie distale du feuillet mitral antérieur (SAM) dans un cas de cardiomyopathie hypertrophique au cours d'un épisode d'hypovolémie.
Vidéo: flux Doppler couleur en cas de SAM (vue long-axe); en mésosystole, présence de tourbillons dans la CCVG (subobstruction par le SAM) et d'une insuffisance mitrale dirigée postérieurement.
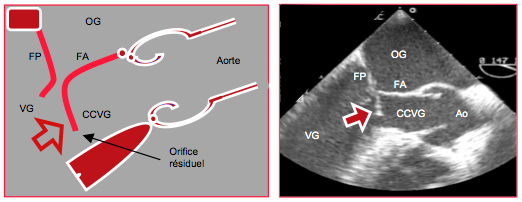
Figure 27.42 : SAM ou systolic anterior motion. Le feuillet antérieur (FA) de la valve mitrale est poussé puis aspiré dans la chambre de chasse du VG (CCVG) ; il se plie en son milieu au cours de la systole de manière caractéristique. FP : feuillet postérieur.
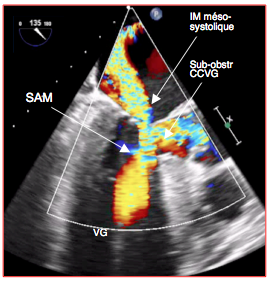
Figure 27.43 : Flux couleur en cas de SAM. Il prend une forme en "Y": une branche est le jet de l'insuffisance mitrale, l'autre est l'accélération du sang dans la CCVG; le pied du "Y" est la zone d'accélération dans le VG.
Le rétrécissement mésosystolique de la CCVG diminue brusquement le volume systolique, ce qui se traduit par deux phénomènes (Vidéo et Figure 27.44) [25].
- Déformation en dague du flux aortique ; au milieu de l’éjection, la subobstruction accélère le flux, mais le volume systolique baisse ; l’image spectrale du flux devient donc plus étroite, puisque sa surface est proportionnelle au VS, mais sa vélocité augmente brusquement. Le décrochement dans la courbe de flux a lieu entre 1 et 2.5 m/s. La Vmax voisine 4 m/s (gradient 64 mmHg).
- Collapsus partiel des cuspides de la valve aortique (notching) ; la baisse méso-systolique du VS ne permet plus de maintenir la valve aortique complètement ouverte ; en mode TM, on voit les cuspides vibrer et collaber. Ce signe est pathognomonique de l’obstruction dynamique de la CCVG.
Vidéo: collapsus partiel des cuspides de la valve aortique en cours de systole lors de SAM; les cuspides faseyent et se referment progressivement à cause de la chute du volume systolique en cours d'éjection.
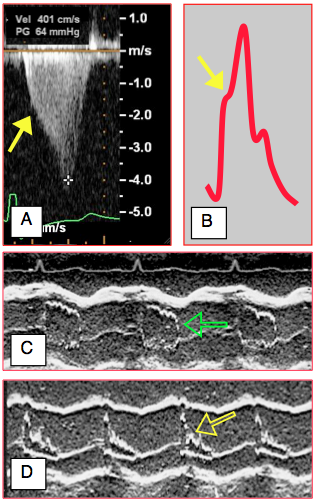
Figure 27.44 : Chute brusque du débit aortique en cours de systole lorsque le feuillet antérieur de la valve mitrale vient subocclure la chambre de chasse du VG. A : l’image spectrale du flux aortique prend une allure en dague due à baisse soudaine du volume systolique et à l'accélération de la vélocité du flux; le décrochement est signalé par la flèche. B : cette silhouette se retrouve sur la courbe de pression artérielle. C: normalement, la valve aortique maintient sa forme ouverte tout au long de l’éjection (flèche verte) en mode TM. D : lors de cardiomyopathie obstructive (CMO) et de SAM, le volume systolique devient insuffisant pour maintenir la valve aortique complètement ouverte, et celle-ci se referme partiellement en cours de systole (flèche jaune) ; cette fermeture partielle prématurée de la valve aortique est pathognomonique de la CMO.
La survenue d'une subobstruction de la CCVG est aussi variable qu'imprévisible. Cependant, plusieurs éléments sont des prédicteurs du risque de sténose dynamique en cas d'hypovolémie, lors de stimulation adrénergique, après plastie mitrale ou suite à un remplacement valvulaire aortique pour sténose (Figure 27.45) [5,14,24].
- Petite cavité gauche, diamètre télédiastolique du VG < 4.2 cm, diamètre télésystolique < 2.5 cm, CCVG étroite (< 2.0 cm);
- Vmax du flux intraventriculaire > 1.3 m/s;
- Rapport entre l’épaisseur du septum et celle de la paroi postérieure ≥ 1.45;
- Gradient moyen transvalvulaire préopératoire > 50 mmHg;
- Distance entre le point de coaptation mitrale et le septum interventriculaire < 2.6 cm;
- Angle mitro-aortique refermé (< 140°);
- Longueur excessive du feuillet postérieur déployé en diastole > 1.5 cm;
- Longueur excessive du feuillet antérieur déployé en diastole > 2.0 cm;
- Rapport longueur du feuillet antérieur / longueur du feuillet postérieur < 1.3;
- Présence d’un éperon septal proéminent (épaisseur du septum > 1.5 cm);
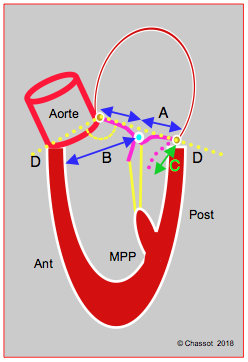
Figure 27.45 : Eléments prédicteurs de bascule du feuillet antérieur dans la chambre de chasse en postopératoire (SAM systolic anterior motion). A : rapport hauteur du feuillet antérieur / hauteur du feuillet postérieur < 1.3. B : distance entre le point de coaptation et le septum < 2.6 cm (C-sept). C : hauteur du feuillet postérieur déployé en diastole > 1.5 cm. D : angle mitro-aortique refermé (< 140°) [14].
L'effet CMO
Un patient ne souffrant pas de cardiomyopathie obstructive peut reproduire une sténose sous-aortique dynamique lorsque certaines conditions sont remplies [6].
- Hypertrophie ventriculaire gauche concentrique avec petite cavité ventriculaire, telle qu'elle se rencontre fréquemment chez les hypertendus chroniques et les porteurs de sténose aortique.
- Baisse du remplissage ventriculaire par hypovolémie.
- Augmentation de la contractilité par β-stimulation.
- Hyperdynamisme secondaire à une anémie aiguë.
- Baisse de l'impédance aortique et des résistances artérielles systémiques ; elle augmente le gradient trans-aortique.
- Vasoplégie (RAS effondrées).
- Après CEC lors de remplacement valvulaire aortique pour sténose, parce que l'obstacle à l'éjection du VG a disparu.
- Contre-pulsion intra-aortique: la pression est très basse dans l'aorte ascendante en systole.
- Rapprochement du point de coaptation mitral de la chambre de chasse après plastie mitrale pour quatre raisons différentes (incidence 4-11%) [12].
- L’anneau de valvuloplastie est trop restrictif ; le SAM est plus fréquent après pose d'un anneau rigide complet et restrictif qu'après celle d'un anneau ouvert semi-rigide.
- La longueur résiduelle du feuillet postérieur est excessive (excès de tissu).
- La cavité ventriculaire est trop petite : hypovolémie, HVG concentrique.
- La course radiaire de la paroi postérieure en systole est trop grande : sur-stimulation β, vasoplégie.
Le résultat de cet effet CMO est un bas débit cardiaque caractérisé par une pression artérielle systémique basse et une tachycardie, mais des pressions de remplissage conservées, voire élevées. Le diagnostic ne peut être posé qu'à l'échocardiographie. Les particularités principales sont les suivantes.
- Cavité ventriculaire de petite taille et VG hyperdynamique.
- Présence d'un éperon septal à l'entrée de la CCVG ; le diamètre de la chambre de chasse est rétréci (valeurs normales: 2 cm chez la femme et 2.2 cm chez l'homme) (voir Figure 27.46).
- Epaisseur du septum > 1.5 fois celle de la paroi postérieure du VG.
- Présence de turbulences de haute vélocité dans la CCVG en systole (Doppler couleur).
- Aspiration du feuillet antérieur de la valve mitrale dans la CCVG pendant la deuxième partie de la systole (SAM) ; le feuillet se coude en son milieu en un genou caractéristique.
- Vélocité excessive (> 2.5 m/s) du flux systolique dans la CCVG ; la silhouette du flux en dague est caractéristique de l'accélération qui survient en deuxième partie de systole.
- Insuffisance mitrale apparaissant à mi-systole, de direction postéro-latérale.
- Collapsus mésosystolique des cuspides de la valve aortique à cause de la baisse du volume éjecté secondaire à la subocclusion de la CCVG (mode TM de la valve aortique).
La seule thérapeutique est l'arrêt des catécholamines β, l’élévation de la précharge (remplissage) et l'augmentation des résistances artérielles systémiques (vasoconstricteur α) ; dans les cas rebelles, le β-blocage est nécessaire.
Chirurgie de la CMO
Lorsque l'obstruction dynamique de la CCVG présente un gradient élevé (≥ 50 mmHg), une épaisseur du septum > 18 mm et une résistance au traitement médical (béta-bloqueur, bloqueur calcique non-dihydropyridine, disopyramide), plusieurs possibilités invasives permettent de lever l'obstacle [10].
Chirurgie de la CMO
Lorsque l'obstruction dynamique de la CCVG présente un gradient élevé (≥ 50 mmHg), une épaisseur du septum > 18 mm et une résistance au traitement médical (béta-bloqueur, bloqueur calcique non-dihydropyridine, disopyramide), plusieurs possibilités invasives permettent de lever l'obstacle [10].
- Ablation septale percutanée par alcoolisation (1-3 mL alcool pur) des premières artères septales (branches de l'IVA) pour nécroser partiellement le septum de la chambre de chasse. Le gradient de pression est diminué à long terme dans 50% des cas [21]. Le risque est un bloc trifasciculaire, un infarctus septal important et une CIV; à long terme, le risque d'arythmie ventriculaire est potentiellement augmenté [27].
- Myectomie chirurgicale, si le patient est symptomatique. Par voie trans-aortique en CEC, on résèque longitudinalement le septum depuis le point de contact avec le feuillet mitral jusqu'à la base de la cuspide coronaire droite. L'opération est souvent complétée par une plastie mitrale (plicature horizontale) pour raccourcir le feuillet antérieur et par un réajustement de l'appareil sous-valvulaire si les cordages ou les piliers sont trop allongés [28]. La mortalité opératoire est de 1-2% [9].
- Transplantation cardiaque en cas de défaillance terminale du VG.
L’ETO est nécessaire pour déterminer le point de contact entre le feuillet antérieur et le septum et pour mesurer l’épaisseur de celui-ci sous la valve aortique. Cette mesure s’effectue en vue long-axe du VG, entre 90° et 140° selon la position du coeur, dans un plan qui offre une bonne image en long-axe de la chambre de chasse et de la valve aortique (Figure 27.46 A).
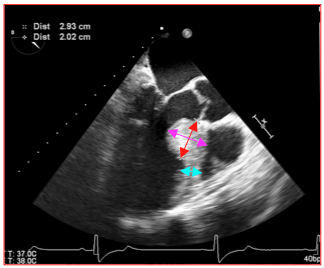
Figure 27.46 A : Image ETO d'éperon septal à l'entrée de la chambre de chasse. Les mesures affichées sont celles du bourrelet et non de l'épaisseur du septum. Cette dernière est représentée par le trait bleu, qui est l'épaisseur minimale du septum; cette dernière est importante pour le chirurgien car elle définit la profondeur jusqu'à laquelle on peut réséquer le muscle sans encourir le risque d'une CIV.
Après la sortie de CEC, plusieurs points sont à vérifier:

Figure 27.46 A : Image ETO d'éperon septal à l'entrée de la chambre de chasse. Les mesures affichées sont celles du bourrelet et non de l'épaisseur du septum. Cette dernière est représentée par le trait bleu, qui est l'épaisseur minimale du septum; cette dernière est importante pour le chirurgien car elle définit la profondeur jusqu'à laquelle on peut réséquer le muscle sans encourir le risque d'une CIV.
Après la sortie de CEC, plusieurs points sont à vérifier:
- La Vmax (Doppler continu) et le gradient résiduel dans la CCVG en vue transgastrique profonde 0° ou long-axe du VG 120°; la Vmax ne doit pas dépasser 2 m/s et le ΔP 16 mmHg;
- L’absence de SAM et d’IM méso-systolique;
- L’éventualité d’une CIV sur résection excessive (0.6% des cas) (Figure 27.46 B);
- Une insuffisance aortique sur déstabilisation de la cuspide coronarienne droite;
- Un bloc de branche complet (10% des cas).
Un retour en CEC pour compléter la résection est nécessaire dans 5% des cas [16].
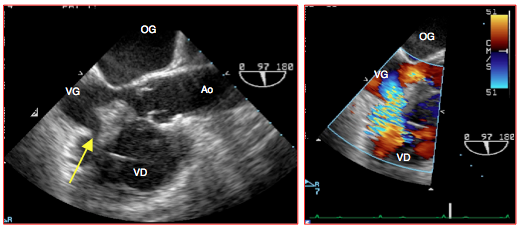
Figure 27.46 B : Communication interventriculaire (CIV) après résection chirurgicale excessive dans la musculature septale. L'image 2D en long-axe (97°) présente une solution de continuité dans le septum interventriculaire à l'entrée de la CCVG. La superposition du Doppler couleur montre le flux tourbillonnant à travers la CIV (image en systole).
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références

Figure 27.46 B : Communication interventriculaire (CIV) après résection chirurgicale excessive dans la musculature septale. L'image 2D en long-axe (97°) présente une solution de continuité dans le septum interventriculaire à l'entrée de la CCVG. La superposition du Doppler couleur montre le flux tourbillonnant à travers la CIV (image en systole).
| Cardiomyopathie hypertrophique |
| Lorsqu’elle est primaire, la cardiomyopathie hypertrophique touche préférentiellement le septum; l’HVG secondaire à un excès de postcharge est homogène dans tout le VG. L’hypertrophie septale peut occasionner une cardiomyopathie obstructive (CMO), ou sténose dynamique de la CCVG, qui est liée à plusieurs phénomènes : - Hypertrophie musculaire concentrique et rétrécissement systolique de la CCVG - Fermeture de l’angle mitro-aortique - Déplacement antérieur du point de coaptation de la valve mitrale - Bascule de l'extrémité du feuillet antérieur dans la CCVG - Aspiration du feuillet mitral antérieur dans la CCVG (SAM : systolic anterior motion) - Hypovolémie, vasoplégie, sur-stimulation béta-adrénergique - Baisse de postcharge: remplacement valvulaire aortique pour sténose, contre-pulsion intra-aortique - En cas de plastie mitrale : excès de tissu mitral ou anneau trop restrictif La CMO est définie par : - Hypertrophie à prédominance septale (septum > 15 mm), cavité VG rétrécie - Fonction systolique conservée mais dysfonction diastolique - Vmax > 2.5 m/s dans la CCVG (Doppler pulsé, Doppler continu avec double enveloppe) - Présence de SAM (vue long-axe 120° de la CCVG) - Gradient sous-aortique > 30 mmHg au repos, > 50 mmHg à la provocation - Aspect en dague du flux aortique - IM méso-télésystolique - Collapsus mésosystolique des cuspides de la valve aortique (mode TM de la valve aortique) |
| Messages pour le chirurgien en cas de CMO |
| Diamètre de la chambre de chasse du VG, présence d’un éperon septal (vue long axe 120°) Présence de SAM, position du point d’occlusion dans la CCVG Epaisseur du septum interventriculaire en dessous de la valve aortique (long axe CCVG 90 – 140°) Longueurs du feuillet antérieur et du feuillet postérieur (vue long-axe VG 120°) Vmax et ΔP dans la CCVG (vue transgastrique profonde 0° ou 120°) Post-CEC: - ΔP résiduel (doit être < 16 mmHg) - SAM résiduel - IM résiduelle (doit être ≤ mineure, ou due à une autre cause que la CMO) - Présence de CIV - Présence d’IA |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- BAYRAK F, KAHVECI G, MUTLU B, et al. Tissue Doppler imaging to predict clinical course of patients with hypertrophic cardiomyopathy. Eur J Echocardiogr 2008; 9:278-83
- EFTHIMIADIS GK, PAGOURELIAS ED, PARCHARIDOU D, et al. Clinical characteristics and natural history of hypertrophic cardiomyopathy with midventricular obstruction. Circ J 2013; 77:2366-74
- ELLIOTT PM, ANASTASAKIS A, BORGER MA, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology. Eur Heart J 2014; 35:2733-79
- GERSH BJ, MARON BJ, BONOW RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy. J Am Coll Cardiol 2011; 58:e212-60
- HYMEL BJ, TOWNSLEY MM. Echocardiographic assessment of systolic anterior motion of the mitral valve. Anesth Analg 2014; 118:1197-201
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- LEFEBVRE XP, HE S, LEVINE RA, et al. Systolic anterior motion of the mitral valve in hypertrophic cardiomyopathy: an in vitro pulsatile flox study. J Heart Valv Dis 1995; 4:422-31
- LEVINE R, LEFEBVRE X, GUERRERO JL, et al. Unifying concepts of mitral valve function and disease: SAM, prolapse and ischemic mitral regurgitation. J Cardiol 1994; 24:15-27
- LOULMET DF, YAFFEE DW, URSOMANNO PA, et al. Systolic anterior motion of the mitral valve: a 30-year perspective. J Thorac Cardiovasc Surg 2014; 148:2787-94
- MARON BJ. Clinical course and management of hypertrophic cardiomyopathy. N Engl J Med 2018; 379:655-68
- MARON BJ, CASEY SA, POLIAC LC, et al. Clinical course of hypertrophic cardiomyopathy in a regional United States cohort. JAMA 1999; 281:650-5
- MARON BJ, MARON M; WIGLE E, et al. The 50-year history, controversy, and clinical implications of left ventricular outflow tract obstruction in hypertrophic cardiomyopathy: from idiopathic hypertrophic subaortic stenosis to hypertrophic cardiomyopathy. J Am Coll Cardiol 2009; 54:191-200
- MARON BJ, OLIVOTTO I, HARRIGAN C, et al. Mitral valve abnormalities identified by cardiovascular magnetic resonance represent a primary phenotypic expression of hypertrophic cardiomyopathy. Circulation 2011; 124:40-7
- MASLOW AD, HAERING JM, LEVINE RA, et al. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease. J Am Coll Cardiol 1999; 34:2096-104
- MEYER MR, EBERLI FR. Cardiomyopathie hypertrophique et dilatée. Forum Méd Suisse 2018; 18: 168-77
- NAKATANI S, MARWICK TH, LEVER HM, et al. Resting echocardiographic features of latent left ventricular outflow obstruction in hypertrophic cardiomyopathy. Am J Cardiol 1996; 78:662-8
- PARK SH, CLICK RI, FREEMAN WK, et al. Role of intraoperative transesophageal echocardiography in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol 1995; 25:82A-83A
- PETSAS AA, ANASTASSIADES LC, CONSTANTINOU EC, et al. Familial discrete subaortic stenosis. Clin Cardiol 1998; 21:63-5
- POLIAC LC, BARRON ME, MARON BJ. Hypertrophic cardiomyopathy. Anesthesiology 2006; 104:183-92
- ROBERTS R, SIGWART U. New concepts in hypertrophic cardiomyopathies. Part II. Circulation 2001 ; 104 :2249-52
- SEGGEWISS H, FABER L, GLEICHMANN U. Percutaneous transluminal septal ablation in hypertrophic obstructive cardiomyopathy. Thorac Cardiovasc Surg 1999; 47:94-100
- SEMSARIAN C, INGLES J, MARON M, et al. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol 2015; 65:1249-54
- SEN-CHOWDHRY A, JACOBY D, MOON JC, et al. Update on hypertrophic cardiomyopathy and a guide to the guidelines. Nat Rev Cardiol 2016; 13:651-75
- SHAPETON A. Dynamic left ventricular outflow obstruction and systolic anterior motion of the nitral valve complicating surgical aortic valve replacement. J Cardiothorac Vasc Anesth 2019; 33:858-62
- SHERRID MV, WEVER-PINZON O, SHAH A, et al. Reflections on inflections in hypertrophic cardiomyopathy. J Am Coll Cardiol 2009; 54:212-9
- SONNY A, SALE S, SMEDIRA NG. Abnormalities of mitral subvalvular apparatus in hypertrophic cardiomyopathy: role of intraoperative 3D transesophageal echocardiography. Anesth Analg 2016; 123:1094-7
- SORAJJA P, OMMEN SR, HOLMES DR, et al. Survival after alcool septal ablation for obstructive hypertrophic cardiomyopathy. Circulation 2012; 126:2374- 80
- SWISTEL DG, BALARAM SK. Surgical myectomy for hypertrophic cardiomyopathy in the 21th century, the evolution of the "RPR" repair: resection, plication, and release. Progr Cardiovasc Dis 2012; 54:498-502
- TURER AT, SAMAD Z, VALENTE AM, et al. Anatomic and clinical correlates of septal morphology in hypertrophic cardiomyopathy. Eur J Echocardiogr 2011; 12:131-9
