La grande majorité des assistance ventriculaires gauches (LVAD: left ventricular assist device) implantées actuellement est du type à flux continu: turbine axiale (HeartMate™ II de Thoratec, Jarvik 2000™, HeartAssist 5™ de MicroMed, InCor™ de BerlinHeart) ou pompe centrifuge (HeartMate™ III, DuraHeart™, Evaheart™, HeartAssist-5™, HVAD™ et MVAD™) (voir Chapitre 12, Dispositifs à long terme). Dès que l’assistance gauche est mise en marche, l’ETO devient le mode de surveillance essentiel pour s’assurer du bon fonctionnement du système et pour diagnostiquer ses dysfonctionnements. Globalement, la mise en route de l'assistance décomprime le VG et surcharge le VD, ce qui agrave une IA ou un shunt D-G s'ils existent. Une désaturation artérielle survenant à la mise en route de la pompe doit faire immédiatement suspecter un shunt (FOP, CIA) non diagnostiqué au préalable. Le degré, la fréquence et la durée d'ouverture de la valve aortique sont le mieux évalués en mode TM au travers du long-axe de la valve [2,4,5,16,18].
Débullage
L’ETO contrôle l'efficacité du débullage avant la mise en charge; l’air provient des cavités gauches, des veines pulmonaires ou du système d’assistance dont la purge est insuffisante. La deuxième source d’air est l’effet de succion de la pompe en cas d’hypovolémie, qui peut aspirer de l’air par les lignes de suture de la canule apicale à cause du collapsus du VG ou de la vitesse de rotation excessive de la turbine [1]. Comme elle s'abouche à la face antérieure de l'aorte, la coronaire droite est un lieu privélégié d'embolie gazeuse; l'obstruction momentanée de la CD contribue à la dysfonction aiguë du VD. Dans les systèmes à compression pneumatique, l'air qui entoure la chambre ventriculaire bloque la transmission des ultrasons; le contrôle du débullage ne peut se faire que dans les oreillettes et les veines pulmonaires, ou à la sortie de la pompe dans l'aorte et l'artère pulmonaire (Vidéo).
Vidéo: microbulles dans les cavités gauches en fin de CEC.
Canules
La position et le flux des canules sont examinés dès le démarrage de l'assistance pour contrôler leur bon fonctionnement et éventuellement apporter des corrections avant la décanulation de CEC (Figure 27.54) (Tableau 27.6) [3,7,17].
Débullage
L’ETO contrôle l'efficacité du débullage avant la mise en charge; l’air provient des cavités gauches, des veines pulmonaires ou du système d’assistance dont la purge est insuffisante. La deuxième source d’air est l’effet de succion de la pompe en cas d’hypovolémie, qui peut aspirer de l’air par les lignes de suture de la canule apicale à cause du collapsus du VG ou de la vitesse de rotation excessive de la turbine [1]. Comme elle s'abouche à la face antérieure de l'aorte, la coronaire droite est un lieu privélégié d'embolie gazeuse; l'obstruction momentanée de la CD contribue à la dysfonction aiguë du VD. Dans les systèmes à compression pneumatique, l'air qui entoure la chambre ventriculaire bloque la transmission des ultrasons; le contrôle du débullage ne peut se faire que dans les oreillettes et les veines pulmonaires, ou à la sortie de la pompe dans l'aorte et l'artère pulmonaire (Vidéo).
Vidéo: microbulles dans les cavités gauches en fin de CEC.
Canules
La position et le flux des canules sont examinés dès le démarrage de l'assistance pour contrôler leur bon fonctionnement et éventuellement apporter des corrections avant la décanulation de CEC (Figure 27.54) (Tableau 27.6) [3,7,17].
- La canule apicale est dans l’axe du VG et dans l’alignement du flux mitral; elle ne doit pas être en contact avec une paroi ventriculaire ni avec le septum (Vidéos). Son flux est continu, laminaire et unidirectionnel, de Vmax 0.5-1.2 m/s; la contraction ventriculaire y ajoute des pics de flux (VIdéo). En vues mi-œsophage 0°, 90° et 120°, le Doppler couleur ne montre ni aliasing ni tourbillons. En cas d’obstruction, la Vmax est > 2.5 m/s et le flux tourbillonnaire. Toute Vmax ≥ 1.5 m/s dans les systèmes à flux continu et ≥ 2.5 m/s dans les systèmes pulsés est à investiguer (Figure 27.55) [5]. La lecture de ce flux peut être contaminée par le flux mitral ou par la présence d'une insuffisance aortique.
- La canule artérielle est implantée à la face antérieure de l’aorte ascendante (vue basale 120°), ≥ 2 cm au-dessus des sinus de Valsalva, au niveau du croisement avec l'AP droite; l’emplacement est repérable au flux couleur s’il est douteux à l’imagerie 2D (Figure 27.56). Son diamètre est de 1.0 à 1.6 cm. Sa Vmax est 1-2 m/s avec les systèmes à flux continu et jusqu’à 2.3 m/s au pic systolique avec les systèmes pulsés. L'angle d'implantation détermine la géométrie du flux (Figure 27.57) (Vidéos).
- En cas d’assistance droite, la canule auriculaire droite doit se trouver au milieu de l’OD et non buter contre le septum interauriculaire ou la valve tricuspide; la canule artérielle pulmonaire est implantée ≥ 2 cm au-delà du plan de la valve pulmonaire (vue rétrocardiaque basale 60-100°).
- La fermeture sternale peut comprimer des canules et modifier leur position. Leur examen doit être répété une fois le thorax fermé et leur vélocité remesurée.
- En cas de système coaxial transaortique (Impella™), l’extrémité aspiratrice de la canule est au niveau de l’extrémité du feuillet antérieur de la valve mitrale (vue long-axe 120°), environ 3-4 cm en dessous du plan de la valve aortique, dirigée vers l'apex; elle ne touche pas les parois ventriculaires (Vidéos). Son extrémité distale est au moins 2 cm au-dessus des sinus de Valsalva; elle se repère au flux couleur tourbillonnaire qui en sort. L'extrémité située dans le VG est souvent cachée par un cône d'ombre acoustique, alors que l'extrémité aortique, proche du transducteur, donne lieu à des artéfacts de reverbération [12].
- Le système TandemHeart™ draine l'OG depuis une canule fémorale par une ponction trans-septale; l'ETO est nécessaire pour contrôler cette manœuvre: positionnement adéquat de l'aiguille donnant une image de tente symétrique au niveau de la fossa ovalis, placement de la canule au centre de l'OG en évitant qu'elle ne s'enfile dans une veine pulmonaire, l'appendice auriculaire ou la valve mitrale [14].
- Après implantation d'un cœur artificiel total, la visibilité est réduite car les ventricules sont des pompes mécaniques qui font obstacle aux ultrasons; de plus, les systèmes pneumatiques sont ceinturés d'air. On ne peut examiner que les veines caves et pulmonaires, les oreillettes et les grosses artères (AP et aorte). Le fonctionnement des valves mécaniques auriculo-ventriculaires est observable en vue mi-oesophagiennes, mais les valves aortiques et pulmonaires de la prothèse sont plus difficile à examiner. L'absence de ventricule supprime l'onde R de l'ECG sur laquelle se repèrent les systèmes d'entegistrement des boucles [6].
Vidéo: canule d'alimentation de l'assistance ventriculaire type HeartMate II en place à l'apex du VG.
Vidéo: vue X-plane de la canule apicale d'un système HeartMate III. La canule est correctement placée et bien dans l'axe du flux mitral.
Vidéo: flux Doppler dans la canule apicale d'un système HeartMate III.
Vidéo: vue long-axe de l'aorte ascendante avec l'implantation de la canule aortique d'un système HeartMate.
Vidéo: même cas que précédemment, avec le flux Doppler couleur de la pompe dans l'aorte ascendante.
Vidéo: vue 2D 4-cavités de la canule du système Impella dans la chambre de chasse du VG.
Vidéo: vue 3D long-axe de la canule du système Impella franchissant la valve aortique et plongeant dans la chambre de chasse du VG.
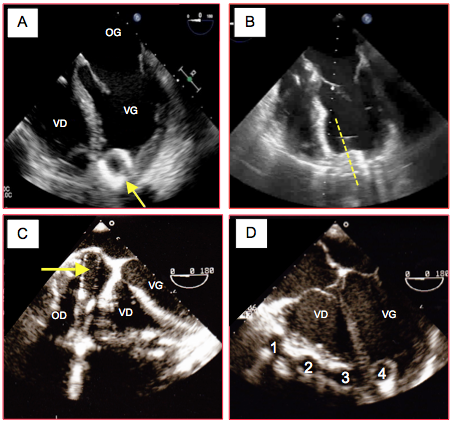
Figure 27.54 : Canules d’assistance ventriculaire. A : canule d'aspiration à l'apex du VG; cette canule est dirigée vers le septum de manière inadéquate. B: canule d'aspiration apicale présentant un meilleur axe. C : canule d'aspiration dans l’OD ; cette canule est trop profonde et appuie fortement contre le septum interauriculaire. D: les 4 canules d’assistance bi-ventriculaire (Thoratek™) sur la face antérieure du cœur ; 1 : canule venant de l’OD ; 2 : canule allant dans l’aorte ; 3 : canule allant dans l’AP ; 4 : canule apicale dans le VG.
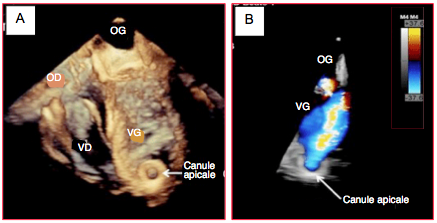
Figure 27.55 : Canules d’assistance ventriculaire en 3D. A : canule d'aspiration apicale en reconstruction 3D; elle est correctement dirigée vers la valve mitrale. B: canule apicale avec l'image du flux aspiré dans le VG; le flux est normal, la Vmax voisine 50 cm/s.
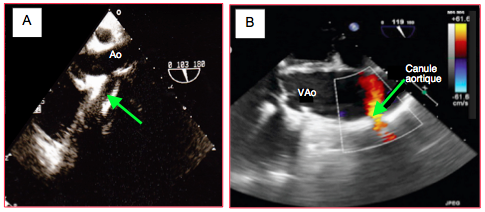
Figure 27.56 : Canules d’assistance ventriculaire. A: canule d'éjection anastomosée à l’aorte ascendante (Ao). B: flux d'éjection dans la canule anastomosée à l'aorte.
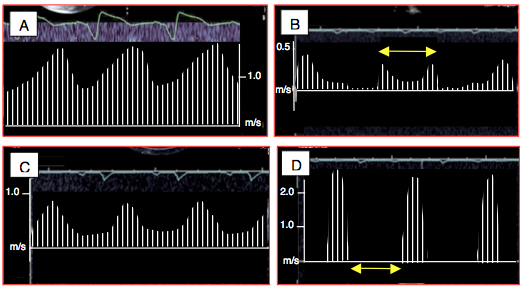
Figure 27.57 : Flux normaux dans les canules d'assistance d'un dispositif à flux continu et d'un dispositif pulsatile. A: flux d'entrée dans la canule apicale d'un système continu. B: flux d'entrée dans la canule apicale d'un système pusatile. C: flux de sortie dans la canule aortique d'un système continu. D: flux de sortie dans la canule aortique d'un système pulsatile (flèche jaune: diastole). Dans les mécanismes continus, l'éjection du VG ajoute un pic de flux par-dessus le débit de base qui est constant; le degré de pulsatilité augmente avec une élévation de la précharge ou de la contractilité ventriculaire, mais il baisse lorsque la postcharge augmente. Dans les mécanismes pulsatiles, le flux aortique est uniquement systolique [d'après: Estep JD, et al. The role of echocardiography and other imaging modalities in patients with left ventricular assist devices. JACC Cardiovasc Imaging 2010; 3:1049-64].

Insuffisance aortique
La valve aortique s’ouvre de manière intermittente selon le degré d’éjection que conserve le VG ; pour éviter un phénomène de stase au niveau des sinus de Valsalva (présence de contraste spontané ou de thrombus en vue long-axe 120°), la pompe doit être idéalement réglée pour permettre une certaine éjection ventriculaire et une ouverture de la valve aortique plusieurs fois par minute (examen du degré d'ouverture en mode TM en vue court-axe 40° ou long-axe 120° de la valve aortique). L'absence d'ouverture favorise la formation de thrombus, le dépôt de collagène, la fusion commissurale et finalement la rétraction des cuspides conduisant à une insuffisance aortique chronique; ce processus est plus fréquent avec les assistances à débit continu (Vidéo et Figure 27.58) [15].
Vidéo: thrombus remplissant les cupules des cuspides aortiques en cas de non-ouverture de la valve aortique pendant une assistance gauche.
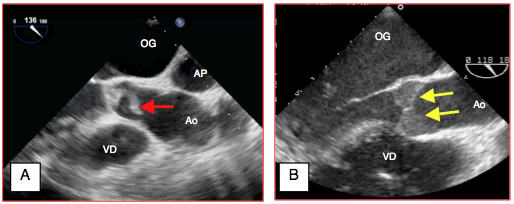
Figure 27.58 : Présence de thrombus au niveau de la valve aortique dans un cas d'assistance ventriculaire gauche. A: thrombus flottant (flèche rouge). B: stase et thrombus dans les cupules aortiques (flèches jaunes). Dans cette situation, il est impératif de ne pas diminuer le débit de pompe, car cela entrainerait une certaine éjection par la valve aortique et un risque dramatique d'embolie systémique.
L'assistance gauche modifie le rapport de pression entre le VG et l'aorte: la Ptd du VG diminue par la décompression de la cavité, mais la pression aortique centrale augmente avec le flux de la canule, particulièrement quand il est continu. De ce fait, toute insuffisance aortique est aggravée; elle peut être intermittente selon la durée d'ouverture de la valve, principalement diastolique, ou continue [16]. Avec les système à flux continu, la fuite persiste aux deux temps du cycle cardiaque, et les mesures Doppler habituelles (diamètre de la vena contracta, Pt1/2, reflux diastolique dans l'aorte) sous-estiment grossièrement l'IA. De nouveaux paramètres paraissent mieux corrélés à l'importance de l'IA et à son pronostic clinique, tels le rapport des pics de vélocité systolique et diastolique (S/D) et l'accélération diastolique du flux dans la canule aortique [8]. En alignant le mieux possible l'axe Doppler avec le flux de la canule aortique au niveau de son anastomose, l'analyse au Doppler pulsé permet ces deux mesures (Figure 27.59).
- Rapport entre la Vmax systolique et la vélocité en télédiastole (Vsyst/Vtd); plus l'IA est importante, plus ce rapport diminue (rapport normal: > 2.5), car la vélocité diastolique tend vers la même valeur que la vélocité en systole.
- Accélération du flux diastolique; plus l'IA est importante, plus la vélocité augmente en cours de diastole. De 5 cm/s2 en l'absence d'IA, elle passe à > 65 cm/s2 en cas d'IA sévère.
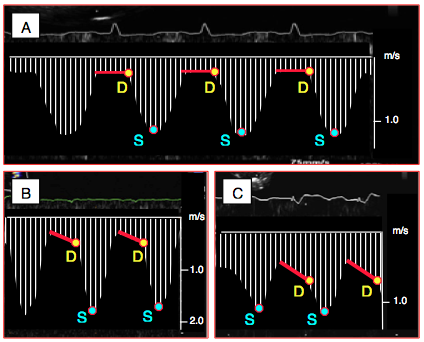
Figure 27.59 : Quantification de l'insuffisance aortique (IA) en cas d'assistance ventriculaire à débit continu. A: situation normale, sans IA; la pente du flux continu en diastole est horizontale. B: IA modérée; la pente présente une certaine accélération, mais la valeur télédiastolique de la vélocité du flux reste basse. C: IA sévère; la pente est plus inclinée et la valeur de la Vmax télédiastolique est beaucoup plus élevée [8]. D: Vmax du flux télédiastolique. S: Vmax du flux systolique.
Même en l'absence d'insuffisance aortique préopératoire, une IA apparaît de novo chez 25-35% des patients dans la première année après l'implantation d'une assistance à flux continu [11].
Dysfonction droite
La dysfonction du VD survient dans 15-40% des cas; elle est précipitée par une accélération trop rapide de la vitesse de pompe. Elle est essentiellement liée à trois phénomènes [7,10,19].
- Surcharge de volume: retour veineux excessif à droite à cause de l'amélioration du débit gauche par le dispositif d'assistance;
- Perte du soutien éjectionnel apporté au VD par le septum interventriculaire qui bascule à gauche à cause de la décompression du VG (effet de succion);
- Défaillance contractile propre du VD (ventilation en pression positive, soutien inotorpe insuffisant, embolie gazeuse dans la CD, etc).
La défaillance droite se traduit par une dilatation du VD et l'apparition ou l'aggravation d'une insuffisance tricuspidienne. La pulsatilité de l'AP (PAPsyst – PAPdiast) / PVC est basse (≤ 0.9) et la PVC est élevée (18 mmHg), la fraction de raccourcissement de surface est < 20%, le TAPSE est < 0.9 cm et la déformation longitudinale globale < 10% [10]. Le septum interauriculaire bombe dans l’OG; le septum interventriculaire bombe dans le VG et peut gêner le flux de la canule apicale d’aspiration. L'allure générale est celle d'un grand VD et d'un minuscule VG. La silhouette du septum est un excellent marqueur à l'ETO: la situation est équilibrée lorsqu'il est en position neutre; la vitesse de pompe doit être réglée pour le maintenir dans cette position (Vidéo). Lorsque la fonction droite est insuffisante pour assurer la précharge gauche malgré un soutien inotrope et vasodilatateur adéquat, une assistance droite doit être envisagée (Vidéo). La persistence d'une fuite tricuspidienne majeure impose une plastie de la valve [13].
Vidéo: défaillance droite après démarrage d'une assitance ventriculaire gauche.
Vidéo: la défaillance du VD persiste malgré un traitement vasodilatateur pulmonaire et nécessite la mise en pace d'une assitance droite.
Contractilité et volumes ventriculaires
Le VG et l’OG sont décomprimés avec le démarrage de l'assistance; le diamètre télédiastolique du VG diminue d'au moins 20% de sa valeur préopératoire. Normalement, le septum interventriculaire est en position neutre, l’insuffisance mitrale est diminuée ou absente ; le diamètre télédiastolique est diminué de 20% (VG) à 40% (VD) [3,7,16,17].
Vidéo: défaillance droite après démarrage d'une assitance ventriculaire gauche.
Vidéo: la défaillance du VD persiste malgré un traitement vasodilatateur pulmonaire et nécessite la mise en pace d'une assitance droite.
Contractilité et volumes ventriculaires
Le VG et l’OG sont décomprimés avec le démarrage de l'assistance; le diamètre télédiastolique du VG diminue d'au moins 20% de sa valeur préopératoire. Normalement, le septum interventriculaire est en position neutre, l’insuffisance mitrale est diminuée ou absente ; le diamètre télédiastolique est diminué de 20% (VG) à 40% (VD) [3,7,16,17].
- Si la pompe dysfonctionne ou tourne trop lentement, l’OG et le VG se dilatent, le septum bombe vers la droite, la valve mitrale fuit, la valve aortique a des mouvements d’ouverture réguliers, et du contraste spontané apparaît dans le VG (Figures 27.60A et 27.60B). L'importance de l'IM est un bon marqueur du degré de dilatation du VG; l'ouverture de la valve aortique à chaque systole signe une vidange insuffisante du VG. L'augmentation de taille de l'OG est la traduction d'une stase en amont qui, se répercutant sur la circulation pulmonaire, augmente la postcharge du VD et contribue à sa défaillance. L'IM peut aussi être occasionnée par une interférence mécanique de la canule apicale avec l'appareil sous-valvulaire mitral; l'ETO est précieux pour explorer ce mécanisme.
- En cas d’hypovolémie ou de débit de pompe excessif, le VG collabe autour de la canule (diamètre VG < 3 cm), le septum interauriculaire et interventriculaire bombe vers la gauche et la valve aortique ne s'ouvre plus (Figure 27.60B); le diamètre télédiastolique du VG peut devenir plus faible que son diamètre télésystolique; le VD est surchargé. L’effet de succion de la pompe sur un ventricule vide (dépression de – 5 mmHg environ) entraine un collapsus pariétal qui peut obstruer la canule apicale. Il peut aspirer de l’air par les points de la bourse autour de la canule; cet air, bien visible à l’ETO, entraîne une embolie gazeuse systémique. Une malposition de la canule démontrée à l'ETO 2D ou 3D cause des aspirations constantes de la paroi et doit être corrigée chirurgicalement.
- La dépression dans l’OG à cause de la décompression du VG fait apparaître un flux droit-gauche à travers le FOP si celui-ci n’a pas été diagnostiqué auparavant (20% des cas); ce flux est accentué par l’éventuelle surpression dans l’OD à cause de la dysfonction droite. Dans ce cas, le FOP doit être occlus, même au prix d'un retour en pompe [1].
- Lorsqu’ils sont de forte taille, les appareillages d’assistance ventriculaire peuvent modifier la position des structures cardiaques et créer une gêne sur le retour veineux systémique et/ou pulmonaire. Il est donc important de contrôler l’anatomie et la vélocité du flux dans les veines caves et dans les veines pulmonaires (≤ 1 m/s). Une accélération du flux > 1.5 m/s signale une obstruction au remplissage auriculaire.
- Sous assistance, la contractilité globale et segmentaire du ventricule n'est plus quantifiable avec les indices habituels.
- Le volume systolique (VS) éjecté par le dispositif d'assistance est calculé dans le conduit de sortie juste avant son anastomose à l'aorte ascendante (vue long-axe 120° de l'aorte ascendante) par la formule habituelle: (0.785 • D2) • ITV. Il est moyenné sur 3-5 cycles cardiaques et multiplié par la fréquence pour obtenir le débit/min. Pour les systèmes à flux continu, l'intégrale des vélocités (ITV) comprend la surface du flux systolique et du flux diastolique au cours d'un cycle cardiaque. En l'absence d'IA et d'ouverture de la valve aortique, le débit du VD est égal à celui de l'assistance; il se mesure dans la CCVD avec la formule: (0.785 • D2) • ITV • Fc, où Fc est la fréquence cardiaque. Si la valve aortique s'ouvre régulièrement, le débit gauche supplémentaire est calculé dans la CCVG avec la même formule, puis est additionné à celui de l'assistance pour connaître le débit systémique. En cas d'IA, une partie du volume éjecté par le système ne fait que tourner entre l'aorte, le VG et la pompe; le volume régurgité est alors égal à la soustraction du VS mesuré dans la CCVD de celui mesuré directement dans la canule de l'assistance: Vrég = VSAssist - VSCCVD [16].
- L'ETO est particulièrement pertinente pour équilibrer la balance entre les flux droit et gauche en cas d'assistance biventriculaire.
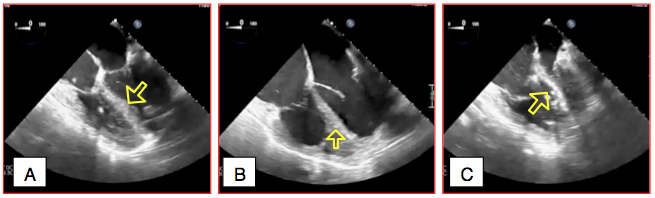
Figure 27.60A : Position du septum interventriculaire comme repère de l'efficacité de la pompe d'assistance. A gauche, le support circulatoire est insuffisant, le VG se dilate et le septum bombe dans le VD. Au milieu, le fonctionnement est adéquat, le septum est en position neutre entre les deux ventricules. A droite, le débit de la pompe est excessif, le septum est déplacé dans le VG qui collabe; cette image peut également être due à une défaillance du VD ou à une hypovolémie.
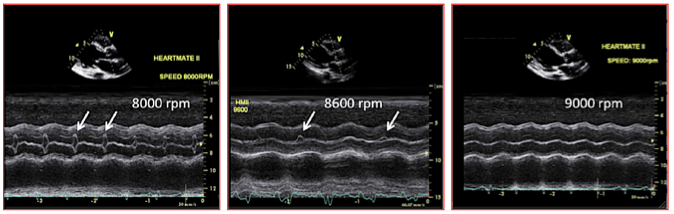
Figure 27.60B : Effets du débit de pompe sur l'ouverture de la valve aortique lors d'assistance par un dispositif HeartMate II™ (vues en mode TM). A 8'000 tours/minute, le débit est insuffisant pour décharger adéquatement le VG; la valve aortique s'ouvre à chaque battement cardiaque. A 8'600 t/m, la précharge du VG est adéquate et la valve s'ouvre tous les 3-4 cycles cardiaques. A 9'000 t/m, le débit de pompe est excessif, le VG totalement déchargé et la valve aortique est immobile, ce qui implique un risque de thrombose; cette image se voit également lorsque la fonction ventriculaire est effondrée, même si la précharge est correcte [16].
Dans le postopératoire, un état de choc peut s’installer suite à plusieurs éléments bien mis en évidence par l’échocardiographie [3]. Le système miniaturisé permettant une imagerie transoesophagienne continue pendant 72 heures (ImaCor™) est bienvenu dans ces circonstances; les informations hémodynamiques qu'il fournit modifient la prise en charge dans 70% des cas [9].
- Hypovolémie : le débit des assistances ventriculaires est dépendant de la précharge. L’hypovolémie sévère entraîne le collapsus des deux ventricules et bloque le retour vers la pompe ; le septum interventriculaire est dévié vers la gauche. D’autre part, le maintien de la pression artérielle exclusivement au moyen de vasoconstricteurs réduit le débit de pompe par excès de postcharge.
- Tamponnade : à part un bas débit de pompe et des pressions de remplissage le plus souvent élevées, les signes cliniques habituels sont en général absents. La situation ressemble à une décompensation droite. Seule l’échocardiographie bidimensionnelle peut mettre en évidence la compression externe d'une ou de plusieurs chambres cardiaques, car les flux Doppler comme la variation respiratoire excessive du flux mitral ne sont pas pertinents dans ce contexte.
- Insuffisance droite : dilatation du VD, insuffisance tricuspidienne et bombement du septum dans le VG. Le diagnostic différentiel entre la décompensation droite et l'embolie pulmonaire se fait par la mesure de la PAP: elle est basse dans le premier cas et élevée dans le second.
- Obstruction de canule : vélocité excessive dans la canule (canule veineuse : > 1.5 m/s, canule artérielle : > 2.5 m/s), flux tourbillonnaire au Doppler couleur, zone de convergence (PISA) à l’orifice d’entrée.
- Thrombose intracavitaire (9-16% des cas) : thrombus dans le VG (autour de la canule ou dans le territoire inféro-septal), dans l’appendice auriculaire gauche ou dans la racine de l’aorte; présence de contraste spontané dans les zones de bas débit thrombogène (VG, OG, sinus de Valsalva). Il faut éviter de diminuer le débit de pompe lorsqu'un thrombus est suspecté à la racine de l'aorte, car une éjection soudaine à travers la valve aortique entraînerait une embolisation systémique dramatique [16].
- Panne de la pompe : flux rétrograde dans l’aorte ascendante et dans la canule apicale, contraste spontané massif dans le VG et l’OG, mouvements d’ouverture de la valve aortique, insuffisance mitrale importante, déviation droite du septum interventriculaire.
- Lésion de la valve aortique: l'immobilité à long terme des cuspides aortiques lorsque la décharge ventriculaire est totale peut causer trois types de lésions: fusion commissurale et blocage de l'ouverture, recroquevillement et insuffisance, ou formation de thrombus avec risque embolique.
- Position du septum interventriculaire : la déviation septale par rapport à sa position neutre est une information capitale [1].
- Déviation vers la droite : décompression inadéquate du VG, obstruction de canule, vitesse de pompe trop basse, dysfonctionnement de pompe.
- Déviation vers la gauche : décompression excessive par vitesse de pompe trop rapide, défaillance du VD.
La fonction ventriculaire résiduelle ou récupérée sous assistance est difficile à évaluer parce que le ventricule est désamorcé. D'autre part, la canule d'admission dans la pompe, implantée à l'apex, bloque la contraction apicale du VG et rétrécit la surface de la cavité ventriculaire en long-axe. Tous les calculs de la FE sont faussés; il en est de même pour ceux basés sur l'éjection aortique (volume systolique, ITV de la CCVG). Le raccourcissement de surface en court-axe médio-ventriculaire est une alternative possible [1]. Les indices tissulaires comme la Vmax S de l'anneau mitral, la déformation longitudinale globale (global longitudinal strain) ou la vitesse de déformation (strain rate) sont plus adéquats, mais ils sont dépendants de la précharge et doivent se calculer au cours d'une période d’interruption au moins partielle de la pompe. Néanmoins, l’ETO est essentielle pour la surveillance du sevrage définitif de l’assistance.
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
| Rôle de l’ETO lors de l’implantation d’une assistance ventriculaire |
| Examen après implantation: - Fonction du VD - Décompression du VG - Septum interventriculaire et interauriculaire en position neutre - Présence ou variation d’IM et d’IT - Contrôle du débullage ou de l’apparition d’air - Ouverture régulière de la valve aortique - Position de la canule apicale dans le long axe du VG - Position de la canule droite au milieu de l’OD - Flux laminaire dans les canules artérielles et veineuses - Vmax normales des flux: < 1.2 m/s dans la canule apicale, < 2.0 m/s (flux continu) ou < 2.5 m/s (flux pulsatile) dans la canule aortique - Canule de l’Impella: 3-4 cm dans la CCVG et 2 cm au dessus des sinus de Valsalva - Evaluation de la volémie - Recherche de contraste spontané, de thrombus, de tamponnade |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- AMMAR KA, UMLAND MM, KRAMER C, et al. The ABCs of left ventricular assist device echocardiography: a systematic approach. Eur Heart J Cardiovasc Imaging 2012; 13:885-99
- CATENA E, MILAZZO F. Echocardiography and cardiac assist devices. Minerva Cardioangiol 2007; 55:247-65
- CATENA E, TASCA G. Role of echocardiography in the perioperative managememnt of mechanical circulatory assistance. Best Pract Res Clin Anaesthesiol 2012; 26:199-216
- CHUMNANVEJ S, WOOD MJ, MacGILLIVRAY TE, et al. Perioperative echocardiographic examination for ventricular assist device implantation. Anesth Analg 2007; 105:583-601
- ESTEP JD, STAINBACK RF, LITTLE SH, et al. The role of echocardiographiy and other Imaging modalities in patients with left ventricular assist devices. JACC Cardiovasc Imaging 2010; 3: 1049-64
- FINE NM, GOPALAN RS, ARABIA FA, et al. Intraoperative transesophageal echocardiographic guidance of total artificial heart implantation. J Heart Lung Transplant 2014; 33:454-7
- FLORES AS, ESSANDOH M, YERINGTON GC, et al. Echocardiographic assessment for ventricular assist device placement. J Thorac Dis 2015; 7:2139-50
- GRINSTEIN J, KRUSE E, SAYER G, et al. Novel echocardiographic parameters of aortic insufficiency in continuous-flow left ventricular assist devices and clinical outcome. J Heart Lung Transplant 2016; 35:976-85
- HAGLUND NA, MALTAIS S, BICK JS, et al. Hemodynamic transesophageal echocardiography after left ventricular assist device implantation. J Cardiothorac Vasc Anesth 2014; 28:1184-90
- LAMPERT BC, TEUTEBERG JJ. Right ventricular failure after left ventricular assist devices. J Heart Lung Transpl 2015; 34:1123-30
- PAK SW, URIEL N, TAKAYAMA H, et al. Prevalence of de novo aortic insufficiency during long-term support with left ventricular assist devices. J Heart Lung Transpoolant 2010; 29:1172-6
- PATEL KM, SHERWANI SS, BAUDO AM, et al. Echo rounds: the use of transesophageal echocardiography for confirmation of appropriate Impelle 5.0 device placement. Anesth Analg 2012; 114:82-5
- PIACENTINO V, GANAPATHI AM, STAFFORD-SMITH M, et al. Utility of concomitant tricuspid valve procedures for patients undergoing implantation of a continuous-flow left ventricular device. J Thorac Cardiovasc Surg 2012; 144:1217-21
- PRETORIUS M, HUGHES AK, STAHLMAN MB, et al. Placement of the TandemHeart percutaneous left ventricular assist device. Anesth Analg 2006; 103:1412-3
- SOLEIMANI B, HAOUZI A, MANOSKEY A, et al. Development of aortic insufficiency in patients supported with continuous flow left ventricular assist devices. ASAIO J 2012; 58:326-9
- STAINBACK RF, ESTEP JD, AGLER DA, et al. Echocardiography in the management of patients with left ventricular assist devices: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2015; 28:853-909
- SUBRAMANIAM K. Mechanical circulatory support. Best Pract Res Clin Anesthesiol 2015; 29:203-27
- THUNBERG CA, GAITAN BD, ARABIA FA, et al. Ventricular assist devices today and tomorrow. J Cardiothorac Vasc Anesth 2010: 24:656-80
- TURNER KR. Right ventricular failure after left ventricular assist device placement – The beginning of the end or just another challenge? J Cardiothorac Vasc Anesth 2019; 33:1105-21
