Les variations du remplissage gauche induites par l’IPPV se traduisent par des variations du volume systolique (VS) et de la pression artérielle systolique (PAs). L’examen de la courbe artérielle révèle deux déviations (Figure 5.97) [13].
- Une augmentation de la PAs (Δup) en début d’inspirium lorsque l’élévation de la pression respiratoire chasse le sang dans l’OG et augmente la précharge du VG.
- Une diminution de la PAs (Δdown) 2 à 5 cycles cardiaques plus tard lorsque les volumes systoliques droits diminués par l’IPPV arrivent à gauche (temps de transit pulmonaire normal : 2-5 secondes). En normovolémie et normocardie, le Δdown est plus important que le Δup.
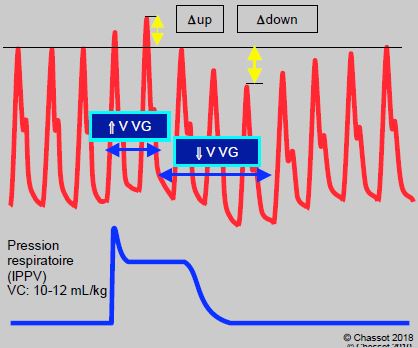
Figure 5.97 : Variations ventilatoires de la pression artérielle par rapport à la pression des voies aériennes lors de ventilation en pression positive. Lorsque la pression intrathoracique (Pit) s’élève à l’inspirium, la pression artérielle est augmentée (Δup) puisque le volume systolique du VG est plus grand (augmentation du retour à l’OG) et que la Pit s’additionne à la pression que génère ce dermier. Mais 2 à 5 cycles cardiaques plus tard, la pression artérielle baisse (Δdown) parce que la diminution du retour veineux au cœur droit, qui a baissé le volume éjecté dans l’artère pulmonaire, arrive maintenant à l’OG et diminue la précharge du VG. Cet enchaînement provoque une oscillation ventilatoire de la pression artérielle (normal < 12%). Le Δup est prédominant lors d’insuffisance du VG, parce que le VG congestif bénéficie grandement de l’aide que représente la compression par la Pit ; c’est l’équivalent d’une baisse de postcharge. Le Δdown est prédominant en hypovolémie, parce que le volume systolique est très dépendant de la précharge lorsque le malade se trouve sur la partie gauche très verticale de la courbe de Frank-Starling. V : volume télédiastolique. VC : volume courant.
L’amplitude de ces variations dépend du volume courant (10-12 ml/kg), de la PEEP et de la compliance thoracique ; elle est normalement < 12% ou < 10 mmHg. Les ΔPAs sont accentuées en hypovolémie à cause d’une prépondérance du Δdown pour trois raisons [7].
- Les veines caves et les oreillettes collabent facilement parce que leur Ptm est faible ; la Pit est du même ordre de grandeur que la Pic.
- La majeure partie du poumon passe en zone II de West, ce qui accentue l’effet sur la postcharge droite, donc sur les ΔVS du VD et sur le remplissage du VG.
- Le ventricule fonctionne sur la partie gauche de sa courbe de Frank-Starling où la pente est raide ; les variations de remplissage liées aux ΔPit se traduisent par de fortes variations du VS.
Dans l’insuffisance ventriculaire gauche, l’amplitude des variations est réduite et le Δup domine parce les pressions de remplissage sont élevées et que la courbe de Starling est aplatie, situation dans laquelle les variations de VS dues au variations de précharge sont très faibles. Par contre, les ΔPAs ventilatoires sont extrêmement marquées lors d’insuffisance diastolique, parce que la courbe de Starling est très redressée (Figure 5.98).
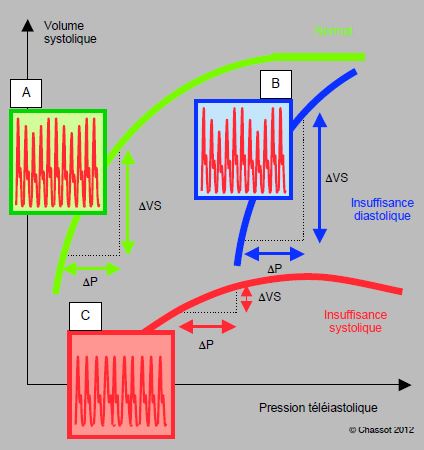
Figure 5.98 : Effet de l’IPPV sur la courbe de pression artérielle dans différentes situations. Les variations ventilatoires de la pression artérielle systolique sont d’autant plus marquées que la pente de la courbe de Starling est raide, c’est-à-dire que les variations de remplissage (ΔP télédiastolique) se traduisent par de plus fortes variations du volume systolique (ΔVS). A : courbe normale ; les variations de la pression artérielle systolique sont marquées en hypovolémie et atténuées en normovolémie. B : courbe lors d’insuffisance diastolique ; la pente de la courbe est très redressée, et les variations de la pression artérielle sont amplifiées. C : courbe lors d’insuffisance systolique ; la courbe est aplatie et les variations de pression artérielle inexistantes.
Manoeuvre de Valsalva
Les variations de pression en jeu dans les interactions cardiopulmonaires sont normalement faibles, mais peuvent devenir très importantes dans des situations pathologiques ou lors de mouvements respiratoires violents; les variations de la pression endothoracique générées par une manoeuvre de Valsalva (surpression) ou de Müller (dépression par inspirium forcé à glotte fermée) sont de l'ordre de 50-100 mm Hg [3]. La démonstration des effets hémodynamiques périphériques de ces phénomènes, décrite par Weber dans les années 1840, est bien illustrée par l'enregistrement de la pression artérielle au cours d'une manoeuvre de Valsalva chez un individu normal (Figure 5.99) [1,6].
- Phase 1: la Pit élevée (expirium forcé à glotte fermée) s’additionne à la Pic ; la PA systémique s'élève. Cette augmentation est suffisante pour qu’une toux rythmique puisse maintenir un débit cardiaque minimal pendant un épisode d’asystolie [2].
- Phase 2 : la diminution du débit droit qui a lieu pendant la phase 1 arrive maintenant à l'OG ; le remplissage gauche diminue ; la PA systémique baisse, la fréquence cardiaque augmente par réflexe.
- Phase 3 : la Pit baisse brusquement (inspirium) ; au faible retour veineux gauche s'ajoute l'effet de l’augmentation du ΔPtm sur le VG ; la PA systémique s'effondre.
- Phase 4 : l'augmentation du débit droit de la phase 3 arrive maintenant au coeur gauche, et s'ajoute à la vasoconstriction périphérique suscitée par l'hypotension de la phase 3 ; la PA systémique augmente, la fréquence baisse par réflexe.
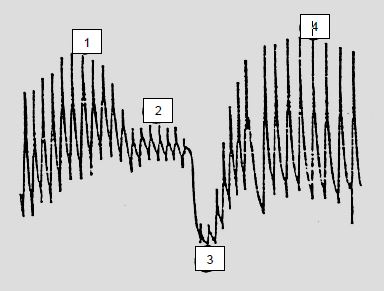
Figure 5.99 : Effet sur la pression artérielle systémique d'une manoeuvre de Valsalva (Pit = 40 mm Hg) tenue pendant 30 secondes chez un individu normal. Les chiffres indiquent les différentes phases [Extrait de: Braunwald E. Heart disease. A textbook of cardiovascular medicine. Philadelphia : W. B. Saunders Co, 1997, 445-70].
Le profil de la pression artériel est très différent lorsque la manœuvre de Valsalva est réalisée chez un patient en insuffisance ventriculaire gauche (Figure 5.100). En cas d’insuffisance systolique sévère, l'hémodynamique reste stable. Les phases 1 et 2 sont normales: l'élévation de la Pit (équivalant à une augmentation de précharge et à une baisse de postcharge pour le VG) est transmise au VG et à la PA systémique, qui améliorent un peu leur performance ; cet accroissement est soudainement perdu lorsque la Pit est relâchée (phase 3). Mais comme le coeur travaille sur la partie horizontale de sa courbe de Starling, la diminution du retour veineux de la phase 2 n'affecte pas son débit; le baroréflexe n'est pas activé; il n'y a pas d'effet rebond en phase 4 [1]. C’est la raison pour laquelle les malades en insuffisance systolique gauche présentent une étonnante stabilité hémodynamique à l’induction. Chez un patient souffrant de cardiomyopathie restrictive sévère (insuffisance diastolique grave), la pression artérielle est au contraire effondrée. Le faible retour veineux au VD n'assure pas une précharge adéquate au VG, qui fonctionne sur une courbe de Starling très redressée ; la moindre baisse de précharge se traduit par une ample chute de volume systolique. D’autre part, la faible compliance du VG ne permet pas une compensation par la fréquence. Les insuffisants diastoliques sont les patients les plus instables à l’induction de l’anesthésie.
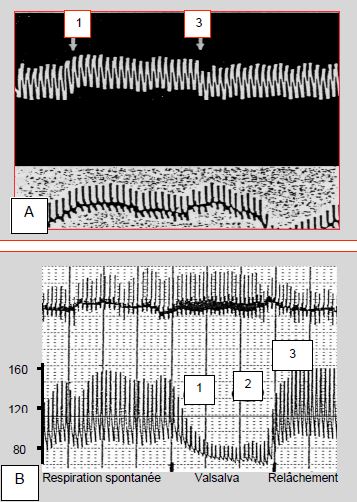
Figure 5.100 : Manœuvre de Valsalva en cas de dysfonction ventriculaire gauche. A : insuffisance systolique sévère ; l'hémodynamique est stable. Les phases 1 et 2 sont normales: l'élévation de la Pit (équivalent à une augmentation de précharge et à une baisse de postcharge pour le VG) est transmise au VG et à la PA systémique ; cet accroissement est soudainement perdu lorsque la Pit est relâchée (phase 3). Mais comme le coeur travaille sur la partie horizontale de sa courbe de Starling, la diminution du retour veineux de la phase 2 n'affecte pas son débit; le baroréflexe n'est pas activé; il n'y a pas d'effet rebond en phase 4 [Extrait de: Braunwald E. Heart disease. Philadelphia : WB. Saunders Co, 1997, 445-70]. B : insuffisance diastolique (patient souffrant de cardiomyopathie restrictive sévère) ; la pression artérielle est effondrée. 1: blocage de la respiration et surpression endothoracique. 2: le faible retour veineux au VD n'assure pas une précharge adéquate au VG. 3: baisse de la pression endothoracique et reprise de la ventilation spontanée. Normalement, le débit du VG devrait augmenter pendant la phase 1 grâce à l'amélioration du retour veineux à l'OG.
Manoeuvre de Müller
La manoeuvre de Müller (inspirium forcé à glotte fermée) démontre la restriction brutale imposée au débit systémique par une dépression endothoracique profonde. Ce phénomène survient dans des situations cliniques telles que les obstructions aiguës des voies aériennes, l’apnée du sommeil, ou le laryngospasme après extubation ; il est également l'une des composantes de l’oedème pulmonaire de haute altitude. Il se caractérise par une augmentation du volume télédiastolique du VD et une accumulation du débit sanguin dans le lit vasculaire pulmonaire. Cette stase pulmonaire entraîne une chute de la précharge du VG. D’autre part, la postcharge de ce dernier augmente considérablement vu l’élévation brusque de la pression transmurale [8]. Au cours d’une dépression endothoracique de 60 mm Hg (Pit = - 60 mmHg), la PAs diminue d’autant (PAs = 120 - 60 = 60 mm Hg) parce que le VG est "décomprimé" par la dépression ambiante. Pour maintenir la PAs, le VG doit développer une Ptm de 60 mmHg plus élevée. S’il ne peut soutenir cette augmentation de travail, l’accumulation liquidienne intrapulmonaire couplée à la défaillance gauche entraîne rapidement un oedème aigu du poumon [10]. Ceci peut survenir chez un individu parfaitement sain qui fait des efforts inspiratoires lors de laryngospasme ou d’apnée obstructive du sommeil, car sa musculature est susceptible de développer des régimes de pression intrathoracique extrême, jusqu’à - 100 mm Hg.
Signe de Kussmaul et pouls paradoxal
Le signe de Kussmaul est une augmentation paradoxale de la POD et de la pression jugulaire pendant un inspirium spontané, liée à une rigidité excessive du VD qui ne peut accomoder l’élévation inspiratoire du retour veineux. Ceci survient en cas de péricardite constrictive ou de dilatation excessive du VD. Le mécanisme est une augmentation de la pression abdominale plus importante que la diminution de la pression intrathoracique lors de la contraction diaphragmatique; ceci a lieu lorsque les conditions de remplissage du VD sont hypervolémiques [12]. Dans la péricardite constrictive, les cavités cardiaques sont isolées des variations de pression intrathoraciques, l'augmentation du retour veineux ne s’écoule pas vers l’OD, puisque sa pression ne baisse pas, mais vers la veine cave supérieure, qui suit les variations de pression intrathoraciques. Donc le remplissage de la VCS augmente, et il apparaît une turgescence jugulaire inspiratoire.
Le pulsus paradoxus est un terme utilisé par Kussmaul en 1873 pour décrire l’absence de pouls radial à l’inspirium chez les patients souffrant de péricardite tuberculeuse, alors que les battements cardiaques auscultés sont réguliers et bien audibles. En réalité, ce phénomène n’a rien de paradoxal. Il n’est que l’amplification des variations respiratoires du débit gauche : en spontanée, la dépression intrathoracique inspiratoire diminue le remplissage du VG et provoque un empiètement du septum interventriculaire dans la cavité gauche. La compression péricardique ne fait qu’accentuer l’interdépendance ventriculaire [9,11,13]. La définition du pouls paradoxal est une chute de plus de 15% (> 12 mm Hg) de la pression artérielle systolique en début d'inspirium non forcé, mais il existe tout un continuum depuis les variations respiratoires normales du pouls (ΔP < 12 mmHg) jusqu’à la situation où le volume systolique devient insuffisant pour ouvrir la valve aortique, lorsque la pression intrathoracique est très inférieure à la pression atmosphérique (inspirium profond, manoeuvre de Müller).
Ce phénomène, caractéristique de la péricardite et de la tamponnade, peut aussi se rencontrer dans le BPCO, la crise d’asthme, l'hypovolémie et la surcharge aiguë du VD (insuffisance mitrale massive, embolie pulmonaire, infarctus droit). Dans ces situations, l’hyperinflation pulmonaire (élévation de postcharge) ou la dépression ventriculaire empêchent le VD d’accomoder l’augmentation du retour veineux en inspirium [4]. Par contre, le pouls paradoxal est absent si le ventricule est protégé de la compression et des variations de pression thoracique par une hypertrophie pariétale importante (HVG ou HVD) ou par une pression diastolique élevée (insuffisance cardiaque congestive, insuffisance aortique, CIA). Etant est lié à la dépression intrathoracique inspiratoire de la respiration spontanée, il s'amenuise ou disparaît en ventilation mécanique ; il n’est donc pas pathognomonique de la tamponnade en ventilation contrôlée.
Ventilation et résistance artérielle pulmonaire
Les résistances dans les artères pulmonaires (RAP) varient en fonction du volume courant (VC) du respirateur. A bas VC, l’hypoventilation induit une hypoxie qui conduit à une vasoconstriction des petites artérioles péri-alvéolaires lorsque la PaO2 locale est < 60 mmHg. Il en résulte une augmentation des RAP et de la postcharge du VD. A haut VC, l’hyperventilation provoque une vasodilatation des petites artérioles, mais l’hyperinflation distend et comprime les gros vaisseaux extra-alvéolaires à cause de la distension des alvéoles, ce qui augmente la résistance dans ces vaisseaux. Toute augmentation ventilatoire du volume aérique pulmonaire (PEEP, par exemple) a pour effet d’agrandir la proportion du poumon en zone I et II de West, donc d’augmenter proportionnellement la postcharge du VD. La courbe des RAP totales a une forme en "U" avec une zone d’équilibre optimal au volume de la capacité résiduelle fonctionnelle (Figure 5.101) [5].
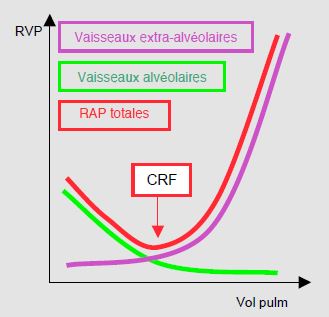
Figure 5.101 : Evolution des résistances dans les vaisseaux pulmonaires (RAP) en fonction du volume courant du respirateur. CRF: capacité résiduelle fonctionnelle. A bas volume courant, l’hypoventilation induit une vasoconstriction des petites artérioles péri-alvéolaires, ce qui augmente les RAP. A haut volume courant, l’hyperventilation provoque une vasodilatation des petites artérioles, mais comprime les gros vaisseaux extra-alvéolaires à cause de la distension des alvéoles, ce qui augmente la résistance dans ces vaisseaux. La courbe des RAP totales (en rouge) a une forme en "U" [5].
| Interactions cardio-respiratoires: effets hémodynamiques |
|
En normovolémie et normocardie, la pression artérielle systolique oscille ≤ 12% avec le cycle respiratoire en IPPV.
- En hypovolémie, les ΔPAsyst et ΔVS sont > 15%
- En insuffisance gauche, les ΔPAsyst et ΔVS sont minimes ou nuls
Manœuvre de Valsalva en situation normale.
- 1 (Pit ↑): ↑ PA systémique (↑ VS du VG)
- 2 (Pit ↑): ↓ PA systémique, tachycardie (transit transpulmonaire du bas débit du VD)
- 3 (inspirium, Pit ↓): ↓↓ PA systémique, tachycardie
- 4 (équilibration): ↑ PA systémique, bradycardie
Manœuvre de Valsalva en insuffisance systolique du VG: faible ↑ PA systémique dans les phases 1 et 2, normalisation en phases 3 et 4; ΔPAsyst peu importants, absence d'hypotension en physe 3.
Manœuvre de Valsalva en insuffisance diastolique du VG: ↓↓ PA systémique en phase 1, 2 et 3.
Les résistances artérielles pulmonaires augmentent en hypoventilation et en hyperinflation; elles sont minimales à la capacité résiduelle fonctionnelle.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2019
Références
- BRAUNWALD E, COLUCCI WS. Clinical aspects of heart failure. In: BRAUNWALD E. Heart disease. A textbook of cardiovascular medicine. Philadelphia : W. B. Saunders Co, 1997, 445-70
- CRILEY JM, BLAUFUSS AH, KISSEL KL. Cough-induced cardiac compression. JAMA 1976; 236:1246-8
- DHAINAUT JF, BRUNET F, MIRA JP, FIEROBE L. Variations phasiques de la pression pleurale et fonction ventriculaire. In: SRLF - Les interactions cardio-pulmonaires. Paris : Arnette, 1994, 71-83
- FEIHL F, BROCCARD AF. Interactions between respiration and systemic hemodynamics. Part II: practical implications in critical care. Intensive Care Med 2009; 35:198-205
- FISCHER LG, VAN AH, BURKLE H. Management of pulmonary hypertension: physiological and pharmacological considerations for anesthesiologists. Anesth Analg 2003; 96:1603-16
- GIVERTS MM, COLUCCI WS, BRAUNWALD E. Clinical aspects of heart failure. In:. ZIPES DP, BRAUNWALD's Heart Disease, 7th edition. Philadephia : Elsevier - WB Saunders Co, 2005, 539-68
- MICHARD F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103:419-28
- OH JK, HATLE LK, SEWARD JB, et al. Diagnostic role of Doppler echocardiography in constrictive pericarditis. J Am Coll Cardiol 1994; 23:154-62
- SAGAWA K, MAUGHAN L, SUGA H, et al. Cardiac contraction and the pressure-volume relationship. New York, Oxford University Press, 1988
- STALCUP SA, MELLINS RB. Mechanical forces producing pulmonary edema in acute asthma. N Engl J Med 1977; 297:592-6
- SWAMI A, SPODICK DH. Pulsus paradoxus in cardiac tamponade: A pathophysiological continuum. Clin Cardiol 2003; 26:215-7
- TAKATA M, BELOUCIF S, SHIMADA M, ROBOTHAM JL. Superior and inferior vena caval flows during respiration: pathogenesis of Kussmaul's sign. Am J Physiol 1992; 262:H763-H770
- VISTISEN ST, ENEVOLDSEN JN, GREISEN J, JUHL-OLSEN P. What the amaesthesiologist needs to know about heart-lung interactions. Best Pract Res Clin Anaesthesiol 2019; 33:165-77
- WU LA, NISHIMURA RA. Pulsus paradoxus. N Engl J Med 2003; 349:666
