Il est aisé de diagnostiquer une insuffisance mitrale à l’ETO, car le capteur est idéalement placé à mi-œsophage pour observer cette valve et pour se situer dans l'axe du jet de régurgitation, mais les deux points essentiels de l’examen sont plus délicats:
- Déterminer le mécanisme de l’IM;
- Quantifier l’insuffisance en synthétisant une série d’éléments.
La pertinence de l'ETO pour l'évaluation de la valve mitrale est bien illustrée par son impact en clinique. Dans 9% des cas, l’examen pré-CEC change le diagnostic préopératoire et modifie la stratégie chirurgicale [4,35]. La valeur prédictive positive de l’ETO concernant le mécanisme de l’IM est de 90-96% [11,15] ; elle monte à 98% avec l’imagerie tri-dimensionnelle [11].
Vues ETO 2D de la valve mitrale
La valve mitrale est orientée à 60° par rapport au plan frontal du corps. Ses plans orthogonaux sont à 60° (vue bicommissurale) et 140° (vue long-axe) par rapport à ceux de l’organisme, qui sont eux à 0° (vue 4-cavités) et 90° (vue 2-cavités) (Figure 26.9). Le diamètre de l’anneau mitral se mesure en diastole exclusivement dans ces deux plans orthogonaux. Le feuillet postérieur, qui est en forme de croissant, est divisé en 3 festons (P1 antérieur, P2 moyen et P3 postérieur). Le feuillet antérieur est divisé en 3 parties (A1, A2 et A3) de manière analogue, bien que cela ne corresponde à aucune structure anatomique, puisque ce feuillet est un trapèze d'un seul tenant. Le feuillet antérieur est implanté sur le pont fibreux qui relie les deux trigones et que jouxte l'anneau aortique; sa base est en relation avec les cuspides non-coronaires et coronaire gauche de la valve aortique.
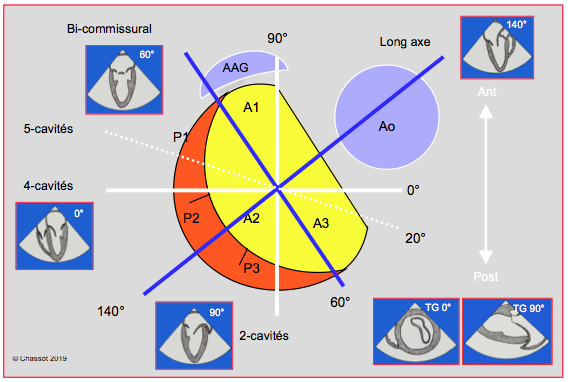
Figure 26.9 : Représentation schématique des plans de coupe de la valve mitrale dans une vue prise depuis l’OG. Sa base et sa commissure font un angle d’environ 60° avec l’horizontale. Les plans orthogonaux du corps (0° et 90°, traits blancs) ne le sont pas pour la mitrale, dont les plans orthogonaux sont à 60° et 140° (traits bleus). Outre ces 4 plans de coupe, l’examen de la valve mitrale comprend encore les vues transgastriques à 0° (court-axe basal) et à 90° (long-axe du VG).
Dans sa représentation planaire, l’anneau mitral a l’allure d’une lettre "D" inversée; il existe donc deux diamètres différents de la valve mitrale, l'un dans le plan bicommissural (60°) et l'autre dans le plan antéro-postérieur (140°); le premier est normalement plus grand que le second (32-40 mm versus 26-35 mm), mais ils tendent à s'égaliser lorsque l'anneau se dilate. Dans sa représentation spatiale, l’anneau mitral présente une forme en selle (paraboloïde hyperbolique) ; ses points les plus élevés sont antérieur (au voisinage de la valve aortique) et postérieur (Figure 26.10). Cette forme s’accentue en systole (élévation 1 cm) lorsque l’anneau se rétrécit de 25%. En vue 4-cavités, on coupe l’anneau dans sa portion basse, le point de coaptation apparaît au niveau du plan de l’anneau, alors qu’en vue long-axe MO, on le coupe dans sa portion haute, et le point de coaptation est en dessous du plan de l’anneau. Ces notions sont importantes pour la définition du prolapsus mitral qui doit être déterminé en vue long-axe (120-140°). En se dilatant, l’anneau mitral s’arrondit et devient circulaire ; il perd sa forme en selle et s’aplatit. Le tiers postérieur de l’anneau fibreux est rudimentaire et peut facilement se distendre parce qu’il est essentiellement musculaire. La partie fixe de l’anneau se situe antérieurement, à la jonction mitro-aortique (trigone fibreux) ; en cas de restriction par un anneau prothétique, c’est la partie postérieure qui est ramenée vers l’avant.
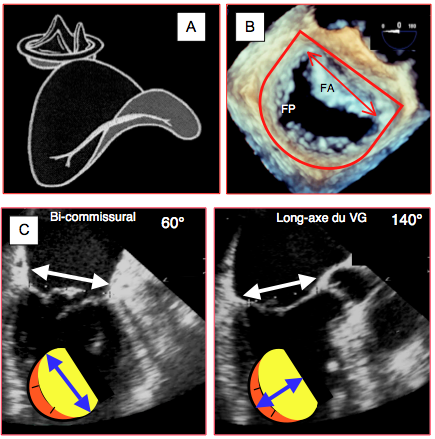
Figure 26.10 : Forme de l'anneau mitral. A: forme en selle de l'anneau, avec les points les plus élevées situés antérieurement (valve aortique) et postérieurement. B: en court-axe, l'anneau présente une forme en D inversée, la partie rectiligne étant accolée au pont fibreux entre les deux trigones et à la valve aortique. La double flèche rouge mesure la distance entre les deux commissures sur cette reconstruction 3D "en face" de la valve mitrale. C: L'asymétrie de l'anneau implique la présence de deux diamètres différents: l'un dans le plan bicommissural 60° (parallèle à la partie rectiligne) et l'autre dans le plan long-axe 140° (perpendiculaire à la partie rectiligne). Dans la figure, le premier mesure 4.2 cm et de second 3.4 cm (valeurs normales supérieures).
Les feuillets mitraux, les commissures, l’anneau, l’appareil sous-valvulaire et les jets d’insuffisance mitrale sont passés en revue dans tous les plans de coupe mi-oesophagiens et transgastriques consacrés à la valve mitrale.
Vues ETO 2D de la valve mitrale
La valve mitrale est orientée à 60° par rapport au plan frontal du corps. Ses plans orthogonaux sont à 60° (vue bicommissurale) et 140° (vue long-axe) par rapport à ceux de l’organisme, qui sont eux à 0° (vue 4-cavités) et 90° (vue 2-cavités) (Figure 26.9). Le diamètre de l’anneau mitral se mesure en diastole exclusivement dans ces deux plans orthogonaux. Le feuillet postérieur, qui est en forme de croissant, est divisé en 3 festons (P1 antérieur, P2 moyen et P3 postérieur). Le feuillet antérieur est divisé en 3 parties (A1, A2 et A3) de manière analogue, bien que cela ne corresponde à aucune structure anatomique, puisque ce feuillet est un trapèze d'un seul tenant. Le feuillet antérieur est implanté sur le pont fibreux qui relie les deux trigones et que jouxte l'anneau aortique; sa base est en relation avec les cuspides non-coronaires et coronaire gauche de la valve aortique.

Figure 26.9 : Représentation schématique des plans de coupe de la valve mitrale dans une vue prise depuis l’OG. Sa base et sa commissure font un angle d’environ 60° avec l’horizontale. Les plans orthogonaux du corps (0° et 90°, traits blancs) ne le sont pas pour la mitrale, dont les plans orthogonaux sont à 60° et 140° (traits bleus). Outre ces 4 plans de coupe, l’examen de la valve mitrale comprend encore les vues transgastriques à 0° (court-axe basal) et à 90° (long-axe du VG).
Dans sa représentation planaire, l’anneau mitral a l’allure d’une lettre "D" inversée; il existe donc deux diamètres différents de la valve mitrale, l'un dans le plan bicommissural (60°) et l'autre dans le plan antéro-postérieur (140°); le premier est normalement plus grand que le second (32-40 mm versus 26-35 mm), mais ils tendent à s'égaliser lorsque l'anneau se dilate. Dans sa représentation spatiale, l’anneau mitral présente une forme en selle (paraboloïde hyperbolique) ; ses points les plus élevés sont antérieur (au voisinage de la valve aortique) et postérieur (Figure 26.10). Cette forme s’accentue en systole (élévation 1 cm) lorsque l’anneau se rétrécit de 25%. En vue 4-cavités, on coupe l’anneau dans sa portion basse, le point de coaptation apparaît au niveau du plan de l’anneau, alors qu’en vue long-axe MO, on le coupe dans sa portion haute, et le point de coaptation est en dessous du plan de l’anneau. Ces notions sont importantes pour la définition du prolapsus mitral qui doit être déterminé en vue long-axe (120-140°). En se dilatant, l’anneau mitral s’arrondit et devient circulaire ; il perd sa forme en selle et s’aplatit. Le tiers postérieur de l’anneau fibreux est rudimentaire et peut facilement se distendre parce qu’il est essentiellement musculaire. La partie fixe de l’anneau se situe antérieurement, à la jonction mitro-aortique (trigone fibreux) ; en cas de restriction par un anneau prothétique, c’est la partie postérieure qui est ramenée vers l’avant.

Figure 26.10 : Forme de l'anneau mitral. A: forme en selle de l'anneau, avec les points les plus élevées situés antérieurement (valve aortique) et postérieurement. B: en court-axe, l'anneau présente une forme en D inversée, la partie rectiligne étant accolée au pont fibreux entre les deux trigones et à la valve aortique. La double flèche rouge mesure la distance entre les deux commissures sur cette reconstruction 3D "en face" de la valve mitrale. C: L'asymétrie de l'anneau implique la présence de deux diamètres différents: l'un dans le plan bicommissural 60° (parallèle à la partie rectiligne) et l'autre dans le plan long-axe 140° (perpendiculaire à la partie rectiligne). Dans la figure, le premier mesure 4.2 cm et de second 3.4 cm (valeurs normales supérieures).
Les feuillets mitraux, les commissures, l’anneau, l’appareil sous-valvulaire et les jets d’insuffisance mitrale sont passés en revue dans tous les plans de coupe mi-oesophagiens et transgastriques consacrés à la valve mitrale.
- Vue 5-cavités (Figure 26.11A) : A1 et P1, vue perpendiculaire à la commissure antérieure (C1), évaluation de sa coaptation.
- Vue 4-cavités mi-œsophage (Figure 26.11B) : vue oblique de la valve mitrale; A2 et P1 ou A3 et P2 selon la profondeur de la sonde. En position basse, le plan est parallèle à la commissure postérieure (C2) (festons A3 et P3) et ne permet pas de l’évaluer.
- Vue bicommissurale 60° (Figure 26.12) : vue orthogonale de la valve, avec visualisation de P1, P3 et A2, du grand diamètre de l’anneau (3.2-4.0 cm) et des 2 commissures; P2 est derrière A2, et n'est visible que s'il prolabe. Une rotation anti-horaire de la sonde met en évidence tout le feuillet postérieur (P1, P2 et P3). Une rotation horaire de la sonde jusqu’à disparition des commissures montre la base du feuillet antérieur (VM base 60); la distance intertrigonale, définissant la taille d’un anneau mitral prothétique, est égale à 0.8 fois la base du feuillet antérieur. La mesure est cependant plus précise sur une reconstruction 3D (voir Figure 26.10A).
- Vue 2-cavités 90° (Figure 26.13) : vue de A1-A2 et P2-P3 et du pilier postérieur. Le pivotement horaire de la sonde place le plan de coupe en travers de la commissure postérieure et permet de l'observer adéquatement puisqu'il lui est perpendiculaire.
- Vue long axe 140° (Figure 26.14) : axe orthogonal et petit diamètre (2.8-3.2 cm) ; vue de A2 et P2 ; utiliser cette vue pour mesurer la longueur du feuillet antérieur dans les plasties, pour définir le recul du point de coaptation dans le prolapsus et pour identifier les pathologies de la CCVG.
- Vue transgastrique basale (0°) (Figure 26.15A): feuillet postérieur (le plus proche) et antérieur (le plus éloigné), mais vue inconstante ; on ne voit souvent que la partie distale des cordages et la zone commissurale des feuillets. La commissure la plus proche du capteur est la commissure postérieure (C2). Cette vue est très utile pour localiser l'origine d'une IM sur la ligne de coaptation (coupe de la zone d'accélération côté ventriculaire).
- Vue TG 2-cavités (90°) (Figure 26.15B): vue de A1-2 et P2-3, piliers postérieur (le plus proche) et antérieur (le plus éloigné); excellente vue sur les cordages qui apparaissent plus épais qu’en vues mi-œsophage car ils sont ici perpendiculaires à l’axe des ultrasons.
- Vue TG long-axe (120°) (Figure 26.15C): vue de A2 et P2. Cette vue n'offre pas d'avantage particulier pour l'analyse de la valve mitrale.
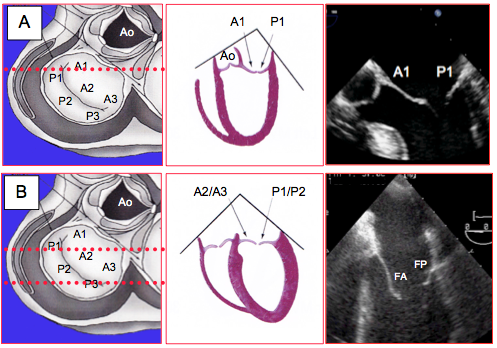
Figure 26.11: Vues mi-œsophage 0° de la valve mitrale. A : en position haute dans l’œsophage (vue 5-cavités), la vue coupe perpendiculairement la commissure antérieure et A1 – P1 ; vue adéquate pour diagnostiquer un prolapsus de la commissure antérieure. B : vues 4-cavités mi-oesophage et bas-oesophage ; coupe oblique de la valve : P1-A2 et P2-A3. La coupe étant parallèle à la commissure postérieure, elle ne permet pas de la visualiser correctement.
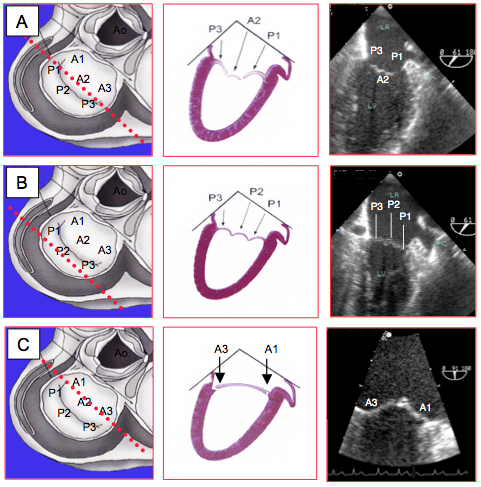
Figure 26.12 : Vues bicommissurales 60° de la valve mitrale. A : vues de P1 à droite, A2 au centre et P3 à gauche; grand diamètre de l’anneau. B : en pivotant l’axe de la sonde dans le sens anti-horaire, le plan de coupe tourne vers l’arrière, et met en évidence les 3 festons du feuillet postérieur. C : en pivotant l’axe de la sonde dans le sens horaire, le plan de coupe tourne vers l’avant ; si l’on stoppe la rotation à la disparition des commissures, on voit la largeur du feuillet antérieur, qui correspond à sa base.
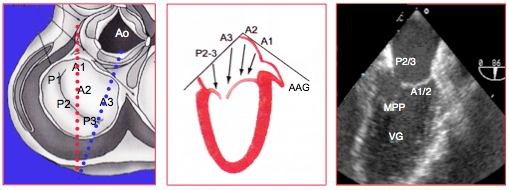
Figure 26.13 : Vues 2-cavités 90° de la valve mitrale; coupe oblique avec visualisation de A1-A2 et P2-P3 (en rouge). Un léger pivotement horaire de la sonde place le plan de coupe perpendiculairement à la commissure postérieure (en bleu) et permet d'en analyser le fonctionnement. MPP: muscle papillaire postérieur. AAG: appendice auriculaire gauche, en regard de la commissure antérieure.
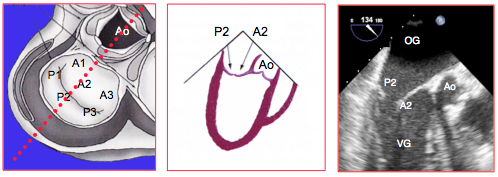
Figure 26.14 : Vues long-axe 120-140° de la valve mitrale; vue orthogonale de la valve avec visualisation de A2-P2 et de la plus grande longueur des 2 feuillets ; petit diamètre de l’anneau. Cette vue coupe les points les plus hauts de l’anneau mitral et convient au diagnostic du prolapsus.
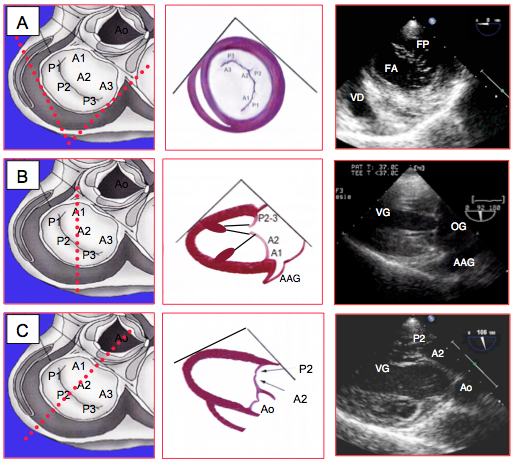
Figure 26.15 : Vues transgastriques de la valve mitrale. A : vue court axe 0°, irréalisable chez certains patients. B : vue 2-cavités 90°, avec P2-3 et A1-2; l’appendice auriculaire gauche est en regard de la commissure antérieure. C : vue long axe 120° avec A2 et P2. Les vues transgastriques offrent une vision optimale de l’appareil sous-valvulaire, mais n'offrent pas d'avantage pour l'examen des feuillets.
Le chirurgien a besoin de plusieurs mesures avant de procéder à un remplacement ou à une plastie mitrale (données moyennes normales pour un adulte) (Tableau 26.1) [46]. Les chances de réussite d'une valvuoplastie sont élevées lorsque ces mesures sont dans certaines limites.
- Dimensions de l’OG : D < 4.5 cm, S ≤ 20 cm2, V ≤ 30 mL/m2
- Diamètre de l’anneau mitral (60° et 140°) : ≤ 4.0 cm (60°) et ≤ 3.5 cm (140°) (diastole)
- Longueur feuillet antérieur (140°) : 2.2 – 3.0 cm
- Rapport feuillet antérieur / anneau (140°) : > 2/3 (> 0.65)
- Base du feuillet antérieur (60°) : 2.5 – 3.5 cm
- Distance intercommissurale (60°) : 3.0 – 3.5 cm
La valve mitrale ne peut être étanche que si les deux feuillets sont appliqués l’un contre l’autre sur une certaine surface par la pression intraventriculaire. En vue 2D, cette surface correspond à une hauteur de 5-10 mm (Figure 26.16). Le rapport entre cette hauteur et la longueur totale du feuillet antérieur est > 0.2 [43]. Si les feuillets ne font que se toucher, la valve ne peut pas être étanche.
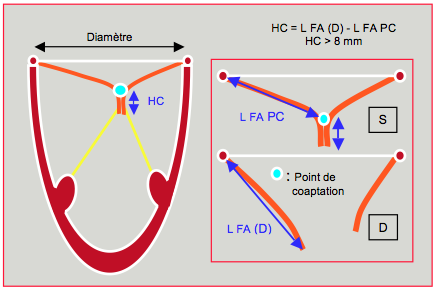
Figure 26.16 : La hauteur de la zone de coaptation (HC) se mesure directement à l’écran ou se calcule par la différence entre la longueur (L) totale du feuillet antérieur (FA) en diastole (D) et la longueur depuis l’anneau mitral jusqu’au point de coaptation (PC) en systole (S). Elle est normalement de 5-10 mm. Le rapport entre la hauteur de coaptation et le diamètre de l’anneau mitral est > 0.2 [43].

Figure 26.16 : La hauteur de la zone de coaptation (HC) se mesure directement à l’écran ou se calcule par la différence entre la longueur (L) totale du feuillet antérieur (FA) en diastole (D) et la longueur depuis l’anneau mitral jusqu’au point de coaptation (PC) en systole (S). Elle est normalement de 5-10 mm. Le rapport entre la hauteur de coaptation et le diamètre de l’anneau mitral est > 0.2 [43].

| Examen 2D de la valve mitrale |
| Vue 5 cavités 0° : A1, P1, commissure antérieure Vue bicommissurale 60° : P1, A2, P3, commissures antérieure et postérieure, grand diamètre de l’anneau; rotation horaire de la sonde : base du feuillet antérieur, distance intertrigonale; rotation anti-horaire : P1, P2 et P3 Vue long axe 120-140° : A2, P2, petit diamètre de l’anneau, longueur feuillet antérieur, rapport feuillet antérieur/anneau Vues 4-cavités 0° et 2-cavités 90° mi-oesophage : non orthogonales à la valve mitrale Vue transgastrique 0° : feuillets antérieur et postérieur, localisation du PISA Vues transgastriques 90 – 120° : appareil sous-valvulaire Hauteur de coaptation normale : moy 8 mm Dans chaque plan, examen bidimensionnel et Doppler couleur |
Images bidimensionnelles de l'IM
A l'échocardigraphie, les affections dégénératives de la valve (IM primaire) présentent plusieurs types de lésions (Vidéos et Figure 26.17) [16].
- Anomalie morphologique: les feuillets sont épaissis, redondants, bosselés, flottants; leur longueur est excessive (floppy valve).
- Ballonisation (billowing): l'excès de tissu valvulaire donne une image de dôme bombant dans l'OG en systole, mais le point de coaptation est maintenu à sa place normale, en-dessous du plan de l'anneau mitral.
- Prolapsus: le point de coaptation est situé > 2 mm en arrière du plan de l'anneau mitral, dans l'OG (mesuré en vue long-axe 120-140°), mais l'extrémité du feuillet pointe vers le ventricule comme normalement. L'image 2D permet la mesure de la distance séparant les 2 feuillets en systole et celle de la largeur du dôme réalisé par le prolapsus.
- Bascule de feuillet (flail leaflet): l'éversion de l'extrémité d'un feuillet fait que celle-ci pointe vers l'oreillette ; elle est en général liée à une élongation ou à une rupture de cordage. Elle est presque toujours associée à une IM sévère.
- Calcification de l'anneau mitral débordant sur la base des feuillets et bloquant la constriction physiologique en systole.
- Fusion commissurale: dans le RAA, les commissures sont fusionnées, les feuillets sont fibrosés et rigides; l'IM est due à leur manque de mobilité qui les rend restrictifs en systole et en diastole; elle est accompagnée d'une composante de sténose.
- Perforation de feuillet, abcès ou végétations en cas d'endocardite.
Vidéo: dégénérescence myxoïde avec prolapsus de P2 et rupture de cordage (vue 2-cavités 90°); les feuillets sont ballonisés, redondants et présentent des zones dégénérées épaissies (A2).
Vidéo: ballonisation de A2 (vue long-axe 120°); la partie distale du feuillet antérieur est bombée dans l'OG mais le point de coaptation est au plan de l'anneau mitral.
Vidéo: ballonisation de A2 en vue bicommissurale à travers le corps du feuillet antérieur.
Vidéo: recul du point de coaptation en arrière du plan de l'anneau mitral; les deux feuillets ne coaptent pas en systole.
Vidéo: prolapsus de P2 qui apparaît en arrière de A2 en systole (vue bicommissurale 60°).
Vidéo: prolapsus de P2 avec dégénérescence myxoïde et rupture de cordage (vue 4-cavités 0°).
Vidéo: prolapsus de P2 avec rupture de cordage sur un feuillet postérieur démesuré et redondant; lésions dégénératives sur les deux feuillets (vue long-axe 130°).
Vidéo: calcification massive du corps de P2 qui est basculé en arrière du plan de coaptation et prolabe en systole; fuite mitrale excentrique en direction du septum interauriculaire (vue long-axe 120°).
Vidéo: sténose mitrale avec affrontement inadéquat des feuillets en systole et léger bascule du feuillet antérieur (vue long-axe 140°).
Vidéo: abcès perforé à la base du feuillet antérieur (vue 2-cavités 90°).
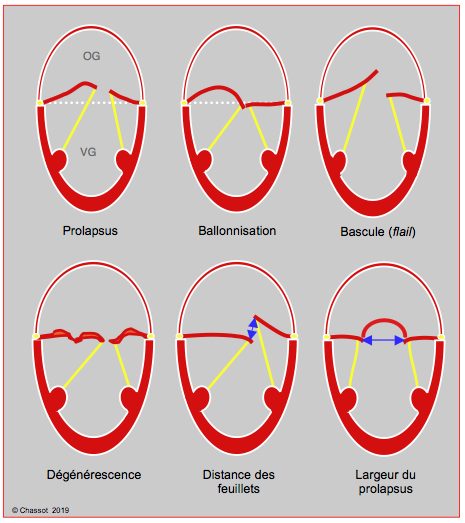
Figure 26.17 : Différentiation des lésions dégénératives. Dans le prolapsus; le point de coaptation est situé ≥ 2 mm en arrière du plan de l'anneau mitral, au sein de l'OG. Dans la ballonisation; le point de coaptation est normalement situé, mais l’excès de tissu valvulaire induit un bombement systolique du corps d’un feuillet. Lors de basculement, tout ou partie d’un feuillet est éversé dans l’OG, la plupart du temps avec une rupture de cordage(s). La dégénérescence est caractérisée par des feuillets remaniés, épaissis, bosselés, avec un excès de tissu (dégénérescence myxoïde, maladie de Barlow). L'image 2D permet de mesurer la distance séparant les feuillets en systole, qui représente l'importance de l'IM, et la largeur du prolapsus, en l'occurrence P2 en vue bicommissurale (60°).
Dans les IM secondaires, les feuillets sont normaux et la pathologie est située dans le ventricule gauche qui a subi un remodelage important. On rencontre essentiellement deux cas de figure: l'ischémie myocardique avec anomalies de la cinétique segmentaire et la dilatation ventriculaire. Une dilatation massive de l'OG entrainant une distension de l'anneau mitral est une troisième possibilité. L'image échocardiographique est caractéristique (Figure 26.18).
- La dilatation de l'anneau empêche une coaptation normale et laisse un orifice persistant en systole (IM type I); ce mécanisme cause en général une IM modérée.
- Les feuillets sont de morphologie normale, mais ils ne se rejoignent pas en systole; ils sont maintenus en-dessous du plan de l'anneau mitral par la traction excessive des cordages due à la dilatation ventriculaire (IM restrictive symétrique, IM type IIIb) ou à l'akinésie d'une paroi (IM restrictive asymétrique, IM type IIIa). Ces mécanismes peuvent causer des IM sévères.
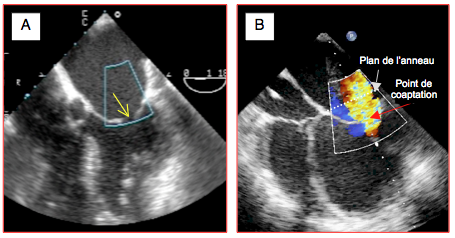
Figure 26.18: Insuffisance mitrale restrictive sur dysfonction du VG. A: en systole, les feuillets mitraux ne se rejoignent pas et laissent un orifice de régurgitation visible à l'œil nu (flèche). B: Le point de coaptation des feuillets mitraux en systole est retenu en-dessous du plan de l'anneau mitral par la dilatation du VG, occasionnant une fuite centrale dans l'OG.
L’insuffisance mitrale (IM) sévère chronique se caractérise par la non-coaptation des feuillets mitraux (distance libre entre les feuillets > 0.5 cm) et par un remodelage des cavités gauches.
- Dilatation de l’anneau;
- Dilatation de l’OG;
- Bombement systolique du septum interauriculaire dans l’OD;
- Hypertrophie dilatative du VG (Dtd > 4.0 cm/m2).
- La valve mitrale fuit dès que la pression intraventriculaire dépasse la POG (5-8 mmHg en protosystole) ; il n’y a pratiquement pas de phase de contraction isovolumétrique, et une partie du volume systolique s’échappe dans l’OG où la pression est basse. Cette baisse de postcharge effective améliore artificiellement la performance systolique du VG.
- Le volume régurgité dans l’OG revient dans le VG pendant la diastole suivante ; cette augmentation de précharge permet au ventricule de se positionner optimalement sur sa courbe de Starling.
- L’hypertrophie dilatative agrandit et arrondit le VG, qui devient plus sphérique ; les approximations géométriques utilisées pour le calcul de la FE ne sont plus applicables.
Insuffisance mitrale fonctionnelle (IM Type I)
Comme les feuillets sont normaux, l’IM est due à une dilatation de l’anneau mitral (ischémie basale, dilatation du VG, dilatation majeure de l'OG), à des calcifications de l’anneau (MAC : mitral annular calcification) qui l’empêchent de se rétrécir normalement en systole, à une perforation endocarditique, ou à une fissure (cleft); celle-ci se différencie du sillon qui sépare les festons postérieurs par une profondeur de > 50% de la hauteur du feuillet. Le jet de l’IM est central et de symétrie circulaire (voir Figure 26.8A) (Vidéos).
Vidéo: fente (cleft) dans le feuillet antérieur en reconstruction 3D vue depuis l'OG. Cette lésion est difficile à mettre en évidence en imagerie bidimensionnelle.
Vidéo: insuffisance mitrale centrale modérée; le jet est symétrique et atteint la paroi postérieure de l'OG.
Prolapsus mitral (IM Type II)
Le prolapsus est un déplacement d’une portion d’un ou des deux feuillets dans l’OG en systole. Il concerne le plus souvent le feston moyen du feuillet postérieur (P2, 57% des cas) et la partie centrale du feuillet antérieur (A2, 33% des cas); la partie postérieure du feuillet postérieur est touchée dans 28% des cas [26]. L’amplitude du mouvement d’un ou des deux feuillets est augmentée (voir Figure 26.8B et 26.8C). Le prolapsus peut prendre plusieurs formes en échocardiographie (Vidéos ci-dessous et vidéos précédentes).
- Recul de la zone de coaptation de plus de 2 mm en arrière du plan de l’anneau mitral; cependant, l'extrémité du feuillet pointe typiquement vers le VG. A cause de la forme en selle de l'anneau mitral, cette distance doit se mesurer en vue long axe mi-oesophage 120-140° de manière à couper l’anneau dans ses points les plus élevés. En vue 4-cavités, on le couperait dans sa portion basse, et le point de coaptation apparaîtrait au niveau du plan de l’anneau, ce qui conduirait à une surestimation des prolapsus (Figure 26.19, voir aussi Figure 11.3) [2,19].
- Non affrontement des feuillets, laissant un espace commissural libre en systole.
- Flottement d’un feuillet dans l’OG par excès de tissu (floppy valve). La longueur du feuillet postérieur mesure > 2 cm.
- Bascule d'un feuillet dans l’OG en systole (flail leaflet); typiquement, l'extrémité du feuillet est retournée et pointe vers l'OG (Figure 26.20); le feston le plus souvent atteint est P2 [8].
- Rupture de cordage(s) qui flotte(nt) dans l’OG à l’extrémité du feuillet; rupture totale ou partielle de muscle papillaire; les cordages rompus sont souvent remaniés et épaissis.
- Remaniement des feuillets dans lesquels apparaissent des zones épaissies, peu échodenses correspondant à la dégénérescence myxoïde.
- Epaississement de l’appareil sous-valvulaire.
- La ballonisation est une protrusion de > 2 mm du corps valvulaire en systole dû à l’excès de tissu caractéristique de la maladie de Barlow ; sans recul du point de coaptation, elle n’induit pas d’IM (Figure 26.21).
Vidéo: prolapsus de A2 et de P2 (vue long-axe 120°).
Vidéo: prolapsus de P2 basculé dans l'OG (vue 4-cavités 0°).
Vidéo: lésions dégénératives des deux feuillets avec prolapsus de A2 et rupture de cordage.
Vidéo: prolapsus de P2 avec dégénérescence du feuillet postérieur qui est redondant; un long cordage flotte à l'extrémité du prolapsus.
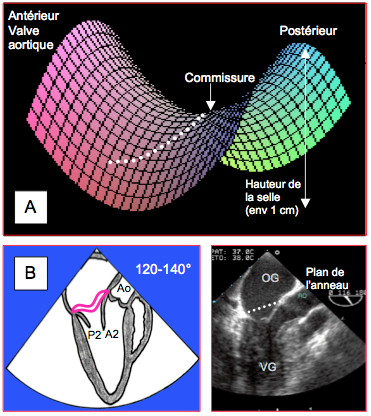
Figure 26.19 : Forme en selle de l’anneau mitral. A : représentation schématique de la forme de l’anneau ; les points les plus élevés sont antérieur (trigone fibreux commun avec la valve aortique) et postérieur, les points les plus bas sont situés en regard des commissures. B : vue mi-oesophagienne long axe à 120-140° ; elle coupe les points les plus hauts de l’anneau mitral. Le diagnostic de prolapsus (recul de > 2 mm du point de coaptation en arrière du plan de l’anneau) doit se poser dans ce plan, car le point de coaptation y est normalement du côté ventriculaire de l’anneau.
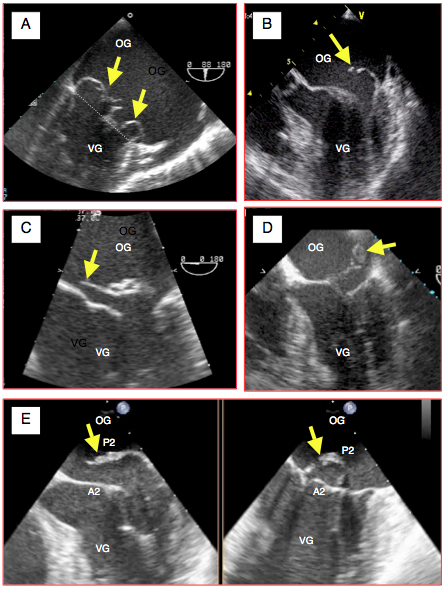
Figure 26.20 : Images ETO d’insuffisance mitrale sur dégénérescence myxoïde. A : excès de tissu avec ballonisation, épaissisement localisé et prolapsus des deux feuillets ; les flèches indiquent le déplacement de l’extrémité des feuillets en arrière du plan de l’anneau mitral (trait pointillé). B : prolapsus isolé de P2. C : prolapsus de P2 avec rupture de cordage (indiqué par la flèche). D : rupture complète de muscle papillaire avec fragment de pilier attaché à l’extrémité du feuillet antérieur (flèche), basculé dans l'OG en systole; l'IM est massive. E: vues orthogonales simultanées (X-plane) d'un prolapsus de P2 (vue 4-cavités et vue bicommissurale)
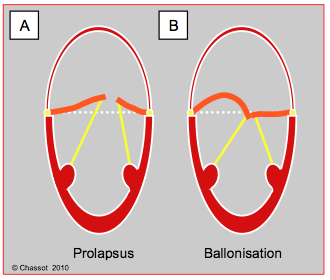
Figure 26.21 : Différentiation du prolapsus (A) et de la ballonisation (B). Dans le deuxième cas, le point de coaptation est normalement situé mais l’excès de tissu valvulaire induit un bombement systolique du corps d’un feuillet (≥ 2 mm).
L'aspect du jet intra-auriculaire de l’IM donne une clef sur le mécanisme en jeu dans le prolapsus.
- Central dans le cas d'un simple recul du point de coaptation;
- Excentrique et oblique dans l'OG dans le cas d'un basculement ou d'une rupture de cordage.
Vidéo: insuffisance mitrale excentrique sévère sur prolapsus du feuillet postérieur; elle est orientée vers le septum interauriculaire.
Vidéo: insuffisance mitrale excentrique sévère sur prolapsus du feuillet antérieur; elle est dirigée vers la paroi latérale de l'OG.
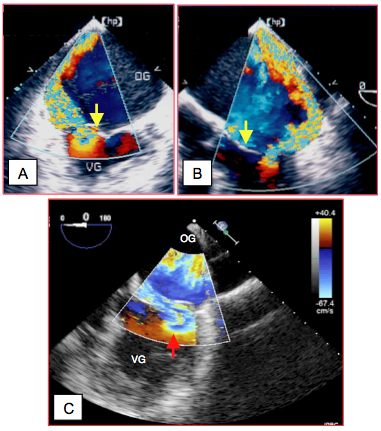
Figure 26.22 : Insuffisance mitrale excentrique sur prolapsus en vues 4-cavités 0°. A : prolapsus du feuillet postérieur ; le jet est dirigé antérieurement vers le septum interauriculaire. B : prolapsus du feuillet antérieur ; le jet est dirigé postérieurement vers la paroi auriculaire postéro-latérale. La flèche pointe le feuillet concerné. C : la zone d'accélération concentrique côté ventriculaire (PISA, flèche rouge) est souvent déformé dans les IM excentriques et ne se prête pas à la quantification.
Lors de l'examen peropératoire, l’analyse systématique des festons, des commissures, de l’appareil sous-valvulaire et de la morphologie du flux couleur dans les différents plans de coupe doit permettre de définir la faisabilité d’une plastie mitrale. On recherche particulièrement plusieurs points (Vidéos).
- Le(s) feston(s) concerné)s) par le prolapsus.
- L’étendue de la lésion à d’autres festons.
- Le(s) cordages(s) rompus flottant à l’extrémité du prolapsus ; les cordages s’insèrent à l’extrémité du feuillet (cordages de 1er ordre) ou sur sa face ventriculaire (cordages de 2ème et 3ème ordre), à la différences des végétations qui apparaissent sur la face auriculaire de la valve.
- Les zones de remaniement et de dégénérescence myxoïde de chaque feuillet.
- L’état des commissures ; le basculement d’une commissure avec capotage de la partie antérieure de A1 et P1 ou postérieure de A3 et P3 en vue bicommissurale 60° signe en général une lésion sous-valvulaire: ischémie ou rupture partielle d’un muscle papillaire, confirmée en vue transgastrique (Figure 26.23).
- La rupture complète d’un muscle papillaire : un fragment musculaire flotte à l’extrémité de cordages et fait un va-et-vient entre le VG et l’OG (Figure 26.24); la commissure correspondante est complètement basculée. Comme la rupture est brusque et l’IM massive, le patient est en choc cardiogène et souvent en OAP.
- La localisation de la (ou des) fuite(s) en recherchant l’emplacement exact du jet à la sortie de la valve (vena contracta) et de la zone d'accélération hémisphérique sur la face ventriculaire (PISA, proximal isovelocity surface area) dans les différentes vues (voir Quantification de l’insuffisance mitrale). La zone de fuite est définie par le passage du flux couleur au travers de la valve et non par la présence de zones tourbillonnaires dans le corps de l’OG ; celles-ci n’indiquent que la direction de la fuite, mais non son origine.
Vidéo: prolapsus de la commissure antérieure sur lésion du muscle papillaire antérieur (vue bicommissurale).
Vidéo: prolapsus de la commissure postérieure sur rupture partielle du muscle papillaire postérieur (vue bicommissurale).
Vidéo: vue court-axe transgastrique montrant la rupture partielle du muscle papillaire postérieur dans le cas de la vidéo précédente.
Vidéo: rupture totale du muscle papillaire antérieur que l'on voit flotter à l'extrémité des feuillets, faisant des aller-retours entre le VG et l'OG. L'IM est massive et non-compatible avec la survie au-delà de quelques heures.
Vidéo: zone d'accélération concentrique (PISA) côté ventriculaire dans une IM excentrique sur prolapsus du feuillet postérieur.
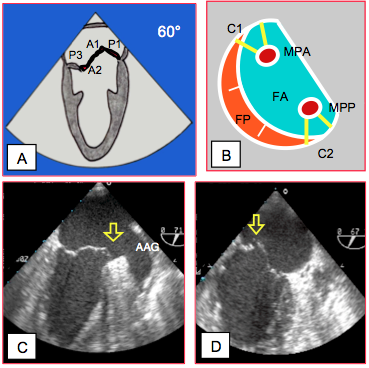
Figure 26.23 : Ischémie ou rupture partielle d'un pilier. A : en vue bicommissurale, toute la commissure antérieure est basculée (prolapsus de A1 et P1). B : ceci s’explique par le fait que les piliers sont anatomiquement axés sur les commissures et envoient des cordages aux 2 feuillets. MPA : muscle papillaire antérieur. MPP : muscle papillaire postérieur. FA : feuillet antérieur. FP : feuillet postérieur. C : prolapsus de la commissure antérieure sur ischémie de la paroi antérieure du VG. D : prolapsus de la commissure postérieure sur rupture partielle du pilier postérieur.
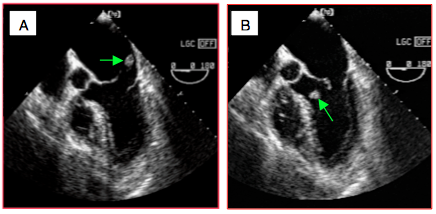
Figure 26.24 : Rupture ischémique totale d'un muscle papillaire. On aperçoit un fragment de pilier à l’extrémité de cordages, flottant dans l’OG en systole (A) et dans le VG en diastole (B). L’orifice de régurgitation est si grand et la dysfonction du VG si profonde que la Vmax de l’IM est basse (1-1.5 m/s) ; le flux Doppler couleur est laminaire en diastole et en systole, seule sa couleur change.
Insuffisance mitrale restrictive (IM Type III)
La course des feuillets mitraux est limitée par un rétrécissement des structures ou par une traction sur les cordages en systole. On distingue plusieurs mécanismes (Vidéos et Figure 26.25) [44].
- Le type systolo-diastolique (Type IIIa) est le plus souvent secondaire au RAA : les deux feuillets sont rétractés, peu mobiles, partiellement calcifiés et non-occlusifs en systole ; ils ne s’ouvrent pas normalement en diastole ; les commissures sont fusionnées. L’appareil sous-valvulaire est aussi restrictif.
- La dilatation du VG empêche les feuillets de rejoindre leur plan de coaptation en systole à cause de la traction excessive exercée sur les cordages (Type IIIb) ; le point de coaptation est situé à plus de 1 cm en dessous du plan de l’anneau mitral. La dysfonction et la sphéricisation du VG étant homogènes, la traction sur les feuillets est symétrique et la fuite est centrale. Ce type d’IM est présent dans la moitié des cas d’insuffisance ventriculaire gauche.
- La paroi ventriculaire où est implanté le muscle papillaire ne se contracte pas et bombe vers l’extérieur et vers l’apex en systole ; ce phénomène ischémique exerce une traction sur les cordages correspondants et maintient la commissure ou le feuillet concernés en dessous du plan de coaptation en systole, alors que l’autre commissure et le reste des feuillets sont en position normale (Type IIIb asymétrique). La fuite est oblique et se dirige du côté du feuillet restrictif. La zone la plus souvent touchée est le feston postérieur du feuillet postérieur (P3) [31].
Vidéo: maladie mitrale avec prédominance de sténose. En diastole, le flux accélère à travers la valve (PISA côté auriculaire); en systole, la valve fuit (IM centrale type IIIa).
Vidéo: défaillance ventriculaire gauche avec IM centrale symétrique de type restrictif (type IIIb). Le VG est dilaté, arrondi et hypocontractile.
Vidéo: insuffisance mitrale avec IM restrictive asymétrique (type IIIb) sur cardiomyopathie ischémique du VG, qui est dilaté et dysfonctionnel.
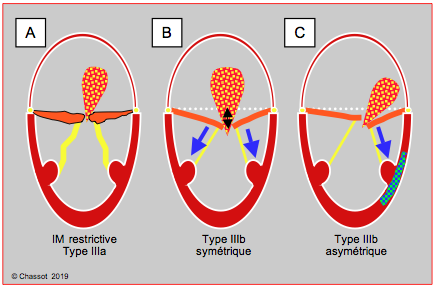
Figure 26.25 : Insuffisance mitrale restrictive (Type III). A : restriction systolo-diastolique des feuillets dans le RAA. B : restriction systolique symétrique des feuillets dans la dilatation du VG. C : restriction systolique asymétrique d’un feuillet lors d’ischémie du VG avec akinésie ou dyskinésie segmentaire.
Le degré de remodelage du VG se traduit par une série de modifications géométriques au niveau de la valve mitrale. Les éléments suivants ont considérés comme marqueurs d’une restriction sévère (Figure 26.26) [18,24,30,33,34,36].
- Dilatation de l’anneau > 3.7 cm.
- Abaissement du point de coaptation (tenting distance) de > 1.1 cm en dessous du plan de l’anneau mitral.
- Surface du triangle compris entre les feuillets et le plan de l’anneau mitral (tenting area) > 2.5 cm2; en imagerie 3D, on peut mesurer le volume compris entre les feuillets et l’anneau (tenting volume): > 3.0 cm3.
- Angle de fermeture entre le plan de l’anneau et le feuillet antérieur > 20° en mésosystole.
- Angle de fermeture entre le plan de l’anneau et le feuillet postérieur > 30° en mésosystole.
- Index de sphéricité du VG ≥ 0.7 (rapport diamètres court axe/long axe).
- Diamètre télésystolique du VG en court-axe > 4 cm.
- Volume télésystolique du VG > 150 mL.
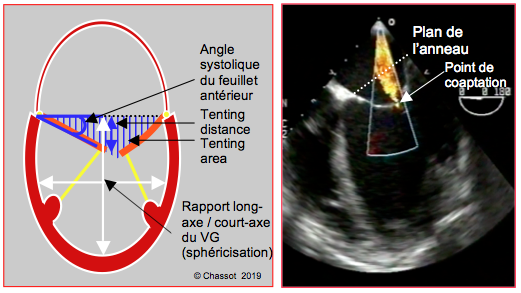
Figure 26.26 : IM restrictive (Type IIIb) sur dilatation du VG. A: distance du point de coaptation au plan de l’anneau mitral (tenting distance), surface triangulaire comprise entre les feuillets et le plan de l’anneau (tenting area) et angle de fermeture du feuillet antérieur mesuré entre le plan de l’anneau et l’extrémité du feuillet. B: dilatation du VG avec maintien du point de coaptation en-dessous du plan de l'anneau mitral en systole et IM centrale.
Lors de défaillance ventriculaire gauche, l'importance de l'IM fonctionnelle (type I ou IIIb) est un excellent marqueur du degré de dysfonction contractile du ventricule, parce qu'elle traduit le degré de dilatation du VG. En sortant de CEC, par exemple, elle est un indice très sensible d'une défaillance systolique momentanée (soutien catécholaminergique insuffisant), d'une surcharge de volume (mise en charge trop rapide), de résistances artérielles trop élevées (excès de vasoconstricteur) ou d'ischémie aiguë (pontage inopérant).
| Insuffisance mitrale (IM) : imagerie bidimensionnelle |
| Vues ETO pour l'évaluation d'une IM: - Vues orthogonales de la valve mitrale: bicommissurale 60°, long-axe VG 120-140° - Vues 4- et 5-cavités 0-20°, vue 2-cavités 90° - Vues transgastriques: court-axe 0°, 2-cavités 90° - Hauteur de coaptation (moyenne): 8 mm Images des lésions pathologiques de l'IM: - Feuillets redondants, flottants et excessivement longs - Ballonisation - Prolapsus: recul du point de coaptation de > 2 mm dans l'OG - Bascule de feuillet - Rupture de cordage ou de pilier (partielle, totale) - Restriction: coaptation située en-dessous du plan de l'anneau mitral Caractéristiques bidimensionnelles de l’IM sévère: - Non-coaptation des feuillets > 0.5 cm, bascule de feuillet dans l’OG, rupture de cordage - Dilatation OG et VG (hypertrophie excentrique) - Bombement septal dans l’OD en systole Type I : IM fonctionnelle - Feuillets normaux, dilatation/non-contraction de l’anneau, perforation - Jet central Type II : prolapsus - Excès de tissu dans les feuillets, dégénérescence, bascule de feuillet, rupture de cordage - Recul du point de coaptation de > 2 mm en vue long-axe 120° - Jet excentrique Type III : IM restrictive - Feuillets normaux maintenus sous le plan de coaptation par traction excessive sur les cordages ou feuillets restrictifs - Type IIIa systolo-diastolique (RAA) : jet ± central - Type IIIb systolique (dilatation VG, symétrique) : jet central - Type IIIb systolique (ischémie pariétale, asymétrique) : jet excentrique |
Examen 3D
L’imagerie tridimensionnelle (3D) est une aide incontestable dans l’évaluation mitrale parce qu’elle démontre la forme spatiale des structures et des flux en relation avec leur voisinage, et permet une reconstruction dynamique de l'anatomie avec tout son relief, alors que le champ opératoire n'offre qu'une vision flaccide et affaissée des feuillets. Elle facilite la reconnaissance et la localisation de lésions comme le prolapsus, la rupture de cordage, la fuite paravalvulaire ou la fente (cleft), cette dernière étant particulièrement difficile à diagnostiquer en mode 2D (Vidéo) [22]. Avec le Doppler couleur, il devient possible d'analyser la forme réelle des jets d'insuffisance mitrale et d'éviter les erreurs attachées aux approximations géométriques utilisées pour reconstituer leur volume à partir du mode 2D. L'évaluation volumétrique du VG indépendamment de toute extrapolation bidimensionnelle permet un calcul fiable du volume systolique et de la fraction d'éjection, mais dépend de l'acuité de la détection automatique des contours de la cavité ventriculaire [6,13,17].
Vidéo: exemple de lésion mal visible en 2D et bien mise en évidence par l'imagerie 3D (fente dans le feuillet antérieur).
La somme d'informations à acquérir pour rendre l'image en trois dimensions sollicite tellement la puissance de calcul du processeur que la cadence d'image ralentit à 10-20 images/seconde, et ce d'autant plus que le volume exploré est plus large. Le réglage du gain est subtil, car un gain insuffisant laisse apparaître des trous là où les structures sont fines; un gain excessif fait perdre la perspective tridimensionnelle; de routine, il est maintenu à 50%. L'imagerie 3D se présente sous cinq modalités différentes [7].
- Mode X-plane: affichage de deux plans simultanés; excellente définition spatiale et temporelle. But: optimisation de l'image et des plans pour les vues 3D (Vidéo).
Vidéo: prolapsus massif de P2 avec rupture de cordage en vue simultanée selon deux plans 4-cavités et bi-commissural (mode X-plane).
Vidéo: prolapsus massif de P2 en vue simultanée selon deux plans bi-commissural (65°) et long-axe (155°) (mode X-plane). Bien que remanié, le feuillet antérieur est en position normale.
- Mode live 3D: affichage en temps réel d'une pyramide restreinte (totalité de la profondeur mais 30° x 60° d'ouverture); cadence d'image: 15-30 images/s.
- Mode zoom: affichage en temps réel d'une tranche de pyramide; la restriction en profondeur est troquée contre une augmentation du champ latéral et du champ d'élévation; cadence: 10 images/s, pas de possibilité de Doppler couleur. Permet une vue "en-face" en temps réel.
- Mode full-volume: reconstruction en différé à partir d'une boucle de 4-12 cycles cardiaques synchronisés par l'ECG; seule une tranche de volume est enregistrée au cours de chaque cycle cardiaque, puis l'image tridimensionnelle est reconstituée en "collant" les tranches les unes aux autres. Ce procédé permet d'afficher un grand volume avec une cadence de 30 images/s. Le volume peut ensuite être découpé (cropping) à volonté pour afficher la vue désirée. L’acquisition 3D full-volume prend quelques minutes, ce qui est compatible avec le déroulement des évènements peropératoires. Elle présente toutefois des inconvénients: artéfacts de collage dus à des arythmies ou des mouvements respiratoires du patient, complexité du software, résolution spatiale limitée.
- Addition du Doppler couleur: représentation du jet de l'IM au sein du volume de l'OG, mais ralentissement de la cadence d'image dans les modes en temps réel.
Les modes 3D en temps réel sont particulièrement utiles pour diriger les cathéters dans les interventions percutanées comme la pose de Mitraclip™ [31].
La vue dite "en-face" de la valve mitrale est attrayante parce qu'elle correspond à la vue qu'en a le chirurgien depuis l'OG dans le champ opératoire (Figure 26.27) (Vidéo) [17,25]. L'image est positionnée de manière à avoir la valve aortique à 12 heures, l'appendice auriculaire gauche à 10 heures, la commissure antérieure à 9 heures et la commissure postérieure à 3 heures On peut également regarder la valve à l'opposé depuis le VG et apprécier ainsi les relations du feuillet antérieur avec la chambre de chasse.
Vidéo: reconstruction 3D d'une valve mitrale normale telle que la voit le chirurgien dans le champ opératoire. Le feuillet postérieur est en bas à gauche de l'écran et le feuillet antérieur en-haut à droite, jouxtant la valve aortique (à 2 heures).
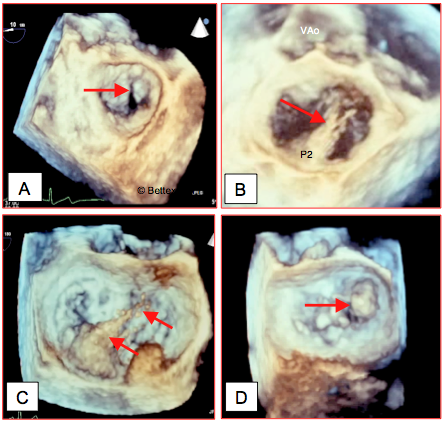
Figure 26.27 : Imagerie tri-dimensionnelle de l’IM vue depuis l’OG (vue "en-face"). A : fente (cleft) dans le feuillet antérieur; cette pathologie peut être très difficile à mettre en évidence en 2D alors qu'elle est bien visible en 3D. B : Image protosystolique d’un prolapsus mitral de P2 ; on voit deux rutptures de cordage à l’extrémité du prolapsus (flèche). Au tout début de la systole, le prolapsus bascule immédiatement dans l'OG avant que les feuillets ne soient venus à leur coaptation, raison pour laquelle ils n'apparaissent pas dans cette vue. C : Large prolapsus de P2 avec ruptures de cordages. D : prolapsus de la commissure postérieure.
La stratégie de la valvuloplastie peut être décidée de manière plus rigoureuse sur des images 3D où l’on voit les mouvements du prolapsus, des cordages, des feuillets et de l’anneau comme ils apparaissent au chirurgien depuis l’oreillette gauche (Vidéos). Du fait que la valve est visualisée entourée des structures adjacentes, on peut mieux prédire le risque de bascule du feuillet antérieur dans la chambre de chasse en systole. L’exactitude du diagnostic concernant le feston et le mécanisme impliqués dans le prolapsus passe de 90% avec le 2D à 98-100% avec le 3D [11,13]. Cette amélioration est particulièrement évidente pour les affections complexes touchant les deux feuillets (de 86% à 100%). Les ruptures de cordages sont identifiées correctement dans 95% des cas, au lieu de 69% des cas en 2D; les fentes sont aisées à diagnostiquer en 3D [13]. Le 3D améliore considérablement la précision de mesures qui sont difficiles à faire en vue 2D, telle par exemple la distance intercommissurale (voir Figure 26.9A).
Vidéo: vue 3D depuis l'OG d'un prolapsus de P2.
Vidéo: vue 3D depuis l'OG d'une rupture de la commissure postérieure et d'un prolapsus de P3.
Vidéo: vue depuis le VG de la chambre d'admission avec la valve mitrale (en bas à l'écran) et de la chambre de chasse avec la valve aortique (en haut).
Grâce à des algorithmes basés sur des programmes semi-automatiques de modelage paramétrique à partir des données de full-volume, on peut afficher directement la surface de l'orifice de régurgitation, la surface des feuillets, le volume des prolapsus, le volume de tente, l'angle de non-planarité de l'anneau, la localisation des muscles papillaires, la quantification volumétrique du jet d'IM, etc [5]. Cet examen de montre que l’anneau mitral normal modifie sa morphologie de plusieurs manières au cours de la systole [12].
- Contraction dans l’axe antéro-postérieur (partie haute de l’anneau) mais absence de modification de diamètre dans l’axe bi-commissural (partie basse de l’anneau).
- Accentuation de 40% de la forme en selle : augmentation de la distance entre les parties hautes et les parties basses de l’anneau par descente vers l’apex plus prononcée de ces dernières (effet de la contraction longitudinale du VG) ; cette déformation augmente la circonférence de l’anneau.
- Rétrécissement de 25% de la surface effective de l’anneau en protosystole, qui se maintient pendant toute la durée de la systole.
- Dimensions agrandies dans le sens antéro-postérieur et bi-commissural; augmentation de surface de 43% par rapport à la norme.
- Contraction antéro-postérieure de moindre amplitude que la norme en systole.
- Dilatation systolique dans l’axe bi-commissural.
- Aplatissement de la forme en selle.
- Faible accentuation de la forme en selle durant la systole ; l’augmentation de hauteur est de 13% au lieu de 38%. Cet approfondissement de la selle survient également plus tard pendant la systole.
- Agrandissement de la surface effective de l’anneau en télésystole.
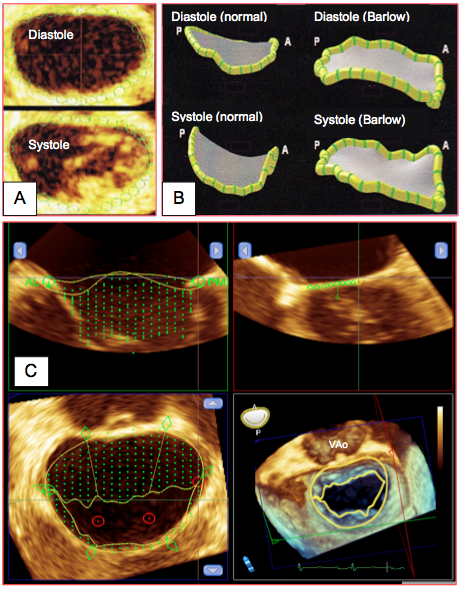
Figure 26.28 : Reconstruction 3D de l'anneau mitral. A : anneau mitral en diastole (en-haut) et en systole (en-bas). B : reconstruction de l’anneau mitral en diastole (en-haut) et en systole (en-bas) en situation normale et lors de maladie de Barlow [extrait de: Grewal J, et al. Mitral annular dynamics in myxomatous valve disease. New insights with real-time 3-dimensional echocardiography. Circulation 2010; 121 :1423-31]. C : étapes de la reconstrcution paramétrique de la valve mitrale; l'anneau est en forme de selle, avec une base rectiligne le long de l'anneau aortique; les feuillets sont marqués par une série de points dont le déplacement est suivi dans l'espace.
On peut ensuite faire une série de mesures sur ce type de reconstruction, montrant par exemple le modifications de l'anneau et des feuillets dans la maladie de Barlow (Figure 26.29) [3,31,39].
- Diamètre antéro-postérieur de l'anneau: > 2.5 cm/m2 (normal < 1.6 cm/m2);
- Surface de l'anneau: > 7.5 cm2/m2 (normal < 5 cm2/m2);
- Surface du feuillet antérieur: > 4.75 cm2/m2 (normal < 2.75 cm2/m2);
- Surface du feuillet postérieur: > 3.0 cm2/m2 (normal < 2.0 cm2/m2);
- Diamètre intercommissural: > 1.8 cm/m2, avec élargissement en télésystole (normal < 1.8 cm/m2, sans modification au cours de la systole);
- Elévation de l'anneau mitral (hauteur de selle): < 0.8 cm (normal > 1 cm);
- Hauteur de ballonisation: dégénérescence fibro-élastique < 1 cm, Barlow > 1 cm;
- Volume de ballonisation: dégénérescence fibro-élastique < 1.15 cm3, Barlow > 1.15 cm3;
- Volume de tente: > 1.5 cm3 (IM secondaire sévère).
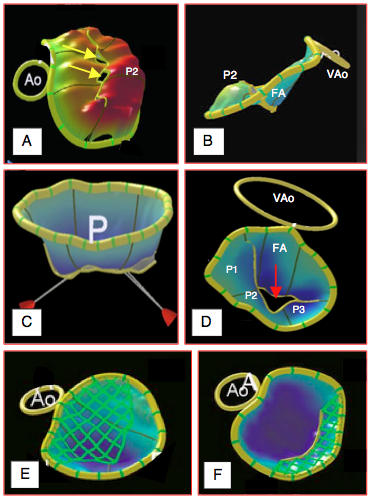
Figure 26.29: Reconstructions 3D paramétriques de la valve et de l'anneau mitral. A: prolapsus de P2 dans le cas d'une maladie de Barlow; l'orifice de régurgitation est marqué d'une flèche rouge. B: vue de profil de l'anneau mitral mettant en évidence la perte de la forme en selle de l'anneau, le bombement du prolapsus de P2 et la position normale du feuillet antérieur (FA). C: insuffisance mitrale restrictive; l'écartement des pilliers (en rouge) maintient les feuillets au sein de la cavité ventriculaire en systole; la valve forme un cône. P: partie postérieure de l'anneau. D: IM restrictive; la profondeur est rendue par une coloration bleue. L'orifice de régurgitation (flèche) est une fente triangulaire; le calcul de sa surface, assimilée à un cercle dans une vue 2D (vena contracta, PISA), serait erroné. VAo: valve aortique. E: calcul de la surface du feuillet antérieur. F: calcul de la surface du feuillet postérieur.
Dans l’IM ischémique, l’anneau est adynamique et ne modifie pas sa forme au cours de la systole.
Les calculs opérés à partir des vues bidimensionnelles du Doppler couleur, comme le diamètre du jet à la vena contracta et la surface de la zone d'accélération (PISA, proximal isovelocity surface area), présupposent que les orifices et les jets ont une symétrie circulaire (voir Quantification de l'IM). Cette approximation est tolérable dans les IM primaires, où l'orifice de régurgitation est plus ou moins rond. Par contre, elle est franchement erronée dans les IM secondaires, où l'orifice est en forme de croissant ou de fente puisqu'il correspond à un simple écartement des feuillets, qui sont normaux. L'analyse tri-dimensionnelle permet de corriger la sous-estimation habituelle d'environ 20-25% de l'importance d'une IM par l'imagerie 2D [1,14,20,27,38].
- La surface de l’orifice de régurgitation (SOR) est en général de forme plus elliptique que circulaire dans les IM primaires. Si la forme du PISA est considérée comme un hémi-ellipsoïde plutôt que comme un hémisphère, l'erreur est diminuée de moitié [29]. De nouveaux algorithmes 3D permettent de calculer la surface de 1er aliasing du PISA quelle que soit sa forme spatiale.
- En n'en mesurant que le diamètre, l'écho 2D présuppose que la surface de la vena contracta est circulaire. Par découpe au sein de la reconstruction 3D selon un plan perpendiculaire au flux de l'IM, il est possible de mesurer la surface réelle de la vena contracta. La mesure obtenue présente une excellente corrélation avec la mesure de la SOR par IRM (r = 0.91), bien meilleure que celle de la mesure en écho 2D (r = 0.78) [45]. L'écart sur le volume régurgité est de 0.08 mL/battement au lieu de 2.9 mL/batt [37].
- Les jets excentriques sont minces mais ont un grand volume parce qu’ils sont étalés sur une vaste surface. Le 3D donne une appréciation fine de ce volume.
- Dans les IM secondaires, la reconstruction intégrale et automatique de chaque surface d'isovélocité du PISA permet de reconstituer plus exactement la surface du SOR et d'avoir un écart avec la réalité 6 fois moins important qu'en imagerie 2D, où le PISA est considéré comme hémisphérique et symétrique [21].
- Les jets d'IM secondaire reproduisent la forme en arc de la commissure, puisque les feuillets sont normaux. Ils se présentent souvent sous la forme d'un rideau, large en vue bicommissurale 60° et mince en vue 4-cavités 0° ou long-axe 120°. La reconstruction 3D aide à quantifier correctement l'importance de cette fuite.
| Insuffisance mitrale: imagerie 3D |
| Le 3D améliore considérablement la compréhension des mécanismes de l'IM Mesures quantitatives plus fiables qu'en 2D car ne présupposant pas la circularité des lésions: - Orifice de régurgitation elliptique ou en fente - PISA asymétrique et aplati - Section de la vena contracta ovale ou allongée - Distance intercommissurale |
Fonction ventriculaire gauche
Bien qu’habituellement conservées, les mesures habituelles de fonction comme la fraction d’éjection (FE ≥ 0.5) ne traduisent pas la contractilité réelle du VG pour trois raisons.
- La valve mitrale fuit dès que la pression intraventriculaire dépasse la POG (5-8 mmHg en protosystole) ; il n’y a pratiquement pas de phase de contraction isovolumétrique, et une partie du volume systolique s’échappe dans l’OG où la pression est basse. Cette baisse de postcharge effective améliore artificiellement la performance systolique du VG.
- Le volume régurgité dans l’OG revient dans le VG pendant la diastole suivante ; cette augmentation de précharge permet au ventricule de se positionner optimalement sur sa courbe de Starling.
- L’hypertrophie dilatative agrandit le VG pour accommoder la surcharge de volume en maintenant le débit systémique, mais elle l'arrondit: le VG devient plus sphérique. De ce fait, les approximations géométriques utilisées pour le calcul de la FE ne sont plus applicables.
- Dimension télésystolique : diamètre (Dts) > 3.7 cm ou 2.5 cm/m2 ; surface en court-axe (Sts) > 6.5 cm2/m2 ; c’est l’évaluation la plus fiable du risque de dysfonction post-CEC parce qu'elle dépend peu des conditions de charge.
- Pente ascentionnelle de l’IM : la durée nécessaire à augmenter la vélocité de l’IM de 1 à 3 m/s représente celle qu’il faut au VG pour augmenter la pression intraventriculaire de 32 mmHg. La valeur normale est ≤ 27 msec ; un allongement de cette durée traduit une diminution de la performance systolique [42].
- Index de Tei : (tCI + tRI) / téj (somme des durées de la contraction et de la relaxation isovolumétrique divisée par la durée d’éjection) ; cet indice est indépendant de la géométrie du VG. Une valeur > 0.4 indique une dysfonction systolique [23,40].
- Déformation longitudinale globale (strain): degré de raccourcissement longitudinal de la paroi antérieure ou latérale du VG au Doppler tissulaire ou selon la technique du speckle-tracking; une valeur < 15% traduit une atteinte contractile, même si les mesures conventionnelles sont encore normales (voir Chapitre 25 Doppler tissulaire) [32].
Même si l’on rencontre souvent des situations où les trois types d'insuffisance mitrale se combinent, cette classification est importante pour la clinique, car le comportement hémodynamique diffère d’une catégorie à l’autre (Figure 26.30):
- Types I et III: la régurgitation est diminuée par la réduction du volume ventriculaire en systole, qui permet aux feuillets de retrouver une coaptation normale; ceci se produit grâce à une baisse de postcharge, une amélioration de la fonction systolique, ou une diminution du remplissage.
- Type II (prolapsus avec recul du point de coaptation): la régurgitation est diminuée par un agrandissement de la taille du ventricule en systole, qui tend les cordages et ramène le feuillet prolabant vers le plan de coaptation; ceci est réalisé par une augmentation de précharge et par une baisse de contractilité. Ce phénomène est significatif dans la maladie de Barlow accompagnée d'une IM modérée; il ne s'applique pas aux IM sévères sur lésions organiques graves (bascule de feuillet, rupture de cordage).
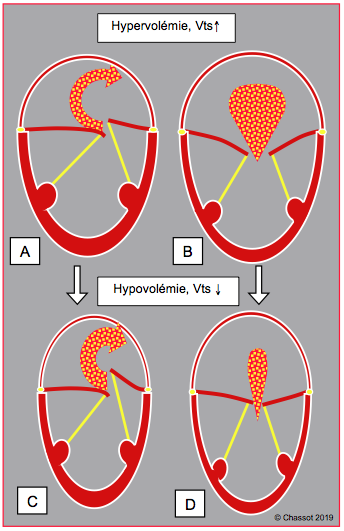
Figure 26.30 : Comportement différent de la régurgitation mitrale avec les variations de volémie selon le type d’IM. A et B: hypervolémie; le ventricule se dilate, son volume télésystolique (Vts) augmente; l'IM diminue dans le prolapsus (A) car les cordages sont tirés vers le bas, mais augmente dans les types I et III (B), car la restriction des feuillets mitraux s'accroît. C et D: hypovolémie; le ventricule se rappetisse, son volume télésystolique diminue; l'IM augmente dans le type II (C) car les cordages ont davantage de course, mais diminue dans les types I et III (D), car la restriction diminue et les feuillets arrivent presque à coapter.
D’une manière générale, l’importance d'une IM est très sensible aux conditions hémodynamiques.
- La baisse du tonus sympathique due à l’anesthésie générale diminue l’IM de 1-2 degrés (sur une échelle de 4) [10].
- Une élévation de la postcharge systémique augmente la fuite mitrale parce que la résistance à l’éjection est moindre dans l’OG que dans l’aorte ; le VG est soulagé mais le volume systolique aortique baisse. L’IM est extrêmement sensible à la postcharge systémique, particulièrement en cas d’IM fonctionnelle. Il est capital de rétablir une PA systémique normale (PAM ≥ 80 mmHg) pour quantifier correctement une IM, car on sous-estime gravement l’IM en cas d’hypotension artérielle.
- La fonction ventriculaire est le principal déterminant du gradient de pression entre le VG et l'OG. Si la contractilité est basse, le flux de l'IM est artificiellement diminué. Le VG fonctionne dans un mode à précharge élevée et à postcharge basse, artificiellement très favorable, qui masque son éventuelle baisse de contractilité.
- La pression moyenne de l’OG: le déclenchement de l’IM est retardé si cette pression s’élève. La ventilation en pression positive augmente le retour par les veines pulmonaires et freine l'IM; de plus, l'augmentation de la pression endothoracique diminue la pression transmurale des cavités gauches et la postcharge effective du VG. Une IM tend donc à être sous-estimée en IPPV.
- Les IM fonctionnelles ou secondaires (Type I et IIIb) sont très dépendantes des conditions hémodynamiques, alors que les IM organiques ou primaires (Type II et IIIa) sont plus stables.
| Insuffisance mitrale: hémodynamique |
| L'IM crée des conditions favorables pour le VG: précharge élevée à pression physiologique, postcharge basse. La FE surestime donc la contractilité réelle du VG. Indices fonctionnels fiables: dimension télésystolique, pente ascentionnelle de l'IM, indice de Tei, déformation longitudinale (strain) IM et volémie: - Types I et III: IM diminuée si réduction du volume VG - Type II: IM diminuée si augmentation du volume VG (sauf en cas d'IM massive) L'IM est très sensible aux conditions hémodynamiques: - IM abaissée par l'anesthésie générale et la ventilation mécanique - IM abaissée par la vasodilatation artérielle et augmentée par la vasoconstriction - IM abaissée par la dysfonction du VG et augmentée par l'hyperdynamisme - IM abaissée par l'augmentation de la POG - Les IM fonctionnelles sont particulièrement sensibles aux conditions hémodynamiques |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- AGRICOLA E, BADANO L, MELE D, et al. Real-time three-dimensional transesophageal echocardiography: technical apsects and clinical applications. Heart Intern 2010; 5: e6
- BETTEX D, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie-réanimation. Paris, Masson, Williams & Wilkins, 1997
- CALLEJA A, POULIN F, WOO A, et al. Quantitative modeling of the mitral valve by three-dimensional transesophageal echocardiography in patients undergoing mitral valve repair: correlation with intraoperative surgical technique. J Am Soc Echocardiogr 2015; 28:1083-92
- CHALIKI HP, CLICK RL, ABEL MD. Comparison of intraoperative transesophageal echocardiographic examination with the operative findings: prospective review of 1918 cases. J Am Soc Echocardiogr 1999; 12:237-40
- COBEY FC. Intelligent algorithms in perioperative echocardiography: a new era. J Am Soc Echocardiogr 2017; 30:A26-7
- COBEY FC, FERREIRA R, URSPRUNG WW, et al. A novel approach to assess the three.dimensional anatomy of a mitral valve regurgitant orifice. J Cardiothorac Vasc Anesth 2017; 31:169-73
- CORRIGAN FE, MAINI A, REGINAULD S, et al. Contemporary evaluation of mitral regurgitation – 3D echocardiogrpahy, cardiac magnetic resonance and procedural planning. Exp Rev Cardiovasc Ther 2017; 15:715-25
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- GISBERT A, SOULIERE V, DENAULT AY, et al. Dynamic quantitative echocardiographic evaluation of mitral regurgitation in the operating department. J Am Soc Echocardiogr 2006; 19:140-6
- GREWAL KS, MALKOWSKI MJ, PIRACHA AR, et al. Effect of general anesthesia on the severity of mitral regurgitation by transesoophageal echocardiography. Am J Cardiol 2000; 85:199-203
- GREWAL J, MANKAD S, FREEMAN WK. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009; 22:34-41
- GREWAL J, SURI R, MANKAD S, et al. Mitral annular dynamics in myxomatous valve disease. New insights with real-time 3-dimensional echocardiography. Circulation 2010; 121:1423-31
- HIEN MD, RAUCH H, LICHTENBERG A, et al. Real-time three-dimensional transesophageal echocardiography: improvements in intraoperative mitral valve imaging. Anesth Analg 2013; 116:287-95
- KWAK J, ANDRAWES M, GARVIN S, et al. 3D transesophageal echocardiography: a review of recent literature 2007-2009. Curr Opin Anesthesiol 2010; 23:80-8
- LAMBERT AS, MILLER JP, MERRICK SH, et al. Improved evaluation of the location and mechanism of mitral valve regurgutation with a systematic transesophageal echocardiography examination. Anesth Analg 1999; 88:1205-12
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LEE APW, ACKER M, KUBO SH, et al. Mechanisms of recurrent functional mitral regurgitation after mitral valve repair in nonischemic dilated cardiomyopathy. Circulation 2009; 119:2606-14
- LEVINE RA, HANDSCHUMACHER MD; SANFILIPPO AJ, et al. Three-dimensional echocardiographic reconstruction of the mitral valve, with implications for the diagnosis of mitral valve prolapse. Circulation 1989; 80:589-98
- LITTLE SH. Three-dimensional echocardiography to quantify mitral valve regurgitation. Curr Opin Cardiol 2012; 27:477-64
- LITTLE SH, IGO SR, PIRAT B, et al. In vitro validation of real-time three-dimensional color Doppler echocardiography for direct measurement of proximal isovelocity surface area in mitral regurgitation. Am J Cardiol 2007; 99:1440-7
- LOOI JL, LEE AP, WAN S, et al. Diagnosis of cleft mitral valve using real-time 3-dimensional transesophageal echocardiography. Int J Cardiol 2013; 168:1629-30
- MABROUCK-ZERGUINI N, LEGER P, AUBERT S, et al. Tei index to assess perioperative left ventricular systolic function in patients undergoing mitral valve repair. Brit J Anaesth 2008; 101:479-85
- MAGNE J, SENECHAL M, DUMESNIL J, PIBAROT P. Ischemic mitral regurgitation: A complex multifactorial disease. Cardiology 2009; 112:244-59
- MAHMOOD F, WARRAICH HJ, SHAHUL S, et al. En face view of the mitral valve: definition and acquisition. Anesth Analg 2012; 115:779-84
- MASLOW A. Mitral valve repair: an echocardiographic review: Part I. J Cardiothorac Vasc Anesth 2015; 29:156-77
- MATSUMARA Y, FUKUDA S, TRAN H. Geometry of the proximal isovelocity surface area in mitral regurgitation by 3-dimensional color Doppler echocardiography: difference between functional mitral regurgitation and prolapse regurgitation. Am Heart J 2008; 155:231-8
- MATSUMURA T, OHTAKI E, TANAKA K, et al. Echocardiographic prediction of left ventricular dysfunction after mitral valve repair for mitral regurgitation as an indicator to decide the optimal timing of repair. J Am Coll Cardiol 2003; 42:458-66
- MATSUMARA Y, SARACINO G, SUGIOKA K, et al. Determination of regurgitant orifice area with the use of a new three-dimensional flow convergence geometric assumption in functional mitral regurgitation. J Am Soc Echocardiogr 2008; 21:1251-6
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11(4):e007028
- POELART JI, BOUCEZ S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thor Surg 2016; 50:801-12
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography. The case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11:260-74
- RYAN L, JACKSON B, PARISH L. Quantification and localization of mitral valve tenting in ischemic mitral regurgitation using real-timew three-dimensional echocardiography. Eur J Cardiothorac Surg 2007; 31:839-4
- RYAN L, JACKSON B, PARISH L. Regional and global patterns of annular remodeling in ischemic mitral regurgitation. Ann Thorac Surg. 2007;84:553-9
- SAVAGE RM, LYTLE BW, ARONSON S, et al. Intraoperative echocardiography is indicated in high-risk coronary artery bypass grafting. Ann Thorac Surg 1997; 64:368-74
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- SHANKS M, SIEBELINK HM, DELGADO V, et al. Quantitative assessment of mitral regurgitation: comparison between three-dimensional echocardiography and magnetic resonance imaging. Circ Cardiovasc Imaging 2010; 3:694-700
- SUGENG L, CHANDRA S, LANG RM. Three-dimensional echocardiography for assessment of mitral valve regurgitation. Curr Opin Cardiol 2009; 24:420-5
- SUGIMOTO T, DULGHERU R, MARCHETTA S, et al. What does 3D echocardiography ass to 2D echocardiography in the assessment of mitral regurgitation ? Curr Cardiol Rep 2017; 19:90
- TEI C, NISHIMURA RA, SEWARD JB, et al. Non-invasive Doppler-derived myocardial performance index: correlation with simultaneaous measurements of cardiac catheterization. J Am Soc Echocardiogr 1997; 10:169-78
- TRIBOUILLOY C, RUSINARU D, SZYMANSKI C, et al. Predicting left ventricular dysfunction after valve repair for mitral regurgitation due to leaflet prolapse : additive value of left ventricular end-systolic dimension to ejection fraction. Eur J Echocardiogr 2011 ; 12 :702-10
- VUILLE C, WEYMAN AE. Left ventricle I: General considerations, assessment of chamber size and function. In: WEYMAN AE, ed. Principles and practice of echocardiography. Philadelphia: Lea & Febiger, 1994, 575-624
- YAMAUCHI T, TANIGUCHI K, KUKI S, et al. Evaluation of the mitral valve leaflet morphology after mitral valve reconstruction with a concept of “coaptation length index”. J Card Surg 2005; 20:432-5
- YIU SF, ENRIQUEZ-SARANO M, TRIBOUILLOY C, et al. Determinants of the degree of functional mitral regurgitation in patients with systolic left ventricular dysfunction: A quantitative clinical study. Circulation 2000; 102:1400-6
- ZENG X, LEVINE RA, HUA I, et al. Diagnostic value of vena contracta area in the quantification of mitral regurgitation severity by color Doppler 3D echocardiography. Circ Cardiovasc Imaging 2011; 4:506-13
- ZOGHBI WA, ENRIQUEZ-SARANO M, FOSTER E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003; 16:777-802
