La CEC chez le nouveau-né, le nourrisson et l’enfant diffère de celle de l’adulte sur de nombreux points : les dimensions, l’hémodilution, les besoins métaboliques, l’immaturité des régulations physiologiques, les particularités de la cardiopathie, la régulation du pH, l’intensité du syndrome inflammatoire, la perfusion cérébrale et la nécessité de procéder parfois à un arrêt circulatoire en hypothermie profonde [10,12,44].
Dimensions
Le problème le plus évident est celui du rapport entre la taille de l'enfant et celle du matériel [6,12,44].
- La dimension des veines caves est réduite et les canules y sont facilement obstructrices: risque de syndrome cave supérieur, d'oedème cérébral, de stase hépatique et d'ascite; lorsque la pression veineuse (Pv) augmente, la pression de perfusion en CEC (Partère - Pveine) peut être localement insuffisante si la pression artérielle moyenne (PAM) n'augmente pas: d'où risque d'ischémie cérébrale ou splanchnique. Le drainage veineux dans le réservoir peut être facilité par une aspiration à – 30 mmHg (pompe, vide), ce qui permet d'utiliser une canule veineuse de plus petit calibre.
- La taille de la canule aortique doit être suffisante pour diminuer le risque d’obstruction et le taux d'hémolyse au débit maximal possible (3.2 L/min/m2).
- Plus le circuit est petit, plus la surface étrangère en contact avec le sang est grande par rapport au volume, donc plus les lésions mécaniques des éléments figurés et la libération des substances vasoactives sont intenses.
- Le volume de la CEC (amorçage ou priming) représente 50-75% du volume circulant de l’enfant, alors que le rapport est de 0.25:1 chez l'adulte. Le volume d'amorçage est de 200 - 400 mL alors que le volume circulant du nourrisson est de 200-500 mL. Pour des enfants de < 5 kg, on dispose de circuits dont le volume d’amorçage est de 180-250 mL (Capiox FX™, Lilliput™). Avec certains appareillages, l’oxygénateur est placé sur la table d’opération, et le volume est limité à 120-150 mL. Pour des enfants de 5-10 kg, le priming varie de 270 à 375 mL. On peut réduire l’amorçage et l’hémodilution en drainant lentement le sang du patient dans le circuit de CEC avant le démarrage de celle-ci (retro-priming) et en évacuant le liquide clair dans une poche de transfert; la pression artérielle de l’enfant est maintenue avec un vasoconstricteur.
- Le revêtement des surfaces plastiques avec un matériel les rendant biocompatibles (héparine, poly-méthoxyéthyl-acrylate) ou le dépôt de l'albumine utilisée dans la solution d'amorçage réduisent l'intensité de la réaction inflammatoire [29].
La petite taille de l’enfant augmente sa surface par rapport à son poids; associé à l’immaturité de sa thermorégulation, ce fait augmente ses échanges thermiques avec l’extérieur et accroît le risque de refroidissement en salle d’opération. La technique générale de la CEC est traitée au Chapitre 7 (voir Machines et circuits).
Hémodilution
Le grand volume d'amorçage de la pompe impose une dilution considérable par rapport au volume circulant du nourrisson (85 mL/kg < 10 kg) et de l'enfant (80 mL/kg de 10-20 kg, 70 mL/kg > 20 kg) [44]. Cette hémodilution diminue la pression oncotique et l'hématocrite, ce qui augmente l’œdème tissulaire et baisse les résistances artérielles périphériques. Elle diminue la concentration des plaquettes et des facteurs de coagulation, et baisse le taux sérique des médicaments en circulation. Le risque de réveil et de décurarisation brusque au démarrage de la CEC est très élevé chez le petit enfant. C’est la raison pour laquelle il est recommandé d’"endormir" la pompe avant le démarage de la CEC par une adjonction d’opiacés et de curare à dose d’induction dans le liquide d'amorçage.
L’hémodilution est nécessaire à basse température pour éviter un accroissement excessif de la viscosité qui freinerait le débit dans la microcirculation (sludging). En règle générale, la viscosité est stable si la valeur de l’hématocrite (Ht en %) est la même que celle de la température (T°C). Le degré d'hémodilution recherché correspond à un hématocrite de 20% pour une température de 18°C et de 25% pour une température de 28°C; ces valeurs améliorent les caractéristiques rhéologiques du sang en diminuant sa viscosité sans compromettre le transport d’oxygène (DO2) nécessaire aux besoins métaboliques en hypothermie. Un Ht de 18% est toléré sans acidose à basse température, mais au risque de séquelles neurologiques plus importantes [25]. En effet, un Ht bas est clairement associé à une souffrance cérébrale et à des séquelles neurologiques ultérieures. Il est donc recommandé de ne pas descendre en dessous de 24% en hypothermie profonde et en dessous 25-30% en hypothermie modérée [19,22]. On ajoute à l’amorçage hydro-électrolytique du sang complet d'une durée de conservation inférieure à 48 heures (moins de 6 heures pour les nouveau-nés) pour obtenir un Ht de 24-28%.
L’Ht recherché en CEC (HtCEC) après dilution par le volume d’amorçage (VACEC) se calcule de la manière suivante (VS : volume sanguin, Htpréop : Ht de l’enfant avant l’opération) :
HtCEC = (Htpréop • VSenfant) / (VACEC + VSenfant)
Le calcul du sang à ajouter (VSsuppl) se fait de manière simple (VGR : volume de globules rouges) :
VSsuppl = VGRenfant - VGRCEC
où: VGRenfant = VSenfant • Htpréop
VGRCEC = (VSenfant + VACEC) • HtCEC
Le liquide d’amorçage est une solution hydro-électrolytique tamponnée (Ringer-lactate, Plasma-lyte A), pauvre en calcium. On y ajoute de l'albumine (5% à 25%) ou du plasma frais congelé (PFC) pour maintenir la pression oncotique aux environs de 18 mmHg et limiter l'exsudat interstitiel [15]. L'albumine tend également à diminuer le taux de transfusion (érythrocytes et thrombocytes) et la prise de poids postopératoire, mais sans avoir d'impact sur la mortalité; elle peut être remplacée par du plasma frais décongelé [29]. Certains centres ajoutent également du mannitol pour assurer la diurèse et fonctionner comme neutralisateur de radicaux libres, et un stéroïde pour minimiser la réaction inflammatoire. Le sang complet et les stéroïdes tendent à induire une hyperglycémie. Chez les enfant de < 4 mois, il est habituel d’ajouter du sang au liquide d’amorçage ou au cours de la CEC pour maintenir un Ht suffisant (> 24%) [47]. On choisit autant que possible du sang frais (< 72 heures), déleucocyté, irradié et CMV-négatif, car les poches allologues plus âgées ont un taux de potassium et de lactate excessif; de plus, le citrate est responsable d'une hypocalcémie [6,12]. Ajouter du calcium au liquide d'amorçage limite l'hypocalcémie due au sang et à l'hémodilution, mais sans impact apparent sur la morbi-mortalité [29].
L'ultrafiltration est couramment utilisée chez les enfants pour limiter l'hémodilution, freiner la réaction inflammatoire et améliorer le bilan hydro-électrolytique, les échanges gazeux ou la performance polyorganique. Elle se pratique en cours de CEC (CUF: conventional ultrafiltration) et après la mise en charge (MUF: modified ultrafiltration) (voir Chapitre 7 Hémofiltration) [39]. Le but de la MUF est une soustraction de liquide (750 mL/m2) ou l'obtention d'un Ht précis (40%) [44].
Besoins métaboliques élevés
Les besoins métaboliques élevés du nourrisson (100-150 kcal/kg/24h VO2 6-8 mL/kg/min) sont comblés par un débit cardiaque 30-50% plus élevé que celui de l’adulte. En normothermie, le débit de CEC est en général de 100-150 mL/kg/min chez le petit enfant, mais peut atteindre jusqu'à 150-200 mL/kg/min chez le prématuré (< 3 kg). Plus l'enfant est âgé, plus le débit se rapproche de celui de l'adulte (50 mL/kg/min) [10,12,24].
- < 2.5 kg 175 mL/kg/min 3.2 L/min/m2
- 2.5-5 kg 150 mL/kg/min 3.0 L/min/m2
- 5-15 kg 125 mL/kg/min 2.8 L/min/m2
- 15-30 kg 100 mL/kg/min 2.6 L/min/m2
- 30-50 kg 75 mL/kg/min 2.5 L/min/m2
- > 50 kg 50 mL/kg/min 2.4 L/min/m2
En hypothermie (< 25°C), le débit peut être diminué à 80 mL/kg/min chez l’enfant de < 10 kg. La mesure de la SvO2 sur le retour veineux de la CEC renseigne sur l’adéquation de la perfusion aux besoins de l’organisme. Un débit plus élevé à travers des canules plus petites augmente le risque d'hémolyse par rapport à la situation adulte. La perfusion pulsatile est peut-être plus efficace chez l'enfant que chez l'adulte pour améliorer la performance du myocarde, des reins et des poumons, mais elle présente des risques accrus d'hémolyse pendant l'accélération systolique du flux à travers une petite canule artérielle [2].
La pression artérielle est basse chez l’enfant. A la naissance, elle est de 65/45 mmHg, et à 1 an de 90/45 mmHg. Une pression de perfusion moyenne de 40-45 mmHg est habituellement suffisante en normothermie; elle baisse à 30-40 mmHg en hypothermie (≤ 28°C). Le cœur de l’enfant cyanosé ou en insuffisance congestive est moins tolérant à l’ischémie que celui du nouveau-né normal, alors que celui-ci y semble plus résistant que le cœur adulte.
Immaturité des régulations physiologiques
L’immaturité fonctionnelle du nourrisson touche tous les organes [4,10,26]
- Faible contractilité cardiaque, volume systolique fixe et fréquence-dépendant;
- Faible compliance pulmonaire, faible capacité résiduelle fonctionnelle et volume de fermeture atteint au volume courant ; perte de surfactant et œdème interstitiel en CEC;
- Fragilité des membranes capillaires et risque accentué de fuite interstitielle (capillary leak syndrom);
- Incapacité des reins à concentrer normalement l’urine et à excréter l’eau et le Na+ ; l’incidence d’insuffisance rénale aiguë est de 3-8% après chirurgie cardiaque infantile;
- Coagulopathie: thrombocytopénie, dysfonction plaquettaire, faible synthèse hépatique des facteurs de coagulation;
- Sous stress, retour à des conditions hémodynamiques transitionnelles (voir Figure 14.4).
Les enfants cyanosés présentent une dysfonction plaquettaire et sont déficients en facteurs II, V, VII, VIII, IX et en fibrinogène [10,35]. Des transfusions plaquettaires (1 U par 10 kg de poids) sont en général requises. La réaction inflammatoire systémique est très prononcée après la CEC, avec aggravation de la fuite interstitielle et des défaillances multi-organiques, nécessitant une hémofiltration. A ces caractéristiques s'oppose la résistance plus marquée des organes du nouveau-né normal à l'ischémie et à l'hypothermie. Le cœur, toutefois, échappe à cette constatation : le myocarde immature est plus sensible aux agressions que le myocarde adulte [6]. L’hypoglycémie est un risque majeur chez le nouveau-né dont la néoglucogenèse est encore déficiente. La glycémie doit être soigneusement contrôlée tout au long de l’opération et corrigée au besoin par une perfusion de dextrose 20-30%.
Particularités de la cardiopathie
La présence de shunts aorto-pulmonaires (canal artériel, collatérales aorto-pulmonaires, shunts chirurgicaux de Blalock-Taussig) opère un vol systémique majeur dès le démarrage de la CEC. Lorsque la circulation pulmonaire est court-circuitée et que son régime de pression s'effondre, ces conduits continuent à débiter, remplissent progressivement l'oreillette et le ventricule gauches et provoquent un reflux veineux pulmonaire avec risque d'oedème pulmonaire. L'opérateur doit veiller à occlure ces shunts avant la mise en pompe et à drainer le ventricule (venting) pendant la CEC, parce que la gène est triple.
- La pression systémique est trop basse malgré le haut débit de pompe; l'administration de vasoconstricteur empire l'effet du shunt.
- Le temps de refroidissement systémique (surtout cérébral) est prolongé à cause du vol opéré par la recirculation pulmonaire.
- Le champ opératoire est noyé par le reflux si les cavités gauches sont ouvertes; ces dernières sont dangereusement distendues si elles sont fermées.
Lorsqu’elle est présente, la veine cave supérieure gauche (VCSG) se draine dans le sinus coronaire; la cardioplégie rétrograde est alors impossible, car le perfusat fuit dans le lit systémique.
Anticoagulation
Par rapport au grand enfant et à l'adulte, le nourrisson de moins d'un an présente des différences notables pour l'anticoagulation de CEC [14].
- Le système de la coagulation est immature, les taux de nombreux facteurs sont inférieurs de 30-70%.
- Les cardiopathies congénitales sont associées à une hypo-agrégabilité plaquettaire et à un manque de facteur von Willebrand; l'hypoxémie des affections cyanogènes entraine une baisse du nombre de plaquettes et une sous-production de facteurs vitamine-K dépendants.
- L'hémodilution est plus sévère (augmentation du volume circulant de 40-60%);
- Le taux d'antithrombine III est faible, ce qui diminue l'activité anti-Xa de l'héparine et contraint à en augmenter le dosage (400 UI/kg au lieu de 300 UI/kg) [17]. En cas de résistance accrue à l’héparine (> 600 UI/kg et ACT < 450 sec), un déficit en AT III doit être fortement suspecté et devrait être susbstitué [27].
- Dans notre expérience (CHUV), une dose de 25 UI/kg (max 100 UI/kg) d’AT III (Kybernin®, Atenativ®) dans la CEC, éventuellement répétée une fois, suffit à corriger ce déficit et permets d’atteindre un ACT adéquat (> 450 sec). L’adjonction de PFC peut également être utilisé e, mais le volume requis est beaucoup plus important qu'avec une préparation concentrée.
Pour minimiser les effets de la CEC sur ce fragile système, on utilise de préférences des circuits biocompatibles imitant les propriétés de l'endothélium. Quels que soient les matériaux utilisés et la taille des circuits, l'anticoagulation est conduite avec de l'héparine non-fractionnée (HNF 4 mg/kg) pour viser un ACT ≥ 480 secondes, mais l'ACT tend à surestimer le degré réel de l'anticoagulation chez les petits [17]. Cette dose administrée avant la canulation (par voie centrale ou directement dans l'OD) est immédiatement diluée par le volume d'amorçage au démarrage de la CEC, ce qui oblige à ajouter une dose d'HNF dans le circuit de CEC. L'ultrafiltration modifiée en fin de CEC retire de l'eau, des électrolytes et les petites molécules; l'héparine est concentrée et son taux augmente parce que sa molécule est trop grosse pour filtrée.
Dès que le résultat opératoire est jugé satisfaisant et qu'un retour en pompe est improbable, la protamine est adminstrée dans un rapport 1:1 avec l'HNF ou en fonction du poids de l'enfant (3-4 mg/kg) [44]. Si l'on en dispose, une mesure quantitative de l'héparine circulante (Hepcon™) est plus appropriée. L'incidence de réaction hypotensive à la protamine est plus basse chez l'enfant que chez l'adulte (1.7-2.9%) [37].
Les antifibrinolytiques (acide tranexamique et acide ε-aminocaproïque) ont la même efficacité chez les enfants que chez les adultes. Les dosages recommandés pour l'acide tranexamique sont les suivants [43].
- < 2 mois: 50 mg/kg, perfusion 7 mg/kg/h;
- 2-12 mois: 25 mg/kg, perfusion 6 mg/kg/h;
- > 12 mois: 15 mg/kg, perfusion 5 mg/kg/h.
Régulation du pH
A froid, la constante de dissociation de l’eau et la solubilité des gaz dans les liquides augmentent. Ainsi, la valeur de la PCO2 mesurée dans un échantillon de sang normal (PCO2 = 40 mmHg) refroidi à 27° n'est que de 23 mmHg, quand bien même aucun échange n'a eu lieu avec l'extérieur, parce que la fraction soluble du gaz [HCO3] a augmenté. A 20°, le pH apparent normal est de 7.7 et la PCO2 de 18 mmHg. En clinique, la régulation acido-basique peut se faire selon deux techniques (voir Figure 14.23).
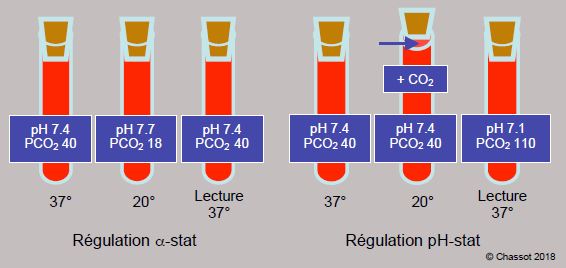
Figure 14.23 : Régulation de l’équlibre acido-basique en hypothermie. Dans le mode α-stat, le contenu total en CO2 est maintenu constant, mais la lecture se fait dans un appareil dont l'échantillon est ramené à 37°, comme si le patient était normothermique. Comme la solubilité du gaz est augmentée à froid, la pression partielle est en réalité plus basse; le sang devient artificiellement alcalin et hypocapnique, mais le rapport [H+]/[OH-] reste constant. Dans le mode pH-stat, le pH du sang est maintenu à 7.4 quelle que soit la température en ajoutant du CO2 au gaz ventilé; le contenu en CO2 augmente (hypercarbie apparente) et le pH baisse. Si le pH est maintenu à 7.4 à 17°, l'échantillon lu à 37° donne une valeur de 7.08 (PCO2 correspondante: 110 mmHg).
- Selon le mode alpha-stat, le contenu total en CO2 est maintenu constant, mais la lecture se fait dans un appareil dont l'échantillon est ramené à 37°, comme si le patient était normothermique. Comme la solubilité du gaz est augmentée à froid, la pression partielle est en réalité plus basse; le sang devient artificiellement alcalin et hypocapnique, mais le rapport [H+] / [OH-] reste constant. Dans cette situation, l'autorégulation cérébrale est intacte, l'acidose extracellulaire est diminuée, le pHi est maintenu stable, et les fonctions enzymatiques intracellulaires sont conservées dans leur intégralité [42].
- Dans le mode pH-stat, on maintient le pH du sang à 7.4 quelle que soit la température en ajoutant du CO2 au gaz ventilé (3-5%); le contenu en CO2 augmente (hypercarbie apparente) et le pH baisse. Si le pH est maintenu à 7.4 à 17°, l'échantillon lu à 37° donne une valeur de 7.08 (PCO2 corrrespondante: 110 mmHg). La courbe de dissociation de l'Hb est déplacée vers la droite. Cette technique provoque une vasodilatation cérébrale hypercarbique ; l'autorégulation est perdue et le flux luxuriant devient pression-dépendant [31]. Malgré l’acidose extra-cellulaire, le pH intracellulaire n’est que peu modifié [38].
La technique alpha-stat est habituellement utilisée de routine pour les CEC en hypothermie modérée (25-30°C) chez les adultes, car les résultats neurologiques à 6 semaines et 2 mois sont sensiblement meilleurs dans ces conditions [32]. La situation semble différente chez le petit enfant, car la stratégie pH-stat offre l'intérêt de doubler le flux sanguin cérébral (FSC), puisque le CO2 est un puissant vasodilatateur cérébral. Comme l'homogénéité des échanges thermiques est améliorée, la technique pH-stat est indiquée pendant le refroidissement et le réchauffement car elle favorise la rapidité et l'uniformité des variations thermiques du cerveau, notamment lors des arrêts circulatoires complets à < 20°C (Figure 14.24) [20,21].
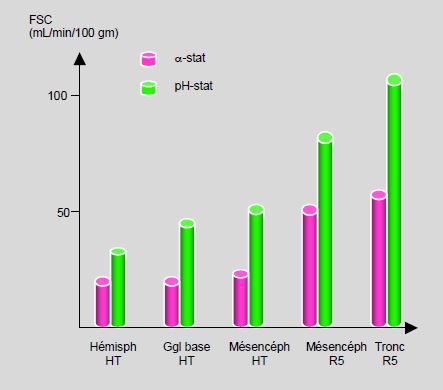
Figure 14.24 : Augmentation du flux sanguin cérébral (FSC) en régulation pH-stat par rapport à la régulation α-stat en différents points du cerveau : hémisphères, ganglions de la base, mésencéphale et tronc cérébral. On voit que toutes les structures cérébrales sont concernées. HT : après 30 minutes d’hypothermie. R5 : après 5 minutes de réchauffement [3].
Chez les enfants, les résultats neurologiques immédiats tendent à être meilleurs en pH-stat après les arrêts circulatoires en hypothermie profonde [3,13,48], mais le développement mental à 4 ans n’est pas différent [5]. La différence entre adultes et enfants tient probablement au fait que les séquelles neurologiques sont primairement dues à des embols chez les adultes, alors que les lésions sont plutôt secondaires à l’ischémie globale chez les enfants. La vasodilatation de la technique pH-stat augmente les risques dans le premier cas, mais les diminue dans le deuxième.
Les protéines se comportent comme des acides faibles au pH habituel du sang et sont un système tampon majeur de l'équilibre acido-basique. Contrairement au système du bicarbonate, elles maintiennent intact leur pouvoir tampon à basse température car le degré de dissociation du groupement imidazole de l'histidine ne se modifie pas en fonction de la température. En hypothermie, il faut donc corriger l'acidose par l'adjonction de protéines, parce que le pouvoir tampon du bicarbonate devient inefficace < 28°C.
Syndrome inflammatoire réactionnel systémique (SIRS)
Plus les enfants sont petits, plus intense est la réaction inflammatoire parce que la surface des éléments étrangers (circuit de CEC, aspirations, filtres) et les déclencheurs (variations thermiques, bas débit) sont proportionnellement plus importants que chez l’adulte. D’autre part, l’équilibre neuro-humoral et les cellules-cibles sont plus fragiles chez le nourrisson. La présence d’une hypertension pulmonaire aggrave les lésions inflammatoires dans les poumons.
Les endotoxines, le système du complément, la kallikréine et les cytokines sont les éléments humoraux de la réaction; ces médiateurs activent les neutrophiles et les cellules endothéliales. L'adhésion des leucocytes à ces dernières est l'étape initiale de la réaction inflammatoire; elle est déclenchée par l'expression de molécules spécifiques à la surface des deux types de cellules; les leucocytes peuvent alors migrer dans l'espace extravasculaire, où ils libèrent leurs toxines (protéases et radicaux libres) qui endommagent les tissus voisins. Les lésions mécaniques de la pompe, de l'oxygénateur et des filtres, le contact du sang avec les surfaces étrangères (circuits) et avec l'air (aspirations, réservoir veineux), sont les éléments déclenchants principaux. Plus de 50% des neutrophiles sont séquestrés dans les poumons durant le réchauffement; leur dégranulation contribue aux dommages cellulaires pulmonaires. La durée de CEC, la profondeur de l'hypothermie et le degré d'hémodilution sont des facteurs aggravants [40].
De nombreuses pistes ont été explorées dans l’espoir de réduire l’intensité de cette réaction. Les plus couramment utilisées sont les suivantes [41].
- Utilisation de circuits héparinés: réduction de l'adhésivité plaquettaire et de l'adsorption des facteurs de coagulation, atténuation des complications pulmonaires, rénales et neurologiques [26].
- Circuits rendus biocompatibles par imprégnation de polymères (poly-2-méthoxyéthyl acrylate) ou de molécules anti-inflammatoires (facteur H inhibant le complément C3a): frein à la cascade du complément et à l'activation leucocytaire [36].
- Hémofiltration en CEC (réchauffement) : chez les enfants, elle a un effet bénéfique en éliminant l’excès liquidien de l’hémodilution et en améliorant les échanges gazeux. Elle élimine une bonne partie des cytokines, mais également celles qui ont un effet anti-inflammatoire [7]. Les avantages de l'hémofiltration sur les complications postopératoires sont certains (diminution de l'eau interstitielle et des défaillance multi-organiques, amélioration de la fonction ventriculaire et de l'hémostase) [23].
- Prophylaxie pharmacologique :
- Décontamination digestive par antibiothérapie préopératoire;
- Administration de stéroïdes ; la méthylprednisolone (10-30 mg/kg) et la dexaméthasone (1-6 mg/kg) modulent la réaction inflammatoire et améliorent le status clinique postopératoire dans certaines séries (voir ci-après); beaucoup de centres les utilisent de routine en pédiatrie [18];
- Anticytokine et anticorps monoclonaux (rarement utilisé).
- Ultrafiltration modifiée : après la CEC, un système d’ultrafiltration est alimenté par le sang en provenance de la canule artérielle ; le sang est réintroduit dans le patient par la canule veineuse ; le circuit tourne à 10-30 mL/kg/min grâce à une pompe de CEC pendant 20-30 minutes. Le système parvient à ultrafiltrer 100-150 mL/min et présente quatre avantages majeurs (Figure 14.25) [1,32] :
- L’eau totale est réduite, l’hématocrite est augmenté;
- La crase est améliorée;
- Les déclencheurs inflammatoires sont en grande partie éliminés;
- le seul problème est un prolongement de la CEC, qui agace souvent le chirurgien.
- Absorbant de cytokine: l’utilisation d’un absorbant de cytokine extracorporel (Cytosorb®) en parallèle à une hémodiafiltration à été décrit chez l’adulte lors de choc septique etde défaillance multiviscérale. Son application durant la CEC fait actuellement l’objet de recherche chez l’adulte; cependant il n’existe actuellement pas de dispositif adpaté à l’enfant de petit poids. En pédiatrie, son utilisation est pour l'instant anecdotique [8].
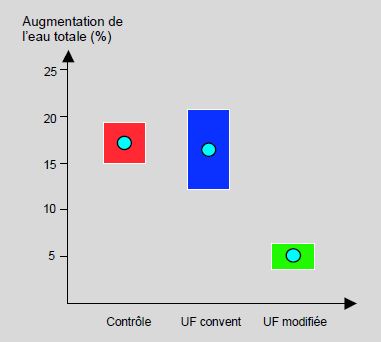
Figure 14.25 : Accumulation liquidienne (eau totale) sans ultrafiltration (contrôle), avec ultrafiltration (UF) conventionnelle et avec ultrafiltration modifiée après CEC chez l’enfant [32]. L’UF modifiée est nettement plus efficace. Les rectangles représentent les déviations standards.
Bien que leur utilisation soit l’objet d’un vif débat en chirurgie cardiaque (voir Chapitre 24 Introduction), les stéroïdes semblent efficaces chez les nourrissons à haut risque (score Aristotle > 10). Ils diminuent les saignements postopératoires et les marqueurs inflammatoires; ils raccourcissent la durée de ventilation et de séjour en soins intensifs sans augmenter le risque hyperglycémique ni infectieux [9,18]. Ils pourraient diminuer la mortalité [45]. Vu leur délai d’action de > 45 minutes, les stéroïdes devraient être administrés avant la CEC; leur efficacité augmente en effet lorsqu’ils sont donnés à l’induction plutôt que dans l’amorçage de la CEC [9]. Le protocole de Necker (Paris), par exemple, associe les deux options :
- Dexaméthazone (1 mg/kg) à l’induction chez tous les nouveau-nés ;
- Méthylprednisolone (30 mg/kg) dans l’amorçage de CEC pour les opérations en hypothermie profonde avec ou sans arrêt circulatoire (Norwood, Sano, Damus-Kaye, retour veineux pulmonaire anormal total, interruption de l’arc aortique).
Néanmoins, l'efficacité des stéroïdes est contestée chez les petits enfants [16] comme elle l'est chez les adultes, où leur apport pour abaisser la morbi-mortalité s'est révélé marginal ou nul [11,46].
Cardioplégie
En général, le myocarde du nouveau-né tolère mieux l’ischémie et la reperfusion que celui de l’adulte, mais la cyanose est associée à une baisse de la résistance myocardique aux différents stresseurs [28]. Le maintien de l’hypothermie cardiaque peut être difficile en présence de flux collatéral chez les cyanosés, ou lors d’anatomie anormale de l’arbre coronarien. A basse température, les solutions cristalloïdes ne semblent pas présenter de différence par rapport à la cardioplégie au sang [49]; pour les cardioplégies chaudes (hot shot), par contre, la solution au sang est préférable. Il suffit d’une plus faible concentration de K+ pour obtenir l’arrêt cardiaque chez l’enfant. L’addition de Ca2+ est bénéfique pour la préservation du myocarde néonatal [34].
Canulations
La taille des canules doit évidemment être adaptée à celle des vaisseaux (1/8, 3/16,1/4). La canulation veineuse se pratique le plus souvent avec deux canules angulées introduites dans la veine cave inférieure et dans la veine cave supérieure. Une canule auriculaire droite unique est utilisable lors de lésion valvulaire ou sous-valvulaire aortique, d’intervention sur les gros vaisseaux, de Fontan extracardiaque, de Norwood ou de retour veineux pulmonaire anormal [6,35]. La canule artérielle est placée dans l’aorte ascendante, sauf en cas de Norwood (elle est placée dans le canal artériel) ou d’interruption de l’arc aortique. La canulation fémorale n’est pas possible chez le petit enfant.
Complications
Parmi les nombreuses complications qui peuvent survenir en CEC (obstruction au flux, défaut d'oxygénateur, thrombose de circuit, dissection aortique sur la canule artérielle, etc) (voir Chapitre 7 Incidents et accidents), une des plus dévastatrice est l'embolie massive d'air, parce que les shunts congénitaux entre la circulation systémique et la circulation pulmonaire conduisent à une embolisation cérébrale dramatique [30]. La prise en charge doit être immédiate et concerne tous les intervenants [44].
- Chirurgien: clampage de l'aorte, retrait de la canule artérielle et canulation de la veines cave supérieure (flux cérébral a retro de 1-2 L/min pour chasser l'air); vidange de l'aorte et recanulation.
- Perfusionniste: stop CEC, clampage artériel et veineux, vidange du circuit et re-remplissage; reprise de la CEC à 22-25°C.
- Anesthésiste: patient en Tredelenburg forcé, compression carotidienne, ventilation à FiO2 1.0, refroidissement.
| CEC chez l’enfant |
|
Volume d’amorçage voisin ou plus grand que le volume circulant de l’enfant
Débit de CEC en normothermie :
- < 2.5 kg 175 mL/kg/min
- 2.5-5.0 kg 150 mL/kg/min
- 5-15 kg 125 mL/kg/min
- 15-30 kg 100 mL/kg/min
- 30-50 kg 75 mL/kg/min - > 50 kg 80 mL/kg/min
Pression de perfusion 40-60 mmHg
Régulation du pH selon le mode -stat en hypothermie modérée et pendant les plateaux de température (> 28°C), mais de type pH-stat pendant le refroidissement à basse température (< 28°C) et le réchauffement
Diminution de la réaction inflammatoire systémique : circuits héparinés, biocompatibles, ultrafitration
Hémofiltration modifiée de routine en sortant de CEC pour freiner le syndrome inflammatoire et diminuer l’excès liquidien
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Décembre 2019
Références
- AGGARWAL NK, DAS SN, SHARMA G, et al. Efficacy of combined modified and conventional ultrafiltration during cardiac surgery in children. Ann Card Anaesth 2007 ; 10 :27-33
- ALKAN T, AKCEVIN A, UNDAR A, et al. Effects of pulsatile and nonpulsatile perfusion on vital organ recovery in pediatric heart surgery; a pilot clinical study. ASAIO J 2007; 52:530-5
- AOKI M, NORMURA F, STROMSKI ME, et al. Effects of pH on brain energetics after hypothermic circulatory arrest. Ann Thorac Surg 1993; 55:1093-1103
- BAUM VC, PALMISANO BW. The immature heart and anesthesia. Anesthesiology 1997; 87:1529-48
- BELLINGER DC, WYPIJ D, DU PLESSIS AJ, et al. Developmental and neurologic effects of alpha-stat versus pH-stat strategies for deep hypothermic cardiopulmonary bypass in infants. J Thorac Cardiovasc Surg 2001; 121:374-83
- CHARRETTE KA, DAVIES RR, CHEN JM, et al. Pediatric perfusion techniques for complex congenital cardiac surgery. In : MONGERO LB, BECK JR. On bypass. Advanced perfusion techniques. Totowa (NJ, USA) :Humana Press 2010, 29-58
- CHEW MS, BRIX-CHRISTENSEN V, RAVN HB, et al. Effect of modified ultrafiltration on the inflammatory response in paediatric open-heart surgery: a prospective, randomized study. Perfusion 2002; 17:327-33
- CIRSTOVEANU CG, BARASCU I, McKENZIE STANCU S. Hemadsorption with adult CytoSorb® in a low weight pediatric case. Case Rep Crit Care 2017; 2017:6987 167
- CLARIZIA NA, MANLHIOT C, SCHWARTZ SM, et al. Improved outcomes associated with intraoperative steroid use un high-risk pediatric cardiac surgery. Ann Thorac Surg 2011 ; 91 :1222-7
- DAVIES LK. Cardiopulmonary bypass in infants and children: How it is different ? J Cardiothorac Vasc Anesth 1999; 13:330-45
- DIELMAN JM, NIERICH AP, ROSSEEL PM, et al. Intraoperative high-dose dexamethasone in cardiac surgery: a randomized controlled trial. JAMA 2012 ; 308 :1761-7
- DÖNMEZ A, YURDAKÖK O. Cardiopulmonary bypass in infants. J Cardiothorac Vasc Anesth 2014; 28:778-88
- DU PLESSIS AJ, JONAS RA, WYPIJ D. Perioperative effects of -stat versus pH-stat strategies for deep hypothermic cardiopulmonary bypass in infants. J Thorac Cardiovasc Surg 1997; 114:990-1001
- EATON MP, IANNOLI EM. Coagulation considerations for infants and children undergoing cardiopulmonary bypass. Pediatr Anesth 2011; 21:31-42
- GOLAB HD, SCOHY TV, DE JONG PL, et al. Relevance of colloid oncotic pressure regulation during neonatal and infant cardiopulmonary bypass: a prospective randomized study. Eur J Cardiothorac Surg 2011; 39:886-91
- GRAHAM EM, ATZ AM, McHUGH KE, et al. Preoperative steroid treatment does not improve markers of inflammation after cardiac surgery in neonates: results from a randomized trial. J Thorac Cardiovasc surg 2014; 147:902-8
- GUZZETTA NA, BAJAJ T, FAZLOLLAH T, et al. A comparison of heparin management strategies in infants undergoing cardiopulmonary bypass. Anesth Analg 2008; 106:419-25
- HEYING R, WEHAGE E, SCHUMACHER K, et al. Dexamethasone pretreatment provides antiinflammatory and myocardial protection in neonatal arterial switch operation. Ann Thoarc Surg 2012; 93:869-76
- HIRSCH JC, JACOBS ML, ANDROPOULOS D, et al. Protecting the infant brain during cardiac surgery: a systematic review. Ann Thorac Surg 2012; 94:1365-73
- HOOVER LR, DINAVAHI R, CHENG WP, et al. Jugular venous oxygenation during hypothermic cardiopulmonary bypass in patients at risk for abnormal cerebral autoregulation: influence of -stat versus pH-stat blood gas management. Anesth Analg 2009; 108:1389-93
- JONAS RA. Hypothermia, circulatory arrest, and the pediatric brain. J Cardiothorac Vasc Anesth 1996; 10:66-74
- JONAS RA, WYPIJ D, ROTH SJ, et al. The influence of hemodilution on outcome after 143 JOURNOIS D, POUARD P, GREELEY WJ, et al. Hemofiltration during cardiopulmonary bypass in pediatric cardiac surgery. Anesthesiology 1994; 81:1181-9
- JOURNOIS D, POUARD P, GREELEY WJ, et al. Hemofiltration during cardiopulmonary bypass in pediatric cardiac surgery. Anesthesiology 1994; 81:1181-9
- KERN FH, UNGERLEIDER RM, REVES JG, et al. The effect of altering pump flow rate on cerebral blood flow and cerebral metabolism in neonates, infants and children. Ann Thorac Surg 1993; 56:1366-72
- KURTH CD, STEVEN JM. Keeping a cool head. Anesthesiology 2000; 93:598-600
- MANGOUSH O, PARKAYASTHA S, HAJ-YAHIA S, et al. Heparin-bonded circuits versus nonheparin-bonded circuits. An evaluation of their effect on clinical outcomes. Eur J Cardiothorac Surg 2007 ; 31 :1058-69
- MANLHIOT C, GRUENWALD CE, HOLTBY HM, et al. Challenges with heparin-induced anticoagulation during cardiopulmonary bypass in children: impact of low antithrombin activity. J Thorac Cardiovasc Surg 2016; 151:444-50
- McAULIFFE JJ. Myocardial preservation. In : LAKE CL, ed. Pediatric cardiac anesthesia, 3rd edition. Stamford :Appleton & Lange, 1998, 259-83
- MEDIKONDA R, ONG CS, WADIA R, et al. Trends and updates on cardiopulmlnary bypass setup in pediatric cardiac surgery. J Cardiothorac Vasc Anesth 2019; 33:2804-13
- MUKHERJI J, HOOD RR, EDELSTEIN SB, et al. Overcoming challenges in management of critical events during cardiopulmonary bypass. Semin Cardiothorac Vasc Anesth 2014; 18:190-207
- MURKIN JM, FARAR JK, TWEED WA. Cerebral autoregulation and flow/metabolism coupling during cardiopulmonary bypass: the influence of PaCO2. Anesth Analg 1987; 66:825-32
- NAIK SK, KNIGHT A, ELLIOTT MJ. A prospective randomized study of a modified technique of ultrafiltration during pediatric open-heart surgery. Circulation 1991 ; 84 :III422-31
- PATEL RL, TURTLE MR, CHAMBERS DJ, et al. Alpha-stat acid-base regulation during cardiopulmonary bypass improves neuropsychologic outcomes in patients udergoing coronary artery bypass grapfting. J Thorac Cardiovasc Surg 1996; 111:1267-79
- PEARL JM, LAKS H, DRINKWATER DC, et al. Normocalcemic blood or crystalloid cardioplegia provides better neonatal myocardial protection than low-calcium cardioplegia. J Thorac Cardiovasc Surg 1993 ; 105 :201-6
- POUARD P, MAURIAT P, LABORDE N, BOURDARIAS B. Cicrulation extracorporelle en chirurgie cardiaque pédiatrique chez le nouveau-né, le nourrisson et l’enfant. In: JANVIER G, LEHOT JJ, eds. Circulation extracorporelle: principes et pratique, 2ème édition. Paris: Arnette (Groupe Liaison SA) 2004, 481-506
- RANUCCI M, BALDUINI A, DITTA A, et al. A systematic review of biocompatible cardiopulmonary bypass circuits and clinical outcomes. Ann Thorac Surg 1009 ; 87 :1311-9
- SEIFERT HA, JOBES DR, TEN HAVE T, et al. Adverse events after protamine administratioon following cardiopulmonary bypass in infants and children. Anesth Analg 2003; 97:383-9
- SWAIN JA, McDONALD TJ, ROBBINS RC, et al. Relationship of cerebral and myocardial intracellular pH to blood pH during hypothermia. Am J Physiol 1991 ; 260 :H1640-4
- WANG S, PALANZO D, UNDAR A, et al. Current ultrafiltration techniques before, during and after pediatric cardiopulmonary bypass procedures. Perfusion 2012; 27:438-46
- WARREN OJ, SMITH AJ, ALEXIOU C, et al. The inflammatory response to cardiopulmonary bypass : Part I – Mechanisms of pathogenesis. J Cardiothorac Vasc Anesth 2009 ; 23 :223-31
- WARREN OJ, WATRET AL, DeWIT KL, et al. The inflammatory response to cardiopulmonary bypass : Part II – Anti-inflammatory therapeutic strategies. J Cardiothorac Vasc Anesth 2009 ; 23 :384-93
- WATANABE T, HRITA H, KOBAYASHI M, et al. Brain tissue pH, oxygen tension and carbon dioxide tension in profoundly hypothermic cardiopulmonary bypass. J Thorac Cardiovasc Surg 1989; 97:396-401
- WESLEY MC, PEREIRA LM, SCHARP MA; et al. Pharmakinetics of tranexamic acid in neonates, infants and children undergoing cardiac surgery with cardiopulmonary bypass. Anesthesiology 2015; 122:746-58
- WHITING D, YUKI K, DINARDO JA. Cardiopulmonary bypass in the pediatric population. Best Pract Res Clin Anaesthesiol 2015; 29:241-56
- WHITLOCK RP, CHAN S, DEVEREAUX PJ, et al. Clinical benefit of steroid use in patients undergoing cardiopulmonary bypass : a meta-analysis of randomized trials. Eur Heart J 2008 ; 29 :2592-600
- WHITLOCK RP, DEVEREAUX PJ, TEOH KH, et al. Methylprednisolone in patients undergoing cardiopulmonary bypass SIRS): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 26:1243-53
- WYPIJ D, JONAS RA, BELLINGER DC, et al. The effect of hematocrit during hypothermic cardiopulmonary bypass in infant heart surgery: results from the combined Boston hematocrit trials. J Thorac Cardiovasc Surg 2008; 135:355-60
- WYPIJ D, NEWBURGER JW, RAPPAPORT LA, et al. The effect of duration of deep hypothermic circulatory arrest in infant heart surgery on late neurodevelopment: the Boston Circulatory Arrest Trial. J Thorac Cardiovasc Surg 2003; 126:1397-403
- YOUNG JN, CHOY IO, SILVA NK, et al. Antegrade cold blood cardioplegia is not demonstrably advantageous over cold crystalloid cardioplegia in surgery for congenital heart disease. J Thorac Cardiovasc Surg 1997 ; 114 :1002-9
