Evaluation préopératoire
La présence d’un souffle systolique râpeux chez la personne âgée est une découverte fréquente lors de l’examen préopératoire pour chirurgie non-cardiaque. L’échocardiographie confirme le diasgnostic et précise le degré de sténose. Cette situation pose deux questions essentielles:
- La sténose aortique implique-t-elle un risque opératoire excessif ?
- Si la sténose est serrée (S < 0.6 cm2/m2, ΔPmoy > 40 mmHg), un RVA est-il indiqué avant l’intervention planifiée ?
Lorsqu’elle est symptomatique (angor, syncope ou dyspnée) ou accompagnée d’une dilatation du VG (Dtd > 4 cm/m2), une sténose aortique serrée doit être corrigée avant de procéder à l’intervention non-cardiaque, quelle qu'elle soit [4,9]. Il est préférable d'utiliser une bioprothèse afin d'éviter les problèmes d'anticoagulation. Classiquement, seules des interventions urgentes et vitales ne pouvant pas souffrir de délai peuvent être envisagées en présence de sténose serrée symptomatique, parce que leur mortalité est ≥ 10%, allant jusqu’à 31% lorsque plus de trois autres comorbidités sont présentes [4,5].
Lorsque la sténose aortique est asymptomatique, il existe trois cas de figure (voir Figure 11.31A) [2,3,9].
- L'intervention prévue est majeure (chirurgie de l’aorte abdominale, chirurgie hépato-pancréatique, etc); dans ce cas, il est indiqué de prévoir un remplacement valvulaire aortique (RVA) avant la chirurgie non-cardiaque.
- La chirurgie prévue est de type intermédiaire ou mineur: le RVA ne se justifie pas. Même si elle est de 15-25%, la morbidité cardiaque est la même que chez les patients qui présentent une sténose mineure-à-modérée. Toutefois, plus la sténose est serrée, plus le risque d'hypotension peropératoire est élevé et plus le contrôle hémodynamique doit être rigoureux.
- La présence d’une dysfonction du VG aggrave le pronostic et renforce l’indication à un RVA préopératoire, mais cette indication est essentiellement basée sur le bénéfice à long terme du malade, car le RVA lui-même affiche une mortalité de 2% en-dessous de 70 ans et de 5% au dessus de 75 ans [2].
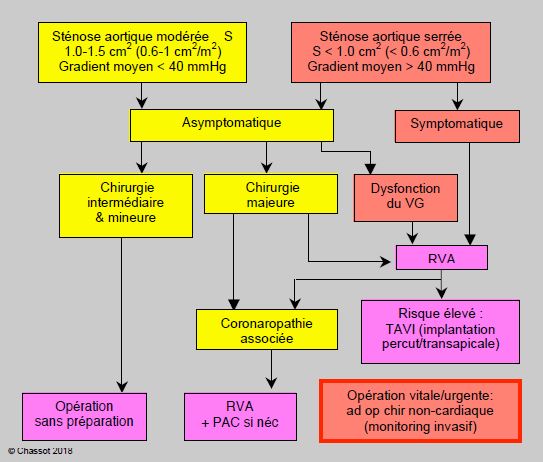
Figure 11.31A : Algorithme classique de prise en charge du malade porteur d’une sténose aortique [3]. Lorsqu’elle est symptomatique (angor, syncope et/ou dyspnée), une sténose aortique serrée découverte dans le préopératoire de chirurgie générale doit être opérée (remplacement valvulaire) avant de procéder à l’intervention non-cardiaque. Lorsque le patient doit subir une intervention élective majeure (chirurgie de l’aorte abdominale, chirurgie hépato-pancréatique), il est prudent de prévoir un remplacement valvulaire aortique (RVA) en cas de sténose serrée même asymptomatique ; par contre, une chirurgie intermédiaire ou mineure ne justifie pas un RVA préopératoire chez un patient asymptomatique. Dans les RVA à haut risque (mortalité prévisible > 10%), le remplacement en CEC peut être substitué par l’implantation percutanée ou transapicale d’une prothèse valvulaire montée dans un stent (TAVI). La présence d’une dysfonction du VG aggrave le pronostic et renforce l’indication à un RVA préopératoire. En cas de coronaropathie associée, on procède à des PAC simultanément au RVA. Si l’intervention est vitale ou urgente, on procède à la chirurgie générale sous cardioprotection d’aspirine et éventuellement de β-bloqueur s’il y a une indication, et sous couvert d'une prise en charge spécifique (anesthésie comme pour un RVA, monitoring invasif avec ETO, etc).
En effet, le RVA présente des risques et une mortalité qui lui sont propres (2-4%) [6]. Si la mortalité prévisible du RVA est > 8-10%, il peut être judicieux de remplacer l'opération en CEC par une implantation valvulaire par cathétérisme, ou TAVI (transcatheter aortic valve implantation), qui se conduit par voie trans-apicale ou trans-fémorale (voir Chapitre 10, Implantation valvulaire aortique). La valvuloplastie aortique par dilatation au ballon donne des résultats décevants dans les sténoses dégénératives et/ou calcifiées chez l'adulte âgé.
Avec les progrès de la prise en charge anesthésique basée sur un contrôle hémodynamique rigoureux, les dernières études comparatives entre porteurs de sténose aortique serrée et malades sans sténose tendent à montrer que les résultats de la chirurgie non-cardiaque sans RVA préalable sont acceptables, même si le risque est plus élevé [1,8]. Les porteurs de sténose serrée ont davantage de complications cardiaques (18.8% versus 10.5%), surtout liée à la décompensation ventriculaire, mais la mortalité à 30 jours est peu modifiée par rapport aux contrôles: patients symptomatiques 5.9% versus 3.1%, patients asymptomatiques 3.3% versus 2.7% [8]. Ces valeurs sont superposables à celles de la chirurgie à risque élevé et à risque intermédiaire dans la population générale. Du fait de ces bons résultats, il est proposé de restreindre le RVA aux malades symptomatiques (voir Figure 11.31B). La chirurgie non-cardiaque intermédiaire et majeure peut être conduite sans danger excessif chez les porteurs de sténose aortique serrée asymptomatiques. Si la mortalité prévisible du RVA est supérieure à 8%, il peut être préférable de procéder directement à la chirurgie non-cardiaque, selon son risque, en prenant soin de conduire l'anesthésie sous monitorage invasif et contrôle strict de l'équilibre hémodynamique. Le TAVI présente lui-même un risque opératoire de 5-8% [6,7].
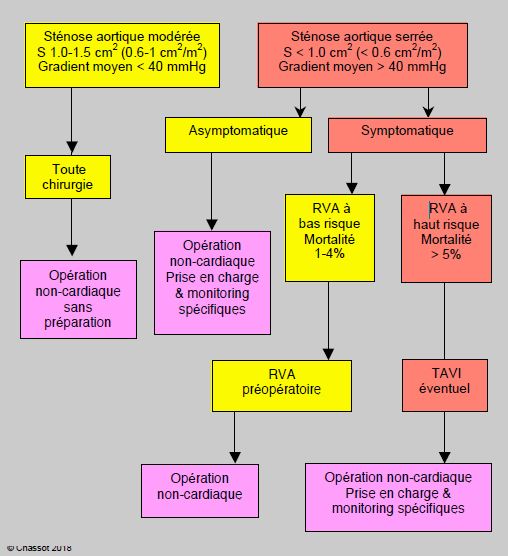
Figure 11.31B : Algorithme de prise en charge du malade porteur d’une sténose aortique selon les propositions récentes [1,8]. La chirurgie non-cardiaque intermédiaire et majeure peut être conduite sans danger excessif chez les porteurs de sténose aortique serrée asymptomatique. Le RVA préopératoire est indiqué chez les malades symptomatiques si sa mortalité prévisible est basse (1-4%). Si elle est supérieure à 5%, il peut être préférable de procéder à la chirurgie non-cardiaque, selon son risque. Le TAVI (implantation valvulaire aortique sur cathétérisme par voie trans-apicale ou trans-fémorale) présente lui-même un risque opératoire de 5-8%.
Technique d’anesthésie
La technique d’anesthésie et le monitorage doivent s’inspirer des recommandations faites pour l’anesthésie cardiaque.
- Induction lente avec cathéter artériel en place.
- Tolérance à l’IPPV jugée par une manœuvre de Valsalva avant l’induction.
- Monitorage :
- Cathéter artériel, surveillance du segment ST.
- ETO (fonction VG, volémie) si chirurgie majeure avec risque d’hypovolémie ; l’ETO est le meilleur moyen de diagnostic différentiel en cas d’hypotension aiguë (hypovolémie, dysfonction VG, ischémie, CMO).
- Swan-Ganz : peu informative, dangereuse (risque d’arythmies et de bloc AV complet).
- Agents d’induction :
- Propofol (hypotension sur baisse de précharge).
- Midazolam (hypotension sur baisse du tonus sympathique, réveil retardé).
- Etomidate (le plus sûr pour les cas à risque).
- Thiopental déconseillé (hypotension et tachycardie).
- Curare : éviter pancuronium (tachycardie).
- Hypotension : vasoconstricteur alpha, pas d’éphédrine.
- Maintien de l’anesthésie :
- Halogéné : sevoflurane (préférence), desflurane (interventions courtes) ; isoflurane déconseillé car trop vasodilatateur.
- Propofol (perfusion), midazolam (intervention longue, extubation tardive)
- IPPV avec la PEEP minimale (Pit moy basse, maintien du retour veineux).
- Hypotension plus dangereuse que l’hypertension (risque ischémique élevé) ; maintenir la PAM ≥ 80 mmHg avec des vasoconstricteurs (phényléphrine, nor-adrénaline).
- Soutien inotrope si nécessaire : dopamine (effets β+ α) ou combinaison dobutamine + nor-adrénaline (dobutamine seule : effet vasodilatateur systémique).
L’anesthésie générale est préférable à l’anesthésie loco-régionale rachidienne. En effet, le bloc sympathique provoque une hypotension profonde, essentiellement liée à une chute de précharge, et une tachycardie réflexe. Cette combinaison, particulièrement marquée lors de rachianesthésie, est hautement défavorable à l’hémodynamique de la sténose aortique serrée. Bien qu’on ne dispose pas d’études de haut degré d’évidence à ce sujet, l’anesthésie générale est habituellement recommandée comme technique de choix en cas de sténose aortique [4]. En cas de nécessité, une anesthésie péridurale est possible si le bloc est installé très progressivement.
| Anesthésie en cas de sténose aortique lors de chirurgie non-cardiaque |
|
Indications au RVA préopératoire :
- Sténose aortique serrée (< 0.6 cm2/m2) symptomatique
- Sténose aortique serrée avec dysfonction (FE < 0.5) ou dilatation (Dtd > 4 cm2/m2) du VG
Sténose aortique serrée asymptomatique : pas d’indication au RVA, mais risque opératoire augmenté de 3-5 fois ; seule les opérations vitales sont envisageables. Opérations majeures électives: envisager un RVA ou TAVI préopératoire si leur mortalité prévisible est < 8%.
Prise en charge anesthésique :
- ↑ précharge (hypovolémie mal tolérée)
- ↑ RAS (hypotension plus dangereuse que l’hypertension car risque ischémique ↑)
- Maintenir fréquence normale et rythme sinusal
- Monitorage : cathéter artériel, voie centrale
- IPPV avec PEEP minimale (Pit moy basse)
- ALR rachidienne : préférence à péridurale avec lente installation du bloc ; rachianesthésie déconseillée (↓ brusque de précharge et postcharge)
Hémodynamique recherchée en cas de sténose aortique
Précharge élevée
Vasoconstriction systémique (PAM ≥ 80 mmHg)
Fréquence normale, rythme sinusal
Soutien inotrope si dysfonction ventriculaire (Dtd > 4 cm/m2)
L’hypotension est plus dangereuse que l’hypertension
Ventilation en pression positive : Pit basse
Plein – Régulier – Fermé
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- AGARWAL S, RAJAMANICKAM A, BAJAJ NS, et al. Impact of aortic stenosis on postoperative outcomes after noncardiac surgery. Circ Cardiovasc Qual Outcomes 2013; 6:193-200
- BONOW RO, BROWN AS, GILLAM LD, et al. ACC/AATS/AHA/ASE/EACTS/HVS/SCA/SCAI/SCCT/SCMR/STS/ 2017 appropriate use criteria for the treatment of patients with severe aortic stenosis. J Am Coll Cardiol 2017; 70:2566-98
- CALLEJA AM, DOMMARAJU S, GADDAM R, et al. Cardiac risk in patients aged > 75 years with asymptomatic, severe aortic stenosis undergoing noncardiac surgery. Am J Cardiol 2010; 105:1159-63
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- KERTAI MD, BOUTIOUKOS M, BOERSMA M, et. Aortic stenosis: An underestimated risk factor for perioperative complications in patients undergoing noncardiac surgery. Am J Med 2004; 116:8-13
- OSNABRUGGE RL, KAPPETEIN AP, SERRUYS PW. Non-cardiac surgery in patients with severe aortic stenosis: time to revise the guidelines ? Eur Heart J 2014; 35:2346-8
- SAMARENDRA P, MANGIONE MP. Aortic stenosis and perioperative risk with noncardiac surgery. J Am Coll Cardiol 2015; 65:295-302
- TAHIRO T, PISLARU SV, BLUSTIN JM, et al. Perioperative risk of major non-cardiac surgery in patients with severe aortic stenosis: a reappraisal in contemporary pratice. Eur Heart J 2014; 35:2372-81
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
