Incidence de l’hypertension artérielle
L'hypertension artérielle (HTA) est probablement la maladie la plus fréquente de l’humanité, puisqu’on estime qu’elle touche un milliard d’individus et cause la mort de 7 millions de personnes par année [9]. C’est une affection dont l’incidence augmente avec l’âge ; du fait du vieillissement de la population, on la rencontre donc de plus en plus fréquemment en salle d’opération. Comme la pression artérielle s’élève avec les années à cause de la perte de souplesse de l’arbre vasculaire, on peut se demander à quel moment elle devient pathologique, puisque les accidents vasculaires auxquels elle est associée deviennent de plus en plus fréquents au fur et à mesure que l’on vieillit. Cela revient à dire que l’âge est une maladie ! C’est en tout cas un gigantesque marché pour l’industrie pharmaceutique, qui ne voit pas d’un mauvais œil la baisse du seuil de pression servant à définir la limite de l’hypertension.
L'hypertension est une affection multisystémique touchant principalement le coeur, l'arbre vasculaire, les reins et le cerveau. Le risque cardiovasculaire est d'autant plus grand que la pression est plus élevée, et pendant une plus longue durée. Entre 40 et 70 ans, chaque augmentation de 20 mmHg de la pression systolique double le risque de développer une maladie vasculaire, particulièrement une ischémie coronarienne ou un accident vasculaire cérébral. Ce risque s’élève dès que la pression systolique dépasse 120 mmHg et la diastolique 75 mmHg [16]. Chez un adulte, les valeurs normales de la pression artérielle (PA) sont 120-129 mmHg de PAsyst et 80-84 mmHg de PAdiast. Une PA de 130-139 / 85-89 mmHg est considérée comme normale-supérieure (high normal) ou pré-hypertensive [17]. Les principaux facteurs de risque associés à l’HTA sont l’âge, l’hypertrophie ventriculaire gauche, le syndrome métabolique, le tabagisme, la dyslipidémie et le diabète. Le risque de l’HTA est essentiellement lié aux lésions des organes-cibles : maladie cérébrovasculaire, coronaropathie, insuffisance ventriculaire, insuffisance rénale, polyartériopathie périphérique.
L'hypertension se définissait auparavant par l'augmentation de la pression diastolique. Cependant, l'analyse de grandes enquêtes épidémiologiques comme la Framingham Study ont révélé une association hautement significative entre le risque cardiovasculaire et la valeur de la pression systolique. Elle a aussi démontré une association très marquée entre le risque cardiovasculaire et la pression différentielle ou pression pulsée (PAsyst – PAdiast), mais une association négative avec la valeur de la pression diastolique [5,6]. Ceci est logique, puisque l'HTA est liée à la fois aux résistances artérielles et à la rigidité des gros vaisseaux. Dès la quarantaine, la pression systolique est une bonne représentation des résistances vasculaires, mais elle sous-estime la rigidité des vaisseaux; la pression pulsée est au contraire une bonne image de cette dernière. Le manque de distensibilité des artères donne lieu à deux phénomènes :
- L’aorte et les grandes artères élastiques ont normalement la capacité de se distendre en systole, ce qui amortit la pression systolique, et de restituer le volume en diastole, ce qui augmente le flux, donc la pression diastolique (voir Figure 21.5) ; nous sommes en quelque sorte physiologiquement contre-pulsés. Chez l’hypertendu, la rigidité des gros vaisseaux supprime cet effet d’amortissement systolique et de renforcement diastolique, ce qui augmente la PAsyst et baisse la PAdiast ; la différentielle augmente.
- La rigidité des parois artérielles fait que l'onde de pression réfléchie en périphérie (voir Figure 21.6) se propage plus rapidement (10-12 m/s) et revient au niveau des grandes artères pendant la systole déjà, et non pendant la diastole (voir Figure 21.7) ; la PAsyst augmente, alors que la PAdiast baisse [21].
Simultanément, la pression de perfusion coronarienne est diminuée du fait de la diastolique abaissée, mais la charge ventriculaire augmentée à cause de l'élévation de la pression systolique (Figure 21.8).

Figure 21.8 : Aspect analogique de la courbe artérielle. A : courbe normale. La pente ascensionnelle est fonction du dP/dt intraventriculaire (pour autant qu’il n’y ait pas de pathologie valvulaire aortique). La surface sous la courbe systolique est proportionnelle au volume systolique, la pente télésystolique et le niveau du dicrotisme sont fonction des résistances artérielles périphériques (RAS), l’amplitude est fonction de la rigidité des parois mais aussi de la volémie et des RAS. La pression artérielle moyenne (PAM) est calculée selon la formule : PAM = (PAsyst + 2 PAdiast) / 3. B : comparaison d’une courbe artérielle normale (en rouge) et de la courbe d’un patient souffrant d’athéromatose (en bleu), dont l’aorte est devenue rigide. 1 : augmentation de la pression systolique due à la superposition de l’onde réfléchie. 2 : augmentation de la postcharge du VG. 3 : diminution de la pression de perfusion coronarienne en diastole. La flèche bleue indique la pression de perfusion réelle des organes, qui est celle générée par le volume systolique et non celle additionnée du retour de l'onde de pression.
Les évènements cardiovasculaires sont davantage liés au stress pulsatile des gros vaisseaux pendant la systole qu'au stress stable lié aux résistances des petites artères en diastole [5]. Ainsi, une augmentation de la systolique est associée à un risque cardiovasculaire accru, quelle que soit la diastolique, mais pour une même valeur systolique, les patients qui ont une diastolique basse sont plus à risque que ceux qui ont une diastolique haute, car leur différentielle est plus grande (Figure 21.19) [7,21].
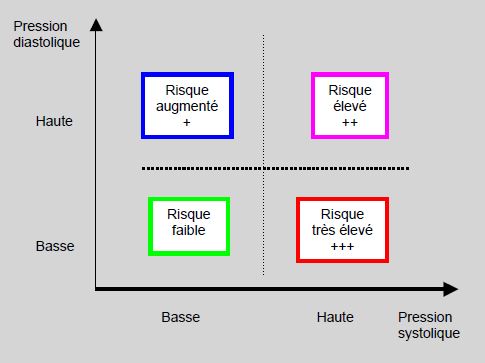
Figure 21.19 : Représentation schématique du risque cardiovasculaire en fonction de la pression systolique et de la pression diastolique [21].
La situation dans laquelle est mesurée la pression a son influence sur le résultat. L'"effet blouse blanche" élève la systolique d'au moins 10 mmHg. Des stresseurs chroniques (soucis professionnels, problèmes affectifs) peuvent obliger à augmenter les doses d'hypotenseurs, car ils sont susceptibles d'accroître la pression de 40-50 mmHg, alors que la vasodilatation induite par la chaleur estivale contraint à diminuer les dosages sous peine d'épisodes hypotensifs sévères. La mesure la plus fiable est obtenue le matin à la maison par un sphygmomanomètre automatique, lorsque l'effet des substances hypotensives est minimal; si elle est bien contrôlée (130/80 mmHg), le risque d'accident cardiovasculaire est bas, même si la pression mesurée en cabinet médical est de l'ordre de 150 mmHg [14].
Définition de l’hypertension artérielle
L'hypertension est classifiée en quatre stades [11,17] :
- HTA stade I: PAsyst 140-159 mmHg PAdiast 90-99 mmHg
- HTA stade II: PAsyst 160-179 mmHg PAdiast 100-109 mmHg
- HTA stade III: PAsyst 180-209 mmHg PAdiast 110-119 mmHg
- HTA stade IV: PAsyst ≥ 210 mmHg PAdiast ≥ 120 mmHg
Cette définition fait que le 40% de la population occidentale adulte peut être considéré comme hypertendu, et, de ce fait, doit être traité comme tel pour contrôler le risque cardiovasculaire [18]. Les qualificatifs de légère, modérée ou sévère ne s’utilisent plus guère pour l’hypertension, car ils n’ont pas de corrélation avec le risque cardiovasculaire. Ce dernier est lié à l’atteinte des organes-cibles ; il reste très faible même au stade II-III en l’absence de facteurs de risque ou de lésions organiques, alors qu’il est modéré à sévère au stade I en présence de diabète, d’ischémie myocardique, d’insuffisance rénale ou d’AVC [17]. L’évidence en faveur d’un traitement au stade I est très faible, et aucune donnée ne permet de justifier un traitement en dessous de 150 mmHg chez la personne âgée de > 70 ans [13,17]. La courbe du risque en fonction de la valeur de PA a une forme en "J" : le gain est minime à abaisser la PA jusqu’à sa valeur normale (120-130/80-85 mmHg), sauf peut-être pour le risque d’AVC. Deux grandes études randomisées ont démontré que la protection maximale contre les complications cardiovasculaires était obtenue avec une pression de 130-140 / 80-85 mmHg [3,10]. La récente étude SPRINT a cependant jeté un pavé dans la mare en révélant une baisse de 25% du risque cardiovasculaire et de 27% de la mortalité dans le groupe sous contrôle strict (PAsyst moyenne 121 mmHg) par rapport au groupe standard (PAsyst moy 136 mmHg) [1]. Le gain porte essentiellement sur le taux de décompensation cardiaque plutôt que sur celui d'AVC, mais les effets secondaires importants (hypotension, chute, dysfonction rénale) tempèrent toutefois le bénéfice. Pour intéressants qu'ils soient, ces résultats ne modifient pas les recommandations actuelles de viser une pression maximale de 140/80 mmHg en-dessous de 60 ans, de 150/90 mmHg entre 60 et 80 ans, et de 160/90 mmHg au-delà de 80 ans [11,13,17,20,23]. Chez les malades de > 60 ans qui ont une anamnèse d'AVC ou d'AIT et chez ceux qui ont un risque cardiovasculaire élevé, il est recommandé de maintenir la PAsyst < 140 mmHg [20,23]. Cette attitude entraine un risque certain d'hypotension en peropératoire. Or la mortalité postopératoire à 30 jours augmente chez la personne âgée lorsque la PAsyst est < 120 mmHg en cours d'intervention [22].
Risque périopératoire
L'HTA représente-t-elle un risque périopératoire significatif ? En d'autres termes, est-il justifié de renvoyer une intervention pour se donner le temps de contrôler l'hypertension ? D'une méta-analyse de 126 études, il ressort que l'hypertension est un facteur de risque mineur, qui a très peu d'influence sur le devenir périopératoire des patients [12]. Ce sont les dommages causés aux organes-cibles (hypertrophie et insuffisance ventriculaire gauche, coronaropathie, maladie cérébrovasculaire, néphropathie hypertensive) qui ont un impact définitif sur l'augmentation du risque opératoire, mais la maladie hypertensive en soi n'en n'a pas, sauf en cas de poussée maligne [15]. En l'absence de lésion organique, il n'existe pas d'évidence qu'une HTA stade I ou II ait un effet sur le devenir des patients [9,11]. En préopératoire, il est important de rechercher scrupuleusement l’atteinte des organes-cibles.
- Cardiopathie hypertensive (HVG) :
- ECG (QRS de haut voltage et de durée > 100 msec, déviation axiale gauche à > – 30°, S en V1 + R en V5, S en V3 + R en aVL) ;
- Echocardiographie (hypertrophie concentrique du VG, dilatation de l’OG, insuffisance diastolique) ;
- Ischémie myocardique ;
- Anamnèse d’AIT ou d’AVC ;
- Dysfonction rénale : créatininémie > 150 μmol/L, clairance abaissée.
En chirurgie cardiaque, toutefois, une hypertension systolique isolée sans élévation de la diastole, donc avec une pression différentielle élevée, cause une augmentation faible mais significative (odds ratio 1.3) de la morbidité cardiovasculaire périopératoire [2]. La corrélation avec l’AVC, l’insuffisance rénale et la mortalité est claire lorsque la pression pulsée (PAs – PAd) est > 80 mmHg [4].
D'une manière générale, seules la crise hypertensive maligne et l'HTA fixée à plus de 180/110 mmHg sont des indications au renvoi d'une opération élective [11].
Instabilité hémodynamique
Les patients hypertendus sont connus pour être instables en anesthésie ; les fluctuations autour de la pression de base dépassent 20%. La baisse de pression qui a lieu à l'induction est importante surtout parce que la pression à l'état de veille est haute, mais le nadir atteint est le même que chez les patients normotendus [8]. La réactivité vasculaire périphérique aux stimuli sympathiques est exagérée. La vasoconstriction chronique conduit à un rétrécissement du volume circulant, qui devient faible, donc très influencé par les interactions cardio-respiratoires. De plus, les médicaments antihypertenseurs interfèrent avec les régulations hémodynamiques lors de l'anesthésie et rendent le contrôle de la pression plus difficile.
Le coeur est l'organe-cible le plus touché. L'augmentation chronique de la postcharge du VG a plusieurs conséquences [19].
- Hypertrophie ventriculaire gauche (HVG) concentrique (réplication en parallèle des sarcomères); la vélocité de contraction est basse; le volume intraventriculaire est petit; la fraction d'éjection est normale ou élevée.
- Dysfonction ventriculaire diastolique: le myocarde épais est rigide, la vitesse de relaxation est abaissée, la compliance est faible (apparition d'un B4 à l'auscultation) et la précharge optimale est élevée; 30-50% du remplissage diastolique est assuré par la contraction auriculaire (le passage en FA peut être catastrophique) (voir Figure 21.4). Le remodelage anatomique donne la silhouette d’un petit VG épais et d’une dilatation de l’oreillette gauche. Une stase en amont et une dyspnée peuvent survenir par dysfonction diastolique, alors que la fonction systolique est encore dans les limites de la norme (FE > 0.5); comme le septum est une paroi commune aux deux ventricules, le VD développe également une insuffisance diastolique progressive.
- Demande en O2 augmentée: la tension de paroi et la force de compression intra-myocardique sont élevées. Simultanément, l'épaisseur du muscle et la compression des couches profondes de la paroi ventriculaire compromettent la perfusion coronarienne sous-endocardique. D’autre part, la baisse de la pression diastolique diminue l’apport. Le risque ischémique est élevé.
- La dépendance extrême des conditions de remplissage et le petit volume circulant rendent ces patients très sensibles aux variations de la précharge: agents anesthésiants (midazolam, propofol), curares (pooling veineux intramusculaire), ventilation en pression positive (baisse du retour veineux au coeur droit), position sur table.
Hypertension aiguë postopératoire
Une poussée hypertensive passagère se développe environ 2 heures après l’intervention chez 0.6-2.0% des patients [4]. La pression systolique augmente de 20% et la pression diastolique dépasse 100 mmHg, à cause de l’activation du système sympathique et du système rénine-angiotensine. Cette poussée est liée au réveil, à la douleur, aux frissons, à l’hypovolémie, à la rétention urinaire, à l’hypoventilation et la présence d’une HTA sous-jacente. Elle est la plus fréquente après chirurgie carotidienne ou intracrânienne et après chirurgie de l’aorte abdominale. L’interruption préopératoire du traitement anti-hypertenseur est fréquemment en cause.
| Risques cardiovasculaires de l’HTA |
|
Les risques cardiovasculaires de l’HTA sont liés à la PA différentielle (PAsyst – PAdiast). Ils sont significatifs lorsque la PAdiff est > 80 mmHg. Hormis la poussée hypertensive maligne et la PA > 180/100 mmHg de manière fixée, l'HTA n'est pas une indication au renvoi d'une opération.
Le risque opératoire en cas d’hypertension artérielle (HTA) est déterminé par les lésions sur les organes-cibles (cerveau, cœur, reins), mais non par la valeur de la pression artérielle. Répercussions cardiaques de l’HTA : hypertrophie ventriculaire gauche concentrique, dysfonction diastolique, risque ischémique sous-endocardique.
|
© CHASSOT PG, Septembre 2007, dernière mise à jour, Décembre 2018
Références
- AMBROSIUS WT, CHEUNG AK, CUSHMAN WC, et al. The SPRINT Research Group. A randomized trial of intensive versus standard blood pressure control. N Engl J Med 2015; 373:2103-16
- ARONSON S, BOISVERT D, LAPP W. Isolated systolic hypertension is associated with adverse outcomes from coronary artery bypass grafting surgery. Anesth Analg 2002; 94:1079-84
- CUSHMAN WC, EVANS GW, BYINGTON RP, et al. The ACCORD Sttudy Group. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362:1575-85
- FONTES ML, VARON J. Perioperative hypertensive crisis: newer concepts. Int Anesthesiol Clin 2012; 50:40-58
- FRANKLIN SS. Cardiovascular risks related to increased diastolic, systolic and pulse pressure. An epidemiologist's point of view. Pathol Biol 1999; 47:594-603
- FRANKLIN SS, KHAN SA, WONG ND, et al. Is pulse pressure useful in predicting risk for coronary heart disease. The Framingham heart study. Circulation 1999; 100:354-60
- GASOWSKI J, FAGARD RH, STAESSEN J, et al. Pulsatile blood pressure component as predictor of mortality in hypertension: a meta-analysis of clinical triaé control groups. J Hypertens 2002; 20:145-51
- GOLDMAN L, CALDERA DL. Risks of general anesthesia and elective operation in the hypertensive patient. Anesthesiology 1979; 50:285-92
- HANADA S, KAWAKAMI H, GOTO T, et al. Hypertension and anesthesia. Curr Opin Anesthesiol 2006;19:315-9
- HANSSON L, ZANCHETTI A, CARRUTHERS SG et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1988; 351:1755-62
- HARTLE A, McCORMACK T, CARLISLE J, et al. The measurement of adult blood pressure and management of hypertension before elective surgery. Joint Guidelines from the Association of Anaesthetists of Great Britain and Ireland and the British Hypertension Society. Anaesthesia 2016; 71:326-37
- HOWELL SJ, SEAR JW, FOËX P. Hypertension, hypertensive heart disease and perioperative cardiac risk. Br J Anaesth 2004; 92:570-83
- JAMES PA, OPARIL S, CARTER BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eight Joint National Committee (JNC 8). JAMA 2014; 311:507-20
- KARIO K, et al. Home blood pressure and cardiovascular outcomes in patients during antihypertensive therapy: primary results of HONEST, a large-scale prospective, real-world observational study. Hypertension 2014; 64:989_96
- LEE TH, MARCANTONIO ER, MANGIONE CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LEWINGTON S, CLARKE R, QIZILBASH N, et al. Age-speciific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002; 360:1903-13
- MANCIA G, FAGARD R, NARKIEWICZ K, et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension. The task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34: 2159-219
- O'BRIEN E, STAESSEN JA. Critical appraisal of the JNC VI WHO / ISH and BHS guidelines for essential hypertension. Expert Opin Pharmacother 2000; 1:675-82
- PRIEBE HJ. The aged cardiovascular risk patient. Br J Anaesth 2000; 85:763-78
- QASEEM A, WILT TJ, RICH R, et al. Pharmacologic treatment of hypertension in adults aged 60 years or older to higher versus lower blood pressure targets: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med 2017; 166:430-7
- STRANDBERG TE, PITKALA K. What is the most important component of blood pressure: systolic, diastolic or pulse pressure ? Curr Opin Nephrol Hypertens 2003; 12:293-7
- VENKATESAN S, MYLES P, MANNING HJ, et al. Cohort study evaluating preoperative blood pressure values and rik of 30-day mortality following elective non-cardiac surgery. Br J Anaesth 2017; 119:65-7
- WHELTON PK, CAREY RM, ARONOW WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/AphA/ASH/ASPC/NMA/PVNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary. J Am Coll Cardiol 2018; 71:2199-269
