L’implantation percutanée (fémorale, sous-clavière), transapicale (mini-thoracotomie) ou trans-aortique (mini-sternotomie) d’une bioprothèse aortique montée dans un stent métallique (transcatheter aortic valve implantation ou TAVI) était réservée jusqu'ici aux malades âgés et à haut risque, dont la mortalité probable au cours d’un remplacement valvulaire aortique en CEC est prohibitive (> 20%), mais dont l’espérance de vie est > 1 an. L'arrivée de dispositif plus performants et l'expérience acquise ces dernières années par les praticiens ont étendu l'indication à des patients à risque intermédiaire; le TAVI devient une alternative moins invasive et plus rapide que le RVA chirurgical. L'anesthésie générale et l'utilisation de l'ETO sont de plus en plus réservées aux cas lourds, aux pathologies valvulaires complexes et à la phase d'apprentissage de la technique. Les centres qui ont un haut débit et une grande routine du TAVI ont tendance à procèder sous sédation-analgésie et échocardiographie transthoracique (ETT) dans une proportion d'au moins deux tiers des cas [14]. En effet, la miniaturisation du matériel, les développements technologiques et la compétence des opérateurs permettent de n'utiliser que le guidage radiologique et le contrôle par ETT. Toutefois, l'ETO fournit des images 2D et 3D de meilleure qualité et de manière continue, permettant ainsi une évaluation de la procédure en temps réel, sans irradiation ni produit de contraste [15].
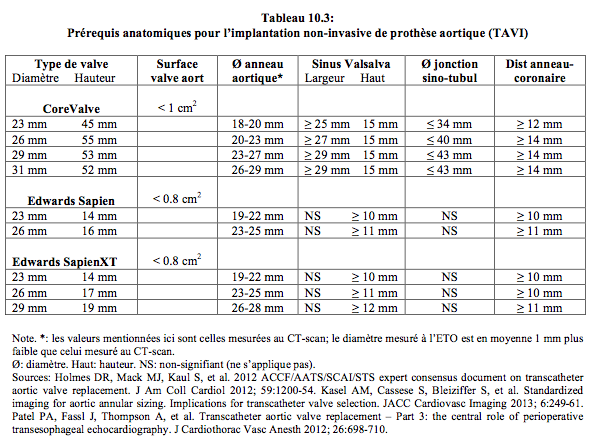
L’anatomie de la valve native doit correspondre aux exigences de la prothèse (tricuspidie, dimensions de l’anneau et de la racine aortique, distance des ostia coronariens). Si les accès vasculaires sont problématiques ou l’aorte trop athéromateuse, on préfère la voie transapicale. Les deux premiers types de valves montées sur cathéter sont la CoreValve™ et l’Edwards Sapien™, mais il existe actuellement une série de nouvelles prothèses qui présentent chacune des améliorations techniques (voir Figure 10.20) (voir Chapitre 10, Indications et résultats du TAVI).
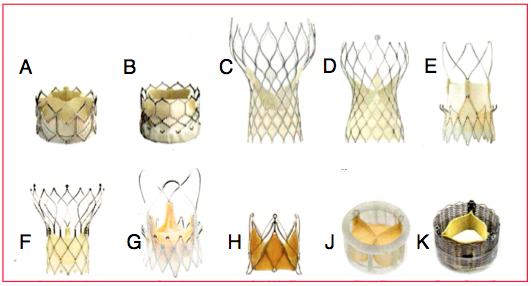
Figure 10.20 : Exemples de valves aortiques biologiques implantables (transcatheter aortic valve implantation ou TAVI). A: Edwards Sapien XT™. B : Edwards Sapien 3™. C : Medtronic Corevalve™. D : Medtronic Corevalve Evolut™. E : Symetis Acurate neo™. F : St.Jude Medical Portico™. G : Symetis Acurate TA™. H : JenaValve™. J : Direct Flow Medical™. K : Boston Scientific Lotus™. Les valves Sapien™ en péricarde bovin, fixées dans un stent en acier inoxydable souple, sont dilatées au moyen d’un ballon lors de sa mise en place. Les valves Corevalve™ en péricarde porcin sont montées dans un stent auto-expensif en nitinol. Les valves Acurate sont montées dans un stent auto-expansif en nitinol; elles peuvent être repositionnées en cours d'intervention et laissent les ostia coronariens accessibles ; le modèle Acurate neo™ est utilisée par voie transapicale, le modèle Acurate TA™ par voie transfémorale. La valve Acurate TA™ et la JenaValve™ consistent en une valve porcine native montée dans une structure auto-expansive [Arsalan M, Walther T. Durability of prostheses for transcatheter aortic valve implantation. Nat Rev Cardiol 2016; 13:360-7].
Le TAVI offre peu d’avantage en terme de survie à long terme par rapport au RVA en CEC, mais il améliore la situation clinique des patients à haut risque et diminue la mortalité opératoire d’environ un tiers [18]. Il réduit le taux d’insuffisance rénale, de fibrillation auriculaire, d’hémorragie et de transfusion. Il accélère la procédure et L’incidence d’AVC (2-5%), d'insuffisance aortique résiduelle (8-15% de degré ≥ 2) et de pacemaker permanent (5% avec valve Sapien™, 31% avec CoreValve™) est cependant plus élevée que lors de RVA [11].
ETO pré-interventionnelle
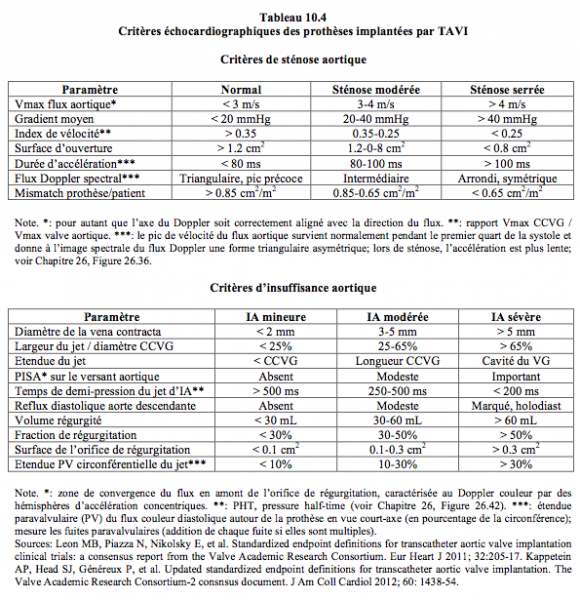
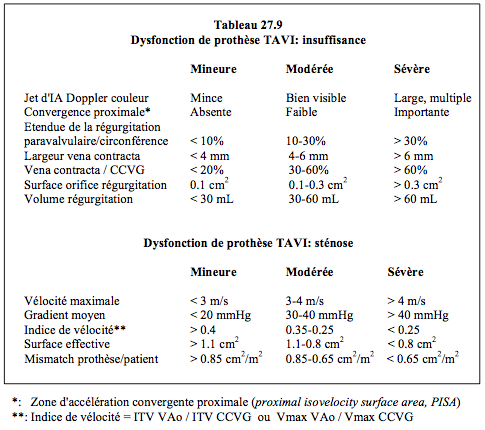
L’échocardiographie doit confirmer la compatibilité de l’anatomie avec les prérequis de chaque type de prothèse (voir Tableau 10.3) [8]. L’ETO bidimensionnelle (2D) permet d’obtenir des vues et des mesures importantes (Vidéos) (voir Chapitre 26, Imagerie 2D et 3D/Insuffisance aortique et Imagerie 2D et 3D/Sténose aortique).
L’anatomie de la valve native doit correspondre aux exigences de la prothèse (tricuspidie, dimensions de l’anneau et de la racine aortique, distance des ostia coronariens). Si les accès vasculaires sont problématiques ou l’aorte trop athéromateuse, on préfère la voie transapicale. Les deux premiers types de valves montées sur cathéter sont la CoreValve™ et l’Edwards Sapien™, mais il existe actuellement une série de nouvelles prothèses qui présentent chacune des améliorations techniques (voir Figure 10.20) (voir Chapitre 10, Indications et résultats du TAVI).

Figure 10.20 : Exemples de valves aortiques biologiques implantables (transcatheter aortic valve implantation ou TAVI). A: Edwards Sapien XT™. B : Edwards Sapien 3™. C : Medtronic Corevalve™. D : Medtronic Corevalve Evolut™. E : Symetis Acurate neo™. F : St.Jude Medical Portico™. G : Symetis Acurate TA™. H : JenaValve™. J : Direct Flow Medical™. K : Boston Scientific Lotus™. Les valves Sapien™ en péricarde bovin, fixées dans un stent en acier inoxydable souple, sont dilatées au moyen d’un ballon lors de sa mise en place. Les valves Corevalve™ en péricarde porcin sont montées dans un stent auto-expensif en nitinol. Les valves Acurate sont montées dans un stent auto-expansif en nitinol; elles peuvent être repositionnées en cours d'intervention et laissent les ostia coronariens accessibles ; le modèle Acurate neo™ est utilisée par voie transapicale, le modèle Acurate TA™ par voie transfémorale. La valve Acurate TA™ et la JenaValve™ consistent en une valve porcine native montée dans une structure auto-expansive [Arsalan M, Walther T. Durability of prostheses for transcatheter aortic valve implantation. Nat Rev Cardiol 2016; 13:360-7].
Le TAVI offre peu d’avantage en terme de survie à long terme par rapport au RVA en CEC, mais il améliore la situation clinique des patients à haut risque et diminue la mortalité opératoire d’environ un tiers [18]. Il réduit le taux d’insuffisance rénale, de fibrillation auriculaire, d’hémorragie et de transfusion. Il accélère la procédure et L’incidence d’AVC (2-5%), d'insuffisance aortique résiduelle (8-15% de degré ≥ 2) et de pacemaker permanent (5% avec valve Sapien™, 31% avec CoreValve™) est cependant plus élevée que lors de RVA [11].
ETO pré-interventionnelle
L’échocardiographie doit confirmer la compatibilité de l’anatomie avec les prérequis de chaque type de prothèse (voir Tableau 10.3) [8]. L’ETO bidimensionnelle (2D) permet d’obtenir des vues et des mesures importantes (Vidéos) (voir Chapitre 26, Imagerie 2D et 3D/Insuffisance aortique et Imagerie 2D et 3D/Sténose aortique).
- Vue court-axe 40°: évaluation des 3 cuspides, mobilité, calcifications, fusions commissurales, éventuelle bicuspidie, taille et position des ostia coronariens; présence d’IA (flux couleur); planimétrie de l’ouverture systolique (surface) (voir Figure 10.23).
- Vue long-axe 120-140°: ouverture systolique, calcifications de la racine aortique et de l’aorte ascendante ; présence d’une insuffisance aortique (flux couleur). Evaluation du diamètre de l’anneau aortique en mésosystole mesuré entre les points d’articulation du feuillet coronarien droit et du feuillet non-coronaire ; la mesure est réalisée sur les bords internes de la structure (trailing edge-to-leading edge) (voir Figure 10.24). Diamètres au niveau des sinus de Valsalva, de la jonction sino-tubulaire et de l’aorte ascendante. Distance entre l’anneau aortique et l’ostium coronarien droit. Diamètre et éventuelle hypertrophie de la chambre de chasse du VG (CCVG) ; exclusion d’une sténose sous-aortique dynamique, qui interfère avec le déploiement de la CoreValve™. De fortes calcifications limitent la précision de la mesure, en particulier pour la partie antérieure de l’anneau qui est masquée par l’ombre des calcifications postérieures. Il est judicieux de répéter la mesure au moins 3 fois sur différents cycles cardiaques.
- Vues transgastriques profonde 0° et long-axe 120°: flux dans la CCVG (Doppler pulsé) et à travers la valve (Doppler continu); flux couleur (insuffisance aortique). Calcul du gradient à travers la valve aortique et la chambre de chasse selon l’équation modifiée de Bernoulli : ΔP = 4 • (V2VAo - V2CCVG); calcul de la surface de la valve aortique par l’équation de continuité.
- Diagnostic et localisation d’athéromes dans l’aorte ascendante, la crosse et l’aorte descendante; des lésions sévères ou mobiles sont une contre-indication à la voie d’accès fémorale. La dilatation de la racine aortique est une contre-indication au TAVI.
Vidéo: vue court-axe 40° d'une valve aortique normale.
Vidéo: vue long-axe 120° normale de la valve aortique.
Vidéo: vue 5-cavités transgastrique profonde avec la valve aortique au centre de l'écran.
Vidéo: vue transgastrique long-axe 120° de la valve aortique.
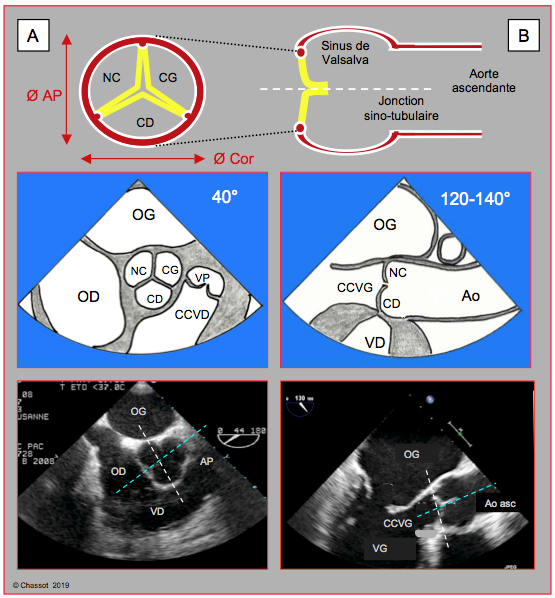
Figure 10.23 : Corrélation anatomo-échocardiographique des 2 plans de coupe de la valve aortique : vues ETO rétrocardiaques mi-oesophagiennes en court-axe à 40° (A) et en long axe à 120-140° (coupe sagittale) (B). Pour chacune des 2 vues sont illustrés verticalement le schéma de l’aorte, le schéma de la vue ETO et l’image ETO bidimensionnelle. L’anneau aortique est elliptique, alors que l’aorte ascendante est circulaire. Le diamètre antéro-postérieur (Ø AP) est plus court que le diamètre gauche-droit ou diamètre coronal (Ø Cor). Sur l’image en court-axe (à gauche), le traitillé blanc représente l’intersection avec le plan à 120-140° ; sur l’image en long-axe (à droite), il représente l’intersection avec le plan à 40°. Le traitillé bleu est l’intersection avec le troisième plan, qui est un plan long-axe perpendiculaire à celui de l’ETO mais qui est situé en avant du capteur oesophagien (plan gauche-droit, coronal ou frontal) et qui n’intercepte pas ce dernier ; il n’est donc visible qu’en ETO tridimensionnelle.
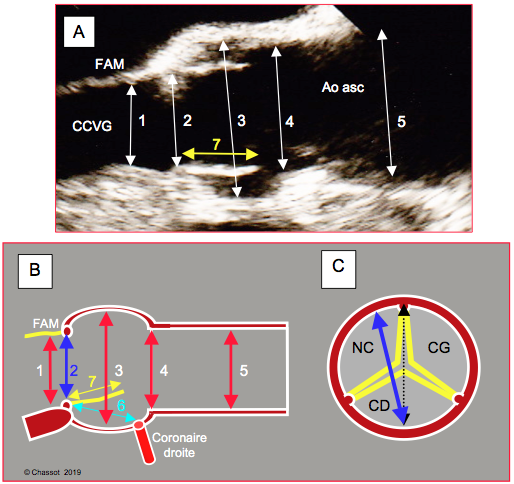
Figure 10.24 : Evaluation ETO préopératoire des diamètres aortiques. A : diamètres en long axe 120°. 1 : chambre de chasse du VG ; 2 : anneau aortique (mesure sur le bord interne, trailing edge-to-leading edge) ; 3 : sinus de Valsalva ; 4 : jonction sino-tubulaire ; 5 : aorte ascendante (au croisement de l’artère pulmonaire droite) ; 7 : hauteur de la cuspide. Ces diamètres se mesurent en systole. FAM : feuillet antérieur de la valve mitrale ; CCVG : chambre de chasse du VG. B : représentation schématique des mêmes diamètres. 6 : distance entre l’anneau aortique et l’ostium coronarien droit ; 7 : hauteur de la cuspide droite (jaune) ; normalement, 6 est > 7. C : le diamètre de l’anneau aortique (en bleu) tel qu’on le mesure en vue long-axe 120° projeté sur la vue court-axe; il est légèrement plus étroit que le diamètre anatomique réel (en pointillé), parce qu’il ne passe pas réellement par le centre de l’anneau, mais un peu antérieurement à celui-ci.
L’ETO 2D évalue le petit diamètre de l’ellipse de l’anneau aortique et n’a pas accès au grand diamètre. L’ETO tridimensionnelle (3D) pallie ce défaut. Il est recommandé de procéder en plusieurs étapes pour l’imagerie 3D (voir Figure 10.25 A) [10,16].
- Centrer l’image de la valve en court-axe et en long-axe au milieu de l’écran ; la qualité de l’image 2D détermine celle de la reconstruction 3D.
- Acquisition en mode full volume d’un volume contenant la CCVG, la racine aortique et le début de l’aorte ascendante (cadence > 10 images/s) ; l’enregistrement se fait en apnée.
- Orientation des plans transverse, sagittal et coronal sur le volume reconstruit.
- Coupe transverse passant par la partie la plus amont des cuspides (points d’articulation avec l’anneau aortique) ; l’anneau est de forme ovale.
- Mesure des diamètres de l’anneau dans le plan sagittal (petit diamètre) et coronal (grand diamètre).
- Mesure des distances entre l’anneau aortique et l’ostium droit (plan sagittal) et entre l’anneau et l’ostium gauche (plan coronal) (Figure 10.25A).
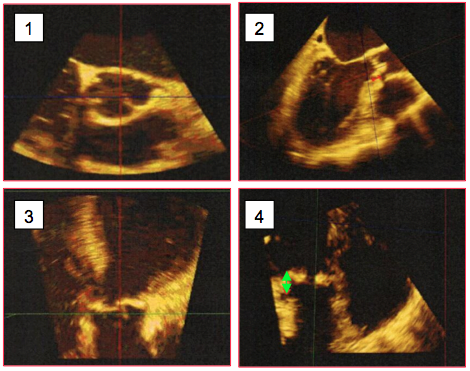
Figure 10.25 A: Mesures préopératoires de la racine aortique par ETO 3D. 1 : court-axe de l’anneau aortique (plan transverse). 2 : long-axe de l’anneau (plan coronal) ; ce plan n’est pas réalisable en ETO 2D. 3 : mesure de la distance à l’ostium droit. 4 : mesure de la distance à l’ostium gauche [Achenbach S, et al. J Cardiovasc Comput Tomogr 2012; 6:366-80. Ferrari E, et al. Ann Thorac Surg 2010; 89:1925-32. Mukherjee C, et al. J Cardiothorac Vasc Anesth 2013; 27:654-9. Patel PA, et al. J Cardiothorac Vasc Anesth 2012; 26:698-710].
Ces mesures ont importantes, car il est recommandé de surdimensionner (oversizing) la prothèse de 5-10% (1-3 mm) par rapport aux mesures pour assurer une bonne étanchéité entre la prothèse et l’anneau aortique [17]. Cette attitude diminue le risque de fuite paravalvulaire et d’embolisation après l’implantation de la valve. Toutefois, un excès de surdimensionnement peut conduire à un déploiement partiel de la prothèse qui limite les mouvements de ses feuillets; une prothèse trop grande gène également les mouvements du feuillet mitral antérieur, induit une insuffisance intra-valvulaire, et peut causer une lésion des tissus de conduction (bloc AV), une obstruction ostiale coronarienne ou même une rupture de l’anneau aortique. A l’inverse, le choix d’une prothèse trop petite entraîne un écartement excessif de ses feuillets avec une fuite centrale, une forte incidence de fuite paravalvulaire et un risque d’embolisation.
Technique d’implantation
Trois approches sont possibles pour implanter une valve aortique (voir Chapitre 10, Technique d'implantation valvulaire aortique) [19].
- Voie percutanée rétrograde par canulation de l’artère fémorale. Le diamètre des vaisseaux et l’absence de tortuosité sont les critères majeurs de faisabilité de cette voie. C’est la voie préférentielle en cardiologie interventionelle. Elle est plus aisée en cas d’anévrysme apical ou de status adhérentiel et cicatriciel dans le péricarde (péricardite, irradiation, réopération). Elle peut se pratiquer sous sédation-anaégésie et permet une une hospitalisation plus brêve. Bien que d’apparence moins invasive, elle présente certains inconvénients: vaisseaux de > 8 mm de diamètre, lésions artérielles, blocage par des sténoses ou des tortuosités, risque d’accident neurologique par embolisation de matériel athéromateux de l’aorte ascendante et de la crosse aortique détaché par les cathéters.
- Voie transapicale antérograde par mini-thoracotomie antérieure gauche (incision de 5-6 cm) à travers le 5ème ou le 6ème espace intercostal. Elle est plus invasive et réclame une anesthésie générale, mais elle est mieux adaptée en cas de vasculopathie périphérique et d’athéromatose aortique (aorte porcelaine) ; elle présente probablement un risque d’AVC un peu plus faible. Les malades chez qui cette voie est préférée sont souvent diabétiques et/ou polyvasculaires, présentent des antécédants d’ictus, d’infarctus ou de BPCO, et ont des scores de risque plus élevés que ceux chez qui on choisit la voie fémorale. D’ailleurs, la voie apicale affiche un excès de mortalité par rapport à la voie fémorale (11.5% vs 7.2%) [3]. Elle occasionne également davantage d’hémorragie, de transfusion et de dialyse [2]. La courte distance entre l’apex et la valve rend les manipulations plus précises. Les inconvénients de cette voie sont l'invasivité, la nécessité d'une anesthésie générale, la ventriculotomie apicale, le risque de tamponnade et la douleur postopératoire [1].
- Voie transaortique par ministernotomie haute. Egalement pratiquée sous anesthésie générale, elle présente moins de problèmes respiratoires et douloureux que la voie apicale par thoracotomie, et supprime les risques liés à la ventriculotomie apicale. Elle a également l’avantage de pouvoir compléter la sternotomie si une conversion en CEC s’impose. Après confection d’une bourse sur l’aorte ascendante, la canulation directe donne le même accès à la valve aortique que lors de canulation fémorale, mais elle impose de manipuler l’aorte, ce qui peut comporter un risque embolique important. Elle est contre-indiquée en cas d’athéromatose de l’aorte ascendante [19].
D’autres voies d’abord sont possibles lorsque les trois précédentes sont impraticables, telles la voie axillaire et la voie sous-clavière [8]. Ces canulations particulières se font préférentiellement sous anesthésie générale. Lorsque la technique transfémorale est bien maitrisée, la tendance vers une simple sédation au lieu d'une anesthésie générale et vers l'utilisation d'échocardiographie transthoracique au lieu de transoesophagienne allège la procédure et simplifie la prise en charge, sans modifier significativement les résultats cliniques [14]. Les contre-indications au TAVI sont la bicuspidie, à cause de la forme elliptique des structures, l’endocardite, les thrombus ventriculaire ou auriculaire, et la dilatation de l’aorte ascendante (> 4.5 cm).
Contrôle radiologique
Un CT-scan préopératoire, plus discriminant que l'échocardiographie, fournit des données numériques précises sur la valve aortique et les structures voisines (voir Figure 10.25 B).
Contrôle radiologique
Un CT-scan préopératoire, plus discriminant que l'échocardiographie, fournit des données numériques précises sur la valve aortique et les structures voisines (voir Figure 10.25 B).
- Diamètres de l’anneau, de la chambre de chasse et de la jonction sino-tubulaire ;
- Distance entre l’anneau et les ostia coronariens droit et gauche ;
- Calcifications aortiques, anomalies coronariennes ;
- Orientation de la valve aortique (plan des 3 cuspides) permettant de positionner ultérieurement l’arc-en-C radiologique dans le plan de la valve sans erreur de parallaxe (moyenne : 17° d’orientation latérale gauche et 10° d’orientation céphalique) [5].
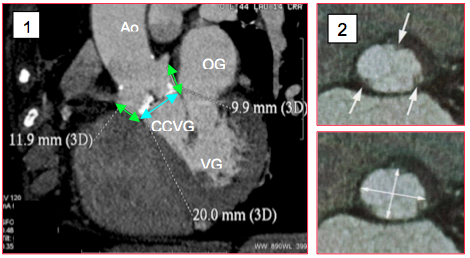
Figure 10.25 B : Mesures préopératoires de la racine aortique par CT-scan. 1 : mesure de l’anneau aortique (flèche bleue) et de la distance des ostia coronariens (flèches vertes) ; en blanc : zones calcifiées. 2 : coupe de l’anneau aortique au CT-scan ; les flèches indiquent les points d’intersection des cuspides et de l’anneau. Figure inférieure : mesure des diamètres de l’ellipse [Achenbach S, et al. J Cardiovasc Comput Tomogr 2012; 6:366-80. Ferrari E, et al. Ann Thorac Surg 2010; 89:1925-32. Mukherjee C, et al. J Cardiothorac Vasc Anesth 2013; 27:654-9. Patel PA, et al. J Cardiothorac Vasc Anesth 2012; 26:698-710].
Le positionnement de la prothèse à cheval sur l’anneau aortique est contrôlé par fluoroscopie et par échocardiographie. L’inconvénient de la radiologie est un taux d’irradiation majeur pour le malade et l’équipe soignante. L’angiographie de contrôle (positionnement et fonction de la prothèse, flux coronarien) consomme une quantité importante de produit de contraste (100-300 mL), ce qui augmente l’incidence d’insuffisance rénale postopératoire chez ces malades à haut risque souffrant déjà de néphropathie liée à l’âge, au diabète ou à l’hypertension. Pour pallier cet inconvénient, il est possible de se passer d’angiographie et de n’utiliser que l’échocardiographie, soit intracavitaire [4] soit transoesophagienne [5,6], accompagnée d’une utilisation minimale de la fluoroscopie. Ceci n’est possible qu’en l’absence d’interférences avec l’image échocardiographique (artéfacts, prothèse mitrale en place, etc).
Contrôle échocardiographique (ETO, ETT)
Très utile pour la surveillance hémodynamique (fonction ventriculaire, volémie, ischémie), l’examen ETO peropératoire continu est un apport important à la précision de l’implantation, mais il requiert habituellement une anesthésie générale. Les centres qui pratiquent le TAVI en locale se contentent d’examens transthoraciques (ETT) itératifs et se fient quasi-exclusivement à la radiologie. L’échocardiographie permet tout d’abord d’évaluer et de mesurer les structures anatomiques.
- Diamètre de l’anneau aortique en mésosystole (3 mesures en vue long-axe 120°), mesuré entre les points d’insertion du feuillet coronarien droit et du feuillet non-coronaire, en incluant les calcifications annulaires. Ce diamètre évalue le petit diamètre de l’anneau, qui est ovale (voir ci-dessus Figure 10.23 et Figure 10.24). La reconstruction 3D (plan coronal) permet la mesure du grand diamètre de la valve. De fortes calcifications limitent la précision des mesures, en particulier pour la partie antérieure de l’anneau qui est masquée par les calcifications postérieures. La prothèse choisie est surdimensionnée de 1-3 mm (voir ci-dessus Tableau 10.3).
- Diamètre et éventuelle hypertrophie de la CCVG ; exclusion d’une sténose sous-aortique dynamique, qui est une contre-indication au TAVI.
- Diamètre et hauteur des sinus de Valsalva, diamètres de la jonction sino-tubulaire et de l’aorte ascendante.
- Position des ostia coronariens ; distance entre l’anneau aortique et l’ostium coronarien droit en vue 2D long-axe 120° (Figure 10.24), distance entre l’anneau et l’ostium gauche dans le plan coronal en imagerie 3D (voir Figure 10.23 et Figure 10.25) ; valeur moyenne 13.5 mm. Une distance de > 10 mm est recommandée pour des prothèses Sapien™ de 23 mm et de > 11 mm pour des prothèses Sapien™ de 26 mm [24]; elle est de > 14 mm pour les prothèses CoreValve™ de 26 à 31 mm (voir Tableau 10.3) [10]. Cette distance doit être plus grande que la hauteur des cuspides correspondantes pour éviter une occlusion coronarienne lorsque la valve native est écrasée contre les parois par la prothèse.
- Surface de la valve aortique (planimétrie en vue court-axe 40° ou calcul par l’équation de continuité).
- Gradient à travers la valve aortique (VAo) et la chambre de chasse selon l’équation modifiée de Bernoulli : ΔP = 4 • (V2VAo - V2CCVG), en vue transgastrique profonde 0° ou long-axe 120°.
- Evaluation de la valve mitrale (éventuelle fuite mitrale, mobilité du feuillet antérieur).
- Diagnostic et localisation d’athéromes dans l’aorte ascendante et la crosse.
- Pendant les manœuvres, l’imagerie 3D X-plane affiche simultanément à l’écran deux plans différents de la même structure (plans long-axe à 120° et court-axe à 30-40°.), ce qui combine la précision du 2D et la reconstruction spatiale du 3D (Vidéo).
Vidéo: vues orthogonales simultanées (X-Plane) d'une sténose aortique serrée en long-axe et en court-axe.
Lors de sa mise en place, la prothèse doit se trouver à cheval sur la valve native, avec 2/3 de sa longueur sur le versant ventriculaire de l’anneau et 1/3 sur le versant aortique. Pour la prothèse Edwards Sapien™, l’extrémité proximale doit se trouver 5 mm en-dessous de l’anneau aortique, juste en amont de l’insertion du feuillet mitral antérieur ; l’extrémité distale doit se situer au niveau de l’extrémité des feuillets aortiques natifs. Pour la prothèse CoreValve™, l’extrémité ventriculaire doit se trouver 5-10 mm en dessous de l’anneau aortique (voir Figure 10.28 et Figure 10.29).
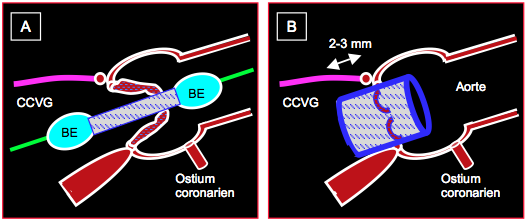
Figure 10.28 : Mise en place d’une endoprothèse aortique Edward’s Sapien™ sous guidage échocardiographique. A: la prothèse est introduite sur son mandrin et placée à cheval sur la valve aortique sténosée ; un gonflement très partiel du ballon d’expansion (BE) permet de localiser précisément la prothèse par rapport à l’anneau aortique à l’ETO. B : prothèse déployée ; la prothèse déborde de 2-3 mm l’insertion du feuillet mitral antérieur en direction de la chambre de chasse du VG (CCVG) ; les orifices coronariens sont dégagés.
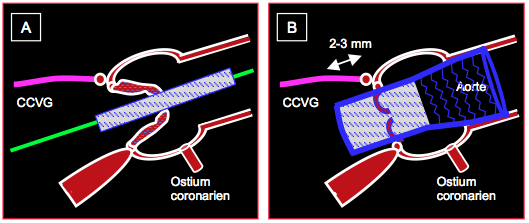
Figure 10.29 : Mise en place d’une endoprothèse aortique Core-Valve™. A: la prothèse est introduite sur son mandrin et placée à cheval sur la valve aortique sténosée. B : prothèse déployée ; la prothèse déborde de 2-3 mm l’insertion du feuillet mitral antérieur en direction de la chambre de chasse du VG (CCVG) et s’appuie dans la racine de l’aorte ascendante avec sa partie grillagée.
A l’ETO, les repères dans une vue long axe à 120° sont l’anneau aortique, l’extrémité des cuspides aortiques, l’extrémité du feuillet mitral antérieur (en diastole), l’ostium coronarien droit et la jonction sino-tubulaire (Figure 27.208) [1,24]. Sur l’écran ETO, on contrôle plusieurs manœuvres.

Figure 10.28 : Mise en place d’une endoprothèse aortique Edward’s Sapien™ sous guidage échocardiographique. A: la prothèse est introduite sur son mandrin et placée à cheval sur la valve aortique sténosée ; un gonflement très partiel du ballon d’expansion (BE) permet de localiser précisément la prothèse par rapport à l’anneau aortique à l’ETO. B : prothèse déployée ; la prothèse déborde de 2-3 mm l’insertion du feuillet mitral antérieur en direction de la chambre de chasse du VG (CCVG) ; les orifices coronariens sont dégagés.

Figure 10.29 : Mise en place d’une endoprothèse aortique Core-Valve™. A: la prothèse est introduite sur son mandrin et placée à cheval sur la valve aortique sténosée. B : prothèse déployée ; la prothèse déborde de 2-3 mm l’insertion du feuillet mitral antérieur en direction de la chambre de chasse du VG (CCVG) et s’appuie dans la racine de l’aorte ascendante avec sa partie grillagée.
A l’ETO, les repères dans une vue long axe à 120° sont l’anneau aortique, l’extrémité des cuspides aortiques, l’extrémité du feuillet mitral antérieur (en diastole), l’ostium coronarien droit et la jonction sino-tubulaire (Figure 27.208) [1,24]. Sur l’écran ETO, on contrôle plusieurs manœuvres.
- Avancement et positionnement des guides et introducteurs dans l’aorte et dans le VG.
- Voie transapicale : identification de l’apex du VG (affichage X-plane de deux plans orthogonaux simultanés, 0° et 90°), guidage des cathéters pour éviter l’accrochage de l’appareil sous-valvulaire mitral. Le repérage de l’apex est également effectué en ETT.
- Positionnement du ballon de valvuloplastie pour dilater la sténose aortique ; la partie centrale rétrécie du ballon doit être placée au niveau de l’anneau aortique (Vidéo). Malheureusement, la sonde ETO gène la visualisation angiographique et doit être retirée de quelques centimètres lors de la dilatation et du déploiement de la prothèse si l’opérateur se concentre sur les données radiologiques.
- Positionnement de la prothèse ; un gonflement partiel du ballon de dilatation intravalvulaire permet une localisation précise de la prothèse, qui doit laisser libres les orifices coronariens (voir Figure 10.28) ; un déploiement trop en amont fait courir le risque d’une chute dans le VG ou d’un dysfonctionnement mitral, alors qu’un déploiement trop en aval favorise une embolisation dans l’aorte ascendante ou une occlusion coronarienne (Vidéos).
Vidéo: dilatation de la valve aortique en vues X-Plane; le patient est en tachycardie ventriculaire électrostimulée.
Vidéo: positionnement de la prothèse en vues X-Plane; le patient est en rythme sinusal.
Vidéo: déploiement de la prothèse en vues X-Plane; le patient est en tachycardie ventriculaire électrostimulée.
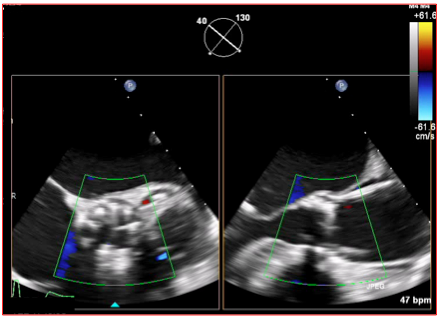
Figure 27.208 : Vue 3D X-plane de 2 plans perpendiculaires d'une endoprothèse de la valve aortique (TAVI). En court-axe 40°, la prothèse est bien circulaire et normalement size dans l'anneau aortique; à 2 heures, on voit un flux dans le tronc commun. En long-axe 130°, elle est positionnée au niveau de la valve native, avec un empiètement normal sur la base du feuillet mitral antérieur et un manchon débordant dans les sinus de Valsalva.
Après la mise en place, l’ETO est intéressante pour l’évaluation fonctionnelle de la prothèse (chaque type présente des caractéristiques ultrasonographiques particulières) et le diagnostic immédiat d’éventuelles complications (voir Figure 10.30) [7,24].
- Mouvements d’ouverture et de fermeture libres et non-restrictifs des 3 feuillets ; absence de sténose (voir Tableau 10.4). Idéalement, on ne note aucune fuite au flux couleur (Vidéos).
- Recherche et quantification d’une insuffisance aortique (IA) résiduelle, qui peut être paravalvulaire (entre la prothèse et l’anneau aortique) ou intravalvulaire (entre les feuillets de la prothèse) (Tableau 27.9, ci-dessous). La quantification de l'IA comprend l'addition de la fuite intravalvulaire et de la fuite paravalvulaire, c'est-à-dire la charge de volume totale imposée au VG [9]. Le volume régurgité est la différence entre le volume systolique (S • ITV) à travers la CCVG et le volume systolique à travers la CCVD. Les signes d’une IA majeure sont les suivants (vues court-axe 40°, long-axe 120°, transgastrique profonde (0°) et transgastrique long-axe (120°) (Tableau 10.4 ci-dessous):
- Zone d'accélération concentrique (PISA) bien visible sur le versant aortique (voir Figure 26.88).
- Extension du jet au-delà de la chambre de chasse.
- Large diamètre du jet à son origine.
- Rapport du diamètre du jet avec le diamètre de la CCVG > 50%.
- Temps de demi-pression < 250 msec (voir Figure 26.92).
- Reflux diastolique dans l’aorte descendante.
- L’IA majeure a des conséquences hémodynamiques facilement appréciables [12,21] :
- Affaissement de la PAdiast sur la courbe de pression artérielle.
- Diminution du gradient télédiastolique entre l’aorte et le VG (PAtd – PtdVG); l'index d'IA, calculé selon la formule (PAtd – PtdVG)/PAsyst, signe une insuffisance ≥ modérée lorsqu'il est ≤ 20 [20].
- Volume systolique plus élevé dans la CCVG que dans la CCVD; les mesures dans la CCVG se font juste en amont de la partie proximale du stent de la prothèse.
- Une fuite modérée ou majeure augmente la morbi-mortalité à un an de 25-50% [20,21,23].
- Recherche et quantification de fuites paravalvulaires (FPV) ; les fuites paravalvulaires mineures (degré I-II) sont fréquentes (60% des cas), les fuites modérées et sévères surviennent dans 7-15% des cas (Vidéos) [8,24]. Elles sont souvent dues à une prothèse sous-dimensionnée. Leur importance est définie par la proportion de la circonférence représentée par leur orifice (ou par la somme des orifices) en court-axe : < 10% (fuite mineure), 10-20% (fuite modérée), > 20% (fuite sévère). Elles peuvent entraîner éventuellement un mouvement de bascule de la prothèse à chaque systole. Il est capital de les rechercher systématiquement sous plusieurs angles de vue avant de retirer le guide, car une ré-expansion de la prothèse avec le ballon intra-aortique permet souvent de les supprimer (Figure 27.209).
- Recherche et quantification des fuites intravalvulaires, fréquemment liées à une prothèse surdimensionnée (Vidéos). L’IA diminue en général lorsqu’on retire le guide ; une IA centrale de degré I n’est pas rare (Vidéo). Une IA excessive et persistante (degré > modérée) peut demander le déploiement d’une seconde prothèse dans la première. Il peut arriver qu’un feuillet reste accolé à la paroi et ne se ferme pas en diastole, provoquant une IA massive ; il est possible de le rabattre en augmentant la postcharge avec un vasoconstricteur (phényléphrine). Le plein déploiement des feuillets peut prendre plusieurs minutes après la mise en place.
- Gradient transvalvulaire (en conditions hémodynamiques normales), en prenant soin de soustraire le gradient de la CCVG : ΔP = 4 • (V2PrAo - V2CCVG). ΔPmoy habituel : 10-12 mmHg ; ΔPmoy acceptable : 15-20 mmHg. L'indice de vélocité (ITVVAo / ITVCCVG ou VmaxVAo / VmaxCCVG) est habituellement voisin de 0.5 [7]. Le gradient est tributaire du volume systolique et de la force d’éjection du VG. La vélocité de la CCVG doit être enregistrée en amont de la prothèse, et non dans sa partie intraventriculaire, juste en-dessous de la valve, qui est une zone déjà rétrécie ; ceci conduirait à sous-estimer le gradient transvalvulaire et à surestimer la surface de la prothèse. Le gradient trans-prothétique (gradient moy 12 mmHg, acceptable jusqu'à 20 mmHg) reste stable à long terme [13].
- Surface d’ouverture de la prothèse, qui est en moyenne de 1.1 cm2/m2.
- Discordance entre le gradient mesuré et la surface calculée; plusieurs éventualités peuvent se présenter [9].
- Gradient > 20 mmHg, surface valvulaire effective normale; si l'indice de vélocité est normal: prothèse normale mais situation de haut débit. Si l'indice de vélocité est < 0.35, la sténose est possible (ou erreur de mesure sur la CCVG).
- Gradient > 20 mmHg, surface effective basse, mais indice de vélocité normal: non-appariement patient/prothèse (patient/prosthesis mismatch).
- Gradient < 20 mmHg, surface effective normale; fonction prosthétique normale si l'indice de vélocité est normal.
- Gradient < 20 mmHg, surface effective basse; si l'indice de vélocité est normal: possible non-appariement patient/prothèse avec bas débit.
- Gradient < 20 mmHg, surface effective basse et indice de vélocité est < 0.35: probable sténose de la prothèse.
- Fonctionnement de la valve mitrale (péjoration de l’IM ou nouvelle fuite mitrale) ; les mouvements du feuillet antérieur peuvent être génés par une prothèse trop bas insérée. La voie transapicale peut endommager directement l’appareil sous-valvulaire mitral.
- Flux dans le tronc commun et la coronaire droite au Doppler couleur.
- Fonction du VG et du VD.
- Eventuelles altérations de la cinétique segmentaire en rapport avec une obstruction coronarienne aiguë.
- Tamponnade sur rupture de la racine aortique ou perforation ventriculaire.
- Dissection aortique.
- Epanchement pleural gauche (voie transapicale).
Vidéo: vue long-axe de la racine aortique montrant la prothèse aortique en place et normalement positionnée.
Vidéo: flux couleur à travers la prothèse en vues X-Plane; le flux est laminaire en systole.
Vidéo: fuite paravalvulaire après pose de TAVI.
Vidéo: fuite paravalvulaire après pose de TAVI.
Vidéo: fuite intravalvulaire excessive après pose de TAVI.
Vidéo: fuite intravalvulaire excessive après pose de TAVI en vue transgastrique.
Vidéo: flux couleur à travers la prothèse en vues X-Plane; le flux est laminaire en systole, présence d'une minime insuffisance intravalvulaire en diastole.
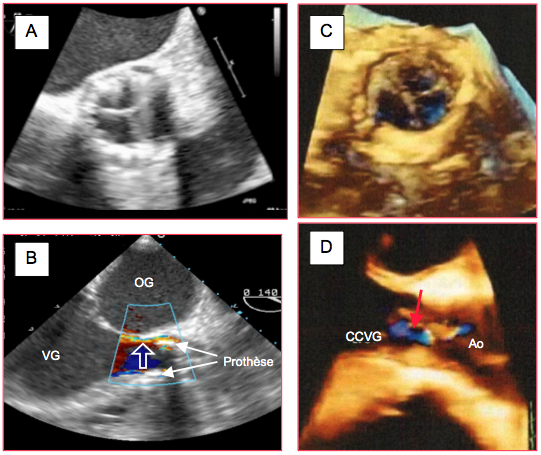
Figure 10.30 : Contrôle postopératoire. A: vue ETO 2D court-axe (54°) de la prothèse aortique (Edwards Sapien™) en place. B: fuite paravalvlulaire (flèche) en vue 2D long-axe 140°. C: vue 3D d’une valve Sapien™. D: vue 3D d’une fuite intravalvulaire (flèche rouge); la vue dans l’espace permet de la différencier clairement d’une fuite paravalvulaire [Zamorano JL, et al. Eur Heart J 2011; 32:2189-214].
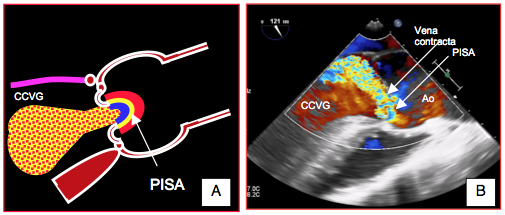
Figure 26.88 : PISA dans l'insuffisance aortique. A: sa forme hémisphérique n'est visible que dans les IA centrales majeures. B: la zone d'accélération concentrique est très déformée dans les IA excentriques.
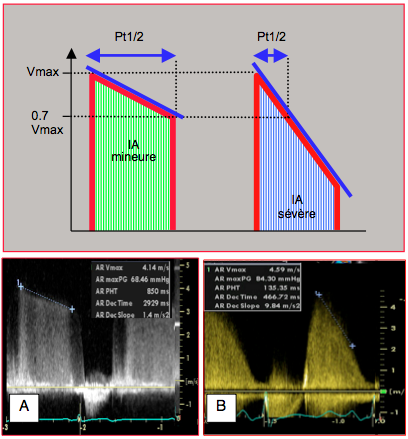
Figure 26.92 : Calcul du temps de demi-pression (Pt1/2) dans deux cas d'insuffisance aortique. A: IA mineure; le Pt1/2 est de 850 ms. B: IA sévère; le Pt1/2 est de 135 ms. Dans les deux cas, la Vmax de l'IA est > 4 m/s.
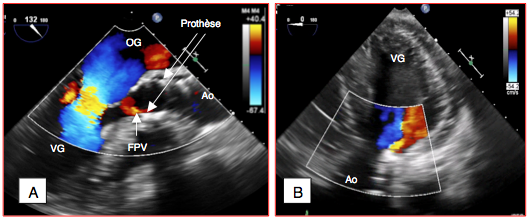
Figure 27.209 : Fuite paravalvulaire après TAVI. A: fuite mineure envue long-axe 130° de la valve aortique. B: fuite modérée en vue 4-cavités transgastrique profonde 0°.
L'ETO, amplifié par ses performances en 3D, est d'un apport supérieur à l'ETT en peropératoire, dont le champ d'accès est plus limité et l'examen non continu [24]. D'autre part, la concordance entre les deux techniques pour le diagnostic des fuites paravalvulaires est modeste (kappa = 0.47) [22]. L'ETO tend à surestimer les fuites par rapport à l'ETT, mais il est probable que la sensibilité de l'ETT soit simplement insuffisante pour visualiser les fuites mineures.
| ETO dans l’implantation de TAVI |
| L’imagerie préopératoire (échocardiographie 2D et 3D, CT-scan) doit mesurer avec précision les diamètres de l’anneau aortique et de la jonction sino-tubulaire, la longueur des cuspides et la distance entre l’anneau aortique et les ostia coronariens. La prothèse choisie est surdimensionnée de 5-10% (1-3 mm) par rapport aux mesures effectuées pour assurer son bon ancrage contre la racine aortique. En peropératoire, l'ETO permet: - Guidage pour la mise en place de la prothèse - Substitut à l'angiographie - Contrôle fonctionnel après implantation - Evaluation et correction immédiate des complications (IA paravalvulaire ou intravalvulaire) |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- BILLINGS FT, KODALI SK, SHANEWISE JS. Transcatheter aortic valve implantation: anesthetic considerations. Anesth Analg 2009; 108:1453-62
- BLACKMAN DJ, BAXTER PD, GALE CP, et al. Do outcomes from transcatheter aortic valve implantation vary according to access route and valve type ? The UK TAVI Registry. J Interv Cardiol 2014; 27:86-95
- COBEY FC, FERREIRA RG, NASEEM TM, et al. Anesthetic and perioperative considerations for transapical transcatheter aortic valve replacement. J Cardiothorac Vasc Anesth 2014; 28:1087-99
- FERRARI E, MARCUCCI C, DI BERNARDO S, et al. Feasibility of transapical aortic valve implantation guided by intracardiac ultrasound without angiography. J Thor Cardiovasc Surg 2010; 140:e32-4
- FERRARI E, SULZER C, MARCUCCI C, et al. Transapical aortic valve implantation without angiography – Proof of a concept. Ann Thorac Surg 2010; 89:1925-32
- FERRARI E, SULZER C, RIZZO E, et al. A fully echo-guided trans-apical aortic valve implantation. Eur J Cardiothorac Surg 2009; 36:928-40
- HAHN RT. Transcatheter valve replacement and valve repair. Review of procedures and intraprocedural echocardiographix imaging. Circ Res 2016; 119:341-56
- HOLMES DR, MACK MJ, KAUL S, et al. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement. J Am Coll Cardiol 2012; 59:1200-54
- KAPPETEIN AP, HEAD SJ, GÉNÉREUX P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research Consortium-2 consensus document. Eur Heart J 2012; 33:2403-18
- KASEL AM, CASSESE S, BLEIZIFFER S, et al. Standardized imaging for aortic annular sizing. Implications for transcatheter valve selection. JACC Cardiovasc Imaging 2013; 6:249-61
- LEON MB, SMITH CR, MACK M, et al, for the PARTNER 2 investigators. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med 2016; 374:1609-20
- LERAKIS S, HAYEK SS, DOUGLAS PS. Paravalvular aortic leak after transcatheter aortic valve replacement. Current knowledge. Circulation 2013; 127:397-407
- MAKKAR RR, FONTANA GP, JILAIHAWI H, et al. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. N Engl J Med 2012; 366:1696-704
- MARINO M, LILIE CJ, CULP WC, et al. The evolution of echocardiographic type and anesthetic technique for transcatheter aortic valve replacement at a high-volume tranbscatheter aortic valve replacement center. J Cardiothorac Vasc Anesth 2019; 33:29-35
- OTTO CM, KUMBHANI DJ, ALEXANDER KP, et al. 2017 ACC expert consensus decision pathway for transcatheter aortic valve replacement in the management of adults with aortic stenosis: a report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2017; 69:1313-46
- PATEL PA, FASSL J, THOMPSON A; et al. Transcatheter aortic valve replacement – Part 3: the central role of perioperative transesophageal echocardiography. J Cardiothorac Vasc Anesth 2012; 26:698-710
- PATEL PA, GUTSCHE JT, VERNICK WJ, et al. The functional aortic annulus in the 3D era: focus on transcatheter aortic valve replacement for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2015; 29:240-5
- PURI R, CHAMANDI C, RODRIGUEZ-GABELLA T, et al. Future of transcatheter aortic valve implantation – evolving clinical indications. Nat Rev Cardiol 2018; 15:5765
- RAMAKRISHNA H, PATEL PA, GUTSCHE JT, et al. Transcatheter aortic valve replacement: Clinical update on access approaches in the contemporary era. J Cardiothorac Vasc Anesth 2016; 30:1425-9
- SINNING JM, HAMMERSTINGL C, VASA-NICOTERA M, et al. Aortic regurgitation index defines severity of peri-prosthetic regurgitation and predicts outcome in patients after transcatheter aortic valve implantation. J Am Coll Cardiol 2012; 59:1134-41
- SINNING JM, VASA-NICOTERA M, CHIN D, et al. Evaluation and management of paravalvular aortic regurgitation after transcatheter aortic vave replacement. J Am Coll Cardiol 2013; 62:11-20
- TEETER EG, DAKIK C, COOTER M, et al. Assessment of paravalvular leak after transcatheter aortic valve replacement: transesophageal echocardiography compared with transthoracic echocardiography. J Cardiothorac Vasc Anesth 2017; 31:1278-84
- VASA-NICOTERA M, SINNING JM, CHIN D, et al. Impact of paravalvular leakage on outcome in patients after transcatheter aortic valve implantation. JACC Cardiovasc Imaging 2012; 5: 858-65
- ZAMORANO JL, BADANO LP, BRUCE C, et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. Eur J Echocardiogr 2011; 12:557-84
