Normalement, le flux sanguin diastolique passe de l'oreillette au ventricule à basse vélocité (< 1 m/s); il est laminaire et tournoie lentement au sein du ventricule pour se positionner sous la chambre de chasse (Vidéos).
Vidéo: flux intraventriculaires normaux. Le flux diastolique mitral (en bleu) est homogène, sans aliasing, de vélocité < 1 m/s, et remplit l'entièreté du VG jusqu'à l'apex.
Vidéo: vue long-axe du VG en IRM cardiaque; le flux diastolique coule de l'OG dans le VG en faisant un vaste vortex qui le place sous la chambre de chasse, d'où il est éjecté en systole. Le cycle cardiaque frappe par la souplesse, la continuité et l'homogénéité du mouvement.
Stades de la dysfonction diastolique
La dysfonction diastolique est classée habituellement en trois stades selon son degré de gravité (Tableau 25.10) [7,10,16,17].
Vidéo: flux intraventriculaires normaux. Le flux diastolique mitral (en bleu) est homogène, sans aliasing, de vélocité < 1 m/s, et remplit l'entièreté du VG jusqu'à l'apex.
Vidéo: vue long-axe du VG en IRM cardiaque; le flux diastolique coule de l'OG dans le VG en faisant un vaste vortex qui le place sous la chambre de chasse, d'où il est éjecté en systole. Le cycle cardiaque frappe par la souplesse, la continuité et l'homogénéité du mouvement.
Stades de la dysfonction diastolique
La dysfonction diastolique est classée habituellement en trois stades selon son degré de gravité (Tableau 25.10) [7,10,16,17].
- Stade I: le défaut de relaxation protodiastolique, caractéristique du vieillissement, de l’hypertrophie ventriculaire (hypertension artérielle, sténose aortique), de l’ischémie, de l’obésité, du syndrome d’apnée du sommeil et de l’effet lusitrope négatif de certaines substances. La POG est normale au repos mais s’élève à l’effort. Le défaut de relaxation est une altération fréquente et bénigne, mais qui peut évoluer vers la restriction dans 10% des cas.
- Stade III: la restriction par perte de compliance ventriculaire (défaut d’élasticité et de distensibilité), caractéristique des cardiomyopathies restrictives, des infiltrations (collagénoses, amyloïdose, œdème post-CEC) et de la dilatation majeure du ventricule. La POG est élevée au repos, l'oreillette gauche est dilatée, et l’effort est extrêmement limité. Il s'agit d'une situation sévère de mauvais pronostic, conduisant à un oedème pulmonaire récurrent même si la fonction systolique est conservée.
- Stade II: entre les deux, se trouve une catégorie de pseudonormalisation, ainsi nommée parce que la silhouette du flux mitral (rapport E/A) paraît normale à cause d’une élévation déjà significative de la POG ; la clinique est intermédiaire entre les deux situations précédentes.
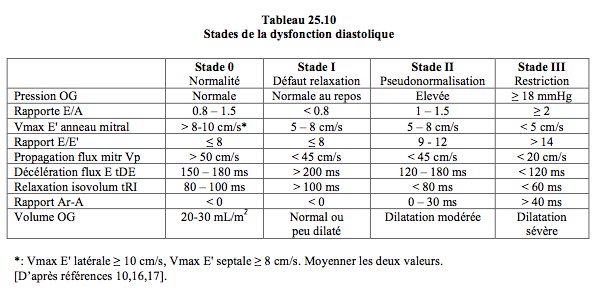
Le passage de la normalité jusqu'au stade III est un continuum progressif qui rend les définitions chiffrées assez arbitraires. C'est la raison pour laquelle les valeurs quantitatives spécifiques à chaque stade sont variables et manquent de cohérence dans la littérature, au point qu'un tiers de patients n'est pas classifiable dans un stade spécifique [12,26]. La position du malade au sein de ce continuum a néanmoins son importance pour la prise en charge clinique. Au stade I, on peut pallier le défaut de relaxation par une augmentation de la précharge et un allongement de la diastole (béta-bloqueur) qui prolonge la durée du remplissage protodiastolique défaillant. Au stade III, au contraire, le malade est en situation congestive par défaut de compliance, il est intolérant à une augmentation de précharge et vit avec un volume systolique fixe; son débit est fréquence-dépendant et baisse en cas de bradycardie; il a besoin de diurétique et de veinodilatateur [9].
Pour autant que les valves auriculo-ventriculaires soient normales, la dysfonction diastolique se traduit par des modifications des flux de remplissage que l'on peut observer dans les veines pulmonaires et à travers la valve mitrale. Ces deux flux se modifient selon la gravité et l'évolution de la dysfonction diastolique (Figures 25.196 et 25.197) (Tableau 25.11) [8,16,17].
- Défaut de relaxation : allongement de la phase de relaxation isovolumétrique (tRI > 100 ms), diminution de vélocité du flux mitral passif (E) et de sa participation au remplissage ventriculaire, allongement du temps de décélération du flux E (tDE > 200 ms), flux A augmenté (augmentation de la contribution auriculaire > 25% du remplissage) ; E/A < 1. Propagation du flux mitral (Vp) < 45 cm/s [1,4,25]. Peu de modification sur le flux veineux pulmonaire à part une légère diminution de la composante diastolique (S ≥ D).
- Pseudo-normalisation : l'augmentation progressive de la pression auriculaire gauche rétablit le gradient de pression OG – VG ; la vélocité du flux E augmente et retrouve sa valeur normale (E/A 1-1.5), mais sa morphologie est pathologique : pentes d'accélération et de décélération accentuées (tDE < 160 ms), raccourcissement de la relaxation isovolumétrique (tRI < 80ms). La composante S (mesurer la Vmax sur S2) du flux veineux pulmonaire diminue parce que la POG (presssion d’aval) augmente (S < D). Lorsque la POG augmente, le flux mitral peut persister pendant le diastasis sous formne d’un pic "L" de Vmax modérée (20-50 cm/s), accompagné de sa contre-partie L' au Doppler tissulaire; cette configuration signe une péjoration de la fonction diastolique et une POG élevée [18]. La réduction de précharge associée à la manoeuvre de Valsalva ou à la nitroglycérine démasque la pseudonormalisation et redonne une image de défaut de relaxation, parce qu’elle supprime l’effet de l’augmentation de la POG comme élément moteur principal du flux de remplissage du VG : le rapport E/A diminue de ≥ 50%. Ceci démontre que la pseudo-normalisation est simplement un défaut de relaxation accompagné d’une élévation de la POG.
- Restriction : c'est la situation la plus grave ; elle concerne 10% des cas. Le ventricule devient tellement rigide (défaut d’élasticité et de distensibilité) et la pression auriculaire tellement haute que la relaxation isovolumétrique est raccourcie (tRI < 60 ms), la vélocité du flux E devient très élevée (> 1.3 m/s) et sa décélération très brutale (tDE < 120 ms) ; l'onde A de la contraction auriculaire est minime parce que le ventricule n'est plus distensible en fin de diastole (E/A ≥ 2). La composante S du flux veineux pulmonaire est très faible, le remplissage auriculaire a lieu en diastole ; le reflux veineux pulmonaire rétrograde dû à la contraction auriculaire (Ar) augmente car le VG n’est pas distensible et la vidange antérograde de l’OG à travers la mitrale (A) est minime (différence de durée Ar - A > 40 ms). Il arrive que l'on observe une petite onde de flux pré-éjectionnelle dans la chambre de chasse; elle représente la réflexion dans le VG rigide de l'onde A de la contraction auriculaire [9,20].
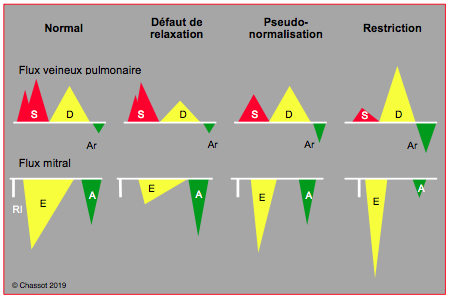
Figure 25.196 : Modifications du flux veineux pulmonaire et du flux mitral selon l'évolution de la dysfonction diastolique. Stade I, défaut de relaxation : allongement de la phase de relaxation isovolumétrique (tRI > 100 msec), diminution de vélocité du flux mitral passif (E), augmentation de la contribution auriculaire (flux A élevé). Peu de modification sur le flux veineux pulmonaire. Stade 2, pseudo-normalisation : l'augmentation progressive de la pression auriculaire gauche rétablit le gradient de pression OG – VG; la vélocité du flux E augmente et retrouve sa valeur normale, mais sa morphologie est pathologique: pente d'accélération et de décélération accentuée (tDE < 150 msec), raccourcissement de la relaxation isovolumétrique (tRI < 80 msec). La composante S du flux veineux pulmonaire diminue parce que la POG augmente. Stade 3, restriction : c'est la situation la plus grave; le ventricule devient tellement rigide et la pression auriculaire tellement haute que la vélocité du flux E devient très élevée et sa décélération très brutale (tDE < 120 msec); l'onde A de la contraction auriculaire est minime parce que le ventricule n'est plus distensible en fin de diastole. La composante S du flux veineux pulmonaire est minime, le remplissage auriculaire a lieu en diastole, le reflux dû à la contraction auriculaire augmente car le VG n’est pas distensible et la vidange par la mitrale est minime.
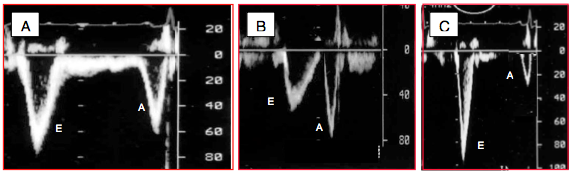
Figure 25.197 : Exemples de modifications du flux mitral avec l'agravation de la dysfonction diastolique. A: flux mitral normal. B: défaut de relaxation; le flux E est moins rapide, le flux A est plus important. C: restriction; le flux E est rapide et de courte durée, sa décélération est brève, le flux A est minime.
Le vieillissement s’accompagne physiologiquement d’une dysfonction diastolique; il est donc normal de rencontrer une image de défaut de relaxation (stade I) au-delà de 65 ans (E/A 0.5-1, Vp < 50 cm/s, tDE > 200 ms) [1,4,17,25]. La POG s'élève avec la progression de la défaillance diastolique depuis le défaut de ralaxation jusqu'à la restriction (stade III). Le démarrage du remplissage initial dépend alors davantage de la pression auriculaire d'amont et moins de l'aspiration par la relaxation active; dans les cas sévères, la relaxation longitudinale (Vmax E', voir Doppler tissulaire) survient après le pic de vélocité du flux E, alors qu'elle la précède normalement [25]. Plus la POG s'élève, plus l'oreillette se dilate et plus la durée de la relaxation isovolumétrique se raccourcit, puisque la force qui pousse contre la valve mitrale pour l'ouvrir augmente.
Effets des variations de charge
Les flux dépendent des gradients de pression instantanés ; les variations de la POG liées à celles de la volémie vont donc modifier l’image des flux de remplissage, puisque la POG est la pression d’aval du flux veineux pulmonaire et la pression d’amont du flux mitral (Figure 25.198).
- Hypovolémie : flux E diminué (pression d’amont POG basse), flux A > flux E comme lors de défaut de relaxation. En cas de tachycardie : fusion de E dans A qui devient plus importante (A > E) parce que le raccourcissement de la diastole restreint le flux de remplissage protodiastolique (OG vide). Veine pulmonaire : flux S augmenté (POG basse) et flux D diminué. Même s'il est en rythme sinusal, un adulte tachycarde (≥ 120 batt/min) présente en général un flux mitral monophasique, constitué de l’onde A dans laquelle l’onde E a fusionné. Indépendamment de la tachycardie, cette fusion se rencontre également en cas de bloc AV ou de bloc de branche gauche.
- Hypervolémie : flux E augmenté (POG haute), tRI et tDE raccourcis, flux A < flux E. Veine pulmonaire : flux S diminué (pression d’aval élevée) et flux D élevé.
- La limite supérieure normale de la POG est définie cliniquement par une PAPO > 12 mmHg et une PtdVG > 16 mmHg [14,21].
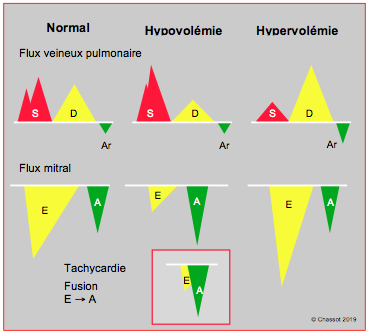
Figure 25.198 : Effet de la volémie sur les flux veineux pulmonaire (FVP) et mitral, lorsqu’ils sont normaux. Comme la POG est basse en hypovolémie, la composante systolique du FVP est élevée, puisque la POG est sa pression d’aval (la valve mitrale est fermée). Par contre, le flux mitral E est faible car la POG est sa pression d’amont (pression motrice). La tachycardie fait fusionner les flux E et A en une seule onde méso-télédiastolique. En hypervolémie, la POG est haute ; la composante systolique du FVP est freinée ; la majeure partie du flux passe en diastole, lorsque la mitrale est ouverte et que le VG se relâche. L’élévation de la POG augmente la vélocité du flux E.
Comme elle est directement proportionnelle au gradient de pression entre l'amont et l'aval du point de mesure, la vélocité d'un flux de remplissage est tributaire de la pression qui règne dans les veines pulmonaires et dans l'OG (ou dans les veines caves et dans l'OD). Il existe donc des interférences de mesure majeures entre la fonction diastolique d'une part, et la volémie ou la précharge d'autre part. Pour éviter ce piège, on peut utiliser des techniques échocardiographiques peu dépendantes de la précharge qui sont spécifiques d'une phase de la diastole (voir ci-après).
- Relaxation active protodiastolique: vitesse de propagation du flux mitral à l'intérieur du VG;
- Elasticité mésodiastolique: pente de décélération du flux E mitral (tDE), pente de décélération du flux D en veine pulmonaire;
- Distensibilité télédiastolique: différence entre la durée de l’onde A rétrograde dans les veines pulmonaires et celle de l’onde A antérograde à travers la valve mitrale.
La propagation du flux mitral (Vp) et la vélocité de l’anneau mitral (E’) sont dépendants de la précharge lorsque la fonction diastolique est normale, mais s’avèrent moins dépendants du remplissage en cas de défaut de relaxation [11]. Ils sont également indépendants de la fréquence et du rythme cardiaques.
Une augmentation brusque de postcharge a des effets variables selon la fonction systolique. Si celle-ci est normale, la relaxation est améliorée. Mais si elle est abaissée, la Vmax du flux E diminue et sa phase de décélération s’allonge (augmentation de tDE) ; le flux prend l’allure d’un défaut de relaxation [19]. La fibrillation auriculaire supprime le flux A et fait varier le flux E en fonction de la durée du cycle cardiaque. En remplissant le VG depuis l’aorte, l’insuffisance aortique raccourcit le tDE et abaisse la vélocité du flux A. Dans l’insuffisance mitrale, le flux E est ample et accéléré, parce que le volume qui doit transiter en diastole est augmenté du volume régurgité en systole, qui revient dans le VG à la diastole suivante. La composante systolique du flux veineux pulmonaire est diminuée (IM modérée) ou abolie, et même inversée en cas d'IM sévère (reflux systolique pulmonaire).
Propagation du flux mitral (Vp)
Pendant la phase de relaxation active protodiastolique, il se forme un important gradient de pression négative entre l’OG et l’apex du VG dû à l’effet de succion. Plus ce gradient est élevé, plus le flux se propage rapidement à l’intérieur du VG. On peut mesurer cette propagation du flux mitral en ajustant la fenêtre du Doppler couleur de manière à avoir une colonne de flux diastolique mitral d’au moins 4 cm en direction de l’apex en vue 4-cavités ou 2-cavités mi-oesophagienne. L’échelle de vélocité-couleur est abaissée de manière à produire une zone d’aliasing au milieu du flux mitral (limite de Nyquist à 75% de la Vmax du flux mitral) (Vidéo).
Vidéo: l'échelle couleur a été abaissée de manière à introduire un effet d'aliasing dans le flux mitral diastolique. La fenêtre du Doppler couleur s'étend jusqu'à 5 cm dans le VG.
Le curseur du mode TM est placé dans l’axe du flux: la pente de la zone de premier aliasing est le marqueur de la vélocité de propagation (Vp) du flux dans le VG ; elle est d’autant plus raide que la relaxation est plus efficace (normal : > 55 cm/s). En cas de défaut de relaxation, cette pente diminue à < 45 cm/s puisque le flux s'avance plus lentement dans le VG pendant le déroulement dans le temps de l'enregistrement en mode TM (Figure 25.199) [2]. L’effet s’accentue avec l’aggravation de la dysfonction diastolique, mais la pente peut parfois se redresser en cas de restriction isolée [6].
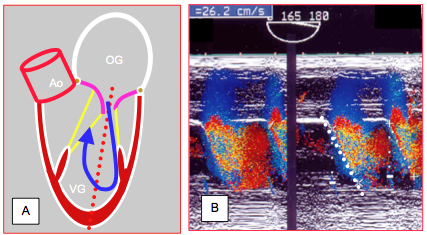
Figure 25.199 : Propagation du flux mitral. A : l’axe du flux mitral est dirigé vers la paroi latéro-postérieure et fait un angle d’environ 20° avec le long-axe du VG (pointillé rouge). B : plus le gradient de pression protodiastolique entre l’OG et l’apex du VG est élevé, plus le flux se propage rapidement à l’intérieur du VG. En mode TM couleur, la vélocité de ce flux est mesurable par la pente de la zone d'aliasing (normal : > 50 cm/s). En cas de défaut de relaxation, cette pente diminue; dans le cas présent, elle est de 26 cm/s. Accélérer l'affichage à 100 mm/s rend la mesure plus précise.
L’intérêt de cette mesure est d’être peu dépendante des conditions de remplissage et de présenter une haute résolution temporelle (5 msec) et spatiale (1 mm, 5 cm/s). Elle permet de différentier la cardiomyopathie restrictive (pente faible) de la péricardite constrictive (pente normale). Toutefois, elle est peu reproductible en cas de dilatation ventriculaire importante (flux excentrique) et n’est pas valide en cas d’insuffisance aortique car elle dépend d'une répartition normale des flux à l'intérieur du VG [22]. D'autre part, elle est influencée par l'âge [13]. Le rapport entre la Vmax du flux E et la propagation du flux mitral (E/Vp) permet d’estimer la PAPO : celle-ci est > 15 mmHg lorsque E/Vp est > 1.5 [3,5].
Pente de décélération du flux E
La durée de la décélération du flux mitral E (tDE) est mesurée depuis l'instant de la Vmax jusqu'à celui où le flux rejoint la ligne de base; elle est extrapolée jusqu'à celle-ci si la pente est interrompue par le diastasis ou le flux A. La pente de décélération est tributaire de la vélocité maximale du flux E et de l'élasticité du myocarde. Elle diminue lorsque la Vmax baisse par défaut de relaxation, mais conserve la même durée. Celle-ci diminue lors de pseudonormalisation parce que le VG perd en élasticité; elle devient très brêve lors de restriction, car le ventricule est tellement rigide que le flux est inerrompu très brusquement (Figure 25.200).
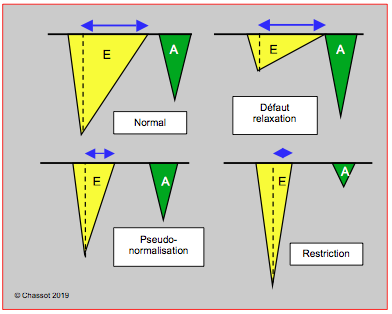
Figure 25.200 : Durée de la phase de décélération du flux E (double flèche bleue) dans les 3 catégories de dysfonction diastolique. Valeur normale: 150-180 ms. Défaut de relaxation: > 200 ms. Pseudo-normalisation: 120-180 ms. Restriction: < 120 ms.
Dans les arythmies qui induisent un remplissage variable comme la fibrillation auriculaire, la Vmax du flux E se modifie constamment. Par contre, la pente de décélération du flux E (tDE) reste un bon indicateur du degré de dysfonction diastolique; un tDE < 130 ms est associé à une POG élevée et à une physiologie restrictive [15].
Rapport entre les durées A/Ar
Lors de la contraction auriculaire, l'OG éjecte le sang dans le VG, mais aussi dans les quatre veines pulmonaires parce que celles-ci ne possèdent pas de valve anti-reflux. Le volume de ce reflux est proportionnel à la résistance rencontrée au passage du sang dans le ventricule. Lorsque la distensibilité de ce dernier s'effondre et que sa pression diastolique est élevée, le frein au flux A antérograde à travers la valve mitrale force davantage de sang à reculer dans les veines pulmonaires plus compliantes. La proportion du flux A rétrograde (Ar) augmente alors que celle du flux A antérograde (A) diminue; le rapport A/Ar diminue. La vélocité du flux Ar devient > 0.35 m/s et sa durée se prolonge (Figure 25.201) [27]. La mesure de la durée des flux A s'est avérée être mieux corrélée à la Ptd du VG que celle de leur vélocité. Lorsque la durée du flux Ar est supérieure de > 40 ms à celle du flux A mitral, la PtdVG est > 20 mmHg (sensibilité 87%) [23,24]. Cet indice est peu dépendant de la précharge; de plus, il est indépendant de l’âge. Mais il dépend de la force de contraction de l'OG, qui doit être normale; lorsqu'elle est très dilatée, l'oreillette n'a plus une puissance contractile suffisante et cet indice perd sa valeur.
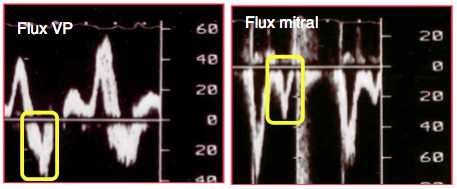
Figure 25.201 : Différence entre la durée du flux Ar rétrograde dans les veines pulmonaires et celle du flux A à travers la valve mitrale (ici 60 ms). La faible composante S du flux veineux pulmonaire (VP) signe également une POD élevée.
Une augmentation brusque de postcharge a des effets variables selon la fonction systolique. Si celle-ci est normale, la relaxation est améliorée. Mais si elle est abaissée, la Vmax du flux E diminue et sa phase de décélération s’allonge (augmentation de tDE) ; le flux prend l’allure d’un défaut de relaxation [19]. La fibrillation auriculaire supprime le flux A et fait varier le flux E en fonction de la durée du cycle cardiaque. En remplissant le VG depuis l’aorte, l’insuffisance aortique raccourcit le tDE et abaisse la vélocité du flux A. Dans l’insuffisance mitrale, le flux E est ample et accéléré, parce que le volume qui doit transiter en diastole est augmenté du volume régurgité en systole, qui revient dans le VG à la diastole suivante. La composante systolique du flux veineux pulmonaire est diminuée (IM modérée) ou abolie, et même inversée en cas d'IM sévère (reflux systolique pulmonaire).
Propagation du flux mitral (Vp)
Pendant la phase de relaxation active protodiastolique, il se forme un important gradient de pression négative entre l’OG et l’apex du VG dû à l’effet de succion. Plus ce gradient est élevé, plus le flux se propage rapidement à l’intérieur du VG. On peut mesurer cette propagation du flux mitral en ajustant la fenêtre du Doppler couleur de manière à avoir une colonne de flux diastolique mitral d’au moins 4 cm en direction de l’apex en vue 4-cavités ou 2-cavités mi-oesophagienne. L’échelle de vélocité-couleur est abaissée de manière à produire une zone d’aliasing au milieu du flux mitral (limite de Nyquist à 75% de la Vmax du flux mitral) (Vidéo).
Vidéo: l'échelle couleur a été abaissée de manière à introduire un effet d'aliasing dans le flux mitral diastolique. La fenêtre du Doppler couleur s'étend jusqu'à 5 cm dans le VG.
Le curseur du mode TM est placé dans l’axe du flux: la pente de la zone de premier aliasing est le marqueur de la vélocité de propagation (Vp) du flux dans le VG ; elle est d’autant plus raide que la relaxation est plus efficace (normal : > 55 cm/s). En cas de défaut de relaxation, cette pente diminue à < 45 cm/s puisque le flux s'avance plus lentement dans le VG pendant le déroulement dans le temps de l'enregistrement en mode TM (Figure 25.199) [2]. L’effet s’accentue avec l’aggravation de la dysfonction diastolique, mais la pente peut parfois se redresser en cas de restriction isolée [6].

Figure 25.199 : Propagation du flux mitral. A : l’axe du flux mitral est dirigé vers la paroi latéro-postérieure et fait un angle d’environ 20° avec le long-axe du VG (pointillé rouge). B : plus le gradient de pression protodiastolique entre l’OG et l’apex du VG est élevé, plus le flux se propage rapidement à l’intérieur du VG. En mode TM couleur, la vélocité de ce flux est mesurable par la pente de la zone d'aliasing (normal : > 50 cm/s). En cas de défaut de relaxation, cette pente diminue; dans le cas présent, elle est de 26 cm/s. Accélérer l'affichage à 100 mm/s rend la mesure plus précise.
L’intérêt de cette mesure est d’être peu dépendante des conditions de remplissage et de présenter une haute résolution temporelle (5 msec) et spatiale (1 mm, 5 cm/s). Elle permet de différentier la cardiomyopathie restrictive (pente faible) de la péricardite constrictive (pente normale). Toutefois, elle est peu reproductible en cas de dilatation ventriculaire importante (flux excentrique) et n’est pas valide en cas d’insuffisance aortique car elle dépend d'une répartition normale des flux à l'intérieur du VG [22]. D'autre part, elle est influencée par l'âge [13]. Le rapport entre la Vmax du flux E et la propagation du flux mitral (E/Vp) permet d’estimer la PAPO : celle-ci est > 15 mmHg lorsque E/Vp est > 1.5 [3,5].
Pente de décélération du flux E
La durée de la décélération du flux mitral E (tDE) est mesurée depuis l'instant de la Vmax jusqu'à celui où le flux rejoint la ligne de base; elle est extrapolée jusqu'à celle-ci si la pente est interrompue par le diastasis ou le flux A. La pente de décélération est tributaire de la vélocité maximale du flux E et de l'élasticité du myocarde. Elle diminue lorsque la Vmax baisse par défaut de relaxation, mais conserve la même durée. Celle-ci diminue lors de pseudonormalisation parce que le VG perd en élasticité; elle devient très brêve lors de restriction, car le ventricule est tellement rigide que le flux est inerrompu très brusquement (Figure 25.200).

Figure 25.200 : Durée de la phase de décélération du flux E (double flèche bleue) dans les 3 catégories de dysfonction diastolique. Valeur normale: 150-180 ms. Défaut de relaxation: > 200 ms. Pseudo-normalisation: 120-180 ms. Restriction: < 120 ms.
Dans les arythmies qui induisent un remplissage variable comme la fibrillation auriculaire, la Vmax du flux E se modifie constamment. Par contre, la pente de décélération du flux E (tDE) reste un bon indicateur du degré de dysfonction diastolique; un tDE < 130 ms est associé à une POG élevée et à une physiologie restrictive [15].
Rapport entre les durées A/Ar
Lors de la contraction auriculaire, l'OG éjecte le sang dans le VG, mais aussi dans les quatre veines pulmonaires parce que celles-ci ne possèdent pas de valve anti-reflux. Le volume de ce reflux est proportionnel à la résistance rencontrée au passage du sang dans le ventricule. Lorsque la distensibilité de ce dernier s'effondre et que sa pression diastolique est élevée, le frein au flux A antérograde à travers la valve mitrale force davantage de sang à reculer dans les veines pulmonaires plus compliantes. La proportion du flux A rétrograde (Ar) augmente alors que celle du flux A antérograde (A) diminue; le rapport A/Ar diminue. La vélocité du flux Ar devient > 0.35 m/s et sa durée se prolonge (Figure 25.201) [27]. La mesure de la durée des flux A s'est avérée être mieux corrélée à la Ptd du VG que celle de leur vélocité. Lorsque la durée du flux Ar est supérieure de > 40 ms à celle du flux A mitral, la PtdVG est > 20 mmHg (sensibilité 87%) [23,24]. Cet indice est peu dépendant de la précharge; de plus, il est indépendant de l’âge. Mais il dépend de la force de contraction de l'OG, qui doit être normale; lorsqu'elle est très dilatée, l'oreillette n'a plus une puissance contractile suffisante et cet indice perd sa valeur.

Figure 25.201 : Différence entre la durée du flux Ar rétrograde dans les veines pulmonaires et celle du flux A à travers la valve mitrale (ici 60 ms). La faible composante S du flux veineux pulmonaire (VP) signe également une POD élevée.
| Flux de remplissage diastolique |
| La dysfonction diastolique se traduit par trois stades d'altération des flux de remplissage du VG (flux veineux pulmonaire FVP et flux mitral): - Défaut de relaxation: ↓ Vmax E, ↑ Vmax A, E/A < 1, Vp ↓, FVP sp - Pseudonormalisation: ↑ Vmax E, E/A 1-1.5, tDE ↓, Vp ↓, FVP S < D - Restriction: ↑ Vmax E, E/A 1.5-2, tDE ↓↓, FVP Ar > A Hypovolémie: ↓ Vmax E, ↑ Vmax A, fusion E-A par tachycardie, FVP S > D Indices moins dépendants des conditions de charge: - Propagation du flux mitral (Vp); < 45 cm/s dans le défaut de relaxation - Durée de décélération du flux E (tDE); < 150 ms si défaut d'élasticité - Rapport durées A/Ar; flux Ar > 30 ms plus long que flux A si défaut de distensibilité |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
Références
- DALEN H, THORSTENSEN A, VATTEN LJ, et al. Reference values and distribution of conventional echocardiographic Doppler measures and longitudinal tissue Doppler velocities in a population free from cardiovascular disease. Circ Cardiovasc Imaging 2010; 3:614-22
- DJAIANI GN, McCREATH BJ, TI LK, et al. Mitral flow propagation velocity identifies patients with abnormal diastolic function during coronary artery bypass graft surgery. Anesth Analg 2002; 95:524-30
- FIRSTENBERG MS, LEVINE BD, GARCIA MJ, et al. Relationship of echocardiographic indices to pulmonary capillary wedge pressure in healthy volunteers. J Am Coll Cardiol 2000; 36:1664-9
- GALDERISI M, RAPACCIULO A, ESPOSITO R, et al. Site-dependency of the E/e' ratio in predictive invasive left ventricular filling pressure in patients with suspected or ascertained coronary artery disease. Eur Heart J Cardiovasc Imaging 2013; 14:555-61
- GARCIA MJ, ARES MA, ASHER C, et al. An index of early left ventricular filling that combined with pulsed Doppler peak E velocity may estimate capillary wedge pressure. J Am Coll Cardiol 1997; 29:448-54
- GARCIA MJ, SMEDIRA NG, GREENBERG NL, et al. Color M-mode Doppler flow propagation velocity is a preload insensitive index of left ventricular relaxation: animal and human validation. J Am Coll Cardiol 2000; 35:201-8
- GARCIA MJ, THOMAS JD, KLEIN AL. New Doppler echocardiographic application for the study of diastolic function. J Am Coll Cardiol 1998; 32:865-75
- KHOURI SJ, MALY GT, SUH DD, WALSH TE. A practical approach to the echocardiographic evaluation of diastolic function. J Am Soc Echocardiogr 2004;17:290-7
- MAHMOOD F, JAINANDUNSING J, MATYAL R. A practical approach to echocardiographic assessment of perioperative diastolic dysfunction. J Cardiothorac Vasc Anesth 2012; 26:1115-23
- MARAGIANNIS D, NAGUEH SF. Echocardiographic evaluation of left ventricular diastolic function: an update. Curr Cardiol Rep 2015; 17:561
- MAYTAL R, SKUBAS NJ, SHERNAN SK, MAHMOOD F. Perioperative assessment of diastolic dysfunction. Anesth Analg 2011; 113:449-72
- McILROY DR, LIN E, DURKIN C. Intraoperative transesophageal echocardiography: a critical appraisal of its current role in the assessment of diastolic dysfunction. J Cardiothorac Vasc Anesth 2015; 29:1033-43
- MEGO DM, DEGEARE VS, NOTTESTAD SY, et al. Variation of flow propagation velocity with age. J Am Soc Echocardiogr 1998; 11:20-5
- MOR-AVI V, LANG RM, BADANO LP, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur J Echocard 2011; 12:167-205
- NAGUEH SF, KOPELEN HA, QUINONES MA. Assessment of left ventricular filling pressure by Doppler in the presence of atrial fibrillation. Circulation 1996; 94:2138-45
- NAGUEH SF, APPLETON CP, GILLEBERT TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur J Echocardiogr 2009; 10:165-93
- NAGUEH SF, SMISETH OA, APPLETON CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association for Cardiovascular imaging. J Am Soc Echocardiogr 2016; 29:277-314
- NAKAI H, TAKEUCHI M, NISHIKAGE T, et al. The mitral L wave: a marker of advanced diastolic dysfunction in patients with atrial fibrillation, Circ J 2007; 71:1244-9
- NISHIMURA RA, ABEL MD, HOUSMANS PR, et al. Mitral flow velocity curves as a function of different loading conditions: evaluation by intraoperative transesophageal Doppler echocardiography. J Am Soc Echocardiogr 1989; 2:79-88
- PAI RG, VARADARAJAN P. Relative duration of transmitted mitral A wave as a measure of left ventricular end-diastolic pressure and stiffness. Echocardiography 204; 21:27-31
- PAULUS WJ, TSCHÖPE C, SANDERSON JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007; 28:2539-50
- RIVAZ-GOTZ C, MANOLIOS M, THOHAN V, et al. Impact of left ventricular ejection fraction on estimation of left ventricular filling pressures using tissue Doppler and flow propagation velocity. Am J Cardiol 2003; 91:780-4
- ROSSI A, CICOIRA M, GOLIA G, et al. Mitral regurgitation and left ventricular diastolic dysfunction similarly affect mitral and pulmonary vein flow Doppler parameters. J Am Soc Echocardiogr 2001; 14:562-8
- ROSSVOLL O, HATLE LK. Pulmonary venous flow velocities recorded by transthoracic Doppler ultrasound: relation to left ventricular diastolic pressure. J Am Coll Cardiol 1993; 21:1687-96
- SMISETH OA, GALDERISI M, OH JK. Left ventricle diastolic function. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 147-61
- SWAMINATHAN M, NICOARA A, PHILLIPS-BUTE BG, et al. Utility of a simple algorithm to grade diastolic dysfunction and predict outcome after coronary artery bypass graft surgery. Ann Thorac Surg 2011; 91: 1844-50
- YAMAMOTO K, NISHIMURA RA, BURNETT JC, et al. Assessment of left ventricular end-diastolic pressure by Doppler echocardiography: contribution of duration of pulmonary venous versus mitral flow velocity curves at atrial contraction. J Am Soc Echocardiogr 1997; 10:52-9
