Bien qu'elle ne soit pas disponible sur tous les appareils, la technologie tridimensionnelle est maintenant une pratique courante au sein de l'examen ETO. Le mode 3D incorpore à la sonde transoesophagienne un capteur matriciel constitué de ≥ 2'500 éléments qui acquièrent en temps réel les données d’un volume pyramidal tridimensionnel au lieu d’un plan bidimensionnel (voir Echocardiographie 3D). Les données brutes sont replacées par le processeur dans un volume cartésien à 3 dimensions ; chaque point est caractérisé par ses coordonnées selon les axes x, y et z, et par son intensité. L'examen 3D permet d'observer directement l'image en trois dimensions et de réaliser la planimétrie des conduits, des orifices ou des cavités, quelle que soit leur forme. Le 3D améliore la visualisation des structures, évite la fastidieuse représentation mentale imposée par plusieurs plans bidimensionnels et facilite grandement la communication avec le chirurgien. Il est moins opérateur-dépendant que le mode 2D, diminue la variabilité inter-observationnelle et facilite le repérage chez les débutants [4]. Il est particulièrement utile pour la quantification de la masse et des volumes myocardiques, pour l'évaluation de la géométrie complexe du VD ou des cardiopathies congénitales, pour la visualisation anatomique des valves mitrale et aortique, et pour le guidage des procédures semi-invasives intracardiaques (TAVI, Mitraclip, etc).
Pour obtenir un rendu de bonne qualité, l’image doit être d’abord optimalisée en mode 2D avec un gain adéquat (un gain insuffisant laisse des trous en 3D, alors qu’un gain excessif épaissit les structures) et une compression adaptée. Une image 2D aussi parfaite que possible est la condition sine qua non pour obtenir une bonne image 3D. Dans le mode en temps réel (live-3D et zoom), plus le volume échantillonné est petit, plus la cadence (frame rate) des images augmente. Une haute densité des lignes d'analyse augmente la résolution spatiale mais freine la cadence d'images. Il s'agit donc de trouver le meilleur compromis entre le volume échantillonné et la densité des lignes pour obtenir la meilleure cadence, car ces trois éléments sont interdépendants [14]. Pour le mode en différé (full-volume), il est recommandé d’ajuster d’abord la zone d’intérêt, le gain et la cadence sur le mode en temps réel avant de procéder à l’acquisition [5]. Les zones les plus profondes sont colorées en bleu, les plus proches en dégradés de brun. Des algorithmes de lissage permettent un fondu et une continuité de l'image, mais sont sujets à des artéfacts (stitching artefacts), notamment lorsque les mouvements respiratoires ou les arythmies modifient la position des structures par rapport au découpage temporel de l'ECG.
L’affichage fonctionne selon plusieurs modalités (voir Figure 25.33) [1,12,26].
Pour obtenir un rendu de bonne qualité, l’image doit être d’abord optimalisée en mode 2D avec un gain adéquat (un gain insuffisant laisse des trous en 3D, alors qu’un gain excessif épaissit les structures) et une compression adaptée. Une image 2D aussi parfaite que possible est la condition sine qua non pour obtenir une bonne image 3D. Dans le mode en temps réel (live-3D et zoom), plus le volume échantillonné est petit, plus la cadence (frame rate) des images augmente. Une haute densité des lignes d'analyse augmente la résolution spatiale mais freine la cadence d'images. Il s'agit donc de trouver le meilleur compromis entre le volume échantillonné et la densité des lignes pour obtenir la meilleure cadence, car ces trois éléments sont interdépendants [14]. Pour le mode en différé (full-volume), il est recommandé d’ajuster d’abord la zone d’intérêt, le gain et la cadence sur le mode en temps réel avant de procéder à l’acquisition [5]. Les zones les plus profondes sont colorées en bleu, les plus proches en dégradés de brun. Des algorithmes de lissage permettent un fondu et une continuité de l'image, mais sont sujets à des artéfacts (stitching artefacts), notamment lorsque les mouvements respiratoires ou les arythmies modifient la position des structures par rapport au découpage temporel de l'ECG.
L’affichage fonctionne selon plusieurs modalités (voir Figure 25.33) [1,12,26].
- Le mode en 2 plans simultanés (X-Plane) affiche deux vues biplan à 30-150° l'une de l'autre, centrées sur la zone d’intérêt (25-8 Xplane VAo) ; le Doppler couleur peut y être ajouté. La cadence d'image est élevée et la résolution spatiale identique à celle du 2D.
Vidéo: vue "X-Plane" simultanée d'une valve aortique insuffisante en court-axe et en long-axe.
- Le 3-D en temps réel (live 3D) affiche un volume pyramidal étroit (30°x60°) sur toute la profondeur choisie à une cadence de 10-15 images/seconde avec une résolution spatiale qui est fonction directe du nombre de lignes et inverse du volume investigué.
Vidéo: vue "live-3D" de la valve mitrale et de la valve aortique depuis le VG; en diastole, le feuillet mitral antérieur flotte librement entre la chambre d'admission et la chambre de chasse.
- Le zoom 3D agrandit une zone isolée du volume pyramidal (de 20°x20° à 90°x90°) en temps réel; la cadence est variable selon le volume (10-20 images/sec).
Vidéo: vue "3D-zoom" de la valve mitrale depuis l'OG; le feuillet antérieur est en-haut, jouxtant la valve aortique, et le feuillet postérieur est en-bas.
- Le mode volume-complet (full volume) acquiert un volume pyramidal sous un grand angle (de 65°x56° à 102°x105°) avec une plus haute résolution spatiale et temporelle, mais le fait en différé sur une acquisition de 3 à 16 cycles cardiaques et le reconstruit à partir d’une synchronisation avec l’ECG; cette modalité demande un certain temps, l’absence d’arythmies ou d'électrocoagulation, et l’arrêt de la ventilation. Par contre, la définition spatiale et la cadence d'image (30-40 images/sec) du volume mis en mémoire sont élevées, pour autant que le volume examiné ne soit pas trop important. Le Doppler couleur peut y être ajouté. il est recommandé d’ajuster d’abord la zone d’intérêt, le gain et la cadence sur le mode live-3D avant de procéder à l’acquisition [5]. Ce mode permet ensuite de procéder à des découpes (cropping) et à des rotations permettant des vues selon n’importe quel plan. Par exemple, en éliminant des deux tiers du VG et de l'OG, on obtient une vue "en face" de la valve mitrale, qui est analogue à celle du chirurgien dans le champ opératoire (Figure 25.140).
Vidéo: vue "full-volume" en reconstruction 3D de la valve mitrale, dite "en-face" c'est-à-dire comme la voit le chirurgien depuis l'OG.
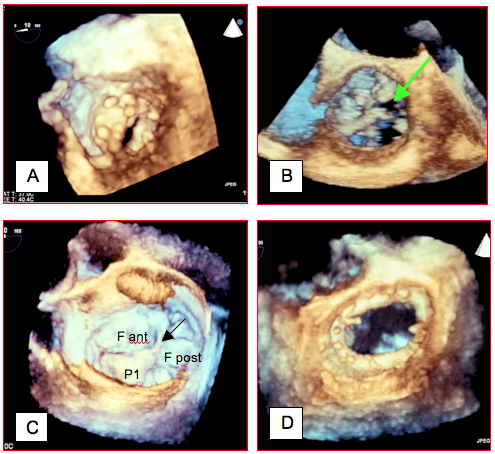
Figure 25.140 : Exemples d’imagerie tridimensionnelle. A : sténose mitrale serrée vue depuis le VG ; la valve est déformée en cône. B : sténose aortique ; la flèche indique le minuscule orifice ouvert en systole. C : valve mitrale souffrant d’un prolapsus du feston antérieur du feuillet postérieur (P1) vue depuis l'OG; la flèche indique une rupture de cordage. D : anneau de plastie mitrale vu depuis l’OG.
Outre les artéfacts liés à l'analyse bidimensionnelle qui en est la base, l'écho 3D est entaché d'une série de distorsions qui lui sont propres (voir Echocardiographie 3D) [13,14].
- Erreur de parallaxe dans les mesures;
- Erreurs de collage (stitching) dans la reconstruction;
- Lacunes dues au manque de gain;
- Flous (blurring) faisant apparaître certains corps étrangers plus épais que la réalité.
Indications
Bien que son application soit en constante expansion, les indications principales du 3D en ETO peuvent être résumées de la manière suivante [2].
Bien que son application soit en constante expansion, les indications principales du 3D en ETO peuvent être résumées de la manière suivante [2].
- Evaluation précise du volume et de la fonction du VG et du VD;
- Examen détaillé de la valve mitrale;
- Dysfonction d'une prothèse mitrale;
- Examen de la valve aortique et de la CCVG dans les situations anatomiques complexes;
- Evaluation pré- et post-CEC de plastie ou de correction de cardiopathie congénitale complexe;
- Guidage des interventions semi-invasives sur les valves (TAVI, Mitraclip), sur l'appendice auriculaire gauche ou sur le septum interauriculaire;
- Situations où l'écho transthoracique ou l'ETO 2D donnent des résultats insuffisants.
| Echocardiographie tridimensionnelle |
| Le transducteur émet un faisceau d'ultrasons de forme pyramidale dans l'espace (3D), au lieu d'un plan orientable (2D). La grande quantité de données à traiter par le processeur ralentit la cadence d'image proportionnellement à la densité de lignes d'analyse (résolution spatiale) et au volume exploré. L'image est rendue selon quatre modalités. - Affichage simultané de 2 ou 3 plans de la même structure - 3D en temps réel (live-3D): volume pyramidal limité (30° x 60°), cadence 10-15 images/s - 3D-zoom: volume sélectionné dans le champ d'exploration global (10-20 images/s) - Full-volume: enregistrement par tranches au cours de 3-12 cycles cardiaques et rendu en différé avec une grande résolution spatiale et temporelle (30-40 images/s); le volume enregistré peut ensuite être découpé selon n'importe quel plan et n'importe quel angle Indications principales: - Evaluation de la valve mitrale - Evaluation de la valve aortique dans les pathologies complexes - Mesure précise du volume et de la fonction du VG et du VD - Evaluation plus précise des pathologies complexes (congénitaux) - Guidage d'interventions intracardiaques (TAVI, Mitraclip, Amplatzer) |
Valve mitrale
L'imagerie tridimensionnelle offre une définition très supérieure des segments de la valve et des dimensions de l’anneau (voir Chapitre 26, Insuffisance mitrale, Imagerie 2D et 3D) [6]. Elle améliore considérablement la précision des mesures qui sont difficiles à faire en vue 2D, telle par exemple la distance intercommissurale. Alors que les vues 2D tendent à sous-estimer l'étendue d'un prolapsus, les mesures de la reconstitution volumétrique sont plus précises en 3D, car le plan de coupe bidimensionnel est relativement arbitraire par rapport aux dimensions maximales de la lésions. La longueur du feuillet antérieur est réduite de 1.4-2.1 mm (2.5 vs 2.7 cm) par rapport aux mesures bidimensionnelles, parce que ces dernières la mesurent depuis l'anneau jusqu’à l'extrémité du feuillet alors que le 3D le fait de l'anneau au point de coaptation [3,4]. La reconstruction tridimensionnelle du full-volume à partir d’une vue mi-oesophagienne 2D 4-cavités permet de voir la valve en face comme l’aperçoit le chirurgien depuis l’OG et de la couper selon différents plans (Vidéos et Figure 25.141, voir aussi Figure 25.35) [7,8].
Vidéo: vue "en-face" d'une valve mitrale normale depuis l'OG.
Vidéo: vue "en-face" depuis l'OG d'un prolapsus de la partie antéro-médiane du feuillet postérieur avec une rupture de cordage.
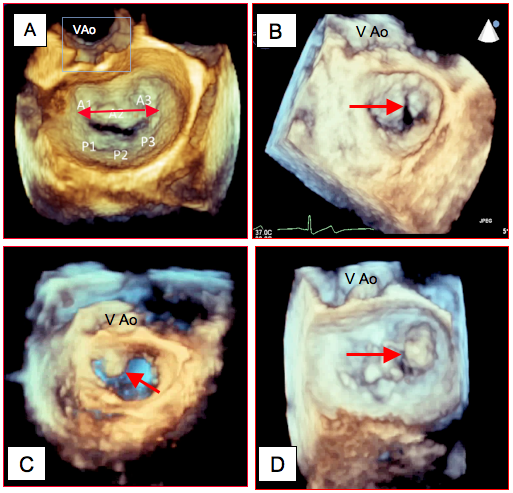
Figure 11.141 : Imagerie tri-dimensionnelle de l’IM vue "en-face" depuis l’OG. A : valve mitrale normale; la mesure du diamètre bicommissural (flèche rouge) est beaucoup plus précise qu'en 2D. B : fente (cleft) dans le feuillet antérieur; cette pathologie peut être très difficile à mettre en évidence en 2D alors qu'elle est bien visible en 3D. C : Prolapsus du feuillet antérieur (flèche) observé en protosystole. D : prolapsus de la commissure postérieure. Par convention, la coupe est orientée de manière à ce que la valve aortique apparaisse à 12 heures en haut de l'écran.
Les programmes semi-automatiques de modelage paramétrique permettent d'extraire des structures comme l'anneau et les feuillets mitraux à partir des données de full-volume préalablement marquées; on peut ensuite y faire une série de mesures, comme les dimensions de l'anneau, son élévation, la hauteur de ballonisation d'un feuillet, le volume de tente ou l'angle mitro-aortique (voir Figure 25.37) [21,24].
Dans l’insuffisance mitrale, l’évaluation tridimensionnelle du PISA montre que la lecture bidimensionnelle sous-estime la surface de l’orifice de régurgitation dans les IM fonctionnelles mais le surestime dans les prolapsus [15]. Le PISA est asymétrique, souvent aplati, et l’hémisphère incomplet ; dans les IM fonctionnelle il est courbé et allongé, alors qu’il est plus arrondi dans les prolapsus. Le 3D révèle aussi que la vena contracta est rarement de section circulaire mais plutôt ovale ou irrégulière selon la pathologie valvulaire [9].
Dans la sténose mitrale, qui a une forme d’entonnoir conique plongeant dans le VG en diastole, la planimétrie bidimensionnelle n’est jamais sûre que la coupe mesure effectivement l’endroit le plus étroit; elle peut se trouver au milieu du cône et surestimer l’ouverture de la valve. Dans la reconstruction 3D, on peut choisir le plan de coupe afin de mesurer la surface d’ouverture à son endroit le plus rétréci (Vidéo).La planimétrie 3D fournit les données les plus fiables de la surface mitrale [10]. Des algorithmes de remodelage paramétrique permettent d'extraire d'une acquisition en full-volume la représentation tridimensionnelle de l'anneau et des feuillets, et d'y faire des mesures comme la surface exacte de ceux-ci, quelle que soit leur forme. Ainsi l'orifice diastolique maximal d'une sténose mitrale est obtenu sans présupposé géométrique comme la surface qui manque à la surface totale des feuillets pour correpondre à celle ceinturée par l'anneau. Comparée aux autres techniques de mesure de la surface mitrale (équation de continuité, PISA, Pt1/2), cette procédure, comme la planimétrie 3D, donne des valeurs jusqu'à 30% plus étroites que la planimétrie 2D ou les mesures hémodynamiques [10]. Comme il illustre la valve mitrale entourée des structures avoisinantes, le 3D permet une meilleure interprétation des interférences entre la chambre d’admission et de la chambre de chasse du VG (Vidéo). La reconstruction 3D est actuellement considérée comme la mesure étalon de la surface d’ouverture de la valve lors de sténose mitrale (Figure 25.142).
Vidéo: vue d'une sténose mitrale serrée depuis le VG; la valve prend un aspect en cône plongeant dans le ventricule, son ouverture n'est plus qu'une fente.
Vidéo: vue de la valve mitrale et de la valve aortique depuis le VG; en diastole, le feuillet mitral antérieur flotte librement entre la chambre d'admission et la chambre de chasse.
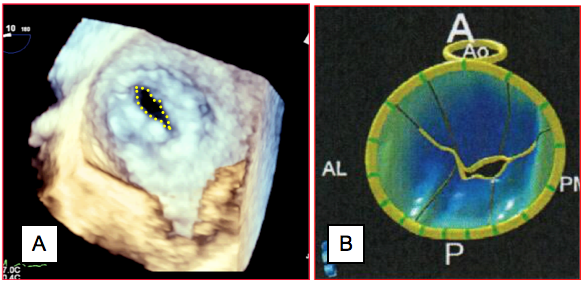
Figure 25.142 : Planimétrie de la surface d’ouverture d’une sténose mitrale serrée. A : en vue tridimensionnelle depuis le ventricule gauche. Comme la valve a une forme conique, il n’est jamais sûr que la coupe bidimensionnelle mesure effectivement l’endroit le plus étroit ; elle peut se trouver au milieu du cône et surestimer la dimension de la valve. L’imagerie 3D évite ce piège puisqu’elle reconstruit l’ensemble des feuillets et permet de faire la mesure à l’endroit exact qui est le plus étroit. B: reconstruction paramétrique de l'anneau et des feuillets mitraux à partir d'une image full-volume. Images diastoliques démontrant la faible ouverture de la valve; les zônes colorées en bleu sont situées en-dessous du plan de l'anneau. [extrait de: Poelaert JI, Bouchez S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thor Surg 2016; 50:801-12].
Valve aortique
Bien que l’examen 3D de la valve aortique soit plus difficile que celui de la mitrale, la planimétrie des sténoses sur la reconstruction en full-volume est plus précise que celle que l’on peut faire en 2D (Vidéo). L’image est construite à partir d’une vue 2D en court-axe 40-60° ou d'une vue 2D en long-axe 120-135°, en réduisant la zone d’intérêt à la valve et en excluant l’aorte ascendante (Vidéo) ; on peut ensuite reconstruire une vue en court-axe idéale pour une mesure de la surface d’ouverture, qui est possible dans 95% des cas et donne des valeurs légèrement plus restrictives que les mesures 2D (St Ao 3D) [19].
Vidéo: vue "en-face" d'une valve aortique normale; présence d'un cathéter pulmonaire de Swan-Ganz dans la chambre de chasse droite.
Vidéo: vue long-axe d'une valve aortique avec une sténose serrée.
Vidéo: vue court-axe d'une sténose aortique serrée sur bicuspidie.
La reconstruction la plus utile est une vue "en face" depuis l'aorte, mais le mouvement translationel longitudinal au cours du cycle cardiaque peut faire la sortir du plan [20]. L’image de la valve aortique la montre en relation avec les coronaires, le septum et le feuillet antérieur de la mitrale, ce qui est précieux pour le placement des endoprothèses aortiques ou la stratégie chirurgicale dans les endocardites.
L’imagerie 3D révèle que la section de la CCVG est elliptique et non circulaire, et que l’écho 2D sous-estime sa surface réelle. En effet, ce dernier coupe la CCVG dans son plus petit diamètre, qui est sagittal, alors que le plus grand diamètre est dans le plan horizontal. La différence est de l'ordre de 10% dans le tiers distal et de > 20% à la jonction entre la CCVG et le VG. En moyenne, le diamètre de la chambre de chasse mesure 2.0 cm verticalement et 2.3 cm horizontalement. La CCVG est plus évasée à sa jonction avec le ventricule: sa surface proximale est de 4.0 cm2 et sa surface distale (sous la valve aortique) de 3.4 cm2 [17]. De plus, le flux n'est pas homogène dans la CCVG; sa Vmax varie du simple au double selon l'endroit où on la mesure (Figure 25.143) [22]. Ces données tridimensionnelles montrent la marge d'erreur qui existe dans le calcul du volume systolique tel qu'il est réalisé habituellement en multipliant l'intégrale des vélocités du flux par la surface de la CCVG mesurée à partir de son diamètre en vue long-axe 120°.
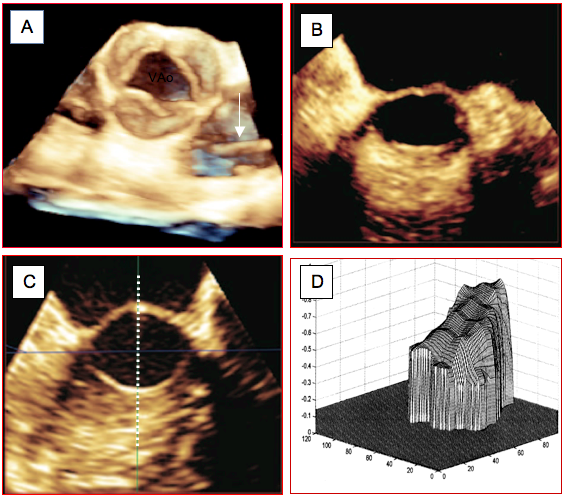
Figure 25.143 : Exemples d’imagerie 3D de la valve aortique et de la chambre de chasse. A: valve aortique normale en systole dans une vue analogue à la vue court-axe 40°; on voit un cathéter de Swan-Ganz dans l’artère pulmonaire (flèche). B: CCVG en vue 3D dans le plan coronal (court-axe) dans sa portion proximale (jonction VG-CCVG). C: vue identique dans le tiers distal. La section est clairement elliptique, le plus petit diamètre étant vertical; le trait pointillé indique le plan de coupe long axe 120° dans lequel on mesure le diamètre de la CCVG en 2D [Extrait de: Montealegre-Gallegos M, et al. Heterogeneity in the structure of the left ventricular outflow tract: a 3-dimensional transesophageal echocardiographic study. Anesth Analg 2016; 123:290-6]. D: profil du flux systolique dans la CCVG; le flux le plus rapide est au niveau de l'éperon septal [Extrait de: Poh KK. Assessing aortic valve area in aortic stenosis by continuity equation: a novel approach using real-time three-dimensional echocardiography. Eur Heart J 2008; 29:2526-35].
Ventricules
En imagerie bidimensionnelle, le volume du VG et le calcul de sa fraction d'éjection ne sont possibles que par le biais d'approximations géométriques qui introduisent une marge d'erreur considérable. Au contraire, l'imagerie tridimensionnelle donne directement accès au volume de la cavité ventriculaire. L'acquisition est faite en vue mi-œsophage 0-120° en englobant la totalité du VG et en faisant attention de ne pas amputer l'apex. La définition de l'endocarde est semi-automatique. Les muscles papillaires ne sont pas pris en compte, comme dans les mesures 2D [12]. Une fois opérée la définition de l'endocarde, le système réalise un moule tridimensionnel de la cavité et peut suivre son évolution au cours du cycle cardiaque (Vidéo). Ce calcul a une bonne corrélation avec la mesure de l’IRM, mais tend encore à sous-estimer le volume réel du VG [18]. La comparaison entre la mesure 2D (règle de Simpson) et la reconstruction 3D montre que l'examen ETO 2D sous-estime systématiquement le volume d'au moins 6-10%; toutefois, cette infirmité ne suffit pas à modifier la répartition des cas en 3 degrés de dilatation (normal, modéré ou sévère) [16]. En répétant la même manœuvre pour l'épicarde, il est possible d'obtenir la masse du VG en valeur directement volumétrique; toutefois, la définition de l'épicarde est plus délicate à réaliser que celle de l'endocarde (Tableau 25.5).
Vidéo: reconstruction 3D d'un moulage de l'endocarde du VG permettant de suivre son volume en continu au cours du cycle cardiaque; l'évolution celui-ci est illustrée par la courbe jaune au bas de l'écran.
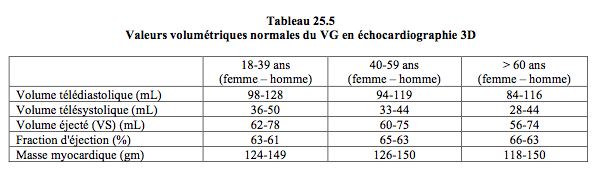
La reconstruction des 17 segments du VG par capture de tout le ventricule dans un seul ensemble offre une vision inégalée des altérations de la cinétique segmentaire et de leur éventuelle désynchronisation ; toutefois, elle ne fournit pas de données sur l’épaississement de paroi, mais seulement sur le déplacement de l’endocarde (Vidéo et Figure 25.144). Pour comparer la cinétique segmentaire, on peut également afficher en parallèle sur l’écran plusieurs coupes successives en court-axe à partir des données de l’enregistrement full-volume.
Vidéo: moulage 3D de l'endocarde du VG avec sa division en 17 segments dont la contractilité est suivie en continu au cours du cycle cardiaque; la déformation systolo-diastolique de chaque segment est illustrée par les courbes colorées au bas de l'écran.
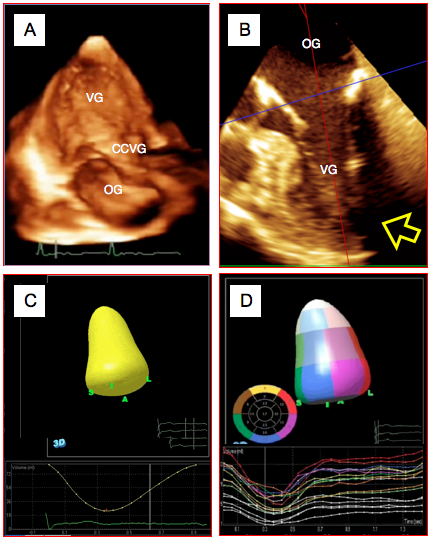
Figure 25.144 : Calcul du volume ventriculaire gauche en 3D. A: reconstruction du VG et de l'OG à partir d'une vue transthoracique apicale. B: en vue mi-œsophage rétrocardiaque, la définition de l'apex est assez souvent défaillante et laisse alors une lacune qui rend la quantification illusoire. C: la détection automatique des contours de l'endocarde réalise un moule de la cavité du VG et calcule son volume en continu au cours du cycle cardiaque; l'évolution du volume est illustrée par la courbe au bas de l'écran. D: analyse de la contractilité segmentaire; les 17 segments sont représentés par des zones colorées et leur déplacement radiaire est suivi individuellement. Leur évolution au cours du cycle cardiaque est illustrée par les courbes de contraction segmentaire au bas de l'écran.
La forme complexe du VD demande des prouesses au processeur pour évaluer son volume; lorsque les images de départ sont bonnes, le résultat est satisfaisant [25]. L'acquisition est faite en vue mi-œsophage 0-120° en pivotant la sonde pour que le VD figure in toto dans la prise de vue, y compris l'anneau tricuspidien. Le volume est calculé à partir d'une définition semi-automatique des contours de l'endocarde en coupe 4-cavités, en coupe sagittale et en coupe frontale. La mesure du volume télédiastolique et du volume télésystolique autorise à calculer la fraction d’éjection du ventricule sans approximation géométrique (Figure 25.145) [12]. Les volumes normaux sont très variables, avec une moyenne de 110 mL pour le volume télédiastolique et de 68 mL pour le volume télésystolique (FE 0.4); ils tendent à être légèrement sous-estimés par rapport à ceux mesurés à l'IRM [11].
Figure 25.145 : Calcul du volume ventriculaire droit. Le VD est représenté en télésystole (silhouette verte) et en télédiastole (image grillagée). On voit bien les mouvements de la contraction longitudinale (flèche jaune), de la contraction radiaire de la paroi libre (flèche bleue) et de la contraction du septum (en réalité partie du VG) (flèche blanche).
Autres structures
Comparé à l’imagerie bidimensionnelle, l’écho 3D permet une nette amélioration des performances diagnostiques dans plusieurs autres domaines de la chirurgie cardiaque et de la cardiologie invasive (Figure 25.146, voir aussi Figure 25.240).
- Les relations d’une masse avec son voisinage sont facilement mises en évidence (Vidéo).
- La vision de face du septum interauriculaire permet une bien meilleure évaluation des CIA et des FOP, et un placement plus rigoureux des dispositifs d’occlusion [23].
- La reconstruction de l'appendice auriculaire gauche à partir d'une acquisition mi-œsophage à 45-120° centrée sur l'AAG offre la possibilité de diagnostiquer plus sûrement la présence d'un thrombus et de mieux le différencier des trabéculations. La vue "en face" de son orifice est précieuse pour évaluer son diamètre et choisir la bonne dimension du dispositif d'occlusion.
- Dans les prothèses valvulaires, la mise en évidence et la localisation des déhiscences et des fuites paravalvulaires est nettement plus précise (Vidéo).
- Le 3D, particulièrement dans le mode XPlane qui visualise simultanément 2 plans orthogonaux, est une aide précieuse pour le positionnement des dispositifs non-invasifs de remplacement valvulaire (Vidéo).
Vidéo: extension d'un hypernéphrome dans la veine cave inférieure; la tumeur atteint l'OD où elle flotte dans le flux sanguin.
Vidéo: vue depuis l'OG d'un anneau prosthétique mitral après plastie de la valve; une fuite para-annulaire est clairement visible à 2 heures.
Vidéo: vues perpendiculaires simultanées (X-Plane) d'une sténose aortique serrée en court-axe et en long-axe; ce type d'imagerie facilite grandement le positionnement d'une endoprothèse valvulaire (TAVI).
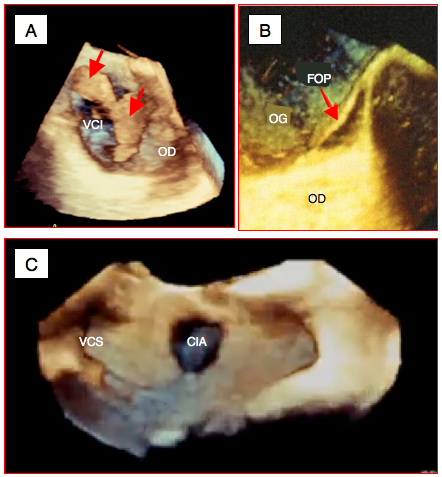
Figure 25.146 : Utilisation de l'écho 3D dans différentes situations. A: envahissement de la veine cave inférieure (VCI) par un hypernéphrome; la tumeur protrude dans l'OD à l'embouchure de la VCI (flèches rouges). B: ouverture oblongue d'un foramen ovale perméable (FOP); l'OD est remplie de microbulles. C: communication interauriculaire (CIA) de type ostium secondum au milieu du septum interauriculaire, vue depuis l'OD.
Par rapport au 2D, les intérêts essentiels du 3D sont une large supériorité dans l’évaluation anatomique des valves, du VD et des malformations congénitales, une mesure plus précise des volumes, et un contrôle plus rigoureux de l’implantation des appareillages intracardiaques (clip mitral, endoprothèse aortique, dispositif d’occlusion de CIA ou d’orifice paravalvulaire, etc). Mais la technologie tridimensionnelle est en plein essor. Les prochaines versions permettront une acquisition plus rapide, une cadence d’image plus élevée, une résolution supérieure et une meilleure incorporation du Doppler.
| ETO tridimensionnelle |
| Le mode tridimensionnel offre de multiples avantages dans l'examen des valves, des ventricules et de certaines pathologies. - Valve mitrale: diagnostic des lésions des feuillets, mesure des sténoses, reconstruction paramétrique de l'anneau, dimensions de la vena contracta (IM) - Valve aortique: planimétrie, structure des cuspides - CCVG: mesure des diamètres (section elliptique) - Ventricule gauche: mesure et suivi précis des volumes et de la fraction d'éjection - Ventricule droit: mesure cohérente du volume et de la fraction d'éjection - Diagnostic des masses et thrombus - Précision sur l'anatomie des cardiopathies congénitales - Aide lors de manœuvres semi-invasives (TAVI, MitraClip, Amplatzer) |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Avril 2020
Références
Références
- AGRICOLA E, BADANO L, MELE D, et al. Real-time three-dimensional transesophageal echocardiography: technical apsects and clinical applications. Heart Intern 2010; 5: e6
- BADANO LP, LANG RM, GONCALVES A. Three-dimensional echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 59-69
- BIAGGI P, JEDRSKIEWICZ S, GRUNER C, et al. Quantification of mitral valve anatomy by three-dimensional transesophageal echocardiography in mitral valve prolapse predicts surgical anatomy and the complexity of mitral valve repair. J Am Soc Echocardiogr 2012; 25:758-65
- BOUCHEZ S, MACKENSEN GB, MAUERMANN E, et al. Differences in two- and three-dimensional assessment of the mitral valve by novices and experts, illustrated using anterior mitral valve leaflet length. J Cardiothorac Vasc Anesth 2019; 33:1022-9
- FLASCHKAMPF FA, BADANO L, DANIEL WG, et al. Recommendations for transoesophageal echocardiography: update 2010. Eur J Echocardiogr 2010; 11:557-76
- GREWAL J, MANKAD S, FREEMAN WK. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009; 22:34-41
- HIEN MD, RAUCH H, LICHTENBERG A, et al. Real-time three-dimensional transesophageal echocarciography: improvements in intraoperative mitral valve imaging. Anesth Analg 2013; 116:287-95
- IZUMO M, SHIOTA M, KAR S, et al. Comparison of real-time three.dimensional transoesophageal echocardiography to two-dimensional transoesophageal echocardiographyfor quantification of mitral valve prolapse in patients with severe mitral regurgitation. Am J Cardiol 2013; 111:588-94
- KAHLERT P, PLICHT B, SCHENK IM, et al. Direct assessment of size and shape of noncircular vena contracta area in functional versus organic mitral regurgitation using real-time three-dimensional echocardiography. J Am Soc Echocardiogr 2008; 21:912-21
- KARAMNOV S, BURBANO-VERA N, HUANG CC, et al. Echocardiographic assessment of mitral stenosis orifice area: a comparison of a novel three-dimensional method versus conventional techniques. Anesth Anlg 2017; 125:774-80
- KARHAUSEN J, DUDARYK R, PHILLIPS-BUTE B, et al. Three.dimensional trasesophageal echocardiography for perioerative right ventricular assessment. Ann Thorac Surg 2012; 94:468-74
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LE HT, HANGIANDREOU N, TIMMERMAN R, et al. Imaging artifacts in echocardiography. Anesth Analg 2016; 122:633-46
- MAHMOOD F, JEGANATHAN J, SARAF R, et al. A practical approach to an intraoperative three-dimensional transesophageal echocardiography examination. J Cardiothorac Vasc Anesth 2016; 30:470-90
- MATSUMARA Y, FUKUDA S, TRAN H. Geometry of the proximal isovelocity surface area in mitral regurgitation by 3-dimensional color Doppler echocardiography: difference between functional mitral regurgitation and prolapse regurgitation. Am Heart J 2008; 155:231-8
- MERIS A, SANTAMBROGIO L, CASSO G, et al. Intraoperative three-dimensional versus two-dimensional echocardiography for left ventricular assessment. Anesth Analg 2014; 118:711-20
- MONTEALEGRE-GALLEGOS M, MATYAL R, KHABBAZ KR, et al. Heterogeneity in the structure of the left ventricular outflow tract: a 3-dimensional transesophageal echocardiographic study. Anesth Analg 2016; 123:290-6
- MOR-AVI V. Real-time 3-dimensional echocardiographic quantification of left ventricular volumes: multicenter study for validation with magnetic resonance imaging and investigation of sources of error. JACC Cardiovasc Imaging 2008; 1:413-23
- MORENA G, SAURA D, OLIVA MJ, et al. Real-time three-dimensional transoesophageal echocardiography in the assessment of aortic valve stenosis. Eur J Echocardiogr 2010; 11:9-13
- MURARU D, BADANO LP, VANNAN M, ILICETO S. Assessment of aortic valve complex by three-dimensional echocardiography: a framework for its effective application in clinical practice. Eur Heart J Cardiovasc Imaging 2012; 13:541-55
- POELAERT JL, BOUCHEZ S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thorac Surg 2016; 50:801-12
- POH KK. Assessing aortic valve area in aortic stenosis by continuity equation: a novel approach using real-time three-dimensional echocardiography. Eur Heart J 2008; 29:2526-35
- SKOLNICK A, VAVAS E, KRONZON J. Optimization of ASD assessment using real-time three-dimensional transesophageal echocardiography. Echocardiography 2009; 26:233-5
- SUGIMOTO T, DULGHERU R, MARCHETTA S, et al. What does 3D echocardiography ass to 2D echocardiography in the assessment of mitral regurgitation ? Curr Cardiol Rep 2017; 19:90
- TAMBORINI G. Feasibility of a new generation three-dimensional echocardiography for right ventricular volumetric and functional measurements. Am J Cardiol 2008; 102:499-505
- VEGAS A, MEINERI M. Three-dimensional echocardiography is a major advance for intraoperative clinical management of patients undergoing cardiac surgery: A core review. Anesth Analg 2010; 110:1548-73
