Outre la coarctation, de nombreuses anomalies sont possibles au niveau de l'arc aortique: hypoplasie, ductus arteriosus, fistules aorto-pulmonaires, anomalies coronariennes.
Anomalies coronariennes
L’arbre coronarien est sujet à de multiples variations anatomiques, qui surviennent dans 0.3% de la population (Figure 15.60) [2].
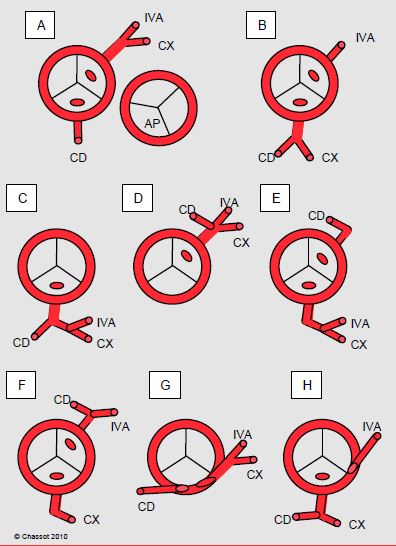
Figure 15.60 : Représentation schématique des anomalies coronariennes les plus fréquentes. A : situation normale, avec la position de la valve pulmonaire (AP). B à H : exemples d’anomalies. En B, C, E, F et H, un vaisseau contourne l’AP par devant et peut poser problème lors de chirurgie de la chambre de chasse droite. G : implantation intramurale [2].
Certaines sont bénignes, d'autres peuvent causer des arythmies, des morts subites ou une ischémie coronarienne. Les plus dangereuses sont l'implantation du tronc commun dans le sinus de Valsalva droit ou de la coronaire droite dominante dans le sinus de Valsalva gauche, l'implantation haute dans l'aorte, le trajet intramural, l'ostium unique pour les trois troncs, et le trajet entre l'aorte et l'AP [3]. Les anomalies coronariennent peuvent aussi poser des problèmes chirurgicaux considérables, notamment lorsque l’IVA passe au-devant de la CCVD lors d’une correction de tétralogie de Fallot ou de sténose pulmonaire. Une coronaire peut également se dilater et donner lieu à un anévrysme, parfois monstrueux (voir Figure 27.18F). Dans le syndrome ALPACA (anomalous left coronary artery from the pulmonary artery), l’implantation coronarienne dans l’AP compromet la perfusion myocardique du territoire concerné et oblige à une revascularisation chirurgicale précoce.
Une coronaire peut avoir une origine anormale sur l'aorte, ou se terminer dans le VD ou l'AP, ce qui crée une fistule gauche - droite. Dans ce cas, le shunt est significatif, de l'ordre de ≥ 1/1.6, et une correction est nécessaire [4]. D'une manière, l'indication opératoire dans les anomalies coronariennes est posée en présence d'ischémie myocardique ou de fistule G-D (syndrome ALPACA) [7].
Canal artériel (ductus arteriosus)
Le canal artériel relie l’aorte descendante juste après le départ de la sous-clavière gauche à la racine de l’artère pulmonaire gauche (voir Figure 14.71). Certains malades conservent un canal artériel perméable jusqu'à l'âge adulte; il est responsable d'un shunt G-D qui surcharge le VG et peut induire sa défaillance. Le débit du shunt dépend de la taille du canal et du rapport des résistances systémiques et pulmonaires (RAS/RAP). S'il est de faible calibre, le shunt G-D devient symptomatique vers la trentaine à cause de la surcharge de volume du VG. Le diagnostic est posé à l'auscultation: souffle 4/6 continu avec un crescendo systolique à l'extrémité supérieure du sternum, irradiant dans le dos. A l'échocardiographie, on aperçoit un flux turbulent continu suspendu dans l'artère pulmonaire et une zone d’accélération concentrique du flux dans l’aorte à l’entrée du canal ; ces flux sont essentiellement visibles en diastole [5]. La persistance d’un canal de diamètre important induit une dilatation du VG et une hypertension pulmonaire ; cette dernière conduit secondairement à une hypertrophie et à une défaillance du VD. Lorsque l’HTAP rejoint les valeurs de pression de l’aorte, le shunt devient bidirectionnel, même si la diastolique pulmonaire reste longtemps inférieure à la diastolique systémique.
Un petit canal silencieux n’est pas une indication opératoire [6]. L’indication est posée si le souffle est audible, si le VG souffre d’une surcharge de volume ou s’il existe une anamnèse d’endocardite. Le shunt doit être exclusivement G-D et le rapport des RAP et des RAS inférieur à 0.65 ; lorsque le shunt est bidirectionnel, seul un banding pour diminuer le flux est encore possible [6,7]. L’intervention se pratique de plus en plus fréquemment par voie percutanée (Transcatheter coil closure) ou par thoracoscopie. L’indication à ligaturer le canal par thoracotomie est désormais réservée au canaux trop larges, trop calcifiés ou trop tortueux pour une fermeture par voie endovasculaire [1,8].
En peropératoire, il est intéressant de monitorer la SpO2 à la main droite et au pied droit. A SpO2 constante au membre supérieur, la SpO2 du pied se modifie de manière inversement proportionnelle au débit à travers le canal. En cas de shunt bidirectionnel, la SpO2 du pied est significativement plus basse que celle de la main parce que le shunt débite partiellement D-G. Tant que la PAP est significativement plus basse que la pression systémique, une vasodilatation artérielle diminue le shunt, mais si les deux pressions sont voisines et le shunt bidirectionnel, il faut éviter toute baisse de pression systémique qui augmenterait la composante D-G du shunt et aggraverait la cyanose post-ductale. La ligature du canal induit immédiatement une élévation de la diastolique systémique, qui était basse, et une surcharge de volume circulant, par remise en circulation du volume détourné dans les poumons.
Fistule aorto-pulmonaire
On rencontre de temps en temps chez l’adulte une petite communication entre l’aorte ascendante et le tronc de l’artère pulmonaire (fistule aorto-pulmonaire) qui crée un shunt G-D analogue à celui d’un canal artériel persistant. La taille de la fistule détermine l’importance de ce shunt et le degré de surcharge de volume pour le VG. A l’échocardiographie, elle apparaît comme un petit jet dans le tronc de l’AP sur sa face antéro-latérale droite, surtout visible en diastole car il est masqué par le flux de l’AP en systole. Le traitement est une fermeture chirurgicale.
| Anomalies artérielles |
|
Parmi les anomalies coronariennes, certaines causent des arythmies majeures, des morts subites ou une ischémie myocardique.
Le canal artériel est une communication entre l’aorte descendante juste après le départ de la sous-clavière gauche et la racine de l’artère pulmonaire gauche. Il cause un shunt G-D. Le canal artériel est fermé par voie endovasculaire ou chirurgicale s'il occasionne un shunt qui surcharge le VG, mais pour autant que le rapport RAP/RAS soit < 0.7; si ce rapport voisine 1, le shunt est bidirectionnel et ne peut plus être occlus.
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Décembre 2019
Références
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BETTEX D, CHASSOT PG. Transesophageal echocardiography in congenital heart disease. In: BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1186-1212
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital hesart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- BISHOP A. Coronary artery anomalies. In: REDINGTON A, et al. ed. Congenital heart disease in adults. A practical guide. London, WB Saunders Co Ltd, 1994, pp 153-60
- MILLER-HANCE WC, SILVERMAN NH. Transesophageal echocardiography (TEE) in congenital heart disease with focus on the adult. Cardiol Clinics 2000; 18:861-92
- SILVERSIDES CK, DORE A, POIRIER N, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Shunt lesions. Can J Cardiol 2010; 26:e70-e79
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
