Pour propulser le volume systolique à travers la valve aortique sans se torchonner sur lui-même, le VG dispose d’un squelette interne assuré par l’ensemble de la valve mitrale, des cordages et des piliers. En effet, la pression exercée sur le sang contenu entre les parois ventriculaires pousse les deux feuillets de la valve mitrale et les appuie l’un contre l’autre au niveau de leurs extrémités (zona rugosa) ; la hauteur de cette surface d’appui est de 8-10 mm. Ils sont maintenus dans le plan de la valve par la traction exercée par les cordages et la contraction des muscles papillaires. Cet équilibre entre les forces d’occlusion et les forces de traction maintient la forme générale du VG et lui permet de propulser le sang en direction de la chambre de chasse (CCVG), qui se contracte en dernier (Figure 5.25).
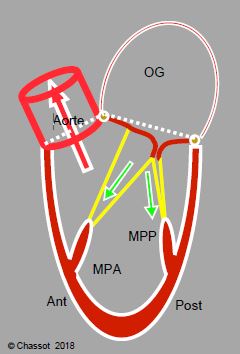
Figure 5.25 : Contraction normale du VG. L’augmentation de la pression intra-ventriculaire en systole applique les deux feuillets de la valve mitrale l’un contre l’autre (flèches violettes) ; la contraction de la paroi et des muscles papillaires (MPA : muscles papillaire antérieur, MPP : muscle papillaire postérieur) tend les cordages et maintient la valve mitrale dans son plan d’occlusion (flèches vertes). Ceci constitue le squelette interne du ventricule. Le sang est expulsé dans la chambre de chasse du VG (CCVG). La contraction débute à l’apex et se termine dans la chambre de chasse.
Le plan de la valve aortique et celui de la valve mitrale forment normalement un angle très ouvert (angle ≥ 150°) ; le flux d’admission à travers la valve mitrale et le flux d’éjection à travers la chambre de chasse sont presque parallèles (angle < 25°). Ils ne sont séparés que par le feuillet mitral antérieur (Vidéo).
Vidéo: Vue depuis le ventricule gauche montrant la proximité de la chambre d'admission, avec la valve mitrale, et de la chambre de chasse, avec la valve aortique. En diastole, le feuillet antérieur pend dans le VG et marque la limite entre les deux voies. S'il est trop long ou si le ventricule est trop petit, il peut facilement être aspiré dans la CCVG en systole (effet CMO).
La zone de coaptation de la valve mitrale est maintenue éloignée postérieurement de la zone d’éjection aortique, qui est antérieure, par plusieurs éléments.
- La longueur du feuillet antérieur est plus grande que celle du feuillet postérieur.
- L'angle mitro-aortique est assez ouvert pour éloigner la chambre d'admission de la chambre de chasse.
- La course radiaire de la paroi postérieure est plus faible que celle des parois antérieure et latérale ; la zone postéro-basale est relativement hypokinétique par rapport au reste du ventricule.
- La paroi postéro-basale est activée électriquement en dernier.
Obstruction dynamique de la CCVG (effet CMO)
Cependant, certaines conditions peuvent déplacer antérieurement la zone de coaptation mitrale et la rapprocher de la zone d’éjection.
- Diminution de taille de la cavité ventriculaire : hypertrophie ventriculaire concentrique, hypovolémie;
- Augmentation de la course systolique de la paroi postérieure : sur-stimulation β;
- Baisse massive de la postcharge (vasoplégie ou remplacement valvulaire aortique pour sténose serrée);
- Elongation des feuillets mitraux (maladie de Barlow);
- Anneau mitral restrictif lors de plastie mitrale.
Dans ces conditions, l’angle mitro-aortique se referme et la zone de coaptation se rapproche de la zone d’éjection parce que la paroi postérieure est déplacée vers l’avant en systole. En effet, l’angle mitro-aortique est un point fixe puisqu’il est situé au niveau du trigone fibreux, qui est le centre de gravité mécanique du cœur sur lequel sont ancrées les valves mitrale, aortique et tricuspide (Figure 5.26A). L’anneau mitral ne peut se rétrécir qu’au niveau de sa partie postérieure, qui est fine et essentiellement musculaire. La diminution de taille de la cavité ventriculaire se traduit donc par un déplacement antérieur des structures postérieures. Ce mouvement a 4 effets en systole (Figure 5.26B) (voir Chapitre 13, Cardiomyopathie hypertrophique) [1,2].
- Déplacement antérieur de la zone de coaptation mitrale;
- Occlusion mitrale entre l’extrémité distale du feuillet postérieur et le corps du feuillet antérieur et non plus bord-à-bord;
- Augmentation de la course des cordages du pilier postérieur permettant davantage de déplacement antérieur des feuillets;
- Partie distale du feuillet antérieur flottant à l’intérieur de la cavité du VG en protosystole [6].
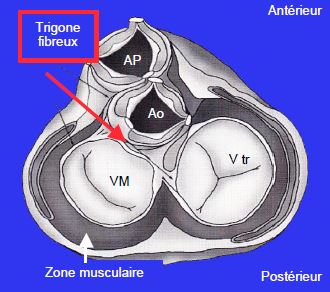
Figure 5.26A : Schéma de la position des valves et du trigone fibreux. L’angle mitro-aortique est un point fixe puisqu’il est situé au niveau du trigone fibreux, qui est le centre de gravité mécanique du cœur sur lequel sont ancrées les valves mitrale, aortique et tricuspide. Si l’anneau mitral se rétrécit, le seul déplacement possible est celui de sa partie postérieure, qui est essentiellement musculaire, et qui se retrouve alors tirée vers l’avant.
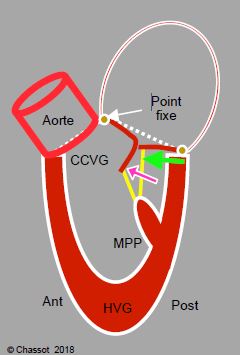
Figure 5.26B : Déplacement antérieur. Si la course de la paroi postérieure et du MPP est trop longue (stimulation béta-adrénergique) ou si le ventricule est trop petit (hypovolémie, hypertrophie concentrique), la paroi postérieure se déplace vers l’avant (flèche verte) ; le point de coaptation de la valve mitrale est déplacé antérieurement vers l’aorte et se rapproche de la CCVG. Le feuillet antérieur, dont la partie distale flotte dans le VG, est alors repoussé vers la CCVG lorsque la pression intraventriculaire augmente pendant la systole (flèche violette). Traitillé blanc : angle mitro-aortique.
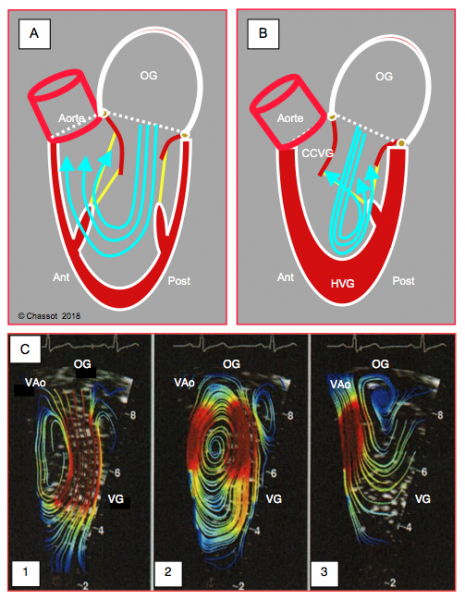
En diastole, le flux mitral est normalement dirigé vers la paroi postéro-latérale et non vers l’apex ; de cette manière, le vortex qui se forme dans le VG amène le sang en regard de la chambre de chasse et en avant du feuillet mitral antérieur ; dès que la pression monte en systole, cette masse de sang pousse le feuillet en arrière jusqu’à l’occlusion (Vidéo) (Figure 5.27A et 5.27C) [5].
Vidéo: vue IRM du coeur gauche (OG, VG et aorte), correspondant à une vue parasternale long-axe en échocardiographie transthoracique; on voit le flux tournoyer dans le sens horaire au sein du VG pour se placer sous la chambre de chasse en diastole.
Dans le cas d’un rétrécissement de la cavité ventriculaire, au contraire, le flux diastolique est dirigé trop vers l’avant, et forme son vortex en arrière du feuillet antérieur ; dans ces conditions, la pression de la phase de contraction isovolumétrique va pousser le feuillet vers l’avant en direction de la CCVG (Figure 5.27B) [6]. Dès que l’éjection commence, la partie distale de ce feuillet peut être aspirée dans la CCVG par effet Venturi et induire un phénomène appelé systolic anterior motion (SAM). Le feuillet antérieur vient alors occlure partiellement la CCVG et le débit systolique baisse brusquement. C’est l’obstruction dynamique de la CCVG ou effet CMO, appelé ainsi par analogie au mécanisme de la cardiomyopathie obstructive (Vidéo et Figure 5.28) [4].
Vidéo: subobstruction mésosystolique de la chambre de chasse du VG par la partie distale du feuillet mitral antérieur (SAM, systolic anterior motion) dans une vue échocardiographique mi-oesophage long-axe du VG.
Un gradient de pression important (> 30 mmHg au repos) apparaît alors dans la deuxième moitié de la systole, lorsque le ventricule est contracté ; ce gradient s'élève à > 60 mm Hg à l'effort [3]. L'aspiration du feuillet mitral dans la CCVG a pour effet de rouvrir la valve en mésosystole et de provoquer une insuffisance mitrale méso-télésystolique. Cliniquement, l'effet CMO se caractérise par une hypotension artérielle, une élévation des pressions de remplissage et un bas débit cardiaque qui ne réagissent pas aux catécholamines; le seul traitement est une hypervolémie, une vasoconstriction et une diminution de l'effet β (β-bloqueur) [2].
Vidéo: vue IRM du coeur gauche (OG, VG et aorte), correspondant à une vue parasternale long-axe en échocardiographie transthoracique; on voit le flux tournoyer dans le sens horaire au sein du VG pour se placer sous la chambre de chasse en diastole.
Dans le cas d’un rétrécissement de la cavité ventriculaire, au contraire, le flux diastolique est dirigé trop vers l’avant, et forme son vortex en arrière du feuillet antérieur ; dans ces conditions, la pression de la phase de contraction isovolumétrique va pousser le feuillet vers l’avant en direction de la CCVG (Figure 5.27B) [6]. Dès que l’éjection commence, la partie distale de ce feuillet peut être aspirée dans la CCVG par effet Venturi et induire un phénomène appelé systolic anterior motion (SAM). Le feuillet antérieur vient alors occlure partiellement la CCVG et le débit systolique baisse brusquement. C’est l’obstruction dynamique de la CCVG ou effet CMO, appelé ainsi par analogie au mécanisme de la cardiomyopathie obstructive (Vidéo et Figure 5.28) [4].
Vidéo: subobstruction mésosystolique de la chambre de chasse du VG par la partie distale du feuillet mitral antérieur (SAM, systolic anterior motion) dans une vue échocardiographique mi-oesophage long-axe du VG.
Un gradient de pression important (> 30 mmHg au repos) apparaît alors dans la deuxième moitié de la systole, lorsque le ventricule est contracté ; ce gradient s'élève à > 60 mm Hg à l'effort [3]. L'aspiration du feuillet mitral dans la CCVG a pour effet de rouvrir la valve en mésosystole et de provoquer une insuffisance mitrale méso-télésystolique. Cliniquement, l'effet CMO se caractérise par une hypotension artérielle, une élévation des pressions de remplissage et un bas débit cardiaque qui ne réagissent pas aux catécholamines; le seul traitement est une hypervolémie, une vasoconstriction et une diminution de l'effet β (β-bloqueur) [2].

Figure 5.27 : Flux mitral diastolique. A : normalement, le flux mitral est dirigé vers la paroi postéro-latérale et non vers l’apex ; de cette manière, le vortex qui se forme dans le VG amène le sang en regard de la chambre de chasse et en avant du feuillet mitral antérieur ; dès que la pression monte en systole, cette masse de sang pousse le feuillet en arrière jusqu’à l’occlusion [3]. B : dans le cas d’un rétrécissement de la cavité ventriculaire, au contraire, le flux diastolique est dirigé trop vers l’avant, et forme son vortex en arrière du feuillet antérieur ; dans ces conditions, la pression de la phase de contraction isovolumétrique va pousser le feuillet vers l’avant en direction de la CCVG [6]. C: images échocardiographiques de vélocimétrie des flux illustrant le mouvement normal du sang dans le ventricule gauche au cours d'un cycle cardiaque. 1: protodiastole (remplissage). 2: télédiastole (tournoiement pour conservation de l'énergie cinétique). 3: systole (éjection). L'accélération est traduite par un passage de la couleur bleue à la couleur jaune puis à la couleur rouge. Grâce à un vortex antérieur, le sang vient se positionner sous la CCVG en diastole [extrait de: Sengupta PP, et al. Emerging trends in CV flow visualization. JACC Cardiovasc Imag 2012; 5:305-16, figure 5].
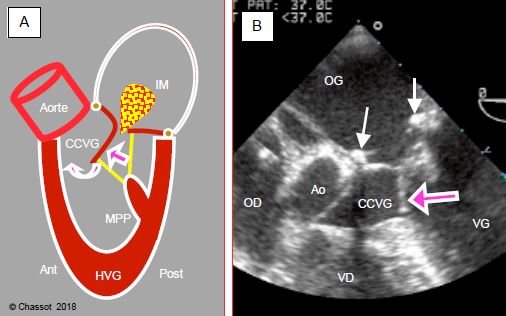
Figure 5.28 : Obstruction dynamique de la CCVG (effet CMO) en cas de restriction de la cavité ventriculaire gauche et d’avancement excessif de la paroi postérieure. A : la pression de la phase de contraction isovolumétrique pousse le feuillet vers l’avant en direction de la CCVG. Dès que l’éjection commence, la partie distale de ce feuillet peut être aspirée dans la CCVG par effet Venturi et induire un phénomène appelé systolic anterior motion (SAM). Le feuillet antérieur vient alors occlure partiellement la CCVG et le débit systolique baisse brusquement. C’est l’effet CMO, appelé ainsi par analogie avec le mécanisme de la cardiomyopathie obstructive. La réouverture de la valve mitrale en mésosystole provoque une insuffisance mitrale méso-télésystolique (IM). B : illustration échocardiographique transoesophagienne ; la flèche indique la coudure du feuillet mitral antérieur (SAM) qui vient obstruer la chambre de chasse gauche (CCVG). Les deux flèches blanches indiquent la position de l’anneau mitral (anneau de Carpentier restrictif après plastie mitrale).
La proximité de la chambre d’admission et de la chambre d’éjection caractéristique du cœur des mammifères les rend sujets à cette obstruction dynamique de la chambre de chasse dès que la cavité ventriculaire se rétrécit et/ou que la stimulation β est intense (Vidéo).
Vidéo: Vue tridimensionnelle depuis le VG de la valve mitrale (en bas) et de la valve aortique (en haut) en situation normale; seul le feuillet mitral antérieur, qui flotte librement dans la cavité ventriculaire en diastole, sépare la chambre d'admission de la chambre de chasse. Cette proximité menace de faire basculer le feuillet dans la CCVG en systole si la cavité ventriculaire se rétrécit.
En clinique, il faut en général une combinaison de plusieurs éléments pour voir s’installer une instabilité hémodynamique sévère liée à un effet CMO [1].
Vidéo: Vue tridimensionnelle depuis le VG de la valve mitrale (en bas) et de la valve aortique (en haut) en situation normale; seul le feuillet mitral antérieur, qui flotte librement dans la cavité ventriculaire en diastole, sépare la chambre d'admission de la chambre de chasse. Cette proximité menace de faire basculer le feuillet dans la CCVG en systole si la cavité ventriculaire se rétrécit.
En clinique, il faut en général une combinaison de plusieurs éléments pour voir s’installer une instabilité hémodynamique sévère liée à un effet CMO [1].
- Hypertrophie ventriculaire concentrique (HVG);
- Hypovolémie;
- Baisse de postcharge (vasoplégie, remplacement valvulaire aortique pour sténose);
- Stimulation β excessive;
- Plastie mitrale excessivement restrictive.
Le diagnostic ne peut être posé que par l’échocardiographie. La thérapeutique consiste en une augmentation de la précharge et de la postcharge, et en une diminution de la fonction inotrope (arrêt des catécholamines béta, béta-blocage).
| Squelette interne du VG |
|
L'appareil sous-valvulaire de la valve mitrale est un squelette interne pour le VG pendant la systole. La pression intraventriculaire appuie les deux feuillets mitraux l'un contre l'autre le long de leur surface distale, et la traction exercée sur les cordages par la contraction ventriculaire empêche la valve mitrale de basculer dans l'OG. Ce système maintient la forme du VG pendant l'éjection vers la CCVG.
Normalement, la zone de coaptation des feuillets mitraux est maintenue éloignée postérieurement de la chambre de chasse:
- Le feuillet postérieur est plus court que le feuillet antérieur
- La paroi postéro-basale a peu de course radiaire en systole
- L'angle mitro-aortique est très ouvert
- La paroi postéro-basale est activée électriquement en dernier
La zone de coaptation mitrale peut être déplacée antérieurement par diminution du volume de la cavité ventriculaire (hypovolémie, HVG concentrique, vasoplégie), par course excessive de la paroi postérieure (stimulation β) ou par restriction de l'anneau mitral (plastie). Ceci a 3 effets en systole:
- Occlusion de l'extrémité du feuillet postérieur contre le corps du feuillet antérieur, perte de la surface d'occlusion des feuillets
- Augmentation de la course des cordages du pilier postérieur
- Flottement de la partie distale du feuillet antérieur dans la cavité ventriculaire, qui est poussée en direction de la CCVG lorsque la pression s'élève
En cours d'éjection, le feuillet mitral antérieur est en plus aspiré dans la CCVG par effet Venturi (SAM: systolic anterior motion). Le résultat est une subobstruction dynamique de la CCVG (effet cardiomyopathie obstructive ou effet CMO) et une réouverture mésosystolique de la valve mitrale avec insuffisance (IM).
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- HENSLEY N, DIETRICH J, NYHAN D, et al. Hypertrophic cardiomyopathy: a review. Anesth Analg 2015; 120:554-69
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- LEFEBVRE XP, HE S, LEVINE RA, YOGANATHAN AP. Systolic anterior motion of the mitral valve in hypertrophic cardiomyopathy: an in vitro pulsatile flow study. J Heart Valve Dis 1995; 4:422
- MARON BJ. Clinical course and management of hypertrophic cardiomyopathy. N Engl J Med 2018; 379:655-68
- SENGUPTA PP, PEDRIZZETTI G, KILNER PJ, et al. Emerging trends in CV flow visualization. JACC Cardiovasc Imag 2012; 5:305-16
- SHERRID MV, GUNSBURG DZ, MOLDENHAUER S, et al. Systolic anterior motion begins at low left ventricular outflow tract velocity in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2000; 36:1344-54
