Chirurgie cardiaque
L’état clinique préopératoire est le premier facteur de risque de complications postopératoires en chirurgie de revascularisation coronarienne (PAC : pontage aorto-coronarien). Les différents indices de risque en usage (voir Chapitre 03, Facteurs de risque) démontrent une aggravation du pronostic avec plusieurs éléments : dysfonction ventriculaire, ischémie aiguë ou infarctus préopératoires, degré d’atteinte coronarienne, opération en urgence ou réopération, insuffisance rénale, diabète, maladie polyvasculaire, âge, sexe féminin [27].
Le taux d’infarctus postopératoire après PAC varie de 0.1% à > 10% selon les études, avec une moyenne de 2.4% [26] à 3.42% [32]. Contrairement à la chirurgie non-cardiaque, la présence d’épisodes d’ischémie peropératoire, notamment avant la CEC, est un facteur de risque d’infarctus postopératoire ; ces épisodes sont souvent associés à une tachycardie [15]. La persistance d’anomalies de la contraction segmentaire (ACS) du VG après la CEC est un facteur de mauvais pronostic, directement lié à l’incidence d’infarctus postopératoire [22]. Dans une étude sur les revascularisations à cœur battant, 71% des complications cardiaques postopératoires se retrouvent chez les patients qui n'ont pas récupéré de leur ACS en peropératoire, mais aucune complication n'est enregistrée chez ceux qui ont une contractilité segmentaire normale en fin d'intervention [24].
Conventionnellement, l'infarctus postopératoire après revascularisation chirurgicale (infarctus de type 5) est diagnostiqué sur la base des éléments suivants [33].
- Montée et descente typiques du taux de troponine (TnT-hs) avec un pic (> 10 fois la valeur du 99ème percentile) après l'acte chirurgical (en l'absence d'autre explication, telle une embolie pulmonaire), en combinaison avec l'un au moins des éléments suivants :
- Douleurs ischémiques (peu fréquentes).
- Apparition progressive d'onde Q pathologiques (≥ 30 ms dans 2 dérivations ECG contiguës).
- Modifications du segment ST (sus-décalage ≥ 1 mm, sous-décalage ≥ 1-2 mm) dans au moins 2 dérivations contiguës ; apparition d’un bloc de branche gauche.
- Inversion symétrique de l'onde T (> 1 mm).
- Nouvelles altérations de la cinétique segmentaire à l'échocardiographie (lésion impliquant > 20% de l'épaisseur de la paroi myocardique).
- Intervention sur les coronaires (pontage aorto-coronarien).
- Image coronarographique de thrombose de vaisseaux natifs, de stents ou de greffons.
- Infarctus aigu ou cicatrisé à la pathologie.
Le mode de définition de l’infarctus postopératoire est un problème majeur : l’incidence d’infarctus peut varier de 2.8% sur la base de l’ECG à 31% avec le scan au technétium ou l'IRM [9]. La présence d’une onde Q ou d’une élévation des troponines de plus de dix fois la limite supérieure de référence traduit des lésions transmurales importantes, mais de petites zones sous-endocardiques peuvent échapper à la détection. Bien qu’elles ne permettent pas de faire la différence entre une ischémie et les dégâts de l’intervention chirurgicale elle-même, les troponines sont un indicateur assez spécifique d’infarctus en chirurgie cardiaque [2]. Leur évolution dans le temps (pic à 12-24 heures) imposait un certain délai diagnostique [7], mais ce problème est résolu avec les tests ultrasensibles qui dosent des valeur de l'ordre de 1-3 ng/L de troponines I ou T; l'élévation est mesurable dans la première heure après l'événement ischémique [38]. Un taux postopératoire de troponine T supérieur à 10 fois la valeur de base est un prédicteur efficace de la mortalité à 6 mois en chirurgie cardiaque [12]. Mais une élévation isolée de < 10 fois la limite supérieure de référence survient dans la majorité des patients qui subissent des pontages aorto-coronariens (PAC), notamment lorsqu'on teste les troponines à haute sensibilité (TnT-hs) [37]. La retransfusion de sang médiastinal complique le diagnostic biologique de l’infarctus, car l’autotransfusion augmente le taux des marqueurs habituels [36].
| Infarctus postopératoire en chirurgie cardiaque |
|
L'incidence d'infarctus après revascularisation coronarienne varie de 0.1 à 4%. La persistence d'anomalies de la contraction segmentaire après CEC est un bon marqueur. L'infarctus est défini par une augmentation de > 10 fois des troponines à haute sensibilité, accompagné d'au moins un des signes suivants:
- Onde Q pathologique
- Modification du segment ST
- Inversion de l'onde T
- Altération de la cinétique segmentaire
- Thrombose de pontage à l'angiographie
|
Chirurgie non-cardiaque
L’incidence de complications cardiaques dans la période périopératoire est de 1.4% dans la population générale, toutes interventions confondues ; elle s'élève à 3.9% dans les populations à risque [3,4,20,23]. Le taux d'ischémie et d'infarctus peropératoire est plus faible qu’en-dehors de la salle d’opération (voir Figure 3.10). En effet, le malade analgésié, endormi et minutieusement monitorisé est dans une situation privilégiée; seuls 16% des infarctus surviennent en cours d'opération [1]. Dans le postopératoire, au contraire, l’incidence d’infarctus est 4-6 fois plus élevée à cause du réveil, de la douleur et du stress postopératoire. Alors que les épisodes ischémiques peropératoires n’ont que peu de lien avec l’incidence de l’infarctus postopératoire, les évènements ischémiques postopératoires, eux, sont directement reliés à la survenue d’infarctus [17,23]. L'ischémie survient le plus souvent dans la période postopératoire immédiate (24-48 premières heures), qui est un moment de fort déséquilibre hémodynamique. Elle ne se manifeste que par un sous-décalage prolongé du segment ST, pour autant que le malade soit sous surveillance ECG constante. Elle est très souvent précédée ou accompagnée d’une période de tachycardie, qui débute dès les premières heures postopératoires [18].
La période postopératoire est particulièrement à risque d'infarctus pendant plusieurs jours à cause de la vulnérabilité du patient à trois phénomènes [25].
- Syndrome inflammatoire systémique (acute phase reaction).
- Elévation de tous les marqueurs inflammatoires, activation leucocytaire;
- Activation généralisée de l’inflammation dans les plaques instables;
- Hypercoagulabilité : augmentation du nombre et de l’adhésivité des plaquettes, élévation du taux de fibrinogène, de facteur VIII et de von Willebrand, chute de la fibrinolyse.
- Augmentation de la demande en O2 (mVO2).
- Stimulation sympathique : hypertension artérielle, tachycardie et augmentation de la contractilité;
- Douleur, stress, hypothermie (les frissons augmentent la VO2 de 400%);
- Dans les coronaires : vasoconstriction épicardique, sécrétion locale d’endothéline, augmentation des forces de cisaillement sur les plaques instable.
- Baisse de l’apport d’O2 (DO2).
- Hypotension et hypovolémie;
- Anémie aiguë;
- Diminution des échanges gazeux (atélectasie, hypoventilation);
- Augmentation de la viscosité (déshydratation, hypovolémie).
L’infarctus postopératoire est silencieux dans la majorité des cas [4,17] : l'angor n'est présent que chez 14% des patients, et des symptômes cliniques n'apparaissent que dans 53% des cas [3,23]. Sa mortalité de 10-20% est plus élevée que celle de l'infarctus qui survient en dehors d'un contexte chirurgical (5%). Après un acte de chirurgie générale, on rencontre les deux types d’infarctus mentionnés précédemment ; ils surviennent préférentiellement pendant les premières 24 à 96 heures.
- Infarctus sur sténose serrée et déséquilibre DO2/VO2 (infarctus de type 2): 60-75% des accidents coronariens sont précédés de longs épisodes de tachycardie, d'hypotension et de sous-décalage du segment ST (non-STEMI) [11,14,17,18]. La durée de ce sous-décalage est directement associée à la valeur du pic de troponine enregistré ultérieurement [30]. L’ascension des troponines est tardive, et l’accident survient en général au 3ème ou 4ème jour [19,21]. Le β-blocage est une prévention possible; la prise en charge est initialement médicale, suivie secondairement de tests d'effort et d'une revascularisation si indiquée.
- Infarctus sur rupture de plaque instable et thrombose (infarctus de type 1): 22-40% des infarctus apparaîssent sur des plaques thrombosées, en-dehors des sténoses les plus serrées à la coronarographie [10,14,29]. Ce type d’infarctus survient plus tôt, en général dans les 36 premières heures, mais il peut apparaître n’importe quand dans les dix jours qui suivent l’intervention [21]. Il n’est pas précédé de modifications du segment ST et se caractérise par une surélévation ST (STEMI) ; l’élévation des troponines est brusque et précoce. La seule prévention efficace est les antiplaquettaires (aspirine, clopidogrel, prasugrel, ticagrelor) et les statines [6]. Le traitement est une revascularisation d’urgence (angioplastie et stent).
En outre, 10% des syndromes coronariens aigus périopératoires sont liés à une cardiomyopathie de stress et ne présentent pas de lésion coronarienne [14]. Bien que la morphologie de leurs plaques soit semblable, les infarctus périopératoires présentent moins souvent un thrombus intracoronarien que les infarctus rencontrés en cardiologie (13% versus 67% des cas) [31]. Ceci traduit l'implication plus fréquente d'une altération du rapport DO2/VO2 dans la genèse des premiers que dans celle des seconds, comme le prouve le fait qu'une hypotension peropératoire (baisse de la PA de ≥ 40% par rapport à la valeur pré-induction pendant ≥ 30 minutes) double le risque de lésion myocardique définie par le taux de troponine postopératoire [34]. En effet, l'hypotension et la tachycardie sont directement associées à l'ischémie, à l'infarctus et à la mortalité cardiaque (OR 1.41-1.81) [1]. La mortalité de l'infarctus postopératoire (9% à 1 mois et 14-25% à 1 an, moyenne 10-15%) est plus élevée que celle de l'infarctus qui survient en dehors d'un contexte chirurgical (5%) [8,14]. Elle est également plus importante en cas de STEMI (31%) que de N-STEMI (8.5%), lorsque la situation requiert une revascularisation d'urgence [29]. Dans les deux catégories, les malades de chirurgie vasculaire ont la plus forte morbi-mortalité.
Une étude déjà ancienne de l'évolution postopératoire des taux de troponine I (cTnI) après chirurgie de l'aorte abdominale montre que le 14% des patients présente une élévation de la cTnI [21]. Chez 9%, cette élévation est inférieure au seuil fixé à 1.5 ng/L; il s'agit de lésion myocardique sans infarcissement (mortalité 7%). Chez 5%, le seuil de 1.5 ng/L est franchi, traduisant la présence d'un infarctus. Dans ce dernier cas, les malades se répartissent en deux catégories selon la période à laquelle apparaît le pic de cTnI (Figure 5.147):
- Pic à 37 heures chez 2% ; mortalité 24% ;
- Pic à 74 heures chez 3% ; mortalité 21%.
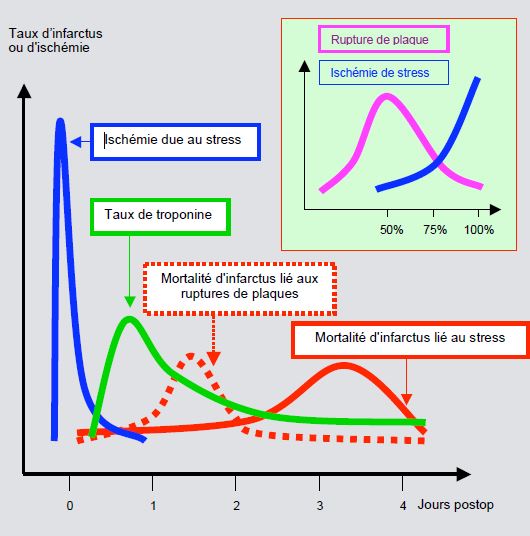
Figure 5.147 : Représentation schématique de l'incidence d'ischémie, du taux de troponine, et de la mortalité de l'infarctus postopératoire précoce. On distingue deux types d'infarctus: infarctus non-Q lié à l'ischémie survenue sur une sténose coronarienne serrée (trait plein), et infarctus avec onde Q du à une rupture de plaque instable sur une sténose non significative (traitillé). Le premier culmine entre vers le 3ème jour après l'intervention, alors que le deuxième est plus précoce [21]. En cartouche, l'incidence des deux types d'infarctus selon le degré de sténose coronarienne à l'angiographie: l'infarctus lié à une rupture de plaque est le plus fréquent dans les sténoses non significatives, alors que l'infarctus lié à l'ischémie est d'autant plus courant que la sténose est plus serrée [16].
Le premier pic, très soudain, traduit probablement des infarctus liés à des ruptures de plaques instables. Le second pic survient après une période d'élévation constante de la troponine I traduisant une ischémie persistante, de même niveau que celle des lésions cellulaires sans infarctus. Dans ce cas, l’infarctus est probablement secondaire à une ischémie sur déséquilibre DO2/VO2. Le contrôle de la fréquence cardiaque est un élément capital dans la prévention de cet accident, d'où l'efficacité du β-blocage prophylactique.
La dichotomie en deux types séparés d’infarctus est une simplification méthodologique pratique, mais probablement trop grossière. L’infarctus postopératoire est la manifestation ultime d’une longue cascade d’évènements multiples et interdépendants, qui interagissent entre eux de manière dynamique et imprédictible (Figure 5.148). Le nombre et la variété des mécanismes en jeu expliquent l’aspect aléatoire du phénomène et le peu d’impact de la revascularisation préopératoire sur le devenir des patients en chirurgie non-cardiaque. Ces données justifient la tendance de préférer une cardioprotection pharmacologique maximale (β-bloqueurs, antiplaquettaires, statines, préconditionnement, anesthésie combinée) et le strict contrôle hémodynamique peropératoire (fréquence ≤ 65 batt/min, PAM > 80 mmHg) à une série d’investigations préopératoires.
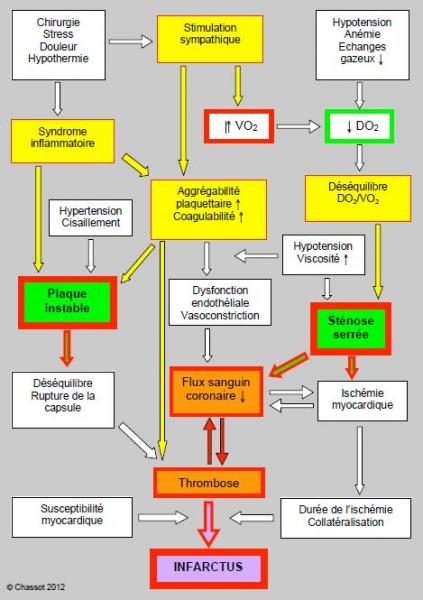
Figure 5.148 : Représentation schématique des mécanismes liés à l’infarctus postopératoire au niveau de la circulation coronarienne. La dichotomie entre plaque instable et sténose serrée est noyée au milieu d’une série d’éléments interdépendants et d’importance variable selon les situations, d’où l’imprédictibilité fondamentale de l'infarctus postopératoire.
Toutefois, l'infarctus n'est pas la seule menace après une intervention de chirurgie générale. Définie par les troponines à haute sensibilité (TnT/I-hs), une ischémie myocardique postopératoire est présente chez 8-20% des patients à risque intermédiaire et élevé, bien que 58% d’entre eux ne remplissent pas les critères d’un infarctus et que 84% soient asymptomatiques [5,8,34]. Ils souffrent de ce qu’il est convenu d’appeler MINS (Myocardial Injury after Noncardiac Surgery) [5]. Cette souffrance myocardique sans traduction clinique ni électrocardiographique correspond toutefois à une pathologie bien réelle, puisqu'elle est associée à une péjoration significative du pronostic et à une mortalité 3 fois plus élevée (OR 2.9) [28]. Cette mortalité est proportionnelle au taux de troponine. Ainsi, une élévation de 0.02 ng/L, 0.03-0.25 ng/L et de ≥ 0.3 ng/L est associée à une élévation de la mortalité postopératoire de 2.41, 5.0 et 10.5 fois respectivement [35]. Toutefois, l’élévation du taux de troponine postopératoire à des valeurs inférieures à celles admises pour le diagnostic non-équivoque d’infarctus est un marqueur de risque pour les complications cardiovasculaires et générales (embolie pulmonaire, insuffisance respiratoire, AVC, sepsis) plus que pour l’infarctus per se [34]. La question est de savoir si la mise en évidence de MINS réclame une sanction thérapeutique, bien que le taux de troponine soit faible et l’ECG sans altération. Une étude portant sur 667 patients de chirurgie vasculaire a montré que le traitement correspondant à celui d’une ischémie myocardique stable asymptomatique (antiplaquettaires, anticoagulant, statine, béta-bloqueur, inhibiteur de l’enzyme de conversion et, à long terme, modifications du style de vie) est bénéfique: le risque de complication est nettement diminué (HR 0.63) chez les patients traités activement alors qu'il est augmenté chez ceux qui ne l'ont pas été (HR 2.8) [13].
| Infarctus postopératoire en chirurgie non-cardiaque |
|
En chirurgie non-cardiaque, le taux d'infarctus postopératoire chez les coronariens stables varie de 1-6% selon le type de chirurgie (mortalité moyenne: 7-20%); en cas de syndrome coronarien aigu, il varie de 8% à 31% (mortalité moyenne: 10-20%). Les épisodes ischémiques postopératoires, non peropératoires, sont liés à l'incidence d'infarctus. L'infarctus postopératoire est en général silencieux. Ses pics d'incidence sont à 24-36 heures (infarctus sur plaque instable) et à 72 heures (infarctus sur déséquilibre DO2/VO2, plus fréquent et en général précédé de longs épisodes de tachycardie).
L'infarctus de type 1 (STEMI, plaque instable) est moins frequent que l'infarctus de type 2 (N-STEMI, déséquilibre DO2/VO2) dans le périopératoire: proportion approximative de 1/3 – 2/3. Une élévation asymptomatique et isolée des troponines à haute sensibilité est présente dans environ 15% des cas après une chirurgie majeure (MINS, Myocardial Injury after Noncardiac Surgery); elle est liée à une augmentation de la mortalité proportionnelle à celle des troponines.
L'hypotension et la tachycardie sont directement associées aux lesions ischémiques. La meilleure protection contre l'infarctus périopératoire est une cardioprotection pharmacologique maximale (β-bloqueurs, antiplaquettaires, statines, préconditionnement, anesthésie combinée) et un strict contrôle hémodynamique peropératoire (fréquence ≤ 65 batt/min, PAM > 80 mmHg, maintien du transport d'O2).
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- ABBOTT TEF, PEARSE RM, ARCHBOLD A, et al. A prospective international multicentre cohort study of intraoperative heart rate and systolic blood pressure and myocardial injury after noncardiac surgery: results of the VISION study. Anesth Analg 2018; 126:1936-45
- ALPERT JS, THYGESEN K, ANTMAN JP. Myocardial infarction redefined – a consensus document of the Joint European Society of Cardiology / American College of Cardiology Committee for the redifinition of myocardial infarction. J Am Coll Cardiol 2000; 36:959-69
- ASHTON CM, PETERSEN NJ, WRAY NP, et al. The incidence of perioperative myocardial infarction in men undergoing noncardiac surgery. Ann Intern Med 1993; 118:504-10
- BADNER NH, KNILL RL, BROWN JE, et al. Myocardial infarction after noncardiac surgery. Anesthesiology 1998; 88:572-8
- BOTTO F, ALONSO-COELLO P, CHAN MT, et al. Myocardial injury after noncardiac surgery: a large international prospective cohort study establishing diagnostic criteria: characteristics, predictors, and 30-day outcomes. Anesthesiology 2014:120:564-78
- CANNESSON M, ATTOFF Y, ROSAMEL P, et al. Respiratory variations in pulse oxymetry plethysmographic waveform amplitude to predict fluid responsiveness in the operating room. Anesthesiology 2007; 106:1105-11
- CHAN MY, PRONOVOST PJ. Clinical utility of biomarkers in myocardial injury. Curr Opin Anesthesiol 2004; 17:49-55
- CHAPMAN AR, SHAH ASV, LEE KK, et al. Long-term outcomes in patients with type 2 myocardial infarction and myocardial injury. Circulation 2018; 137:1236-45
- CHENG D, VEGAS A. Anesthesia for the surgical management of ischemic heart disease. In: THYS DM, et al editors. Textbook of Cardiothoracic Anesthesiology. New York, McGraw-Hull Co, 2001, pp 530-88
- DAWOOD MM, GUPTA DK, SOUTHERN J, et al. Pathology of fatal perioperative myocardial infarction: implications regarding physiopathology and prevention. Int J Cardiol 1996; 57:35-44
- DUVALL WI, SEALOVE B, PUNGOTI C, et al. Angiographic investigation of the pathophysiology of perioperative myocardial infarction. Catheter Cardiovasc Interv 2012; 80:768-76
- FELLAHI JL, GUEX X, RICHOMME X, et al. Short-and long-term prognostic value of ppostoperative cardiac troponin I concentration in patients undergoing coronary artery bypass grafting. Anesthesiology 2003; 99:270-4
- FOUCRIER A, RODSETH R, AISSAOUI M, et al. The long-term impact of early cardiovascular therapy intensification for postoperative troponin elevation after major vascular surgery. Anesth Analg 2014; 119:1053-63
- HELWANI MA, AMIN A, LAVIGNE P, et al. Etiology of acute coronary syndrome after noncardiac surgery. Anesthesiology 2018; 128:1084-91
- JAIN U, LAFLAMME CJA, AGGARWAL A, et al. Electrocardiographic and hemodynamic changes and their association with myocardial infarction during coronary artery bypass surgery. Anesthesiology 1997; 86:576-91
- LANDESBERG G. The pathophysiology of perioperative myocardial infarction: Facts and perspectives. J Cardiothorac Vasc Anesth 2003; 17:90-100
- LANDESBERG G, LURIA MH, COTEV S. et al. Importance of long-duration postoperative ST-segment depression in cardiac morbidity after vascular surgery. Lancet 1993; 341:715-9
- LANDESBERG G, MOSSERI M, ZAHGER D, et al. Myocardial infarction following vascular surgery: The role of prolonged, stress induced, ST-depression type ischemia. J Am Coll Cardiol 2001; 37:1839-45
- LANDESBERG G, SHATZ V, AKOPNIK I, et al. Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term survival after major vascular surgery. J Am Coll Cardiol 2003; 42:1547-54
- LEE TH, MARCANTONIO ER, MANGIONE CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LE MANACH Y, PERREL A, CORIAT P, et al. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102: 885-91
- LEUNG JM, O'KELLY B, BROWNER WS, et al. Prognostic importance of postbypass regional wall motion abnormalities in patients undergoing CABG surgery. Anesthesiology 1989; 71:16-23
- MANGANO DT, BROWNER WS, HOLLENBERG M, et al. Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery. The study of Perioperative Ischemia Research Group. N Engl J Med 1990; 323:1781-8
- MOISES VA, MESQUITA CB, CAMPOS O, et al. Importance of intraoperative transesophageal echocardiography during coronary artery surgery without cardiopulmonary bypass. J Am Soc Echocardiogr 1998; 11:1139-44
- NAGHAVI M, LIBBY P, FALK E, et al. From vulnerable plaque to vulnerable patient. A call for new definitions and risk assessment strategies. Part I. Circulation 2003; 108:1664-72
- NALYSNYK L, FAHRBACH K, REYNOLDS MW, ZHAO SZ, ROSS S. Adverse events in coronary artery bypass graft (CABG) trials: a systematic review and analysis. Heart 2003; 89:767-72
- NASHEF SAM, ROQUES F, MICHEL P, et al. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 1999; 16:9-13
- OBERWEIS BS, SMILOWITZ NR, NUKALA S, et al. Relation of perioperative elevation of troponin to long-term mortality after orthopedic surgery. Am J Cardiol 2015; 115:1643-8
- PARASHAR A, AGARWAL S, KRISHNASWAMY A, et al. Percutaneous intervention for myocardial infarction after noncardiac surgery: patient characteristics and outcomes. J Am Coll Cardiol 2016; 68:329-38
- RAPP HJ, RABETHGE S, LUIZ T, et al. Perioperative ST-segment depression and troponin T release. Identification of patients with highest risk for myocardial damage. Acta Anaesthesiol Scand 1999; 43:124-9
- SHETH T, NATARAJAN MK, HSIEH V, et al. Incidence of thrombosis in perioperative and non-operative myocardial infarction. Br J Anaesth 2018; 120:725-33
- STS – Society of Thoracic Surgeons National Cardiac Surgery Database, 2017. https://www.sts.org/site/defaut/files/documents/ ACSD_ExecutiveSummary2017Harvest4_RevisedReport.pdf
- THYGESEN K, ALPERT JS, JAFFE AS, et al. Fourth universal definition of myocardial infarction (2018). J Am Coll Cardiol 2018; 72:2231-64
- VAN WAES JA, VAN KLEI WA, WIJEYSUNDERA DN, et al. Association between intraoperative hypotension and myocardial injury after vascular surgery. Anesthesiology 2016; 124:35-44
- VISION – The Vascular Events in Noncardiac Surgery Patients Cohort Evaluation study investigators. Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307:2295-304
- WAHL GW, FEINS RH, AQLFIERES G, et al. Reinfusion of shed blood after coronary operation causes elevation of cardiac enzyme levels. Ann Thorac Surg 1992; 53:625-31
- WANG TK, STEWART RA, RAMANATHAN T, et al. Diagnosis of MI after CABG with high-sensitivity troponin T and new ECG or echocardiogram changes: relationship with mortality and validation of the Universal Definition of MI. Eur Heart J Acute Cardiovasc Care 2013; 2:323-33
- WESTERMANN D, NEUMANN JT, SÖRENSEN NA, et al. High-sensitivity assays for troponin in patients with cardiac disease. Nat Rev Cardiol 2017; 14:472-83
