Images ETO avant plastie
L'examen ETO avant une plastie aortique doit déterminer le mécanisme de l'IA, l'état des cuspides, la direction du jet de l'insuffisance et la taille de tous les éléments de la racine aortique en fonction de leurs valeurs normales [4,8]. Il est essentiel de bien détailler certains points, comme la redondance ou la restriction des cuspides, leur épaisseur, leur pliabilité et leur mobilité, la configuration des commissures et leurs positions, la morphologie de la racine aortique. Pour le chirurgien, ces données sont plus importantes que la quantification de l'IA.
L'examen ETO avant une plastie aortique doit déterminer le mécanisme de l'IA, l'état des cuspides, la direction du jet de l'insuffisance et la taille de tous les éléments de la racine aortique en fonction de leurs valeurs normales [4,8]. Il est essentiel de bien détailler certains points, comme la redondance ou la restriction des cuspides, leur épaisseur, leur pliabilité et leur mobilité, la configuration des commissures et leurs positions, la morphologie de la racine aortique. Pour le chirurgien, ces données sont plus importantes que la quantification de l'IA.
- Diamètres normaux de l'ensemble de la racine aortique en vue long-axe 120-140° ou en reconstruction 3D.
- Anneau aortique: 2.2-2.6 cm
- Sinus de Valsalva: 3.0-3.4 cm
- Jonction sino-tubulaire: 2.6-2.9 cm
- Aorte ascendante proximale: 2.7-3.0 cm
- Hauteur de coaptation (diastole): 5-8 mm
- Hauteur des cuspides (systole): 1.2-1.4 cm
- Distance anneau-coronaires: 1.5 cm
Les quatre vues ETO de la valve aortique sont mises à contribution pour l'évaluation préopératoire de la faisabilité d'une plaste [12].
- Vue mi-oesophagienne court-axe 40°: bicuspidie vs tricupsidie, symétrie des cuspides, qualité du tissu; origine du/des jet(s) de régurgitation. Mesure: planimétrie de l'orifice de régurgitation central.
- Vue mi-oesophagienne long-axe 120°: prolapsus, ballonisation, mobilité des cuspides; direction du jet (central vs excentrique). Mesures: diamètres, hauteur et position de la coaptation, vena contracta, PISA.
- Vues transgastriques profonde 0° et long-axe 120°: prolapsus, ballonisation; direction du jet (central vs excentrique) et étendue dans le VG. Mesure du flux (CCVG, valve aortique) pour l'équation de continuité, temps de demi-pression de l'IA.
Les facteurs prédisposant à un échec de plastie sont tous ceux qui diminuent la hauteur de coaptation et abaissent le point de coaptation vers la CCVG [12]. Certains éléments sont à vérifier en fonction du type de lésion (Figure 26.76) [15].
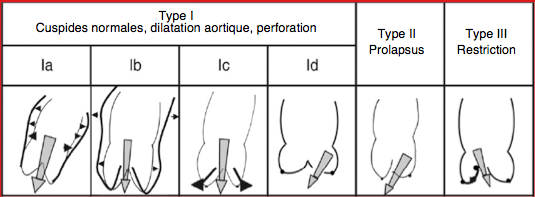
Figure 26.76: Les différents types anatomo-pathologiques d'insuffisance aortique classés selon le degré de mobilité des cuspides [D'après: El Khoury G, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21].

Figure 26.76: Les différents types anatomo-pathologiques d'insuffisance aortique classés selon le degré de mobilité des cuspides [D'après: El Khoury G, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21].
- Type Ia: vérification en télédiastole de la taille de l'anneau aortique et des sinus de Valsalva qui ne doivent pas être dilatés. Le jet d'IA doit être central.
- Type Ib: la jonction sino-tubulaire est effacée et dilatée, dilatation des sinus de Valsalva. L'IA est due à un déplacemnt vers l'extérieur des commissures; l'orifice de régurgitation triangulaire est bien visible en court-axe 40°; l'IA est centrale.
- Type Ic: la dilatation porte sur l'anneau aortique (diamètre > 26 mm); le jet d'IA est central.
- Type Id: le jet couleur est originaire du corps d'une cuspide (perforation, fénestration); sa direction est variable. En court-axe 40°, la commissure est étanche.
- Type II: une cuspide bascule dans la CCVG en diastole et donne un jet d'IA excentrique dirigé vers le côté opposé. Le jet d'un prolapsus de la cuspide coronaire droite est dirigé postérieurement, celui d'un prolapsus de la cuspide coronaire gauche (CG) ou non-coronaire (NC) un jet dirigé antérieurement. La différenciation entre CG et NC n'est pas possible en vue long-axe 120-140° mais seulement en vue court-axe 40° ou en 3D. Le prolapsus peut constituer une simple bascule de l'extrémité distale d'une cuspide ou être complètement éversé dans la CCVG (flail leaflet) (Vidéo); dans ce deuxième cas, la coupe en court-axe de la CCVG montre une structure circulaire qui est la section de la cupule prolabante. Une ballonisation entrainant le nadir d'une cuspide en-dessous du plan de l'anneau traduit un défaut de structure de la valve; c'est un facteur de risque en cas de plastie [12].
Vidéo: vue long-axe 120° d'une déchirure avec prolapsus de la cuspide coronarienne droite.
- Type III: les feuillets sont fibrosés, rétractés, partiellement calcifiés et les commissures fusionnées en court-axe 40°. En systole, on voit en général une déformation en dôme comme dans la bicuspidie (voir Figure 26.122). Le jet de l'IA est plus ou moins central selon le degré de symétrie des lésions.
- Opération de Ross (Figure 26.93): outre l'étude de la valve aortique, l’examen pré-CEC doit mesurer l’épaisseur du septum interventriculaire en dessous de la valve pulmonaire pour indiquer au chirurgien la profondeur à laquelle il peut inciser le septum sans risquer de créer une communication avec la chambre de chasse droite, et obtenir une description fiable de la valve pulmonaire: tricuspidie ou bicuspidie, diamètre, mobilité, hauteur de coaptation. La valve pulmonaire est fine et très antérieure; son image est peu contrastée à l'ETO. Son plan est à peu près orthogonal par rapport à celui de la valve aortique, au même niveau que celui de cette dernière (léger pivotement horaire de la sonde ETO): court-axe à 50-85°, long-axe à 140-160°.
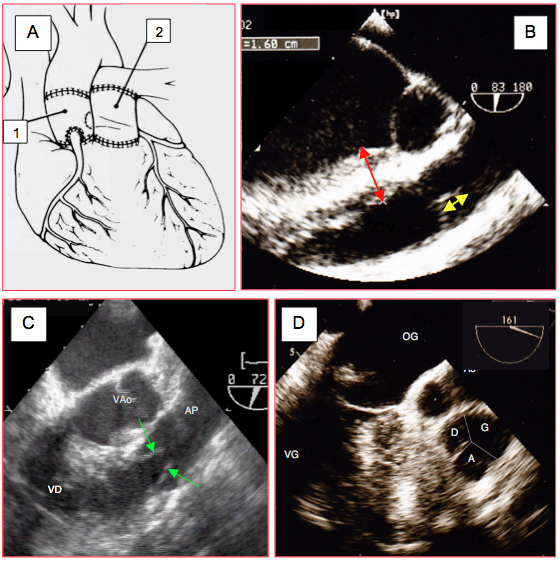
Figure 26.93 : Opération de Ross. Après excision de la valve aortique, la valve pulmonaire du patient est prélevée avec un manchon de chambre de chasse droite ; elle est transplantée en position aortique (autogreffe) et les coronaires y sont réimplantées. La valve pulmonaire est remplacée par une homogreffe ou une hétérogreffe. A : illustration de l’opération. 1 : autogreffe et néovalve aortique. 2 : homogreffe pulmonaire. B : hauteur de coaptation satisfaisante de la valve pulmonaire (flèche jaune). Le prélèvement du manchon de chambre de chasse droite implique de disséquer longitudinalement le septum interventriculaire ; l’examen pré-CEC doit en mesurer l’épaisseur en dessous de la valve pulmonaire (flèche rouge, 1.6 cm). C: examen de la mobilité des cuspides pulmonaires en long axe (70°). D: examen de la valve pulmonaire en court-axe (160°); en l'occurrence, la valve est tricuspide (l'apparente inégalité des cuspides est un effet de coupe).
IM simultanée
En présence d'une insuffisance mitrale (IM) significative au cours d'une intervention pour corriger une insuffisance aortique, l'anesthésiste-échocardiographeur doit répondre à deux questions.
- L'IM est-elle primaire ou secondaire ?
- L'IM est-elle suffisamment importante pour justifier une intervention simultanée (plastie ou remplacement) ?
Une IM modérée ou sévère se rencontre dans 35% des cas de chirurgie de la valve aortique [6,7]. Une IM majeure due à une pathologie claire de la valve et de ses feuillets (IM primaire) justifie une action chirurgicale selon les indications reconnues pour la plastie ou le remplacement mitral (voir Chapitre 11, Insuffisance mitrale, Indications opératoires) [2,9]. La situation est plus délicate en cas d'IM secondaire (structure mitrale normale), qui est présente dans 23% des cas [11]. Celle-ci ne tend à s'améliorer en postopératoire que si le volume télédiastolique du VG est significativement réduit par la chirurgie aortique, mais sa persistence est associée à une augmentation de mortalité à long terme [6]. Si l'IM est modérée-à-sévère ou sévère et si une plastie est réalisable aisément, une opération simultanée est raisonnable; l'option d'une intervention ultérieure par cathétérisme percutané (MitraClip™) est une alternative dans les cas à risque [7].
Plastie de la valve aortique
La plastie est préférable à une prothèse lorsqu’elle est faisable, car l’anticoagulation n’est pas nécessaire et le taux de thrombo-embolie ou d’endocardite est très bas. La mortalité opératoire est d’environ 1% et le taux de succès à 10 ans de 87% ; le taux d’échec immédiat est de 14% [1]. Le type de plastie varie selon la pathologie valvulaire [2,10,15].
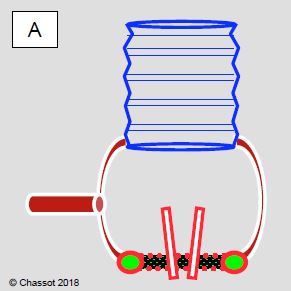
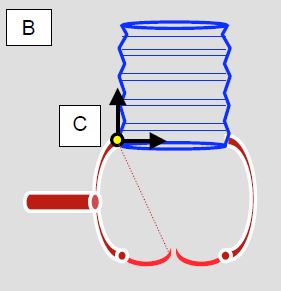
Figure 11.143 : Schéma des interventions sur l’aorte ascendante lorsque l’anneau valvulaire et les sinus de Valsalva sont normaux. A : en cas de pathologie de l’aorte et de la valve aortique, on peut remplacer séparément la partie tubulaire de l’aorte par un tube en Dacron™ et la valve par une prothèse (mécanique ou biologique) ; les coronaires restent en place. B : si la valve aortique ne fuit pas ou ne présente qu’une insuffisance mineure-à-modérée, on ne remplace que la partie tubulaire de l’aorte. C : en adaptant le diamètre de la prothèse tubulaire de manière à ce que la jonction sino-tubulaire dilatée ait le même diamètre que l’anneau aortique, on peut resuspendre les cuspides et les amener à une coaptation normale sans changer la valve.
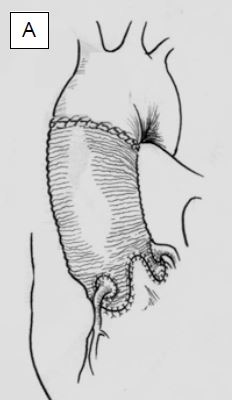
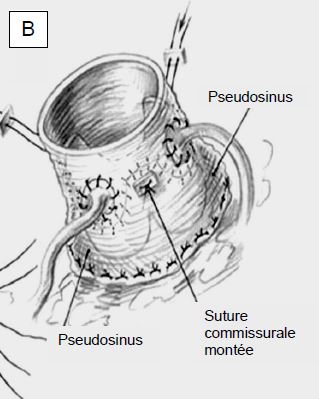
Figure 11.144 : Plastie de la valve aortique lors de dilatation de la racine aortique. A : resuspension des cuspides aortiques par le découpage en trèfle à trois feuilles de la prothèse aortique ascendante et réimplantation coronaire (opération de Yacoub); le diamètre de la racine aortique doit mesurer < 3 cm. La persistance de tissu de la racine aortique peut conduire à une dilatation récidivante et à un retour de l'IA. B : resuspension et inclusion de la valve aortique et de l’anneau dans la prothèse tubulaire, réimplantation coronaire (opération de Tyrone David).
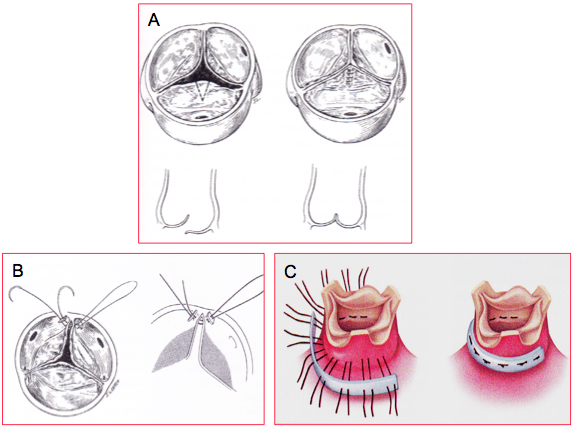
Figure 11.60 : Plastie aortique. A : résection triangulaire d’un prolapsus uni-cuspidien et suture de la cuspide. B : resuspension d’une commissure. C : annuloplastie aortique [Braunwald’s Heart Disease, 7th ed, Philadelphia:Elsevier 2005, 1601].
Contrôle ETO après plastie
Quelques critères simples permettent de se rendre compte très rapidement si la plastie est réussie (Vidéos et Figure 26.94) [12,15].
Vidéo: status après plastie de la valve aortique; bien que la valve paraisse étanche, il existe une certaine ballonisation de la cuspide droite.
Vidéo: status après plastie de la valve aortique; petite IA résiduelle.
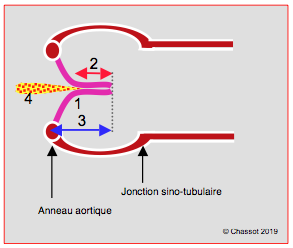
Figure 26.94 : Mesures post-CEC après plastie aortique. Schéma des conditions d’une plastie réussie ; pas de prolapsus, coaptation en aval du plan de l’anneau aortique (1), hauteur de coaptation > 4 mm (2, flèche rouge), hauteur des cuspides > 8 mm, soit jusqu'à mi-hauteur des sinus de Valsalva (3, flèche bleue), IA résiduelle < mineure (4).
Dès le déclampage de l'aorte et la reprise d'un rythme cardiaque, l'examen de la valve réparée doit rechercher tous les signes avant-coureurs d'un éventuel échec de la plastie (Figure 26.95) [5,12,15].
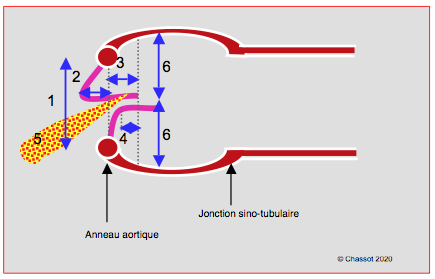
Figure 26.95 : Mesures immédiates post-CEC importantes pour la prédiction d'une persistence ou d'une récidive de l'IA (représentation schématique). 1: diamètre de l'anneau aortique. 2: distance entre le plan de l'anneau et le nadir de la cuspide prolabante. 3: distance entre le sommet de la coaptation et l'anneau. 4: hauteur de coaptation. 5: degré d'IA résiduelle et angle entre l'axe de l'IA et celui de la CCVG. 6: distances entre le sommet des cuspides et les parois des sinus de Valsalva (doivent être égales pour que la coaptation soit centrale).
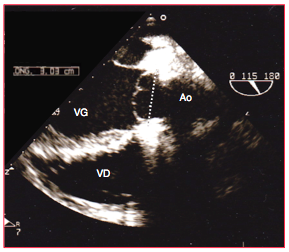
Figure 26.96 : Vue long axe de la néo-valve aortique après opération de Ross. Les cuspides sont nettement en-dessous du plan de l'anneau aortique et leur hauteur de coaptation est quasi-nulle. Même sans fuite aortique significative en sortant de CEC, cette configuration est vouée à l'échec car elle se soldera par une fuite majeure dans les jours ou les mois ultérieurs.
Certains points précis sont à rechercher en fonction du type d'intervention selon la catégorie d'IA (voir Chapitre 11, Insufisance aortique, CEC et post-CEC) [15].
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
| Messages pour le chirurgien en cas d’insuffisance aortique |
| Description : nombre de cuspides (bicuspidie), position, prolapsus, bascule, déchirures, orifice de régurgitation central (dilatation de l’anneau) ou asymétrique (lésion des cuspides), présence d’une IM (mécanisme), jet-lesion sur le feuillet antérieur de la valve mitrale, dilatation et remodelage du VG. Le mécanisme de l'IA est plus important à élucider que la quantification de l'IA. Dimensions : planimétrie de l’orifice de régurgitation, diamètres (mesurés en long axe 120°) de la CCVG, de l’anneau aortique, des sinus de Valsalva, de la jonction sino-tubulaire, de l’aorte ascendante, distance anneau aortique – jonction sinotubulaire, taille du VG Flux Doppler : jet central ou excentrique, étendue du jet d’IA, présence d’une sténose associée Toute IA, même minime et asymptomatique, peut provoquer une dilatation aiguë du VG lorsque la contraction ventriculaire cesse en début de CEC (cardioplégie) Fonction et dimension du VD, état de la valve tricuspidienne (indication à une plastie si diamètre de l'anneau > 4 cm) |
Plastie de la valve aortique
La plastie est préférable à une prothèse lorsqu’elle est faisable, car l’anticoagulation n’est pas nécessaire et le taux de thrombo-embolie ou d’endocardite est très bas. La mortalité opératoire est d’environ 1% et le taux de succès à 10 ans de 87% ; le taux d’échec immédiat est de 14% [1]. Le type de plastie varie selon la pathologie valvulaire [2,10,15].
- IA type Ia (dilatation de la jonction sino-tubulaire): remodelage de la jonction sino-tubulaire par une prothèse aortique tubulaire, resuspension des commissures, éventuellement annuloplastie sous-commissurale (voir Figure 11.143).
- IA type Ib (dilatation des sinus de Valsalva): remodelage de la racine aortique par l'anastomose proximale d'une prothèse en Dacron (voir opérations de Tirone David et de Yacoub) (voir Figure 11.144).
- IA type Ic (dilatation de l'anneau aortique): annuloplastie interne ou externe, réimplantation de la valve dans un tube en Dacron.
- IA type Id (perforation): occlusion par un patch péricardique.
- IA type II (prolapsus): plicature de la zone prolabante autour du nodule d'Arantius, résection triangulaire, annuloplastie, resuspension, plicature de la base des triangles fibreux inter-cuspidiens, opération de Ross (voir Figure 11.60).
- Bicuspidie: tricuspidisation, commissuroplastie.
- IA type III: résection, abrasion, décalcification, extension par patch; les résultats étant peu satisfaisants, on procède le plus souvent au remplacement par une prothèse.
- Opération de Ross: transposition de la valve pulmonaire en position aortique (avec réimplantation des coronaires) et mise en place d’une homogreffe ou hétérogreffe en position pulmonaire. L’intérêt de cette stratégie est d’avoir une valve native en position aortique. Lorsque l’homogreffe/hétérogreffe dégénère, la voie pulmonaire peut accomoder une insuffisance, même importante ; si l’homogreffe souffre de sténose, on peut la dilater par cathétérisme sans risque d’embolie systémique. Les mêmes lésions d’usure en position aortique imposeraient la mise en place d’une prothèse. Les contre-indications à l’opération sont une dilatation de la racine aortique, une valve pulmonaire bicuspide, une insuffisance pulmonaire et une discordance de > 3 mm entre le diamètre de l’anneau aortique et celui de la valve pulmonaire.


Figure 11.143 : Schéma des interventions sur l’aorte ascendante lorsque l’anneau valvulaire et les sinus de Valsalva sont normaux. A : en cas de pathologie de l’aorte et de la valve aortique, on peut remplacer séparément la partie tubulaire de l’aorte par un tube en Dacron™ et la valve par une prothèse (mécanique ou biologique) ; les coronaires restent en place. B : si la valve aortique ne fuit pas ou ne présente qu’une insuffisance mineure-à-modérée, on ne remplace que la partie tubulaire de l’aorte. C : en adaptant le diamètre de la prothèse tubulaire de manière à ce que la jonction sino-tubulaire dilatée ait le même diamètre que l’anneau aortique, on peut resuspendre les cuspides et les amener à une coaptation normale sans changer la valve.


Figure 11.144 : Plastie de la valve aortique lors de dilatation de la racine aortique. A : resuspension des cuspides aortiques par le découpage en trèfle à trois feuilles de la prothèse aortique ascendante et réimplantation coronaire (opération de Yacoub); le diamètre de la racine aortique doit mesurer < 3 cm. La persistance de tissu de la racine aortique peut conduire à une dilatation récidivante et à un retour de l'IA. B : resuspension et inclusion de la valve aortique et de l’anneau dans la prothèse tubulaire, réimplantation coronaire (opération de Tyrone David).

Figure 11.60 : Plastie aortique. A : résection triangulaire d’un prolapsus uni-cuspidien et suture de la cuspide. B : resuspension d’une commissure. C : annuloplastie aortique [Braunwald’s Heart Disease, 7th ed, Philadelphia:Elsevier 2005, 1601].
| Chirurgie de l'insuffisance aortique |
| Plastie de l'insuffisance aortique: - IA type I : plastie par resuspension (tube droit, opérations de Yacoub ou de Tirone David) - IA type II : plastie par résection, plicature et/ou resuspension des cuspides - IA type III : résection, décalcification ou extension par patch, mais en général remplacement valvulaire par une prothèse |
Contrôle ETO après plastie
Quelques critères simples permettent de se rendre compte très rapidement si la plastie est réussie (Vidéos et Figure 26.94) [12,15].
Vidéo: status après plastie de la valve aortique; bien que la valve paraisse étanche, il existe une certaine ballonisation de la cuspide droite.
Vidéo: status après plastie de la valve aortique; petite IA résiduelle.
- Absence de dilatation du VG au déclampage;
- Absence de prolapsus résiduel;
- Absence de ballonisation en-dessous du plan de l'anneau;
- Coaptation en aval (au-dessus) du plan de l’anneau aortique;
- Hauteur de coaptation > 5 mm;
- Hauteur des cuspides > 8 mm;
- IA résiduelle < mineure et centrale.

Figure 26.94 : Mesures post-CEC après plastie aortique. Schéma des conditions d’une plastie réussie ; pas de prolapsus, coaptation en aval du plan de l’anneau aortique (1), hauteur de coaptation > 4 mm (2, flèche rouge), hauteur des cuspides > 8 mm, soit jusqu'à mi-hauteur des sinus de Valsalva (3, flèche bleue), IA résiduelle < mineure (4).
Dès le déclampage de l'aorte et la reprise d'un rythme cardiaque, l'examen de la valve réparée doit rechercher tous les signes avant-coureurs d'un éventuel échec de la plastie (Figure 26.95) [5,12,15].
- Le niveau de base de la coaptation des cuspides doit être situé au-dessus (en aval) du plan de l'anneau; une coaptation située au niveau de l'anneau ou en-dessous dans la CCVG est directement lié à une récidive de l'IA. Même en l'absence de fuite diastolique, la coaptation dans la CCVG est un critère de reprise immédiate (Figure 26.96).
- La hauteur de la coaptation doit être d'au moins 6-8 mm; l'extrémité des cuspides en systole doit se situer à mi-hauteur des sinus de Valsalva (distance avec l'anneau aortique d'au moins 10 mm). Une hauteur de coaptation < 4 mm et une distance entre l'anneau aortique et l'extrémité distale de la coaptation < 6 mm sont directement associées aux récidives d'IA.
- En systole, la longueur des cuspides doit être d'au moins 10 mm, mais ne pas atteindre le niveau des orifices coronariens (distance normale ostium – anneau: 1.5 cm).
- Doppler couleur: tout jet d'IA correspondant à une insuffisance plus que triviale ou mineure (degré > 1) signe un échec de la plastie. Une fuite excentrique est plus dangereuse pour la récidive qu'une fuite centrale.
- Gradient systolique transaortique < 10 mmHg; un gradient maximal et un gradient moyen supérieurs à 30 et 15 mmHg, respectivement, sont inacceptables. Un état de haut débit passager et une contre-pulsion intra-aortique peuvent surestimer significativement le gradient.
- Prédicteurs majeurs d'échec: IA résiduelle (OR 5.3), coaptation en-dessous du plan de l'anneau (OR 7.9), hauteur de coaptation < 4 mm (OR 9.1) [3,5].
- La différenciation entre IA mineure et IA modérée est cruciale, car elle signifie l'acceptation du résultat dans le premier cas mais le retour en pompe dans le second [13].
- Après opération de Ross, la néo-valve aortique doit être compétente (IA tolérée : degré ≤ mineure), coapter en aval du niveau de l’anneau (pas de prolapsus) sur une hauteur de > 4 mm, et avoir un gradient maximal < 20 mmHg ; si ces conditions ne sont pas remplies, un retour en pompe s’impose (Vidéos). Une lésion de la première artère septale lors du prélèvement du manchon de CCVD avec la valve pulmonaire peut occasionner une akinésie basale du septum interventriculaire. Les anti-hypertenseurs diminuent le stress sur la néo-valve aortique et un traitement anti-inflammatoire prolonge la survie de l’homogreffe pulmonaire [14].
Vidéo: vue court-axe de la néo-valve aortique après opération de Ross; la géométrie est symétrique et l'occlusion satisfaisante.
Vidéo: vue court-axe de la néo-valve aortique après opération de Ross avec Doppler couleur; le flux est laminaire en systole et ne présente pas de fuite en diastole.
- En cas de réimplantation des coronaires, le flux couleur visualise la perméabilité de la racine des deux troncs coronariens et l'examen de la contractilité segmentaires des ventricules attire l'attention sur des zones hypokinétiques ou akinétiques impliquant la réfection d'une l'anastomose ou un pontage aorto-coronarien.

Figure 26.95 : Mesures immédiates post-CEC importantes pour la prédiction d'une persistence ou d'une récidive de l'IA (représentation schématique). 1: diamètre de l'anneau aortique. 2: distance entre le plan de l'anneau et le nadir de la cuspide prolabante. 3: distance entre le sommet de la coaptation et l'anneau. 4: hauteur de coaptation. 5: degré d'IA résiduelle et angle entre l'axe de l'IA et celui de la CCVG. 6: distances entre le sommet des cuspides et les parois des sinus de Valsalva (doivent être égales pour que la coaptation soit centrale).

Figure 26.96 : Vue long axe de la néo-valve aortique après opération de Ross. Les cuspides sont nettement en-dessous du plan de l'anneau aortique et leur hauteur de coaptation est quasi-nulle. Même sans fuite aortique significative en sortant de CEC, cette configuration est vouée à l'échec car elle se soldera par une fuite majeure dans les jours ou les mois ultérieurs.
Certains points précis sont à rechercher en fonction du type d'intervention selon la catégorie d'IA (voir Chapitre 11, Insufisance aortique, CEC et post-CEC) [15].
- Type Ia: prothèse tubulaire rétablissant la taille normale de la jonction sino-tubulaire et resuspendant les commissures. Une IA résiduelle peut être due à un prolapsus non détecté avant l'opération ou à un sous-dimensionnement de la prothèse.
- Type Ib: remplacement de la racine aortique par une prothèse de Bentall ou remodelage/réimplantation préservant la valve (opérations de Yacoub et de Tirone David). A l'ETO, on peut suivre la prothèse jusqu'au niveau de l'anneau (paroi en double strie); les sinus de Valsalva apparaissent en général plus larges. L'examen de la cinétique segmentaire ventriculaire permet de s'assurer que les réimplantations coronariennes sont bien perméables; le Doppler couleur y montre un flux proximal systolo-diastolique.
- Type Ic: l'annuloplastie à la jonction ventriculo-aortique doit assurer une coaptation normale des feuillets.
- Type Id: le patch de fermeture rigidifie la cuspide et peut gêner la coaptation.
- Type II: l'opération consiste en plicature, résection triangulaire, resuspension, implantation de patch et souvent annuloplastie sous-commissurale. La cuspide concernée apparaît épaissie et moins mobile; les pledgets de la commissuroplastie se manifestent comme une structure dense avec un cône d'ombre. Les gradients permettent de vérifier que la commissurotomie n'est pas trop restrictive.
- Type III: ces lésions conduisent plus souvent à un remplacement par une prothèse et qu'à une plastie (commissurotomie, pelage des cuspides, décalcification, extension par du péricarde).
| Contrôle après plastie aortique |
| Critères de réussite d'une plastie en sortant de CEC: - Absence de prolapsus résiduel - IA résiduelle < mineure - Coaptation en aval (au-dessus) du plan de l’anneau aortique - Hauteur de coaptation > 5 mm - Hauteur des cuspides > 8 mm |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- AICHER D, FRIES R, RODIONYCHEVA S, et al. Aortic valve repair leads to a low incidence of valve-related comnplications. Eur J Cardiothorac Surg 2010; 37:127-32
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- KARI FA, SIEPE M, HAN-HINRICH S, et al. Repair of the regurgitant bicuspid and tricuspid aortic valve: background, principles, and outcomes. Circulation 2013; 128:854-63
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LE POLAIN DE WAROUX JB, POULEUR AC, ROBERT A, et al. Mechanisms of recurrent aortic regurgitation after aortic valve repair. Predictive value of transesophageal echocardiography. JACC Cardiovasc Imaging 2009; 2:931-9
- LIM JY, JUNG SH, KIM JB, et al. Management of concomitant mild to moderate functional mitral regurgitation during aortic valve surgery for severe aortic insufficiency. J Thorac Cardiovasc Surg 2014; 148:441-6
- MALHOTRA A, RAMAKRISHNA H, GUTSCHE JT, et al. Options for incidental mitral regurgitation found during aortic valve surgery for aortic regurgitation: an evidence-based clinical update for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2016; 30:555-60
- MUKHERJEE C, HEIN F, HOLZHEY D, et al. Is real-time 3D transesophageal echocardiography a feasible approach to detect coronary ostium during transapical aortic valve implantation? J Cardiothorac Vasc Anesth 2013; 27:654-9
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- PRODROMO J, D'ANCONNA G, AMADUCCI A, et al. Aortic valve repair fort aortic insufficiency: a review. J Cardiothorac Vasc Anesth 2012; 26:923-32
- REGEER MW, AL AMRI I, VERSTEEGH MI, et al. Mitral valve geometry changes in patients with aortic regurgitation. J Am Soc Echocardiogr 2015; 28:455-62
- RIDLEY CH, SOHMER B, VALLABHAJOSYULA P, et al. Aortic leaflet billowing as a risk factor for repair failure after aortic valve repair. J Cardiothorac Vasc Anesth 2017; 31:1001-6
- SZYMANSKI T, MASLOW A, MAHMOOD F, et al. Three-dimensional imaging of the repaired aortic valve. J Cardiothorac Vasc Anesth 2016; 30:1599-610
- TAKKENBERG JJM, KLIEVERIK LMA, SCHOOF PH, et al. The Ross procedure: a systematic review and meta-analysis. Circulation 2009; 119:222-8
- VAN DYCK MJ, WATREMEZ C, BOODHWANI M, et al. Transesophageal echocardiography evaluation during aortic valve repair surgery. Anesth Analg 2010; 111:59-70
