La zone d'éjection du ventricule gauche est l'objet de plusieurs malformations fréquemment rencontrées chez l'adulte, décrites dans les chapitres des valvulopathies (voir Chapitre 11, Sténose aortique) et de l’aorte thoracique (Chapitre 18 Aorte ascendante). La sténose congénitale du cône éjectionel gauche peut avoir 3 localisations différentes:
- Sous-aortique dans la chambre de chasse du VG;
- Valvulaire proprement dite;
- Supravalvulaire à la racine de l’aorte ascendante.
Obstruction de la chambre de chasse
La sténose sous-aortique peut être fixe ou dynamique. Dans le premier cas, il s'agit d'une membrane plus ou moins circulaire qui ceint la chambre de chasse du septum interventriculaire au feuillet antérieur de la valve mitrale, et occasionne l'équivalent d'une sténose aortique (Vidéo et Figure 15.48).
Vidéo: Vue long-axe de la chambre de chasse du VG avec la présence d'une membrane sous-aortique visible sous la forme d'un éperon fibreux au niveau du versant septal de la CCVG.
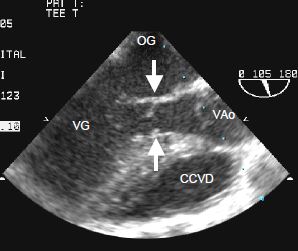
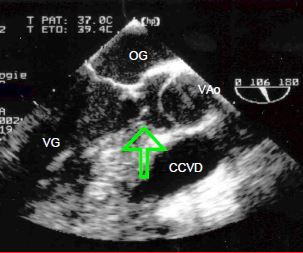
Figure 15.48 : Images long-axe d’une sténose sous-aortique. Les flèches indiquent la membrane insérée sur le septum et sur la valve mitrale (feuillet antérieur).
La valve, située distalement à la membrane, est hypoplasique et incompétente dans > 50% des cas, car la sténose réduit le flux dès la naissance et le jet post-sténotique traumatise les cuspides [13]. Ce phénomène oblige à intervenir tôt dans l’évolution de la maladie pour sauvegarder la valve aortique, soit dès que le gradient moyen est > 30 mmHg (gradient maximal > 50 mmHg) [9,11,13]. L’association avec la coarctation de l’aorte ou une CIV est fréquente. Une subobstruction de la CCVG est une complication classique de la correction d'un canal AV; elle est liée à la déformation en col-de-cygne de la chambre de chasse dans l'anatomie particulière de cette malformation (voir Canal AV) [2].
La sténose peut aussi être dynamique et se comporter comme une cardiomyopathie obstructive (CMO) (voir Chapitre 11 Sténose sous-aortique dynamique). Caractérisée par une vélocité > 2.5 m/s (norme: 1.0-1.5 m/s) et un gradient maximal > 25 mmHg dans la CCVG, elle est aggravée par la stimulation sympathique béta, par l'hypovolémie et par la baisse des résistances périphériques. La prise en charge implique un β–bloqueur, une hypervolémie et un α–stimulant. Le traitement chirurgical consiste en une résection de la membrane ou une myectomie élargie de la chambre de chasse; le risque opératoire est la création d'une CIV par résection excessive, ou un gradient persistant par résection insuffisante. L'ETO peropératoire est d'une grande importance pour diagnostiquer une CIV iatrogène ou un gradient résiduel excessif; dans 12-25% des cas, une révision chirurgicale immédiate est indiquée en fonction de cet examen [7,10].
Sténose supravalvuaire
Le rétrécissement se présente comme un diaphragme ou une déformation en sablier. Il est situé à la jonction sino-tubulaire ou au-delà des sinus de Valsalva. De ce fait, les coronaires sont en amont de la sténose et soumises au régime de l’hypertension systolique. Cette situation induit une dilatation de ces vaisseaux, accélère leur dégénérescence athéromateuse et force à intervenir tôt dans l’évolution de la maladie [11,13]. L’intervention consiste en une reconstruction de la racine aortique avec réimplantation des coronaires. Elle est indiquée si le gradient de pression moyen est ≥ 50 mmHg ou le patient symptomatique [9].
Bicuspidie aortique
La bicuspidie aortique est la malformation congénitale la plus fréquente de l'adulte, puisqu'on la rencontre chez 1-2% des patients [3]. Elle est fréquemment associée à la coarctation de l'aorte et plus rarement à la CIV périmembraneuse. Les anomalies de la racine aortique qui lui sont liées peuvent conduire à une dilatation aortique, à un anévrysme ou à une dissection [1]. La bicuspidie se reconnaît à la présence de deux valvules au lieu de trois. Elle est dite vraie lorsque ces deux valvules sont de taille plus ou moins égale, avec deux points commissuraux et une ouverture ellipsoïde (type 0) (Vidéo et Figure 15.49) (voir Chapitre 11 Bicuspidie aortique).
Vidéo: Bicuspidie aortique en court-axe; les deux cuspides sont dans une position antéro-postérieure.
Vidéo: Bicuspidie aortique en court-axe; les deux cuspides sont dans une position antéro-postérieure.
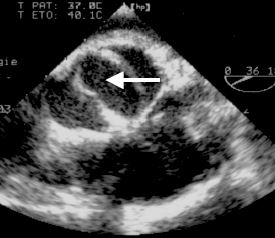
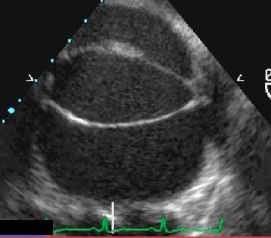
Figure 15.49 : Bicuspidie aortique. A: il n'y a que deux commissures, l'ouverture (flèche blanche) est ellipsoïde. B: bicuspidie dans le cadre d'un syndrome de Marfan; l'ouverture de la valve est ellipsoïde, les bords des deux feuillets n'atteignent pas les parois de l'aorte en systole.
On parle de fausse bicuspidie (type I) lorsqu'il existe trois points commissuraux et que deux valvules ont secondairement fusionné, laissant la trace de cette fusion sous forme d'un raphé; l'ouverture est en forme de banane (Vidéo). La classification actuelle est basée sur le nombre de raphés (voir Chapitre 11, Bicuspidie aortique).
Vidéo: Bicuspidie calcifiée avec fusion des cuspides coronaire droite et coronaire gauche; la valve présente cependant 3 commissures.
La valve aortique bicuspide est fragile, ses valvules sont soumises à un stress plus intense que celui d'une valve normale. Ses bords ne peuvent pas rejoindre la paroi des sinus de Valsalva à l'ouverture et vibrent pendant la systole, ce qui donne naissance à un souffle systolique. Lorsqu'elle se fibrose et se calcifie, elle devient sténotique, en général vers 40-50 ans (Figure 15.50).
Vidéo: Bicuspidie calcifiée avec fusion des cuspides coronaire droite et coronaire gauche; la valve présente cependant 3 commissures.
La valve aortique bicuspide est fragile, ses valvules sont soumises à un stress plus intense que celui d'une valve normale. Ses bords ne peuvent pas rejoindre la paroi des sinus de Valsalva à l'ouverture et vibrent pendant la systole, ce qui donne naissance à un souffle systolique. Lorsqu'elle se fibrose et se calcifie, elle devient sténotique, en général vers 40-50 ans (Figure 15.50).
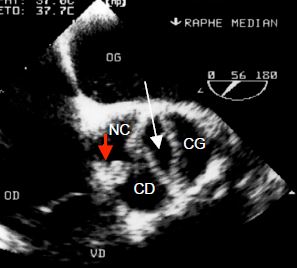
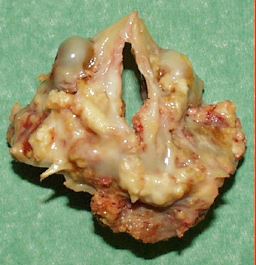
Figure 15.50 : Bicuspidie aortique. A: "Fausse" bicuspidie; il y a trois commissures (marquées 1, 2 et 3), mais l'ouverture (flèche blanche) est ellipsoïde parce que les feuillets non-coronaire et coronarien droit sont fusionnés au niveau d'un raphé calcifié (flèche verticale rouge) et ne forme plus qu'un seul feuillet. B: Pièce anatomo-pathologique du cas présenté en A.
La valve peut aussi devenir insuffisante par dilatation de l'anneau, par bascule ou par déchirure d'un feuillet; ceci survient en général à un âge plus précoce que la sténose. Le plus souvent, il s’agit d’une maladie aortique avec combinaison à des degrés variables de sténose et d’insuffisance (Vidéo).
Vidéo: Vue long-axe 130° d'une bicuspidie aortique présentant une insuffisance mineure et une sténose serrée.
La progression est d’autant plus rapide que l’ouverture est plus excentrique. L'auscultation de la sténose aortique consiste en un souffle éjectionnel 5/6 avec un thrill, un dédoublement paradoxal du deuxième bruit, et un click d'éjection audible à l'apex.
Vidéo: Vue long-axe 130° d'une bicuspidie aortique présentant une insuffisance mineure et une sténose serrée.
La progression est d’autant plus rapide que l’ouverture est plus excentrique. L'auscultation de la sténose aortique consiste en un souffle éjectionnel 5/6 avec un thrill, un dédoublement paradoxal du deuxième bruit, et un click d'éjection audible à l'apex.
Options chirurgicales
Dans la bicuspidie aortique sténotique, l’indication opératoire est posée lorsque le gradient moyen est ≥ 50 mmHg, la surface ≤ 0.6 cm2/m2, le patient symptomatique ou le VG en voie de dilatation [9,13]. En cas d’insuffisance, l’indication est fondée sur la sévérité de l’IA et sur la dilatation du VG. Chez l’enfant et chez le jeune adulte, on évite de mettre en place une prothèse valvulaire, car une prothèse mécanique réclame une anticoagulation à vie et une prothèse biologique ne dure que 10 à 15 ans (voir Chapitre 11 Prothèses valvulaires). Si la valve est souple, non-calcifiée et sans insuffisance, une valvotomie percutanée par un ballon gonflable permet de lever l’obstacle et d’empêcher le remodelage ventriculaire. Le risque est de créer une insuffisance résiduelle. Le taux de succès à long terme est équivalent à celui d’une prothèse [8].
Si la situation ne se prête pas à une valvulotomie, on peut procéder à une plastie aortique (voir Chapitre 11 Autres plasties valvulaires) ou à une opération de Ross. Lors de celle-ci, on transpose la valve pulmonaire en position aortique (avec réimplantation des coronaires) et on met en place une homogreffe en position pulmonaire (Figure 15.51 et Figure 11.146).
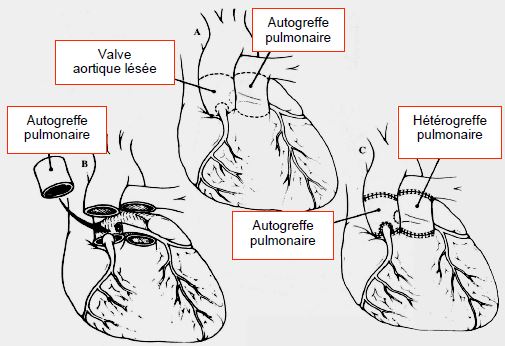
Figure 15.51 : Opération de Ross. Elle consiste à réséquer la valve aortique malade, à y implanter la valve pulmonaire du patient, et à remplacer cette dernière par un conduit valvé entre le VD et l'AP.
Cette technique évite l’anticoagulation et permet la croissance de la valve. La raison de ce croisement est que le taux d’usure des homogreffes est élevé en position aortique (30% à 10 ans); il est alors préférable d’avoir une incompétence sur la voie pulmonaire qui peut accommoder de grandes variations de volume, ou d’avoir une sténose que l’on peut dilater par cathétérisme sans risque d’embolie systémique; les mêmes lésions d’usure en position aortique imposeraient la mise en place d’une prothèse. L’opération de Ross est contre-indiquée s'il existe une insuffisance pulmonaire, une bicuspidie pulmonaire ou une dysfonction ventriculaire importante. La mortalité opératoire de l’opération de Ross est de 3% et la mortalité à long-terme < 1%/an ; le taux de détérioration de l’autogreffe aortique est de 1%/an, mais celui de l’homogreffe de la voie droite est plus élevé (2-3%/an). Une insuffisance de la néovalve aortique se développe chez 30% des malades [4]. Le taux de réopération au-delà de 12 ans est de 10% pour la valve aortique et de 20-30% pour l'homogreffe pulmonaire [12]. Au-delà de 40 ans, la valve est remplacée par une prothèse, de préférence mécanique. La prothèse biologique est réservée aux patients qui ne peuvent pas être anticoagulés ou qui sont âgés de plus de 65 ans. L’implantation transcathéter de type TAVI n’est pas adaptée à la bicuspidie aortique, mais peut traiter une sténose ou une incompétence de l’homogreffe pulmonaire de manière non-invasive [5,6].
Anesthésie
Les contraintes de l’anesthésie sont celles d’une sténose aortique (voir Chapitre 11 Sténose aortique, Anesthésie).
- Maintien de la précharge;
- Maintien de la normocardie;
- Maintien de la pression de perfusion systémique par des vasoconstricteurs artériels;
- Prise en charge d’une éventuelle dysfonction du VG;
- En résumé, le malade doit être: plein – régulier - fermé.
La prise en charge est modifiée lorsqu’une insuffisance aortique est présente (voir Chapitre 11 Insuffisance aortique, Anesthésie).
- Maintien de la précharge;
- Tachycardie (fréquence 80 batt/min);
- Baisse de la pression systémique par des vasodilatateurs artériels;
- Prise en charge de la dysfonction du VG, qui est dilaté;
- En résumé, la malade doit être : plein – rapide – ouvert.
Dans la sténose sus-aortique, le flux sanguin est dévié de telle manière que le flux s’engouffre dans le tronc brachiocéphalique, où la pression est plus élevée que dans la crosse distale [1]. De ce fait, il est important de placer le cathéter artériel en position radiale gauche ou fémorale. Dans les reconstructions de la racine aortique, l’emplacement du cathéter varie selon la stratégie chirurgicale et la canulation de CEC (voir Chapitre 18, Aorte ascendante, Monitorage).
Syndrome de Marfan
Le syndrome de Marfan est une maladie du tissu conjonctif autosomale dominante dont la prévalence est de 0.3‰. Une dilatation de la racine de l’aorte et de l’aorte ascendante est retrouvée chez 60-80% de ces malades (Vidéos et Figure 15.52); la dissection en est une complication classique (voir Chapitre 18 Aorte ascendante) [1].
Vidéo: Dilatation massive de la racine de l'aorte dans un cas de syndrome de Marfan.
Vidéo: Insuffisance aortique au flux couleur (même cas que la vidéo précédente).
Vidéo: Dilatation massive de la racine de l'aorte dans un cas de syndrome de Marfan.
Vidéo: Insuffisance aortique au flux couleur (même cas que la vidéo précédente).
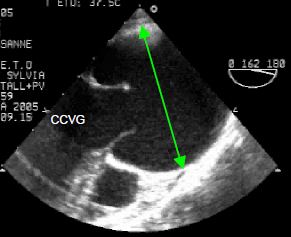
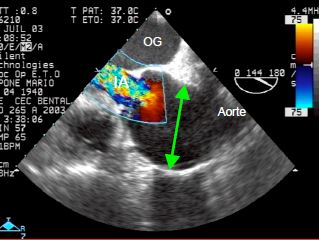
Figure 15.52: Syndrome de Marfan. A : dilatation massive de la racine aortique ; la valve aortique est bicuspide ; elle ne s’ouvre pas complètement en systole. B : insufffisance aortique (IA) majeure dans une cas de Marfan avec dilatation de la racine aortique.
La force éjectionnelle du VG doit être abaissée par un béta-bloqueur et la pression artérielle strictement contrôlée par des vasodilatateurs (PAsyst < 120 mmHg). L’indication opératoire est posée lorsque le diamètre de l’aorte ascendante est ≥ 5.0 cm (≥ 2.75 cm/m2) ou lorsqu’il augmente de > 5 mm/an [1,9]. L’intervention consiste à remplacer la racine de l’aorte (voir Chapitre 18, Chirurgie de la racine aortique) en épargnant la valve aortique si cela est possible. L’anesthésie est décrite au Chapitre 18 (Aorte ascendante, Anesthésie).
| Lésions de la voie éjectionnelle gauche |
|
Trois affections congénitales :
- Sténose sous-aortique membraneuse (dysplasie valvulaire et IA fréquentes) ;
- Biscupidie valvulaire (sténose et/ou insuffisance) ;
- Sténose supra-aortique.
La prise en charge anesthésique est celle d’une sténose aortique (Plein – Régulier - Fermé) ou d’une insufisance aortique (Plein – Rapide – Ouvert) selon la lésion prédominante.
Le syndrome de Marfan est associé à une insuffisance aortique et à une dilatation anévrysmale de la racine de l'aorte + de l'aorte ascendante, avec risque de dissection et de rupture.
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Décembre 2019
Références
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital hesart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- FRIEDMAN WF. Aortic stenosis. In: EMMANOULIDES GC, ed. Moss and Adam's heart disease in infants, children and adolescents including fetus and young adult. Baltimore: Williams & Wilkins 1995, 1087
- FRIGIOLA A, RANUCCI M, CARLUCCI C, et al. The Ross procedure in adults: long-term follow-up and echocardiographic changes leading to pulmonary autograft reoperation. Ann Thorac Surg 2008; 86:482-9
- NISHIMURA RA, OTTO C, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO C, RIGOLIN VH, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70: 252-89
- ROSENFELD HM, GENTLES TL, WERNKOVSKY G, et al. Utility of intraoperative echocardiography in the assessment of residual cardiac defects. Ped Cardiol 1998; 19:346-51
- ROUINE-RAPP K, RUSSELL IA, FOSTER E. Congenital heart disease in the adult. Int Anesthesiol Clin 2012; 50:16-39
- SILVERSIDES CK, KIESS M, BEAUCHESNE L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Outflow tract obstruction, coarctation of the aorta, tetralogy of Fallot, Ebstein anomaly and Marfan’s syndrome. Can J Cardiol 2010; 26:e80-e97
- STEVENSON JG, SORENSEN GK, GARTMAN DM, et al. Left ventricular outflow tract obstruction: An indication for intraoperative transesophageal echocardiography. J Am Soc Echocardiogr 1993; 6:525-35
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- TAKKENBERG JJM, KLIEVERIK LMA, SCHOOF PH, et al. The Ross procedure: a systematic review and meta-analysis. Circulation 2009; 119:222-8
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
