Arrêt programmé
L'abaissement du métabolisme autorise à interrompre la circulation cérébrale pendant un certain laps de temps (maximum 30-40 minutes) après un refroidissement à 18-20°C et une protection myocardique par cardioplégie (arrêt circulatoire en hypothermie, ACH). Cependant, il n'y a pas de températures ni de durées que l'on puisse considérer comme sans risque de séquelles neurologiques; seule la probabilité de lésions irréversibles est quantifiable. C'est ce qu'illustre la Figure 24.9 [4], qui résume les durées dites "sûres" d'arrêt complet en fonction de la température [3,5].
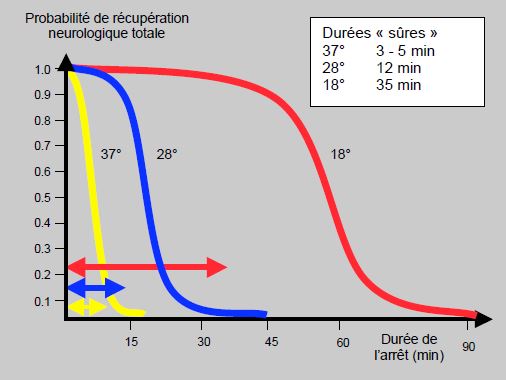
Figure 24.9 : Nomogramme d'une estimation de la probabilité de récupération neurologique complète après un arrêt circulatoire total à trois différentes températures du cerveau. Les durées dites sûres sont représentées par les flèches de couleur [d'après réf 4]. Les durées dites "sûres" en fonction de la température sont définies par le genou supérieur de la courbe, point d'inf-lexion auquel la probabilité de séquelles neuro-logiques devient significative.
Ces durées sont définies par le point d'inflexion de la courbe, auquel correspond une augmentation significative de la probabilité de séquelles neurologiques. Mais il ne s'agit que d'une probabilité: elle n'est jamais nulle, et tout allongement de la durée l'augmente. Un des problèmes de cette notion de "durée sûre" est la difficulté de définir un critère précis dans les résultats neurologiques à court et à long terme. De plus, ceux-ci dépendent largement de l'âge du patient et de son status vasculaire. En outre, l'hypothermie profonde s'accompagne d'altérations systémiques comme une coagulopathie, une réaction inflammatoire majeure et une dysfonction multiorganique (reins, poumons) [14]. On peut éviter l'hypothermie profonde et opérer la crosse aortique en normothermie grâce à une perfusion cérébrale sélective doublée d'une perfusion des viscères par voie fémorale, un ballon intravasculaire placé au départ de l'aorte descendante assurant l'étanchéité (voir Protection cérébrale) [9].
Dans la chirurgie de la crosse de l'aorte, qui implique une interruption de la circulation cérébrale, les lésions neurologiques sont fonctionnelles, passagères ou permanentes; elles sont directement proportionnelles à la durée de l'arrêt et à l'âge du patient (> 60 ans). Elles ont une incidence de 3-8% dans les cas électifs; dans les situations d'urgence, le risque s'élève jusqu'à 15% [15]. En hypothermie à 18°C, un arrêt de la perfusion cérébrale pendant 20-30 minutes n’aura probablement pas de conséquences neurologiques, alors qu’un arrêt d’une heure entraîne des séquelles; à cette température, la limite extrême de sécurité se place à environ 45 minutes [6]. Les troubles neurologiques vont des hallucinations et modifications comportementales jusqu'aux convulsions (5-10%), choréo-atétose (1-12%) et coma profond (1.5%) [13]. A défaut de disposer de données hautement fiables, on continue à considérer l'ACH, avec ou sans perfusion sélective, comme la meilleure mesure de protection pour le cerveau et pour les autres organes pendant la chirurgie de la crosse aortique [2]. Mais si l'arrêt circulatoire en hypothermie profonde est la seule mesure de protection cérébrale, la phase critique de l'intervention ne doit pas dépasser 30 minutes [11].
Post-réanimation
Après un arrêt cardiaque sur tachycardie ou fibrillation ventriculaire réanimé avec succès, l’hypothermie cérébrale à 33-36°C permet une amélioration du devenir neurologique (en moyenne, récupération de 50% au lieu de 25% des cas) [1,12]. La survie globale est actuellement de 55% [7]. Elle doit être mise en route le plus vite possible et durer 24-72 heures. Le choix de la température est variable selon les études, car les bénéfices obtenus en descendant en-dessous de 35°C ne sont pas évidents dans la littérature [7], mais le contrôle ciblé de la température cérébrale est le point capital [8,10].
Le refroidissement est réalisé par voie externe (couvertures refroidissantes), par perfusion de solutés froids ou par voie endovasculaire (2 L NaCl 0.9% à 4°C circulant dans un cathéter d’échange thermique) [8,10]. Les frissons, gros consommateurs d'O2, sont évités par une sédation (buspirone + mépéridine), une perfusion de magnésium ou éventuellement une curarisation. Le réchauffement est géré à la vitesse de 0.5°C par heure [10].
| Arrêt circulatoire |
|
L’hypothermie cérébrale permet d’étendre la durée d’un arrêt circulatoire en CEC de 4 minutes (37°C) à 12 minutes (28°C) et 35 minutes (18°C) sans risquer de séquelles neurologiques majeures. Aprés une réanimation pour arrêt cardiaque, l’hypothermie (32-34°C) pendant 24-72 heures améliore le pronostic neurologique.
|
© CHASSOT PG, Juin 2008, dernière mise à jour, Juin 2018
Références
- AZMOON S, DEMAREST C, PUCILLO AL, et al. Neurologic and cardiac benefits of therapeutic hypothermia. Cardiol Rev 2011; 19:108-14
- BASSIN L, BELL D. Temporary extracorporeal bypass modalities during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:341-57
- KERN FH, GIESER WG, FARRELL DM. Extracorporeal circulation and circulatory assist devices in the pediatric patient. In: LAKE CL. Pediatric cardiac anesthesia, 2nd edition. Norwalk : Appleton & Lange, 1993, pp 151-79
- KERN FH, UNGERLEIDER RM, REVES JG, et al. The effect of altering pump flow rate on cerebral blood flow and cerebral metabolism in neonates, infants and children. Ann Thorac Surg 1993; 58:1366-72
- KIRKLIN JW, BARRAT-BOYES BG. Cardiac Surgery, 2nd edition, New-York: Churchill-Livingstone 1993, p 74
- MARTIN TD. Thoracic aortic surgery and cardiopulmonary bypass. In: MORA CT. Cardiopulmonary bypass. New-York: Springer Verlag, 1995, 329-39
- NIELSEN N, WETTERSLEV J, CRONBERG T, et al. Targeted temperature management at 33° versus 36° after cardiac arrest. N Engl J Med 2013; 369:2197-206
- NOLAN JP, SOAR J, CARIOU A, et al. European Resuscitation Council and European Society of Intensive Care Medicine 2015 Guidelines for post-resuscitation care. Intens Care Med 2015; 41:2039-56
- PREVENTZA O, COSELLI J, GARCIA A, et al. Moderate hypothermia at warmer temperatures is safe in elective proximal and total arch surgery: results in 665 patients. J Thorac Cardiovasc Surg 2017; 153:1011-8
- RATANO D, ODDO M. Hypothermie thérapeutique après arrêt cardio-respiratoire en 2017 – revue pour le praticien. Praxis 2017; 106:1169-74
- SECO M, EDELMAN JJB, VAN BOXTEL B, et al. Neurologic injury and protection in adult cardiac and aortic surgery. J Cardiothorac Vasc Anesth 2015; 29:185-95
- STUB D, BERNARD S, DUFFY SJ, et al. Post cardiac arrest syndrome. A review of therapeutic strategies. Circulation 2011; 123:1428-35
- SVENSSON LG, CRAWFORD ES, HESS KR, et al. Deep hypothermia with circulatory arrest. Determinants of stroke and early mortality in 656 patients. J Thorac Cardiovasc Surg 1993; 106:19-24
- TIAN DH, WAN B, BANNON PG, et al. A meta-analysis of deep hypothermic circulatory arrest alone versus with adjunctive selective antegrade cerebral perfusion. Ann Cardiothorac Surg 2013; 2:261-70
- WILLIAMS JB, PETERSON ED; ZHAO Y, et al. Contemporary results for proximal aortic replacement in North America. J Am Coll Cardiol 2012; 60:1156-62
