Le diagnostic différentiel entre ces deux entités peut être difficile, car elles présentent un aspect clinique superposable: dyspnée, fatigabilité, hypotension, tachycardie, intolérance à l’effort, insuffisance diastolique sévère et tendance à l'œdème pulmonaire. La fonction systolique est conservée dans les deux cas.
La cardiomyopathie restrictive (CMR) est une maladie diastolique en général secondaire à une infiltration myocardique par du tissu non-contractile qui rigidifie sa paroi : amyloïdose, sarcoïdose, fibrose endomyocardique, maladie du collagène ou fibrose post-actinique. L’affection atteint quasi exclusivement le VG (voir Chapitre 13, Cardiomyopathie restrictive). La cavité ventriculaire est de dimension normale, mais l’oreillette est très dilatée, à cause de l’augmentation des pressions de remplissage. La PAPO est élevée et les variations respiratoires de la pression artérielle peu marquées. La rigidité de la paroi ventriculaire provoque une insuffisance diastolique gravissime caractérisée par un flux mitral passif protodiastolique (flux E) très brusque et très court, mais de haute vélocité (≥ 1.5 m/s) parce que la POG est élevée ; le flux de la contraction auriculaire (flux A) est faible car le ventricule ne se laisse plus distendre en fin de diastole [6]. La composante systolique "S" du flux veineux pulmonaire est très abaissée puisque la POG élevée diminue le gradient entre les veines pulmonaires et le coeur gauche. Plusieurs données échocardiographiques permettent de bien différencier la cardiomyopathie restrictive de la péricardite constrictive (PC) (Figure 16.13) [4,5].
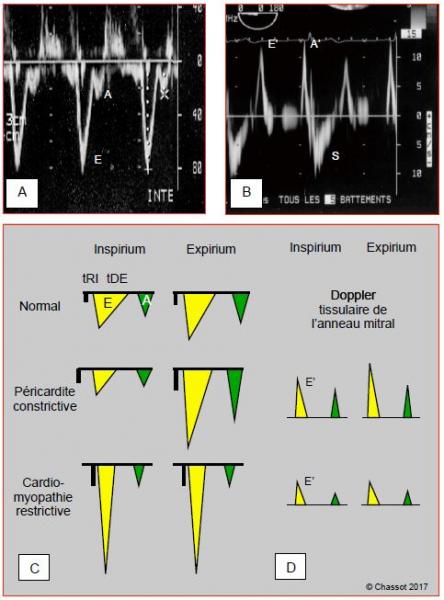
Figure 16.13 : Différentiation de la péricardite constrictive et de la cardiomyopathie restrictive en respiration spontanée à l'échocardiographie transoesophagienne. A : Flux mitral de péricardite constrictive ; E: flux mitral passif protodiastolique, A: flux mitral de la contraction auriculaire. B : Vélocité de l’anneau mitral au Doppler tissulaire ; E’: mouvement protodiastolique, A’: mouvement de la contraction auriculaire, S : mouvement systolique (descente de l’anneau mitral du à la contraction longitudinale du VG). C : Les variations respiratoires très marquées de la péricardite constrictive sont absentes en cas de cardiomyopathie restrictive. tRI: phase de relaxation isovolumétrique (n : 90 ms). tDE: temps de décélération du flux E (n : 160ms) [6]. D : La vélocité du mouvement de l’anneau mitral, normal dans la péricardite constrictive (12-15 cm/s), est très faible dans la cardiomyopathie restrictive (< 5 cm/s) et n’a pas de variations respiratoires [10].
- Comme les cavités cardiaques ne sont pas isolées des variations de pression intrathoracique et que la Ptd est très élevée, la vélocité du flux mitral est peu variable avec la respiration spontanée dans la cardiomyopathie restrictive [12]. Au contraire, la péricardite constrictive est caractérisée par une variation respiratoire excessive du flux mitral mitral (> 25%) et du flux tricuspide (> 40%) en respiration spontanée.
- La vélocité du mouvement de l’anneau mitral examiné au Doppler tissulaire est basse (E’ < 5 cm/s) dans la cardiomyopathie restrictive puisqu’il s’agit d’une maladie de la relaxation diastolique, alors qu’elle est normale dans la péricardite constrictive (E’ > 10 cm/s) où la relaxation est normale puisque la maladie concerne le péricarde et non le myocarde [9,10].
- L'interdépendance ventriculaire est accentuée dans la PC, car la constriction contraint les deux ventricules à un remplissage alterné au cours de la respiration et la coque fibreuse isole les cavités cardiaques des variations de pression endothoracique; le septum interventriculaire bascule dans le VG en inspirium et dans le VD en expirium [3,11]. Ce phénomène est absent dans la cardiomyopathie restrictive [5].
- Bien que les deux affections se traduisent par une élévation des pressions de remplissage, la CMR conduit à une dilatation massive de l'OG et/ou de l'OD. La constriction externe par le péricarde prévient ce phénomène dans la PC.
- La morphologie du flux mitral est normale dans la PC, alors qu'elle est très altérée dans la CMR: le flux E protodiastolique est de haute vélocité, très bref, avec un fort raccourcissement de la relaxation isovolumétrique et du temps de décélération du flux E. Le ventricule rigide de la CMR limite le flux mitral télédiastolique de la contraction auriculaire (flux A), dont la Vmax est très faible à l'écho Doppler, alors qu'elle est normale dans la PC.
- Au Doppler tissulaire, la contraction longitudinale est préservée mais la contraction circulaire est atténuée dans la PC, alors que la contraction systolique est homogène dans la CMR où l'affection atteint primairement la fonction diastolique dont tous les indices sont effondrés [3].
- Lorsqu'il est présent, le signe de Kussmaul est spécifique de la péricardite constrictive [4].
L’IRM et le CT-scan peuvent être une aide précieuse pour visualiser l’épaississement de la coque péricardique (≥ 4 mm) dans la péricardite constrictive. Dans la cardiomyopathie restrictive, l'IRM dévoile la composante de myocardite, de fibrose, d’atrophie et d’infiltration [2]; dans la péricardite constrictive, elle permet de mesurer l'amplitude du basculement du septum interventriculaire au cours de la respiration spontanée (> 12%) [1]. L'ECG n'a pas de spécificité pour différentier les deux affections, mais les biomarqueurs (BNP, NT-proBNP) sont élevés dans la CMR (> 600 pg/mL), alors qu'ils sont normaux dans la PC [5].
Ce diagnostic différentiel est important parce que le traitement des deux affections est très différent. Hormis la transplantation cardiaque, il n'y a aucune thérapeutique pour la cardiomyopathie restrictive, dont la survie moyenne est de 5 ans après le début des symptômes cliniques. Au contraire, dans 90% des cas de péricardite constrictive le traitement médical (AINS, colchicine, stéroïdes) est efficace et la péricardectomie est curative [7,8]. En anesthésie, la différentiation entre ces deux entités est également importante, car leur réponse hémodynamique à la ventilation en pression positive n'est pas la même, comme l'illustre la tolérance à une manœuvre de Valsalva réalisée avant l'induction (Figure 16.14).
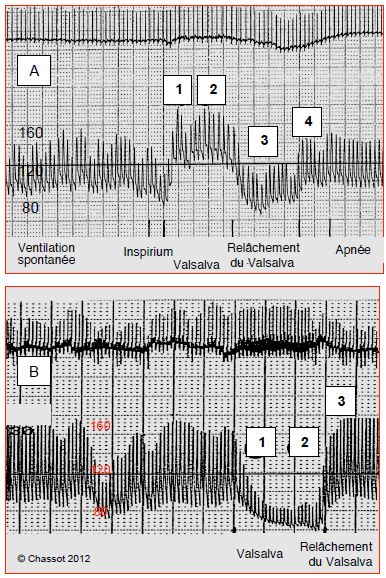
Figure 16.14 : Manoeuvre de Valsalva préopératoire. A : lors de tamponnade ; disparition du pouls paradoxal lors du Valsalva avec augmentation de la pression artérielle moyenne (phases 1 et 2); chute tensionnelle importante lors de l'inspirium profond (phase 3) et stabilisation à des valeurs normales en apnée (phase 4). Ce cas est l'illustration d'une prédominance hémodynamique sur le coeur gauche. Ce patient sera stabilisé en ventilation en pression positive. B : lors de cardiomyopathie restrictive ; irrégularité du pouls paradoxal en ventilation spontanée et effondrement tensionnel lors du Valsalva (phases 1 et 2), secondaire à la grave insuffisance diastolique ; la pression artérielle remonte lors de l'inspirium profond (phase 3) par augmentation du retour veineux droit. Cette patiente sera hypotendue en ventilation en pression positive, la ventilation spontanée sera préférable. La décompression péricardique ne modifiera guère l’hémodynamique.
Comme la dépression endothoracique inspiratoire accentue le déséquilibre hémodynamique de la constriction péricardique (PC), la surpression du Valsalva ramène les conditions de charge ventriculaire vers l’équilibre ; les ventricules eux-mêmes sont protégés de cette surpression par la coque péricardique. La manoeuvre de Valsalva est bien tolérée. Dans la restriction myocardique (CMR), au contraire, le débit systolique est extrêmement dépendant de la précharge (courbe de Starling très redressée) ; la baisse du retour veineux périphérique compromet immédiatement le débit cardiaque. D’autre part, l’augmentation de la pression transmurale du VG non protégé limite l’expansion diastolique du ventricule, déjà compromise par la maladie. La pression s’effondre au cours du Valsalva.
| Péricardite constrictive (PC) vs cardiomyopathie restrictive (CMR) |
|
La PC est une affection péricardique qui comprime des ventricules essentiellement normaux, alors que la CMR est une affection myocardique caractérisée par une défaillance diastolique gravissine. Malgré leur clinique très ressemblante, les deux affections se différencient à l’échocardiographie sur deux points principaux :
- Flux mitral E : variations respiratoires > 25% dans la PC mais normales dans la CR
- Doppler tissulaire de l’anneau mitral : vélocité normale (10-12 cm/s) dans la PC mais abaissée (< 5 cm/s) dans la CR
Sous anesthésie, l'IPPV est en général bien tolérée en cas de PC, alors qu'elle engendre un effondrement hémodynamique dans la CMR.
|
© CHASSOT PG, Décembre 2007, Dernière mise à jour, Septembre 2017
Références
- ANAVEKAR NS, WONG BF, FOLEX TA, et al. Index of biventricular interdependence calculated using cardiac MRI: proof of concept study in patients with and without constrictive pericarditis. Int J Cardiovasc Imaging 2013; 39:363-9
- COSYNS B, PLEIN S, NIHOYANOPOULOS P, et al. European Association of Cardiovascular Imaging (EACVI) position paper: multimodality imaging in pericardial disease. Eur Heart J Cardiovasc Imaging 2015; 16:12-31
- DAL-BIANCO JP, SENGUPTA PP, MOOKADAM F, et al. Role of echocardiography in the diagnosis of constrictive pericarditis. J Am Soc Echocardiogr 2009; 22:24-33
- GARCIA MJ. Constrictive pericarditis versus restrictive cardiomyopathy ? J Am Coll Cardiol 2016; 67:2061-76
- GESKE JB, ANAVEKAT N, NISHIMURA RA, GERSH BJ. Differentiation of constriction and restriction. Complex cardiovascular hemodynamics. J Am Coll Cardiol 2016; 68:2329-47
- HATLE LK, APPLETON CP, POPP RL. Differentiation of constrictive pericarditis and restrictive cardiomyopathy by Doppler Echocardiography. Circulation 1989; 79:357-70
- IMAZIO M. Contemporary management of pericardial disease. Curr Opin Cardiol 2012; 27:308-17
- MEIJBOOM FJ. Constrictive pericarditis and restrictive cardiomyopathy. In: GATZOULIS MA, et all, eds. Diagnosis and management of adult congenital heart disease. Edinburgh: Churchill-Livingstone, 2003; 459-65
- RAJAGOPALAN N, GARCIA MJ, RODRIGUEZ L, et al. Comparison of new Doppler echocardiographic methods to differentiate constrictive pericardial heart disease and restrictive cardiomyopathy. Am J Cardiol 2001; 87:86-94
- SOHN DW, KIM YJ, KIM HS, et al. Unique features of early diastolic mitral annulus velocity in constrictive pericarditis. J Am Soc Echocardiogr 2004; 17:222-6
- WELCH TD, LING LH, ESPINOSA RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 2014; 7:526-34
- ZHANG S, KERINS DM, BYRD BF. Doppler echocardiography in cardiac tamponade and constrictive pericarditis. Echocardiography 1994; 11:507-21
