La revascularisation coronarienne est le premier choix thérapeutique de la maladie coronarienne sévère et des syndromes coronariens instables. Le but de toute revascularisation est triple.
- Reperfusion de la masse myocardique ischémiée;
- Soulagement de l'angor persistant malgré le traitement médical;
- Amélioration de la survie à long terme.
Angioplastie coronarienne et stents passifs
Les lésions qui ont le meilleur pronostic pour l'angioplastie percutanée (PCI, percutaneous coronary intervention) sont des obstructions non-excentriques, sans calcifications importantes, sur des vaisseaux de dimensions moyennes, à distance d'embranchements importants, chez des malades mono- ou bi-tronculaires avec une fonction ventriculaire conservée (FE > 0.4) et un score SYNTAX bas (score décrivant la complexité des lésions coronariennes, voir Tableau 9.18). Les facteurs de risque qui péjorent les résultats sont l'âge avancé (> 75 ans), le diabète, le sexe féminin, la sténose du tronc commun, la dysfonction ventriculaire, une zone de myocarde à risque très étendue et un score SYNTAX élevé [36,77]. D'autre part, la revascularisation percutanée est indiquée dans les 2 heures lors d'ischémie aiguë avec surélévation du segment ST (STEMI) et dans les 12-72 heures dans les évènements ischémiques aigus sans surélévation du segment ST (non-STEMI).
Pour assurer le bénéfice de la dilatation, il est d'usage d'introduire un stent qui maintient ouverte la lumière du vaisseau. A cet effet, on a utilisé en premier lieu des stents métalliques nus, ou stents passifs (bare metal stents ou BMS). Les premiers jours, l’armature est en contact direct avec le sang, puis une mince membrane de fibrine recouvre le stent. Il faut 6 semaines pour qu'il soit protégé par ce qui n'est encore qu'une couche de cellules musculaires lisses, et 12 semaines pour que la prothèse soit complètement recouverte d'endothélium [24]. Ceci explique que le stent soit l'équivalent d'une plaque instable pendant le premier mois et nécessite une bithérapie antiplaquettaire pendant 4-6 semaines. Le taux de thrombose est de 1-2% pendant le premier mois et < 0.1% au-delà. Mais le défaut majeur des BMS est un taux élevé de resténose: 20-30% à 6-9 mois, dont le 10% des cas s'accompagne d'un infarctus [3,38,61]. Par rapport aux stents actifs de 1ère génération, ils ont été réservés aux patients chez qui la bithérapie présente de très hauts risques hémorragiques et à ceux qui doivent subir une intervention chirurgicale dans un délai de 1-3 mois [7,11,37]. Les BMS sont de moins en moins utilisés, car les stents actifs de 3ème génération (type Biolimus A9) permettent la même durée de bithérapie en cas de nécessité [71].
Stents actifs
Pour remédier à la haute incidence de resténose dans les stents passifs, on a développé des stents à élution, dits stents actifs (DES, drug-eluting stent), qui libèrent progressivement des produits antiprolifératifs. Les substances utilisées dans la première génération de stent actif étaient le sirolimus (rapamycine) et le paclitaxel; d'autres ont pris le relai dans les nouvelles générations. Les stents actifs sont constitués de trois composants.
- Armature : elle assure la rigidité du stent ; les nouveaux alliages permettent un meilleur déploiement, davantage de flexibilité et une apposition plus complète ; la taille des barrettes diminue (60-160 μm).
- Acier, alliages chrome-cobalt ou platine-cobalt;
- Résorbable : magnésium, polymère d’acide L-lactique.
- Matrice : support chimique de l’agent antiproliférant, elle assure la cinétique et l’homogénéité de l’élution.
- Polyoléfine, phosphorylcholine, polyéthylène-métacrylate, fluoropolymère;
- Résorbable : acide polylactique.
- Agent antiproliférant : dérivés liposolubles d’immunosuppresseurs et d’antifongiques;
- Stents actifs de 1ère génération: sirolimus (Orsiro™), paclitaxel (Taxus™);
- Stents actifs de 2ème et 3ème génération: zotarolimus (Endeavor™, Resolute™), everolimus (Xience V™, Synergy™), biolimus (Biomatrix™).
Avec les DES, le taux de resténose est descendu à 3% à 1 an et à 6% à 3 ans, sans modification de la mortalité [6,62,64]. Toutefois, ce progrès s’est accompagné d’un ralentissement considérable de la réendothélialisation. En effet, seule 13% de la surface des stents actifs de 1ère génération est endothélialisée à 3 mois et 56% à 1 an [31,34]. Contrairement à la néointima épaisse qui se forme après angioplastie ou après stent passif, la surface de ces stents est couverte d’une couche endothéliale fine et fragile, très voisine de celle d’une plaque instable [78]. Cette situation augmente le risque de thrombose [81] et requiert une double thérapie antiplaquettaire (aspirine + ticagrelor, prasugrel ou clopidogrel) pendant 12 mois [7,33,37,71].
Avec les stents actifs de première génération, le risque de thrombose de stent est de 2-3% pendant le 1er mois, de 2% jusqu’à 6 mois et de 1.2% entre 6 mois et 1 an ; au-delà d’un an, lorsque les patients ne sont plus sous bi-thérapie continue, le risque de thrombose tardive est de 0.4-0.6% par an (2.2% à 4 ans), ce qui est plus élevé que pour les BMS [9,13,14,62,68]. Bien qu’elle soit un événement rare, la thrombose de stent est extrêmement dangereuse, car elle correspond à l’occlusion abrupte et totale d’un vaisseau dont le flux était normal et la collatéralisation faible. Elle est grevée d’un taux d’infarctus de 11-48% et d’une mortalité de 9-45% (moyenne 25%) [41]. La resténose, au contraire, est un événement progressif et bénin, dont la mortalité est < 1% et le taux d'infarcissement < 10% [78]. L’accroissement de thrombose tardive avec les stents actifs de première génération par rapport aux stents passifs (2.2% versus 0.7% à 4 ans) les rend très dépendants de la bithérapie.
Avec les DES de 2ème et 3ème générations, les progrès techniques et les nouvelles substances anti-prolifératives modifient les résultats, car l’endothélialisation y est plus rapide et le taux de thrombose 2 à 3 fois plus faible: 0.6% au lieu de 1.2% à 1 an [55,58]. L’activation et l’agrégation locale des plaquettes est nettement moindre. La bithérapie peut même être raccourcie à 3-6 mois dans les cas de coronaropathie stable [10,45,66,71]. Toutefois, les stents biorésorbables (Absorb™) sont un cas particulier, car ils affichent un taux accru de thrombose pendant la première année; il est donc recommandé de continuer la bithérapie pendant 12 mois, quel que soit le status au moment de leur mise en place [70,71]. Les stents actifs de 2ème et 3ème générations sont actuellement utilisés sans restriction et sont le choix par défaut dans toutes les situations cliniques, y compris celles où il était convenu de choisir des BMS, comme les hauts risques hémorragiques ou la revascularisation préopératoire en chirurgie non-cardiaque [28,53,71,77]. Il faut toutefois rester prudent car on manque d'expérience avec les nouveaux DES en périopératoire. Le raccourcissement de la durée de bithérapie, qui est possible lors de coronaropathie stable chez des malades sélectionnés, n'est pas transposable à une situation stressante et thrombogène comme une intervention chirurgicale chez les patients rencontrés en clinique, qui souffrent de coronaropathie complexe et de polymorbidités. La faisabilité d’un traitement de seulement 3-6 mois dans certaines circonstances n’est en aucun cas un argument pour interrompre une thérapie en cours afin de programmer une intervention chirurgicale dans des délais raccourcis.
La thrombose de stent est un accident d’origine multifactorielle, dont les principaux prédicteurs peuvent être classés par ordre d’importance décroissante [12,13,21,61,62].
- La durée du traitement antiplaquettaire (voir Recommandations pour la chirurgie cardiaque et pour la chirurgie non-cardiaque). Le délai entre la revascularisation et l’interruption de la bithérapie est probablement l’élément le plus important, notamment lorsqu’il est inférieur à 1-3 mois.
- La chirurgie non-cardiaque. L’acte chirurgical s’accompagne d’un syndrome inflammatoire systémique et d’un état hypercoagulable, particulièrement importants lors d’intervention majeure. D’autre part, le risque est d’autant plus élevé que le délai entre la pose de stent et l’opération est plus bref ou que l’intervention est réalisée en urgence ; cependant, il reste faible pour les interventions mineures.
- Le status cardiaque: présence de syndrome coronarien aigu (SCA) au moment de la revascularisation, persistance d’un syndrome coronarien instable.
- Le degré de recouvrement endothélial. Entre 1 et 3 ans après la PCI, les zones non recouvertes représentent 2.6% de la surface du stent avec les DES de 2ème génération, mais 19% avec les DES de 1ère génération [54].
- La progression de la maladie coronarienne. Seule la moitié des complications au-delà d’une année après revascularisation coronarienne pour STEMI survient dans le vaisseau incriminé; l'autre moitié apparaît dans un autre vaisseau sous forme d’une progression de la maladie athéromateuse [65].
- L’anatomie coronarienne. Les stents très proximaux et ceux situés dans les vaisseaux dominants ou dans le seul vaisseau perméable sont considérés comme à haut risque. Les stents sous-dimensionnés dans de petits vaisseaux ont une haute incidence de thrombose [51].
- Les problèmes techniques : malapposition, dissection, emboîtement de stents, etc. Ils sont une cause prédominante de thrombose dans les 30 premiers jours après l’implantation, alors que les thromboses tardives sont essentiellement influencées par le degré de recouvrement endothélial et par l’intensité du traitement antiplaquettaire.
- Les indications hors recommandations (off-label indications) des stents actifs : plus de 50% des DES de 1ère génération ont été placés dans des situations qui ne correspondaient pas aux indications formelles pour lesquels ils ont été conçus : stents multiples, emboîtés, situés à des bifurcations, longueur de sténose > 36 mm, coronopathie polytronculaire. Avec les DES de 1ère génération, l'utilisation off-label va jusqu'à doubler le risque de thrombose (HR 2.3), ce qui n'est plus le cas avec les nouveaux DES [40,76].
- Les comorbidités : diabète, insuffisance rénale, dysfonction ventriculaire, maladie cancéreuse (hypercoagulabilité, syndrome paranéoplasique), âge avancé.
- Une inhibition plaquettaire inadéquate. Compte tenu de l’incidence de faibles répondeurs à l’aspirine et au clopidogrel, environ 20% des patients revascularisés ne bénéficient pas d’un traitement optimal. Cet aspect est négligeable avec le ticagrelor et le prasugrel.
Durée du traitement antiplaquettaire
Après une PCI avec pose de stents, une double thérapie antiplaquettaire (aspirine + ticagrelor ou prasugrel ou clopidogrel) est prescrite pour les durées suivantes, variables selon les situations (recommandations européennes) (Tableau 9.11) [37,45,49,71,77].
- 2 semaines après angioplastie avec ballon simple.
- 24 semaines après angioplastie avec ballon à élution (utilisé principalement dans les resténose de stent).
- 4 semaines après stents passifs (BMS), mais 12 mois en cas de syndrome coronarien aigu (SCA);
- 12 mois après l’implantation de stents actifs (DES) de 1ère génération.
- 6 mois après implantation de DES de 2-3ème génération si coronaropathie stable; possibilité de raccourcir à 1-3 mois en cas de risque hémorragique élevé.
- 12 mois après implantation de DES de 2-3ème génération si SCA; possibilité de raccourcir à 6 mois en cas de risque hémorragique élevé.
- 12 mois après implantation de DES biorésorbables.
- 12 mois en cas de SCA, avec ou sans implantation de stent et quel que soit le type de DES.
- > 12 mois dans les stents à haut risque ou les situations complexes, si le risque ischémique est élevé et si le risque hémorragique est faible (voir Tableau 29.6).
- Les anti-GP IIb/IIIa sont cantonnés au sauvetage pendant 48 h dans les stents à très haut risque.
- L'aspirine (50-100 mg/j) est maintenue à vie sans interruption.
- Le ticagrelor est le médicament de première intention dans le SCA, l'infarctus et la PCI.
- Si le risque hémorragique est élevé (anamnèse d'hémorragie digestive ou cérébrale, coagulopathie, anémie, anticoagulation simultanée, etc), il est souhaitable de restreindre la bithérapie à sa durée minimale et de prescrire plutôt du clopidogrel.
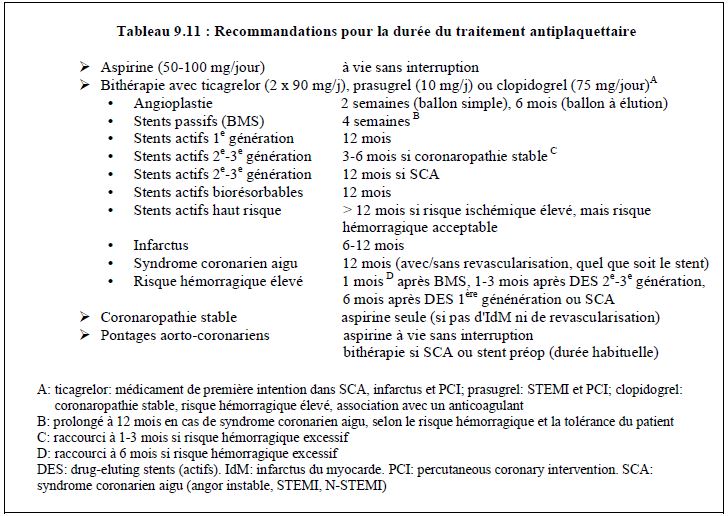
Ces durées correspondent à celles nécessaires pour que l’armature métallique des stents soit recouverte d’une couche cellulaire ; tant que ce n’est pas le cas, les stents se comportent comme des plaques instables. L’aspirine est prescrite à vie et ne doit pas souffrir d’interruption, quel que soit le type de stent. Sous antiplaquettaires, un stent est l’équivalent d’une coronaropathie stable ; lorsqu’on les arrête, il se comporte comme une plaque instable [20].
La question de la durée à long terme de la bithérapie est encore débattue (voir Chapitre 29, Antiplaquettaires et maladies cardiovasculaires). Dans les stents à très haut risque (longs, multiples, situés sur le tronc commun ou l’IVA proximale), chez les patients qui ont fait un infarctus ou un SCA au moment de la PCI et chez ceux qui ont déjà subi une thrombose de stent, il est plus sûr de continuer la bithérapie au-delà d’une année [21,75] ; c’est le cas de 29% des DES [14]. De plus, la bithérapie > 1 an diminue le risque d’infarctus non seulement sur la thrombose de stent mais aussi sur la coronaropathie des vaisseaux non-appareillés [79]. Dans les coronaropathies stables sans SCA, par contre, le traitement prolongé > 1 an est moins bénéfique, parce que le risque ischémique est inchangé alors que le risque hémorragique est augmenté [25,47,48,56,72]. Le bénéfice d'un traitement à long terme est également atténué avec les DES de 2ème génération, moins thrombogènes et plus rapidement réendothélialisés; dans les cas stables sans SCA, une bithérapie de 3-6 mois apparaît d'ailleurs suffisante avec les nouveaus DES [32,48]. La prolongation de la bithérapie est grevée d'une augmentation du risque hémorragique (HR 2.32), mais ce dernier reste inférieur au gain sur le risque ischémique chez les patients à risque thrombotique élevé, notamment parce que la mortalité des saignements (11%) est plus basse que celle des thromboses de stent (31%) [7,30,47,56].
L'arrêt programmé de la bithérapie antiplaquettaire à la fin du traitement recommandé est une période à risque à cause de l'effet rebond sur l'agrégabilité thrombocytaire lors de l'interruption du traitement; le risque de thrombose de stent est momentanément augmenté de 2 à 3 fois [35,42,44]. Il est donc prudent de prévoir un délai minimum d'un mois entre la fin d'une bithérapie et une intervention chirurgicale élective. Mais la nature de l’interruption a un impact significatif sur les complications : celles-ci sont 2 à 7 fois plus fréquentes lors d’un arrêt "sauvage" que lors d’un arrêt préopératoire (+ 41%) ou d’un arrêt programmé (- 37%) [44].
Anticoagulation
Indépendamment du traitement antiplaquettaire, l'angioplastie coronarienne et la pose de stent s'accompagnent d'une anticoagulation systémique pour la durée de la procédure et les heures qui suivent. Le choix comprend trois possibilités [28,77].
- Héparine non-fractionnée (HNF): 70-100 UI/kg iv.
- Bivalirudine: bolus 0.75 mg/kg iv puis perfusion 1.75 mg/kg/h jusqu'à 4 heures après la PCI; préférence en cas de haut risque hémorragique, d'utilisation d'inhibiteurs GPIIb/IIIa ou de thrombocytopénie induite par l'héparine.
- Enoxaparine: 0.5 mg/kg iv, en cas de prétraitement par de l'enoxaparine sous-cutanée (1 mg/kg/12 h).
Les patients sous fondaparinux (2.5 mg/j scut) doivent recevoir un bolus d'HNF au moment de la PCI à cause du risque de thrombose sur le cathéter [2,60].
Il arrive que l’on doive combiner un traitement anticoagulant en cours pour une prothèse valvulaire, une fibrillation auriculaire (FA) ou un thrombus intraventriculaire avec une bithérapie antiplaquettaire justifiée par un récent événement coronarien. Il arrive aussi qu’une FA survienne au cours d’un SCA et impose une anticoagulation en sus des antiplaquettaires. Cette triple thérapie comporte évidemment un risque hémorragique accru; de ce fait, seul le clopidogrel entre en ligne de compte dans cette situation, le ticagrelor et le prasugrel étant trop hémorragipares. Les nouveaux anticoagulants oraux, prescrits à leur dosage minimal efficace, sont préférables aux agents antivitamine K (INR maintenu au maximum à 2.5) [53]. D'autre part, la triple thérapie est limitée: 1 mois dans les coronaropathies stables à haut risque hémorragique, 3 mois dans les SCA à à haut risque hémorragique et 6 mois dans les cas à bas risque hémorragique [71]. Dans les situations où le risque de pertes sanguines est élevé, il est probablement plus efficace d’omettre l’aspirine : le risque hémorragique est significativement diminué sans aspirine (HR 0.36), alors que le risque de thrombose coronarienne ne présente pas de différence significative [16]. Il semble donc possible de renoncer à l’aspirine chez les malades sous anticoagulants nécessitant un antiplaquettaire, tout au moins lorsque le risque hémorragique est élevé et lorsque le status coronarien est stable. Par ailleurs, l’addition d’une faible dose d’anticoagulant (rivaroxaban 2.5-5 mg 2x/j) à la bithérapie antiplaquettaire après un syndrome coronarien aigu permet de réduire le taux d’infarctus, d’AVC, de mortalité (HR 0.84) et de thrombose de stent (HR 0.68), mais au prix d’une augmentation du risque hémorragique, notamment de saignement intracrânien [43]. Celui-ci est diminué (OR 0.59) sans modification du risque thrombotique en associant une dose normale de rivaroxaban (15 mg/j) à une monothérapie par un seul agent inhibiteur P2Y12 [23]. L'addition de rivaroxaban (2.5 mg 2x/j) à l'aspirine diminue de 25% le taux de mortalité, d'infarctus et d'ictus par rapport à l'aspirine seule dans les coronaropathies stables [17]. Les nouveaux anticoagulants oraux sont probablement appelés à jouer un rôle de plus en plus important après revascularisation coronarienne ou dans l'ischémie stable; plusieurs études en cours explorent différentes combinaisons de ces agents.
Pontages aorto-coronariens
Le pontage aorto-coronarien (PAC) a pour but d'apporter un débit suffisant au-delà des sténoses de plus de 50% dans des vaisseaux jusqu'à 1 mm de diamètre. Il garantit un flux distal normal malgré la progression de la maladie dans la zone sténosée proximale. Les indications actuelles sont les suivantes (voir Tableau 9.12) [18,19,37,49,57,77].
- Coronaropathie tritronculaire sévère;
- Tronc commun ou IVA proximale avec anatomie complexe (score SYNTAX élevé);
- Anatomie impropre à la PCI;
- Coronaropathie étendue et dysfonction ventriculaire (FE < 35%) ou diabète;
- Revascularisation simultanée à une autre intervention chirurgicale cardiaque (remplacement ou plastie valvulaire, résection d’anévrysme, correction de CIV, etc).
La mortalité opératoire des PAC varie de 0.5 à 2% [27,52]; en cas d'angor instable, elle est de 4-15% [50]. Le risque d'infarctus postopératoire est 2-4% [5,27,52]. Entre 85 et 95% des patients deviennent asymptomatiques sans traitement médical, avec un taux de récidive de < 3% par an [27]. La perméabilité des pontages artériels est supérieure à celle des pontages veineux: à 10 ans, elle de 90-95% pour la mammaire interne, 90% pour la radiale et 25-50% pour la veine saphène [1,15,74]. Le pontage tout-artériel, qui utilise les deux artères mammaires et des greffons artériels libres, donne les meilleurs résultats à long terme [1,26,69,81]. Chez les diabétiques, les résultats des PAC sont meilleurs que ceux de la PCI [4,63,77].
En urgence, les PAC sont indiqués pour limiter la taille de l’infarctus et revasculariser la zone de pénombre si on peut procéder à la chirurgie dans les 4-6 heures après l’évènement ; au-delà, la chirurgie augmente l’hémorragie, l’oedème lésionnel et la mortalité (15-20%) ; il faut attendre 48-72 heures pour retrouver des conditions favorables, avec une mortalité de 4% [77]. Les indications principales aux PAC en urgence sont l’échec de la PCI, la persistance de l’angor malgré la reperméabilisation et la présence de complications qui sont le fait d'obstruction de vaisseaux terminaux non collatéralisés entraînant des infarctus transmuraux.
- Insuffisance mitrale aiguë par rupture de pilier ; plus fréquente sur le pilier postéro-médian qui n'est vascularisé que par la CD, alors que le pilier antéro-latéral est vascularisé par l'IVA et la CX. La rupture est le plus souvent partielle, car la rupture totale est rapidement léthale (voir Figure 9.23). Elle se traduit par la survenue d'un OAP dans les 4 à 7 jours après un infarctus. Comme l'OG est de compliance normale, les ondes "v" sont gigantesques sur la courbe de PAPO. La mortalité est de 20-50%, malgré un traitement pharmacologique intense (inotropes, vasodilatateurs artériels), une assistance ventriculaire (CPIA) et un remplacement chirurgical de la valve (une plastie est en général impossible). L'insuffisance mitrale ischémique peut aussi être due à une akinésie pariétale qui maintient un feuillet en dessous du plan de coaptation en systole (voir Figure 9.21) ; dans ce cas, l’IM est moins importante. Lorsqu'elle est sévère, le traitement est une plastie mitrale associée à des pontages aorto-coronariens.
- Rupture de paroi libre; en général sur la paroi antérieure ou latérale du VG, plus fréquente lors d'infarctus inaugural, associée à un infarctus étendu; la survie tient au fait que le péricarde couvre la lésion, mais la tamponnade est fréquente (voir Figure 9.24).
- Communication interventriculaire (CIV); de l'importance du shunt dépend le degré de détérioration hémodynamique; en cas de lésion antérieure, la CIV est plutôt apicale; en cas d'infarctus postérieur, elle touche le septum basal et est de plus mauvais pronostic (voir Figure 9.25).
- La résection des zones infarcies et la plastie de la paroi ventriculaire pour reconstruire une forme elliptoïde au VG n'ont pas donné les résultats escomptés; les résultats de cette chirurgie reconstructrice ne sont pas meilleurs que ceux des pontages simples [73].
Reperfusion
Après recanalisation par thrombolyse ou dilatation, la perfusion tissulaire peut rester suboptimale malgré la restauration du flux épicardique. Le score TIMI (Thrombolysis in myocardial infarction) décrit le degré de reperfusion observé à l’angiographie [22].
- TIMI degré 0 : pas de perfusion au-delà du lieu de l’occlusion.
- TIMI degré 1 : passage de contraste mais sans opacification complète du lit vasculaire distal.
- TIMI degré 2 : reperfusion partielle ; la progression du contraste est ralentie.
- TIMI degré 3 : reperfusion totale ; la vitesse de perfusion est identique en deçà et au-delà de la sténose.
Le phénomène de no-reflow indique un défaut de perfusion microvasculaire dans la zone ischémiée ; il est associé à un mauvais pronostic (voir Lésions de reperfusion) [59]. La perfusion microvasculaire est mieux préservée par angioplastie que par thrombolyse.
Traitement palliatif
Lorsqu'un patient présente un angor réfractaire au traitement médical et qu'il n'est pas (ou plus) candidat à une manoeuvre de revascularisation, on peut encore proposer des techniques palliatives dont le but est simplement d’améliorer les douleurs angineuses [67].
- Implantation d'une péridurale cervicale ou thoracique haute (D2-D3) avec perfusion continue de bupivacaïne; la rémission de l'angor est significative, immédiate, et dure de 7 jours à 3 ans [8].
- Implantation d'un stimulateur spinal au niveau C7-D1; le flux coronarien est augmenté de 11%, avec redistribution vers les zones ischémique [46] ; comparée au PAC dans une série de malades avec angor réfractaire, la stimulation électrique offre autant de rémission symptomatologique et une plus faible mortalité immédiate [39].
- Canalisation pariétale depuis la cavité ventriculaire par laser transmyocardique (voir Chapitre 10, Laser transmyocardique).
- La thérapie cellulaire régénérative (administration de cellules souches), encore en investigation, est une thérapeutique apparemment prometteuse. Les études cliniques conduites jusqu’ici en ont prouvé la faisabilité et la sécurité, mais les résultats restent encore modestes [29].
L’angiogenèse thérapeutique est une technique encore expérimentale qui consiste à injecter in situ du facteur de croissance fibroblastique ou endothélial et provoquer, par transfert génétique, le développement de collatérales entre la zone ischémiée et les zones vascularisées voisines. Dans les premières études, l'amélioration de la perfusion locale est de 23-50% à 4 semaines [80]. Pour l’instant, il n’est pas sûr que cette technique tienne ses promesses.
| Traitement interventionnel |
|
Indications classiques à l’angioplastie coronarienne (PCI) et pose de stents :
- Coronaropathie mono- ou bi-tronculaire
- Absence de lésion proximale complexe du tronc commun ou de l’IVA
- Configuration anatomique adéquate, vaisseaux de taille intermédiaire
- Score SYNTAX bas
- Fonction VG conservée
- Intervention en urgence (STEMI)
Indications aux pontages aorto-coronariens :
- Lésions tritronculaires avec IVA proximale ou tronc commun
- Coronaropathie sévère et diffuse, anatomie impropre à la PCI
- Score SYNTAX élevé
- Sténose non protégée du tronc commun ou de l’IVA proximale
- Dysfonction ventriculaire (FE < 0.35)
- Angor persistant malgré une thérapie maximale
- Diabète
- Revascularisation simultanée à une autre intervention chirurgicale cardiaque
Stents intracoronariens
- Stents métalliques simples (passifs ou BMS) : taux de resténose important
- Stents à élution (actifs ou DES) 1ère génération: taux de resténose moindre, mais risque de thrombose même à long terme (0.6%/an)
- DES 2ème et 3éme génération: endothélialisation rapide et risque de thrombose faible
- Aspirine (75-150 mg) à vie
- Double thérapie (aspirine + ticagrelor, prasugrel ou clopidogrel) pendant 4-6 semaines
(BMS), 3-6 mois (DES 2ème et 3éme génération), ou 12 mois (DES 1ère génération)
Le prolongement de la bithérapie au-delà de 12 mois peut être indiqué dans les stents à haut risque si le patient le tolère. Le risque thrombotique est diminué dans les situations très thrombogènes à long terme, mais le risque hémorragique est aggravé. Même programmé dans les règles, l'arrêt de la bithérapie entraine une phase de rebond de l'agrégabilité plaquettaire. Il est donc recommandé d'attendre quelques semaines entre la fin de la bithérapie et une intervention chirurgicale élective.
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- ALDEA GS, BAKAEEN FG, PAL J, et al. The Society of Thoracic Surgeons Clinical Practice Guidelines on arterial conduits for coronary artery bypass grafting. Ann Thorac Surg 2016; 101:801-9
- AMSTERDAM EA, WENGER NK, BRINDIS RG, et al. 2014 AHA/ACC Guideline for the management of patients with non-ST-elevation acute coronary syndromes. J Am Coll Cardiol 2014; 64:e139-228
- ARJOMAND H, TURI ZG, McCORMICK D, GOLDBERG S. Percutaneous coronary intervention: Historical, perspectives, current status, and future directions. Am Heart J 2003; 146:787-96
- ARMSTRONG EJ, RUTLEDGE JC, ROGERS JH. Coronary artery revascularization in patients with diabetes mellitus. Circulation 2013; 128:1675-85
- BARI Investigators. The Bypass Angioplasty Revascularization Investigation investigators. Seven-year outcome in the bypass angioplasty revascularization investigation by treatment and diabetes staus. J Am Coll Cardiol 2000; 35:1122-9
- BAVRY AA, KUMBHANI DJ, HELTON TJ, BHATT DL. Risk of thrombosis with the use of sirolimus-eluting stents for percutaneous coronary intervention (from registry and clinical trial data). Am J Cardiol 2005; 95:1469-72
- BITTL JA, BABER U, BRADLEY SM, et al. Duration of dual antiplatelet therapy: a systematic review for the 2016 ACC/AHA guideline focused update on duration of antiplatelet therapy in patients with coronary artery disease: a report of the ACC/AHA task force on clinical practice guidelines. J Am Coll Cardiol 2016; 68:1116-39
- BLOMBERG SG, SVORKDAL N. Thoracic epidural anesthesia for treatment of refractory angina pectoris. Bail Clin Anesthesiol 1999; 13:83-99
- BRODIE B, POKHAREL Y, FLEISHMAN N, et al. Very late stent thrombosis after primary percutaneous coronary intervention with bare-metal and drug-eluting stents for ST-segment elevation myocardial infarction. JACC Cardiovasc Interv 2011; 4:30-8
- BYRNE RA, KASTRATI A, MASSBERG S, et al. Biodegradable polymer versus permanent polymer drug-eluting stents and everolimus- versus sirolimus-eluting stents in patients with coronary artery disease : 3-year outcome from a randomized clinical trial. J Am Coll Cardiol 2011 ; 58 :1325-31
- COLOMBO A, GIANNINI F, BRIGUORI C. Should we still have bare-metal stents available in our catheterization laboratory ? J Am Coll Cardiol 2017; 70:607-19
- DANGAS GD, CAIXETA A, MEHRAN R, et al. Frequency and predictors of stent thrombosis after percutaneous coronary intervention in acute myocardial infarction. Circulation 2011; 123:1745-56
- D’ASCENZO F, BOLLATI M, CLEMENTI F, et al. Incidence and predictors of coronary stent thrombosis: Evidence from an international collaborative meta-analysis including 30 studies, 221’066 patients, and 4276 thromboses. Int J Cardiol 2013; 167: 575-84
- DE LUCA G, DIRKSEN MT, SPAULDING C, et al. Drug-eluting stents vs bare-metal stents in primary angioplasty. A pooled patient-level meta-analysis of randomized trials. Arch Intern Med 2012; 172:611-21
- DESAY ND, COHEN EA, NAYLOR CD et al. A randomized comparison of radial artery and saphenous vein coronary bypass grafts. N Engl J Med 2004; 351:2302-9
- DEWILDE WJM, JANSSEN PWA, VERHEUGT FWA, et al. Triple therapy for atrial fibrillation and percutaneous coronary intervention. J Am Coll Cardiol 2014 ; 64 :1270-80
- EIKELBOOM JW, CONNOLLY SJ, BOSCH J, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017; 377:1319-30
- FIHN SD, BLANKENSHIP JC, ALEXANDER KP, et al. 2014 ACC/AHA/AATS/PCNA/SCAI/STS focused update of the guidelines for the diagnosis and management of patients with stable ischemic heart disease. J Am Coll Cardiol 2014; 64:1929-49
- FIHN SD, GARDIN JM, ABRAMS J, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/ATA Guideline for the diagnosis and management of patients with stable ischemic heart disease. J Am Coll Cardiol 2012; 60:e44-e164
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GAGLIA MA, WAKSMAN R. Systematic review of thienopyridine discontinuation and its impact upon clinical outcomes. Eur Heart J 2011; 32:2358-64
- GIBSON CM, CANNON CP, DALEY WL, et al. TIMI frame count: A quantitative method assessing coronary artery flow. Circulation 1996; 93:879-95
- GIBSON CM, MEHRAN R, BODE C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375:2423-34
- GREWE PH, DENEKE T, MACHRAOUI A, et al. Acute and chronic tissue response to coronary stent implantation: Pathologic findings in human specimen. J Am Coll Cardiol 2000; 35:157-63
- GWON HC, HAHN JY, PARK KW, et al. Six-month versus 12-month dual antiplatelet therapy after implantation of drug-elunting stents (EXCELLENT study). Circulation 2012 ; 125 :505-13
- HALBERSMA WB, ARRIGONI SC, MECOZZI G, et al. Four-year outcome of OPCAB no-touch with total arterial Y-graft: making the best treatment a daily practice. Ann Thorac Surg 2009; 88:796-801
- HEAD SJ, MILOJEVIC M, TAGGART DP, PUSKAS JD. Current practice of state-of-the-art surgical coronary revascularization. Circulation 2017; 136:1331-45
- IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39:119-77
- IGLESIAS JF, TAPPONNIER M, HULLIN R, et al. Cellules souches en cardiologie: mythe ou réalité ? Forum Méd Suisse 2013; 13:358-62
- JEGER RV, PFISTERER ME, SEORENSEN R, et al. Tradeoff between bleeding and stent thrombosis in different dual antiplatelet therapy regimes: importance of case fatality rates and effective treatment durations. Am Heart J 2014; 168:698-705
- JONER M, FINN AV, FARB A, et al. Pathology of drug-eluting stents in humans. J Am Coll Cardiol 2006 ; 48 :193-202
- KIM BK, HONG MK, SHIN DH, et al. A new strategy for discontinuation of dual antiplatelet therapy. J Am Coll Cardiol 2012; 60:1340-8
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105: 743-9
- KOTANI J, AWATA M, NANTO S, et al. Incomplete neointimal coverage of Sirolimus-eluting stents. J Am Coll Cardiol 2006; 47:2108-11
- KOVACIC JC, LEE P, KARAJGIKAR R, et al. Safety of temporary and permanent suspension of antiplatelet therapy after drug eluting stent implantation in contemporary "real-world" practice. J Interven Cardiol 2012; 25:482-92
- LEVINE GN, BATES ER, BLANKENSHIP JC, et al. 2011 ACCF/AHA/SCAI Guideline for percutaneous coronary intervention: executive summary. Circulation 2011; 124:2574-609
- LEVINE GN, BATES ER, BITTL JA, et al. 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68:1082-115
- MAGALHAES MA, MINHA S, CHEN F, et al. Clinical presentation and outcomes of coronary in-stent restenosis across 3 stent generations. Circ Cardiovasc Interv 2014; 7:768:76
- MANNEHIMER C, ELIASSON T, AUGUSTINSSON LE, et al. Electrical stimulation versus coronary artery bypass surgery in severe angina pectoris. The ESBY study. Circulation 1998; 97:1157-63
- MARROQUIN OC, SELZER F, MULUKUTLA SR, et al. A comparison of bare-metal and drug-eluting stents for off-label indications. N Engl J Med 2008; 358:342-52
- MAURI L, HSIEH W, MASSARO JM, et al. Stent thrombosis in randomized clinical trials of drug-eluting stents. N Engl J Med 2007; 356:1020-9
- MAURI L, KEREIAKES DJ, YEH RW, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371:2155-66
- MEGA JL, BRAUNWALD E, WIVIOTT SD, et al. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366:9-19
- MEHRAN R, BABER U, STEG PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary interventions. PARIS: 2 years results from a prospective observational study. Lancet 2013; 382:1879-88
- MIYAZAKI Y, SUWANNASOM P, SOTOMI Y, et al. Single or dual antiplatelet therapy after PCI. Nat Rev Cardiol 2017; 14:294-303
- MOBILIA G, ZUIN G, ZANCO P, et al. Effect of spinal cord stimulation on regional myocardial blood flow in patients with refractory angina: A positron emission tomography study. G Ital Cardiol 1998; 29:1113-9
- MONTALESCOT G, BRIEGER D, DALBY AJ, et al. Duration of dual antiplatelet therapy after coronary stenting. J Am Coll Cardiol 2015; 66:832-47
- MONTALESCOT G, SABATINE MS. Oral dual antiplatelet therapy: what have we learnt from recent trials ? Eur Heart J 2016; 37:344-52
- MONTALESCOT G, SECHTEM U, ACHENBACH S, et al. 2013 ESC Guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34:2949-3003
- MORRISON DA, SEHTI G, SACKS J, et al. For the Investigators of the Department of Veterans Affairs Cooperative Study 385, the Angina With Extremely Serious Operative Mortality Evaluation (AWSOME). J Am Coll Cardiol 2001; 38:143-9
- MOSES JW, STONE GW, NIKOLSKY E, Mintz GS, et al. Drug-eluting stents in the treatment of intermediate lesions. Pooled analysis from four randomized trials. J Am Coll Cardiol 2006; 47: 2164-71
- NALYSNYK L, FAHRBACH K, REYNOLDS MW, ZHAO SZ, ROSS S. Adverse events in coronary artery bypass graft (CABG) trials: a systematic review and analysis. Heart 2003; 89:767-72
- NEUMANN FJ, SOUSA-UVA M, AHLSSON A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019; 40:87-165
- OTSUKA F, VORPAHI M, NAKANO M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation 2014; 129:211-23
- PALMERINI T, BIONDI-ZOCCAI G, DELLA RIVA D, et al. Stent thrombosis with drug-eluting and bare-metal stents: evidence from a comprehensive network analysis. Lancet 2012; 379.1393-402
- PALMERINI T, STONE GW. Optimal duration of dual antiplatelet therapy after drug-eluting stent implantation: conceptual evolution based on emerging evidence. Eur Heart J 2016; 37:353-64
- PICCOLO R, GIUSTINO G, MEHRAN R, WINDECKER S. Stable coronary artery disease: revascularisation and invasive strategies. Lancet 2015; 386:702-13
- RÄBER L, KELBAEK H, OSTOIJE M, et al. Effect of Biolimus-eluting stent with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction. JAMA 2012; 308:777-87
- REZKALLA SH, KLONER RA. No-reflow phenomenon. Circulation 2002; 105:606-11
- ROFFI M, PATRONO C, COLLET JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2016; 37:267-315
- SERRUYS PW, KUTRYK MJB, ONG ATL. Coronary artery stents. N Engl J Med 2006; 354:483-95
- SIDDIQI O, FAXON DP. Very late stent thrombosis: current concepts. Curr Opin Cardiol 2012; 27:634-41
- SILBER S, SERRUYS PW, LEON MB, et al. Clinical outcome of patients with and without diabetes mellitus and percutaneous coronary intervention with the resolute zotarolimus-eluting stent: 2-year results from the propectively pooled analysis of international global RESOLUTE program. JACC Cardiovasc Interv 2013; 6:357-68
- SPAULDING C, DAEMEN J, BOERSMA E, et al. A pooled analysis of data comparing sirolimus-eluting stents with bare-metal stents. N Engl J Med 2007 ; 356 :989-97
- STONE GW, MAEHARA A, LANSKY AJ, et al. A prospective netural-history study of coronary atherosclerosis. N Engl J Med 2011; 364:226-35
- STONE GW, RIZVI A, NEWMAN W, et al. Everolimus-eluting versus placlitaxel-eluting stents in coronary artery disease. N Engl J Med 2010; 362:1663-74
- SVORKDAL N. Treatment of inoperable coronary disease and refractory angina: spinal stimulators, epidurals, gene therapy, transmyocardial laser, and counterpulsation. Semin Cardiothorac Vasc Anesth 2004; 8:43-58
- TADA T, BYME RA, SIMUNOVIC I, et al. Risk of stent thrombosis among bare-metal stents, first-generation drug-elutng stents, and second-generation drug-eluting stents : results from a registry of 18'334 patients. JACC Cardiovasc Interv 2013 ; 6 :1267-74
- TAGGART DP, ALTMAN DG, GRAY AM, et al. Randomized trial to compare bilateral vs single internal mammary coronary artery bypass grafting: 1-year results of the Arterial Revascularization Trial (ART). Eur Heart J 2010; 31:2470-81
- TOYOTA T, MORIMOTO T; SHIOMI H, et al. Very late scaffold thrombosis of bioresorbable vascular scaffold: systematic review and meta-analysis. JACC Cardiovasc Interv 2017; 10:27-37
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39:213-54
- VALGIMIGLI M, CAMPO G, MONTI M, et al (PRODIGY Investigators). Short- versus long-term duration of dual antiplatelet therapy after coronary stenting: a randomized, multi-center trial. Circulation 2012; 125:2015-26
- VELAZQUEZ EJ, LEE KL, DEJA MA; et al. Coronary artery bypass surgery in patients with left ventricular dysfunction. N Engl J Med 2011; 364:1607-16
- WEISS AJ, ZHAO S, TIAN DH, et al. A meta-analysis comparing bilateral internal mammary artery with left internal mammary artery for coronary artery bypass grafting. Ann Cardiothorac Surg 2013; 2:390-400
- WIJNS W, KOHL P, DANCHIN N, et al. Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010; 31:2501-55
- WIN HK, CALDERA AF, MARESH K, et al. Clinical outcomes and stent thrombosis following off-label use of drug-eluting stents. JAMA 2007; 297:2001-9
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
- WINDECKER S, MEIER B. Late coronary stent thrombosis. Circulation 2007; 116:1952-65
- YEH RW, KEREIAKES DJ, STEG PG, et al. Benefits and risks of extended duration dual antiplatelet therapy after PCI in humans with and without acute myocardial infarction. J Am Coll Cardiol 2015; 65: 2211-21
- YUAN R, XIN Q, SHI W, et al. Vascular endothelial growth factor gene transfer therapy for coronary artery disease: a systematic review and meta-analysis. Cardiovasc Ther 2018; 36:e12461
- ZACHARIAS A, SCHWANN TA, RIORDAN CJ, et al. Late results of conventional versus all-arterial revascularization based on internal thoracic and radial artery grafting. Ann Thorac Surg 2009; 87:19-26.e2
