Les indications à la revascularisation carotidienne sont basées sur la prévention de l’accident vasculaire cérébral (AVC). Elles se fondent essentiellement sur quatre études randomisées qui ont démontré la supériorité du traitement chirurgical sur la prise en charge médicale simple.
- NASCET: réduction du risque d'AVC ipsilatéral dans les sténoses symptomatiques par rapport à la surveillance médicale (9% versus 26%) [33].
- ECST: réduction du risque d'AVC dans les sténoses symptomatiques par rapport à l'aspirine seule (2.8% versus 16%); la chirurgie est hautement bénéfique dans les sténoses serrées (> 70%), mais modérément utile dans les sténoses de 50-70% [14].
- ACAS: réduction du risque d'AVC et de mortalité par la thrombendartérectomie dans les sténoses asymptomatiques à 3 ans (5.1% versus 11%) [44].
- ACST: réduction du risque d'AVC et de mortalité par la thrombendartérectomie dans les sténoses asymptomatiques à 5 ans (6.4% versus 11.8%) [19].
Les indications au traitement invasif, qui varient sensiblement selon la technique choisie (thrombendartérectomie chirurgicale ou angioplastie et pose de stent), peuvent se résumer de la manière suivante (Figure 19.1) [3,7,24,31,37].
- Sténose serrée (70-99%) symptomatique (indication de classe I, degré d'évidence A).
- Sténose de 50-69% symptomatique si le risque chirurgical est faible à modéré (classe I, évidence B).
- Sténose asymptomatique de > 60% (angiographie) ou de > 70% (imagerie non-invasive) si le risque chirurgical est faible (classe IIa, évidence A).
- Sténose symptomatique de < 50% ou asymptomatique de < 60-70%: traitement médical seul (classe I, évidence A).
- Traitement médical optimal pour tous les patients: antiplaquettaire, statine, contrôle rigoureux de l'hypertension, modifications du style de vie (class I, évidence A).
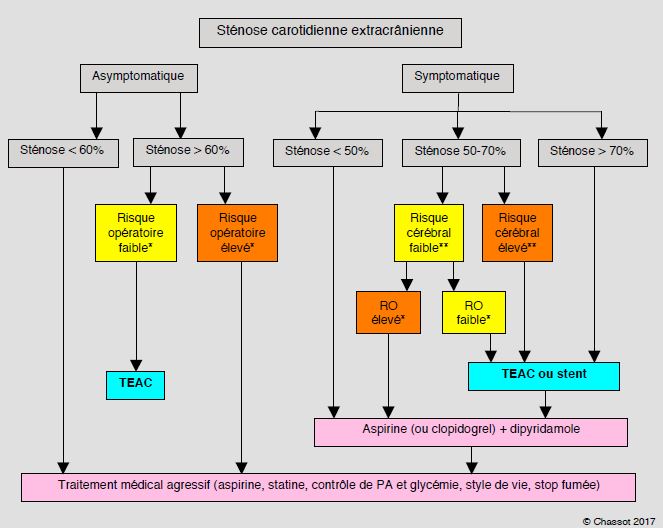
Figure 19.1: Algorithme de la prise en charge d'une sténose de la carotide interne extracrânienne. TEAC: thrombendartérectomie carotidienne. RO: risque opératoire. Risque opératoire élevé (*): âge > 75 ans, cardiopathie instable, comorbidités majeures, espérance de vie < 3 ans, risque combiné d'AVC, d'infarctus et de mortalité > 6% chez les malades symptomatiques et > 3% chez les malades asymptomatiques. Risque cérébral élevé (**): âge > 75 ans, sexe féminin, AVC < 3 mois, sténose intracrânienne, symptôme hémisphérique, plaque instable ou ulcérée [d'après réf 7].
Est considéré comme symptomatique un patient qui a présenté des symptômes neurologiques (AIT, AVC, amaurose) dans les 6 derniers mois. L'intervention devrait avoir lieu à 2 semaines de l'événement critique [3]. Une occlusion carotidienne chronique complète (sténose 100%) n'est pas une indication à la désobstruction. Le traitement conservateur actuel consiste en une série de mesures [3,37].
- Antiplaquettaire: aspirine (75-325 mg/j), ou clopidogrel (75 mg/j), ou combinaison aspirine + dipyridamole (25 mg + 200 mg 2x/j); le bénéfice de l'aspirine en prévention primaire pure n'est pas prouvé. La bithérapie (aspirine + clopidogrel) pendant 3 mois après un AVC non-hémorragique peut réduire le risque de récidive de 30% [45].
- Statine pour une valeur de LDL < 70 mg/dL. Diminution de 2-3 fois du risque d'AVC secondaire après un événement ischémique transitoire sur sténose carotidienne [30].
- Normalisation de la pression artérielle: béta-bloqueur, inhibiteur de l'enzyme de conversion, etc. Valeur visée: PAS < 140 mmHg (< 130 mmHg chez les diabétiques).
- Contrôle de la glycémie.
- Cessation de la fumée.
- Optimalisation du style de vie: exercice physique, alimentation, etc.
- Anticoagulation (INR 2.0-3.0): non recommandée pour les symptômes neurologiques; si elle est requise pour une autre raison (FA, par exemple), il est préférable d'éviter les antiplaquettaires.
- Ce traitement médical intense diminue le risque d'AVC à < 0.5%/an (au lieu de 2.0-2.5%) dans les sténoses asymptomatiques [8].
La revascularisation carotidienne étant une intervention prophylactique, il est important que ses risques soient inférieurs à ceux de l’accident dont elle est sensée protéger le patient. Elle ne prend son sens que si les risques d’AVC, d’infarctus et de décès périopératoires sont < 6% dans chez les patients symptomatiques et < 3% dans les cas asymptomatiques [3,42]. Ceci présuppose que les équipes chirurgicales, neuroradiologiques et anesthésiques assurent des performances élevées et maîtrisent parfaitement la technique qu'elles utilisent. Le gain de la revascularisation carotidienne porte essentiellement sur le long terme, raison pour laquelle l'espérance de vie doit être > 1 an chez les patients symptomatiques et de 3-5 ans au moins chez les malades asymptomatiques [37]. Pour les indications relatives de la thrombendartérectomie carotidienne (TEAC) chirurgicale et de l'angioplastie avec pose de stent, voir Chirurgie vs endoprothèse.
Patients symptomatiques
Dans les sténoses symptomatiques de > 70%, la désobstruction chirurgicale réduit le risque d'AVC ipsilatéral de 25% (sans intervention) à 2.5% en moyenne (0.5 à 3.7%) (réduction du risque de 4.8 fois à 5 ans) [14,16,33]. Dans cette catégorie, la chirurgie est trois fois plus efficace que le traitement médical [3,18,42]. Dans notre expérience de 1’310 TEAC en anesthésie loco-régionale au CHUV, la mortalité chez les malades symptomatiques est de 0.8%, et le taux de complications neurologiques de 3.2% (AVC: 1.8%, AIT 1.2%, convulsions 0.2%) ; le taux de séquelles neurologiques est 1.8% [41]. Les principaux facteurs de risque opératoire sont l’angor stade III-IV (OR 3.58) et la sténose carotidienne controlatérale de > 50% (OR 2.32) [20] ; les complications sont plus fréquentes chez les femmes [38]. Comme le risque de récidive d’un AVC est maximal pendant les premières semaines après celui-ci, l’intervention doit être réalisée dans les 1-2 semaines après l’accident cérébral, car le bénéfice de la chirurgie diminue si le délai s’accroît [3,4,42].
Patients sans symptômes
Chez les patients asymptomatiques, la chirurgie réduit le risque d’AVC à < 1% à 1 an, mais elle est bénéfique pour autant que le taux de complications postopératoires soit < 3%, la mortalité < 1% et l’âge du patient < 75 ans [6]. L'incidence d'AVC per- et postopératoires est maintenant inférieur à 3% dans toutes les grandes séries. Dans notre série du CHUV, elle est de 0.5% et la mortalité de 0% (Tableau 19.1) [41]. Il n’y a pas de différence significative dans le taux de complications neurologiques et vasculaires entre les hommes et les femmes asymptomatiques [25,39]. Un souffle carotidien asymptomatique est donc une indication chirurgicale si la sténose est > 60% ou instable, et si la morbi-mortalité opératoire de l'institution est < 3%. Ces données démontrent que la TEAC est une intervention utile et peu stressante, dont la mortalité et la morbidité sont nettement inférieures à celles des opérations vasculaires majeures [18].

Sténose carotidienne et coronarienne
L’association d’une sténose carotidienne et d’une coronaropathie est fréquente, car toutes deux relèvent de la vasculopathie systémique. Ainsi, le risque d'un d'infarctus myocardique dans la sténose asymptomatique est de 4.2% par an [12]. Le taux d'infarctus périopératoire, qui est de 10% en chirurgie vasculaire majeure, n'est que de 1.4-2.2% lors de chirurgie carotidienne [1,13]. Cette dernière peut donc être considérée comme une intervention de risque intermédiaire [5]. Il est possible que la technique d’anesthésie modifie l’incidence des lésions myocardiques. En effet, l’anesthésie loco-régionale (ALR) réduit leur prévalence, qui passe de 5.6% en anesthésie générale (AG) à 1.1% en ALR dans la base de donnée Cochrane et diminue de moitié en méta-analyse (OR 0.50) [36,43]; par contre, l’étude GALA révèle moins d'accidents cardiaques sous AG que sous ALR (0.2% versus 0.5%), mais leur incidence globale est exceptionnellement basse dans les deux groupes, ce qui obère les conclusions qu'on peut en tirer [26]. Au-delà du choix de la technique d'anesthésie, le déterminant le plus important est probablement l'hypotension artérielle, qui est plus fréquente sous anesthésie générale (AG). Dans la situation inverse, la prévalence d'AVC après PAC est de 2%, mais elle augmente à 6-10% en cas de sténose carotidienne symptomatique [10,32,35]. Toutefois, la présence d’une sténose carotidienne asymptomatique ne prédit pas forcément la mortalité ni le risque d’AVC après pontages aorto-coronariens [29].
La conjonction de maladie carotidienne et coronarienne pose la question d'une intervention combinée. L'incidence de complications coronariennes (infarctus) et carotidiennes (ictus) est un peu plus élevée dans les opérations simultanées (8%) que dans les interventions en deux temps (taux additionnés : 5%) [6,9,28]. La mortalité est de 2-3% en cas d'opérations simultanées, ce qui change peu par rapport à des interventions étagées, puisqu'elle est de 1-2% pour les PAC seuls et de < 1% pour la TEAC seule. Comme les risques additionnés de chaque intervention tendent à être inférieurs à ceux d’une intervention combinée, on procède en général à deux interventions étagées : habituellement, la TEAC est entreprise dans un premier temps, et les PAC 2-4 semaines plus tard [34]. La combinaison de TEAC suivie de pontages à coeur battant (OPCAB) paraît ramener le taux d'AVC à 1% seulement [34]. En cas d’instabilité, le syndrome le plus instable est opéré en premier lieu. Si une intervention simultanée est nécessaire, il est préférable de procéder d'abord à la TEAC et, en l'absence de troubles neurologiques, de suivre ensuite avec les PAC [22,27]. La TEAC peut parfaitement se dérouler sous anesthésie loco-régionale.
Le risque d’AVC étant d’autant plus grand que la sténose est plus serrée, on tend à ne considérer comme indication à une TEAC préopératoire que des sténoses symptomatiques de > 80%, ou des sténoses bilatérales dont la somme est ≥ 160%, mais non les sténoses asymptomatiques à bas risque [11,28]. Comme environ 50% des patients qui souffrent d’ictus après des PAC n’ont pas de pathologie carotidienne et comme jusqu’à 60% des lésions neurologiques après chirurgie cardiaque sont de nature embolique et non ischémique, on peut estimer que la TEAC prophylactique avant des PAC n’aura d’effet préventif que sur 40% des AVC postopératoires [11].
Sténose carotidienne et chirurgie cardiaque
La présence d’un souffle carotidien doit toujours inciter à en rechercher l’importance et la cause. Une sténose carotidienne de plus de 50% est présente chez le quart des malades porteurs de vasculopathie artérielle ou de coronaropathie. Lorsqu’il existe une anamnèse d’AVC, le risque d’accident neurologique est de 25% la première année et de 12% par an par la suite ; il descend à 2%/an en cas d’AIT ou d’amaurose fugace [40]. Pour la chirurgie cardiaque, ce risque impose d’investiguer tous les malades avec un souffle ou une anamnèse, ainsi que tous les patients de plus de 65 ans symptomatiques ou non. La première étape d’investigation est un scan-Duplex, qui combine un examen bidimensionnel et un examen du flux sanguin (Doppler) ; en cas de lésion présentant une indication chirurgicale, il est complété au besoin par une angio-IRM, un angio-CT ou une angiographie carotidienne.
Chez les malades porteurs d'une sténose de > 70% et une anamnèse neurologique dans les 6 derniers mois, il est indiqué de procéder à une thrombendartérectomie carotidienne (TEAC) avant une opération de chirurgie cardiaque pour les raisons suivantes [3,14,16,23,33,34,42].
- Chez les patients symptomatiques, la TEAC réduit le risque d'AVC ipsilatéral de 12%/an (sans intervention) à 2.5% (avec opération) ; la mortalité opératoire est inférieure à 1%.
- Chez les patients asymptomatiques, le taux d’AVC post-TEAC n’est que de 0.5-2%.
- En chirurgie cardiaque, l’incidence d’AVC postopératoire passe de 2% en moyenne à 6-10% en cas de lésion carotidienne associée.
- Le risque d'un d'infarctus myocardique périopératoire lors de TEAC n'est que de 1.8%.
Ces données démontrent que la TEAC est une intervention bénigne dont la mortalité et la morbidité sont très basses. Toutefois, l'indication à la thrombendarctérectomie avant la chirurgie cardiaque n'est pas bien établie chez les malades asymptomatiques [3]. L'angioplastie avec pose de stent n'est pas une alternative en préopératoire, parce qu'elle est obligatoirement suivie d'une bithérapie antiplaquettaire (aspirine + clopidogrel) pendant 1-3 mois.
Chirurgie après un AVC
En chirurgie générale, une anamnèse d'AVC survenu moins de 6 semaines avant une intervention chirurgicale est associée à un risque d’accident cérébral de 3-4%, ce qui représente une augmentation de 20 fois par rapport au risque dans une population standard (0.2%) [15]. Après un AVC, l'autorégulation vasculaire cérébrale est affectée pendant environ 2 semaines. Il est donc recommandé d’attendre au minimum 4 semaines après un AVC symptomatique ou hémorragique pour procéder à une intervention vitale ; un délai de trois mois est préférable pour une intervention élective [2,17,21].
| Indications opératoires |
|
Les indications à la thrombendartérectomie carotidienne (TEAC) sont :
- Sténose serrée symptomatique (> 70%)
- Sténose modérée symptomatique (50-70%) si le risque chirurgical est faible à modéré
- Sténose asymptomatique (> 70%) si le risque chirurgical est faible
- Traitement médical impératif pour tous les patients: antiplaquettaire, statine, antihypertenseur, contrôle de la glycémie, modification du style de vie
Délai recommandé entre l'AVC et la TEAC: 2 semaines
Délai pour la chirurgie non-cardiaque après un AVC
- Opération vitale : 4 semaines
- Opération élective : 3 mois
En cas de sténose carotidienne + coronarienne combinée, il est préférable de procéder d’abord à la TEAC et ensuite aux PAC (délai 2-4 semaines)
|
© CHASSOT PG, Décembre 2010, dernière mise à jour, Décembre 2017
Références
- ASSADIAN A, SENEKOWITSCH C, ASSADIAN O, et al. Perioperative morbidity and mortality of carotid artery surgery under loco-regional anaeshtesia. Vasa 2005; 34:41-5
- BLACKER DJ, FLEMMING KD, LINK MJ, et al. The preoperative cerebrovascular consultation: common cerebrovascular questions before general or cardiac surgery. Mayo Clin Proc 2004; 79:223-9
- BROTT TG, HALPERIN JL, ABBARA S, et al. 2011 ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS Guideline on the management of patients with extracranial carotid and vertebral artery disease. Circulation 2011; 124:e54-e130
- BROWN MM, EDERLE J, BONATI LH, et al. Safety results of the International Carotid Stenting Study (ICSS): early outcome of patients randomised between stenting and endarterectomy for symptomatic carotid stenosis. Cerebrovasc Dis 2009; 27(suppl 6):10
- CHASSOT PG, DELABAYS A, SPAHN DR. Preoperative evaluation of patients with, or at risk of, coronary artery disease undergoing non-cardiac surgery. Brit J Anaesth 2002; 89:747-59
- CHATURVEDI S, BRUNO A, FEASBY T, et al. Carotid endarterectomy – an evidence based review: Report of the Therapeutics and technology assessment subcommittee of the American Academy of Neurology. Neurology 2005; 65:794-801
- CHATURVEDI S, SACCO RL. How recent data have impacted the treatment of internal carotid artery stenosis. J Am Coll Cardiol 2015; 65:1134-43
- CHIMOWITZ MI, LYNN MJ, DERDEYN CP, et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis. N Engl J Med 2011; 365:993-1003
- CYWINSKI JB, KOCH CG, KRAJEWSKI LP, et al. Increased risk associated with combined carotid endarterectomy and coronary artery bypass graft surgery: A propensity-matched comparison with isolated coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth 2006; 20:796-802
- DAS SK, BROW TD, PEPPER J. Continuing controversy in the management of concomitant coronary and carotid disease: An overview. Int J Cardiol 2000; 74: 47-65
- DELLAGRAMMATICAS D, GOUGH MJ. Management of concommittant carotid and coronary disease. In: HOWELL S, et al, eds. Heart disease and the surgical patient. New York:Informa Healthcare, 2007, 293-303
- DIVYA KP, SANDEEP N, SARMA A, et al. Risk of stroke and cardiac events in medically treated asymptomatic carotid stenosis. J Stroke Cerebrovasc Dis 2015; 24:2149-53
- EAGLE KA, RIHAL CS, MICKEL MC, et al. Cardiac risk of non-cardiac surgery: influence of coronary disease and type of surgery in 3,368 operations. Circulation 1997; 96:1882-7
- ECST: European Carotid Surgery Trialist's Collaborative Group – Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial. Lancet 1998; 351:1379-87
- EVANS BA, WIJDICKS EF. High-grade carotid stenosis detected before general surgery: is endarterectomy indicated ? Neurology 2001; 57:1328-30
- FERGUSON GG, ELIASZIW M, BARR HW, et al. The North American Symptomatic Carotid Endarterectomy Trial (NASCET): surgical results in 1415 patients. Stroke 1999; 30:1751-8
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GUAY J, OCHROCH EA. Carotid endarterectomy plus medical therapy or medical therapy alone for carotid arterx stenosis in symptomatic or asymptomatic patients: a meta-analysis. . J Cardiothorac Vasc Anesth 2012; 26:835-44
- HALLIDAY A, MANSFIELD A, MARCO J, et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurologiocal symptoms: randomized controlled trial. Lancet 2004; 363:1491-502
- HALM EA, HANNAN EL, ROJAS M, et al. Clinical and operative predictors of outcomes of carotid endarterectomy. J Vasc Surg 2005; 42:420-8
- HOWELL SJ. Carotid endarterectomy. Br J Anaesth 2007; 99:119-31
- HUSSAIN MA, VERMA S, GUPTA N et al. Carotid artery revascularization. What's best strategy ? Circulation 2015; 131:2226-31
- ILLUMINATI G, RICCO JB, CALIO F, et al. Short-term results of a randomized trial examining timing of carotid endarterectomy in patients with severe asymptomatic unilateral stenosis undergoing coronary artery bypass grafting. J Vasc Surg 2011; 54:993-9
- KERNAN WN, OBVIAGELE B, BLACK HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014; 45:2160-236
- LEE JW, POMPOSELLI F, PARK KW. Association of sex with perioperative mortality and morbidity after carotid endarterectomy for asymoptomatic carotid stenosis. J Cardiothorac Vasc Anesth 2003; 17:10-16
- LEWIS SC, WARLOW CP, BODENHAM AR, et al. General anaesthesia versus local anaesthesia for carotid surgery (GALA): a multicentre, randomised controlled trial. Lancet 2008; 372:2132-42
- MADI-JEBARA S, YAZIGI A, SLEILATY G, et al. Staged anesthesia for combined carotid and coronary artery revascularization: A different approach. J Cardiothorac Vasc Anesth 2006; 20:803-6
- MAHARAJ R. A review of recent developments in the management of carotid artery stenosis. J Cardiothorac Vasc Anesth 2008; 22:277-89
- MAHMOUDI M, HILL PC, XUE Z, et al. Patients with severe asymptomatic carotid artery stenosis do not have a higher risk of stroke and mortality after coronary artery bypass surgery. Stroke 2011; 42:2801-5
- MERWICK A, ALBERS GW, ARSAVA EM, et al. Reduction in early stroke risk in carotid stenosis with transient ischemic attack associated with statin treatment. Stroke 2013; 44:2814-20
- MESCHIA JF, BUSHNELL C, BODEN-ALBALA B, et al. Guidelines for the primary prevention of stroke: a statement for healthcare professionals form the American Heart Association/American Stroke Association. Stroke 2014; 45:3754-832
- NALYSNYK L, FAHRBACH K, REYNOLDS MW, ZHAO SZ, ROSS S. Adverse events in coronary artery bypass graft (CABG) trials: a systematic review and analysis. Heart 2003; 89:767-72
- NASCET: North American Symptomatic Carotid Endarterectomy Trial Collaborators - Beneficial effect of carotid endarterectomy in symptomatic patients with high grade carotid stenosis. N Engl J Med 1991; 325:445-53
- NAYLOR AR, CUFFE R, TORHWELL PM, et al. A systematic review of outcomes following synchronous carotid endarterectomy and coronary artery bypass: Influence of surgical and patient variables. Eur J Vasc Endovasc Surg 2003; 26:230-41
- NAYLOR AR, MEHTA Z, ROTHWELL PM, et al. Stroke during coronary artery bypass surgery: A critical review of the role of carotid artery disease. Eur J Vasc Endovasc Surg 2002; 23:283-94
- RERKASEM K, BOND R, ROTHWELL PM. Local versus general anaesthesia for carotid endarterectomy. Cochrane Database Syst Rev 2004; (2):CD000126
- RICOTTA JJ, ABURHAMA A, ASCHER E, et al. Updated Society for Vascular Surgery guidelines for management of extracranial carotid disease. J Vasc Surg 2011; 54:e1-e31
- RINGLEB PA, ALLENBERG J, BRUCKMANN H, et al. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomized noninferiority trial. Lancet 2006; 368:1239-47
- ROCKMAN CB, CASTILLO J, ADELMAN MA, et al. Carotid endartectomy in female patients: are the concerns of the asymptomatic carotid atherosclerosis study valid ? J Vasc Surg 2001; 33:236-41
- ROGER VL, GO AS, LLOYD-JONES DL, et al. Heart disease and stroke statistics – 2011 update: a report from the American Heart Association. Circulation 2011; 123:e18-e209
- RUCHAT P. Statistiques concernant les thrombendarterectomies carotidiennes au CHUV. Données non publiées. Décembre 2009
- SACCO RL, ADAMS R, ALBERS G et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. Stroke 2006; 37:577-617
- UNIC-STOJANOVIC D, BABIC S, NESKOVIC V. General versus regional anesthesia for carotid endarterectomy. J Cardiothorac Vasc Anesth 2013; 27:1379-83
- WALKER MD, MARLER JR, GOLDSTEIN M, et al. Endarterectomy for asymptomatic carotid artery stenosis. Executive committee for Asymptomatic Carotid Artery Stenosis study (ACAS). JAMA 1995; 273:1421-8
- WONG KS, WANG Y, LENG X, et al. Early dual versus mono antiplatelet therapy for acute noncardioembolic ischemic stroke or transient ischemic attack: an updated systematic review and meta-analysis. Circulation 2013; 128:1656-66
