Le Doppler tissulaire (DT) et le speckle-tracking (ST) sont des techniques de quantification de la déformation myocardique au cours du cycle cardiaque. Elles consistent à observer les mouvements d'un segment isolé au sein du myocarde, en général d'une longueur voisine de 10 mm. La déformation linéaire (strain ε) de ce segment est traduite par la formule: ε = (L – L0) / L0 (en %), où L est la longueur finale et L0 la longueur de base du segment observé. La déformation a lieu selon quatre axes: longitudinal (en vues long-axe du VG), radial, circonférentiel (en vue court-axe du VG) et rotationnel [7]. La déformation longitudinale est mesurée parallèlement à l'endocarde, alors que la déformation radiale est perpendiculaire à ce dernier. La déformation circonférentielle (contraction concentrique) et la rotation du ventricule sur lui-même sont moins utilisées en clinique [35]. Un allongement (diastole) est une déformation positive, un raccourcissement (systole) est une déformation négative. La déformation systolique longitudinale est donc négative, alors que l'épaississement (déformation radiale) a une valeur positive [27]. La déformation est plus importante au niveau endocardique et à l'apex qu'au niveau épicardique et à la base [1].
Les systèmes cliniques sont basés habituellement sur le principe de la déformation de Lagrange, dans laquelle toutes les mesures sont rapportées à la même longueur de base L0 (Figure 25.27). La déformation dite naturelle (déformation de Euler) se réfère à un système dans lequel la longueur de référence se modifie au fur et à mesure que l'objet se déforme; ce système décrit donc le changement instantané de longueur et représente la dérivée première de la déformation par rapport au temps [35].
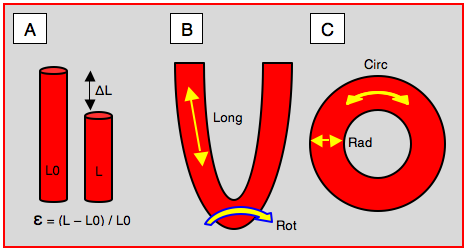
Figure 25.27 : Déformation tissulaire (strain). A: illustration de la déformation systolique; le segment se raccourcit (ΔL) à la longueur L à partir de la longueur de base L0: ε = (L – L0) / L0 (en %). B: déformation longitudinale (Long) et rotationnelle (Rot) en long-axe du ventricule. C: déformation radiaire (Rad) et circonférentielle (Circ) en court-axe du ventricule.
En la rapportant à l'unité de temps, on définit la vitesse de cette déformation, ou strain rate (SR): SR = ε / Δt (en sec-1). Cette dernière mesure traduit la rapidité des mouvements locaux du myocarde. Elle est un bon indice de la performance systolique. Elle présente l’avantage de ne pas dépendre de la définition souvent difficile de l’endocarde et de l’épicarde, ni des mouvements de rotation ou de translation de la paroi cardiaque puisqu’on observe la déformation d’un segment par rapport à lui-même. On dispose donc de trois types de courbe exprimant la déformation tissulaire en fonction du temps au cours d'un cycle cardiaque (Figure 25.28) [7,12,22].
Les systèmes cliniques sont basés habituellement sur le principe de la déformation de Lagrange, dans laquelle toutes les mesures sont rapportées à la même longueur de base L0 (Figure 25.27). La déformation dite naturelle (déformation de Euler) se réfère à un système dans lequel la longueur de référence se modifie au fur et à mesure que l'objet se déforme; ce système décrit donc le changement instantané de longueur et représente la dérivée première de la déformation par rapport au temps [35].

Figure 25.27 : Déformation tissulaire (strain). A: illustration de la déformation systolique; le segment se raccourcit (ΔL) à la longueur L à partir de la longueur de base L0: ε = (L – L0) / L0 (en %). B: déformation longitudinale (Long) et rotationnelle (Rot) en long-axe du ventricule. C: déformation radiaire (Rad) et circonférentielle (Circ) en court-axe du ventricule.
En la rapportant à l'unité de temps, on définit la vitesse de cette déformation, ou strain rate (SR): SR = ε / Δt (en sec-1). Cette dernière mesure traduit la rapidité des mouvements locaux du myocarde. Elle est un bon indice de la performance systolique. Elle présente l’avantage de ne pas dépendre de la définition souvent difficile de l’endocarde et de l’épicarde, ni des mouvements de rotation ou de translation de la paroi cardiaque puisqu’on observe la déformation d’un segment par rapport à lui-même. On dispose donc de trois types de courbe exprimant la déformation tissulaire en fonction du temps au cours d'un cycle cardiaque (Figure 25.28) [7,12,22].
- Vélocité de déplacement d'une structure au Doppler tissulaire (moyenne normale 10-12 cm/s).
- Déformation du tissu en fonction de sa longueur initiale (strain); valeurs normales pour le VG: déformation longitudinale 20%, circonférentielle 23%, radiale 45%; valeurs normales pour le VD: déformation longitudinale 29%.
- Vitesse de la déformation (strain rate; moyenne normale 1.1 - 1.5 s-1).
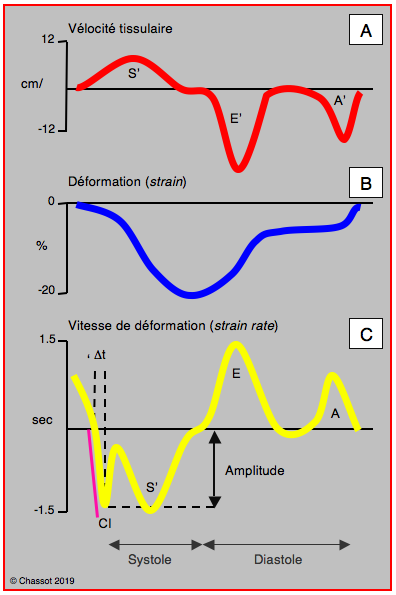
Figure 25.28 : Déformation tissulaire. A: vélocité de déplacement du tissu myocardique dans le VG au cours d'un cycle cardiaque; la Vmax est de 10-12 cm/s (voir aussi Figure 25.29B). B: déformation tissulaire (strain); la systole est une déformation négative (raccourcissement) et la diastole une déformation positive. C: vitesse de la déformation (strain rate); elle varie avec les phases du cycle cardiaque. CI: contraction isovolumétrique. S': systole mécanique. E': relaxation protodiastolique. A': contraction auticulaire. Le trait violet représente l'accélération de la contraction isovolumétrique (Vmax/Δt). Δt: durée de la CI. Amplitude: valeur de la Vmax de la CI [12].
La structure myocardique présente quatre mouvements différents au cours d’un cycle cardiaque.
- Bref mouvement lors de la contraction isovolumétrique.
- Contraction de la phase d’éjection (S', 8-12 cm/s).
- Mouvement protodiastolique (E’, 8-15 cm/s) simultané et en sens inverse du flux diastolique transmitral E ; il représente la relaxation active du myocarde.
- Mouvement télédiastolique (A’, 5-10 cm/s) simultané et en sens inverse du flux diastolique transmitral A ; il est lié à la contraction auriculaire.
Doppler tissulaire (DT)
Toute structure en mouvement provoque un effet Doppler. La vélocité du sang dans le cœur normal est de l'ordre de 0.5 à 1.0 m/s, mais son échogénicité est faible. Les parois myocardiques, au contraire, ont une forte échogénicité (> 20 dB) mais des déplacements beaucoup plus lents, en moyenne de 0.5 à 15 cm/s. Lorsqu'on examine les vélocités sanguines, un système de filtres élimine les basses vélocités et les fortes amplitudes de l’écho des tissus. En inversant ces filtres, on peut examiner sélectivement les déplacements du myocarde et des valves en excluant ceux du sang (Vidéo).
C’est le Doppler tissulaire (DT), qui s'affiche sous forme de tracé spectral ou d'image-couleur. Comme tout Doppler, le DT observe des décalages de phase dans la fréquence des ondes d’écho et non des variations d’amplitude. Il n’est possible que sur des mouvements qui sont dans l’axe des ultrasons, et dépend de l’angle entre le déplacement observé et l’axe d'analyse; celui-ci doit rester < 20° [3]. En vue 4-cavités, on visualise de cette manière la contraction-relaxation longitudinale du ventricule gauche.
Vidéo: Doppler tissulaire du septum interventriculaire et de la paroi du VD; le mouvement des parois myocardiques est coloré en bleu lorsque celle-ci s'éloigne du transducteur oesophagien (systole) et en orange lorsqu'elle s'en rapproche (diastole).
Comme le Doppler mesure des vélocités, le Doppler tissulaire calcule directement la vitesse de déformation (SR, strain rate) et en déduit la déformation (strain) par intégration par rapport au temps (Figure 25.29A) [6].
Strain rate: SR = (V2 – V1) / (L – L0) = ΔV / ΔL (s-1)
Strain: ε = ∫t SR
où: V1 et V2 sont les vélocités des 2 extrémités du segment L0.
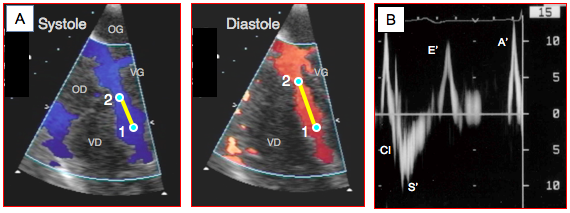
Figure 25.29 : Doppler tissulaire (DT). A : affichage couleur des mouvements du septum interventriculaire en vue 4-cavités 0°. La descente de l'anneau mitral en systole se traduit par une vélocité de déplacement longitudinal illustrée par une coloration bleue (éloignement du capteur); le mouvement inverse a lieu en diastole (couleur rouge). Le DT mesure la vélocité des deux points situés à l'extrémité du segment sélectionné (V1 et V2). B : affichage Doppler spectral de la vélocité du mouvement de l’anneau mitral (échelle de vélocité 15 cm/s). CI : contraction isovolumétrique. S' : éjection systolique (descente de l’anneau mitral dû à la contraction longitudinale), Vmax 10-15 cm/s. CI: contraction isovolumétrique. E’ : mouvement de l’anneau mitral en relation avec la relaxation protodiastolique. A’ : mouvement de l’anneau mitral en relation avec la contraction auriculaire.
L'enregistrement du mouvement tissulaire doit se faire dans l'axe du déplacement avec une acquisition à haute fréquence (≥ 100 images/s) en rétrécissant au maximum la zone d'intérêt (environ 10 mm) pour favoriser une cadence d'image élevée [3]. En ETO, la déformation longitudinale est mesurée en vues mi-oesophagiennes rétrocardiaques selon le long-axe du VG, sur les parois qui présentent le meilleur alignement avec l'axe Doppler (4-cavités 0°, 2-cavités 60-90° ou long-axe 120°). La déformation radiale n'est mesurable qu'en vue transgastrique court-axe dans les parois inférieure et antérieure. Les valeurs considérées comme normales pour le VG sont de - 20% ± 2% en longitudinal et de 35-45% en radial (mesures transthoraciques chez des sujets en respiration spontanée). Pour le ventricule droit, la déformation longitudinale est de - 29% ± 4.5% (paroi libre); cette valeur largement supérieure à celle du VG est due à la grande compliance du VD et à sa faible postcharge [7,18].
Plus simplement, l’affichage spectral du DT pulsé permet d’examiner la vélocité de déplacement de l’anneau mitral ou de la musculature longitudinale (sous-endocardique) de la paroi latérale, de la paroi antérieure ou du septum interventriculaire (Figure 25.29B). Après réglage de la machine sur la fonction Doppler tissulaire (DT) et sur une émission de basse fréquence (≤ 4 MHz), la fenêtre du Doppler pulsé est ajustée au niveau de l’anneau mitral avec une ouverture de 5-10 mm ; l’échelle des vélocités est de 15-20 cm/s. L’axe du Doppler est positionné aussi parallèle que possible au déplacement mitral, parfois en modifiant légèrement l’angle du capteur. Les vélocités de l'anneau mitral sont diminuées en cas de dysfonction ventriculaire ou d’ischémie. Elles sont bien corrélées à la fraction d’éjection et au dP/dt intraventriculaire [33]. Elles permettent d'objectiver la désynchronisation des différents segments du VG dans la dilatation du ventricule ou les altérations de la cinétique segmentaire dans l'ischémie myocardique; à cet effet, le VG est divisé en 3 segments longitudinaux et 6 segments circulaires (Figure 25.30) [34].

Figure 25.30 : Doppler tissulaire en cas d'ischémie myocardique. En vue 4-cavités, le septum interventriculaire est divisé en 3 segments (proximal, médian et apical). La vélocité de chacun de ces segments est calculée séparément et la déformation affichée en parallèle. Dans cette illustration, on voit que la contractilité basale est normale, alors que les parties médiane et apicale sont hypokinétiques. S' : déformation de l'éjection systolique. FVA: fermeture de la valve aortique. OVA: ouverture de la valve aortique.
La simple mesure de la vélocité du déplacement de l'anneau mitral (vues 4-cavités ou 2-cavités) ou de l'anneau tricuspidien (TAPSE, vue transgastrique VD 100-120°) au Doppler pulsé fait partie de l'examen standard de la fonction ventriculaire; elle est effectuée en temps réel. Par contre, l'analyse segmentaire du Doppler tissulaire (strain et strain rate) est réalisée en différé sur des boucles enregistrées avec une cadence d'image élevée (> 100 images/s).
Speckle-tracking (ST)
L’hétérogénéité des échos du myocarde permet d’isoler de petites tachetures de 20-40 pixels, appelées speckles, présentant une configuration particulière dans leur réflexion des ultrasons qui ne se modifie pas au cours du cycle cardiaque. Elles fonctionnent comme marqueurs tissulaires. Au moyen d’algorithmes de reconnaissance de forme, le processeur peut suivre les déplacements de ces marqueurs acoustiques naturels les uns par rapport aux autres; c’est le speckle-tracking (ST) (Vidéos et Figure 25.31A) [19].
Vidéo: vue court-axe du VG en speckle-tracking; la couleur du bleu au rouge traduit l'intensité de la déformation systolo-diastolique. On voit l'inhomogénéité de la contraction et le mouvement de rotation du VG.
Vidéo: vue long-axe du VG en speckle-tracking; chaque paroi est divisée en 3 segments dont le degré de contraction est évalué de manière indépendante. Cette technique permet une appréciation fine et quantitative de la contractilité segmentaire en cas d'ischémie myocardique.
En traçant plusieurs d’entre eux, l’ordinateur peut évaluer en continu la distance qui les sépare et la déformation du segment de tissu observé [21]. Comme précédemment, la technique permet le calcul de la déformation myocardique (strain et strain rate) longitudinale, radiale, circonférentielle et rotationelle (torsion) [10].
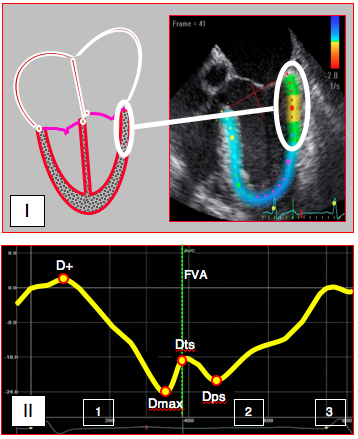
Figure 25.31 A : Technologie du speckle-tracking. I: L’inhomogénéité de la structure myocardique permet de suivre les déplacements de petits granules de 20-40 pixels (speckle) présentant une configuration stable au moyen d’algorithmes de reconnaissance de forme ; ces zones se modifiant peu entre la systole et la diastole, on peut les marquer (points de couleur) et quantifier ainsi la cinétique tissulaire indépendamment des mouvements de translation et de rotation du ventricule. Contrairement au Doppler tissulaire, le speckle-tracking est indépendant de l’angle existant entre l’axe du mouvement et celui des ultrasons. II: courbe de déformation (strain) longitudinale au cours du cycle cardiaque (schéma) [35]. Après un léger étirement pendant la contraction isovolumétrique (D+), la paroi se raccourcit (déformation négative) jusqu'au pic de déformation systolique Dmax (peak systolic strain); la déformation télésystolique (Dts) est enregistrée à la fermeture de la valve aortique (FVA). La déformation post-systolique (Dps) ne se rencontre que dans l'ischémie aiguë, dont elle est typique. La déformation devient positive lorsque la paroi s'allonge en diastole. 1: contraction systolique. 2: relaxation. 3: contraction auriculaire. FVA: fermeture de la valve aortique.
Par rapport au Doppler tissulaire, l’avantage de cette technique est de ne pas dépendre de l’angle d’observation entre la direction du déplacement et l’axe des ultrasons, puisqu'elle analyse le déplacement relatif des speckles à l'intérieur d'un certain segment de myocarde. De plus, elle est fiable en cas d'ischémie, car elle n'est pas sujette au faux mouvement local induit par la translation du cœur ou la traction des éléments voisins. La déformation longitudinale est l'indice le plus employé en clinique, car elle correspond à la contraction-relaxation de la zone sous-endocardique qui est la plus sensible à l'ischémie et à la surpression.
Les meilleurs résultats sont obtenus avec une acquisition semi-automatique des trois vues mi-oesophagiennes 4-cavités (0°), 2-cavités (60-90°) et long-axe (120°) en respectant un certain nombre de prérequis [1,5,24,29,35].
Toute structure en mouvement provoque un effet Doppler. La vélocité du sang dans le cœur normal est de l'ordre de 0.5 à 1.0 m/s, mais son échogénicité est faible. Les parois myocardiques, au contraire, ont une forte échogénicité (> 20 dB) mais des déplacements beaucoup plus lents, en moyenne de 0.5 à 15 cm/s. Lorsqu'on examine les vélocités sanguines, un système de filtres élimine les basses vélocités et les fortes amplitudes de l’écho des tissus. En inversant ces filtres, on peut examiner sélectivement les déplacements du myocarde et des valves en excluant ceux du sang (Vidéo).
C’est le Doppler tissulaire (DT), qui s'affiche sous forme de tracé spectral ou d'image-couleur. Comme tout Doppler, le DT observe des décalages de phase dans la fréquence des ondes d’écho et non des variations d’amplitude. Il n’est possible que sur des mouvements qui sont dans l’axe des ultrasons, et dépend de l’angle entre le déplacement observé et l’axe d'analyse; celui-ci doit rester < 20° [3]. En vue 4-cavités, on visualise de cette manière la contraction-relaxation longitudinale du ventricule gauche.
Vidéo: Doppler tissulaire du septum interventriculaire et de la paroi du VD; le mouvement des parois myocardiques est coloré en bleu lorsque celle-ci s'éloigne du transducteur oesophagien (systole) et en orange lorsqu'elle s'en rapproche (diastole).
Comme le Doppler mesure des vélocités, le Doppler tissulaire calcule directement la vitesse de déformation (SR, strain rate) et en déduit la déformation (strain) par intégration par rapport au temps (Figure 25.29A) [6].
Strain rate: SR = (V2 – V1) / (L – L0) = ΔV / ΔL (s-1)
Strain: ε = ∫t SR
où: V1 et V2 sont les vélocités des 2 extrémités du segment L0.

Figure 25.29 : Doppler tissulaire (DT). A : affichage couleur des mouvements du septum interventriculaire en vue 4-cavités 0°. La descente de l'anneau mitral en systole se traduit par une vélocité de déplacement longitudinal illustrée par une coloration bleue (éloignement du capteur); le mouvement inverse a lieu en diastole (couleur rouge). Le DT mesure la vélocité des deux points situés à l'extrémité du segment sélectionné (V1 et V2). B : affichage Doppler spectral de la vélocité du mouvement de l’anneau mitral (échelle de vélocité 15 cm/s). CI : contraction isovolumétrique. S' : éjection systolique (descente de l’anneau mitral dû à la contraction longitudinale), Vmax 10-15 cm/s. CI: contraction isovolumétrique. E’ : mouvement de l’anneau mitral en relation avec la relaxation protodiastolique. A’ : mouvement de l’anneau mitral en relation avec la contraction auriculaire.
L'enregistrement du mouvement tissulaire doit se faire dans l'axe du déplacement avec une acquisition à haute fréquence (≥ 100 images/s) en rétrécissant au maximum la zone d'intérêt (environ 10 mm) pour favoriser une cadence d'image élevée [3]. En ETO, la déformation longitudinale est mesurée en vues mi-oesophagiennes rétrocardiaques selon le long-axe du VG, sur les parois qui présentent le meilleur alignement avec l'axe Doppler (4-cavités 0°, 2-cavités 60-90° ou long-axe 120°). La déformation radiale n'est mesurable qu'en vue transgastrique court-axe dans les parois inférieure et antérieure. Les valeurs considérées comme normales pour le VG sont de - 20% ± 2% en longitudinal et de 35-45% en radial (mesures transthoraciques chez des sujets en respiration spontanée). Pour le ventricule droit, la déformation longitudinale est de - 29% ± 4.5% (paroi libre); cette valeur largement supérieure à celle du VG est due à la grande compliance du VD et à sa faible postcharge [7,18].
Plus simplement, l’affichage spectral du DT pulsé permet d’examiner la vélocité de déplacement de l’anneau mitral ou de la musculature longitudinale (sous-endocardique) de la paroi latérale, de la paroi antérieure ou du septum interventriculaire (Figure 25.29B). Après réglage de la machine sur la fonction Doppler tissulaire (DT) et sur une émission de basse fréquence (≤ 4 MHz), la fenêtre du Doppler pulsé est ajustée au niveau de l’anneau mitral avec une ouverture de 5-10 mm ; l’échelle des vélocités est de 15-20 cm/s. L’axe du Doppler est positionné aussi parallèle que possible au déplacement mitral, parfois en modifiant légèrement l’angle du capteur. Les vélocités de l'anneau mitral sont diminuées en cas de dysfonction ventriculaire ou d’ischémie. Elles sont bien corrélées à la fraction d’éjection et au dP/dt intraventriculaire [33]. Elles permettent d'objectiver la désynchronisation des différents segments du VG dans la dilatation du ventricule ou les altérations de la cinétique segmentaire dans l'ischémie myocardique; à cet effet, le VG est divisé en 3 segments longitudinaux et 6 segments circulaires (Figure 25.30) [34].

Figure 25.30 : Doppler tissulaire en cas d'ischémie myocardique. En vue 4-cavités, le septum interventriculaire est divisé en 3 segments (proximal, médian et apical). La vélocité de chacun de ces segments est calculée séparément et la déformation affichée en parallèle. Dans cette illustration, on voit que la contractilité basale est normale, alors que les parties médiane et apicale sont hypokinétiques. S' : déformation de l'éjection systolique. FVA: fermeture de la valve aortique. OVA: ouverture de la valve aortique.
La simple mesure de la vélocité du déplacement de l'anneau mitral (vues 4-cavités ou 2-cavités) ou de l'anneau tricuspidien (TAPSE, vue transgastrique VD 100-120°) au Doppler pulsé fait partie de l'examen standard de la fonction ventriculaire; elle est effectuée en temps réel. Par contre, l'analyse segmentaire du Doppler tissulaire (strain et strain rate) est réalisée en différé sur des boucles enregistrées avec une cadence d'image élevée (> 100 images/s).
Speckle-tracking (ST)
L’hétérogénéité des échos du myocarde permet d’isoler de petites tachetures de 20-40 pixels, appelées speckles, présentant une configuration particulière dans leur réflexion des ultrasons qui ne se modifie pas au cours du cycle cardiaque. Elles fonctionnent comme marqueurs tissulaires. Au moyen d’algorithmes de reconnaissance de forme, le processeur peut suivre les déplacements de ces marqueurs acoustiques naturels les uns par rapport aux autres; c’est le speckle-tracking (ST) (Vidéos et Figure 25.31A) [19].
Vidéo: vue court-axe du VG en speckle-tracking; la couleur du bleu au rouge traduit l'intensité de la déformation systolo-diastolique. On voit l'inhomogénéité de la contraction et le mouvement de rotation du VG.
Vidéo: vue long-axe du VG en speckle-tracking; chaque paroi est divisée en 3 segments dont le degré de contraction est évalué de manière indépendante. Cette technique permet une appréciation fine et quantitative de la contractilité segmentaire en cas d'ischémie myocardique.
En traçant plusieurs d’entre eux, l’ordinateur peut évaluer en continu la distance qui les sépare et la déformation du segment de tissu observé [21]. Comme précédemment, la technique permet le calcul de la déformation myocardique (strain et strain rate) longitudinale, radiale, circonférentielle et rotationelle (torsion) [10].

Figure 25.31 A : Technologie du speckle-tracking. I: L’inhomogénéité de la structure myocardique permet de suivre les déplacements de petits granules de 20-40 pixels (speckle) présentant une configuration stable au moyen d’algorithmes de reconnaissance de forme ; ces zones se modifiant peu entre la systole et la diastole, on peut les marquer (points de couleur) et quantifier ainsi la cinétique tissulaire indépendamment des mouvements de translation et de rotation du ventricule. Contrairement au Doppler tissulaire, le speckle-tracking est indépendant de l’angle existant entre l’axe du mouvement et celui des ultrasons. II: courbe de déformation (strain) longitudinale au cours du cycle cardiaque (schéma) [35]. Après un léger étirement pendant la contraction isovolumétrique (D+), la paroi se raccourcit (déformation négative) jusqu'au pic de déformation systolique Dmax (peak systolic strain); la déformation télésystolique (Dts) est enregistrée à la fermeture de la valve aortique (FVA). La déformation post-systolique (Dps) ne se rencontre que dans l'ischémie aiguë, dont elle est typique. La déformation devient positive lorsque la paroi s'allonge en diastole. 1: contraction systolique. 2: relaxation. 3: contraction auriculaire. FVA: fermeture de la valve aortique.
Par rapport au Doppler tissulaire, l’avantage de cette technique est de ne pas dépendre de l’angle d’observation entre la direction du déplacement et l’axe des ultrasons, puisqu'elle analyse le déplacement relatif des speckles à l'intérieur d'un certain segment de myocarde. De plus, elle est fiable en cas d'ischémie, car elle n'est pas sujette au faux mouvement local induit par la translation du cœur ou la traction des éléments voisins. La déformation longitudinale est l'indice le plus employé en clinique, car elle correspond à la contraction-relaxation de la zone sous-endocardique qui est la plus sensible à l'ischémie et à la surpression.
Les meilleurs résultats sont obtenus avec une acquisition semi-automatique des trois vues mi-oesophagiennes 4-cavités (0°), 2-cavités (60-90°) et long-axe (120°) en respectant un certain nombre de prérequis [1,5,24,29,35].
- Le rythme cardiaque doit être régulier (variation < 10 batt/min) et l'ECG de bonne qualité, car l'onde R détermine la synchronisation avec la télédiastole. La fermeture de la valve aortique, qui définit la télésystole, est contrôlée en mode TM à travers la valve aortique.
- La cadence (frame rate) est de 60-90 image/s, ce qui est trop lent pour des évènements brefs comme la contraction isovolumétrique, mais ce qui permet d'analyser la totalité du VG.
- Le réglage du gain et de la compression doit être très précis et la qualité des images 2D parfaite; on utilise souvent l’imagerie en deuxième harmonique lors d'examen transthoracique [23].
- L'image doit comprendre la totalité du VG sans amputation de l'apex et être d'excellente qualité pour que le processeur puisse l'analyser (contraste suffisant entre le tissu et le sang, absence de "trous" et d'ombres).
- L'enregistrement d'une boucle de 3-4 cycles cardiaque est réalisé en apnée; l'analyse est conduite en différé sur le meilleur enregistrement.
- Le marquage de 3 points, sur la face ventriculaire de l'anneau mitral (2 points) et à l'apex (1 point), permet au logiciel de reconnaissance de l'endocarde de définir la zone d'intérêt (region of interest, ROI). Celle-ci doit inclure l'apex mais non l'anneau mitral, ni la chambre de chasse, ni le péricarde, car ils induiraient une sous-estimation de la contraction. Une correction manuelle permet de rectifier le tracé si nécessaire.
- Le trait interne qui définit la zone d'intérêt est situé au niveau de l'endocarde; les trabéculations et les muscles papillaires sont inclus dans la cavité ventriculaire. Le trait externe doit passer au milieu de l'épaisseur de paroi du VG, côté ventriculaire de l'anneau mitral et s'arrêter à l'entrée de la CCVG; il se tient à distance du péricarde. L'épaisseur de la zone doit permettre une analyse du mouvement longitudinal de la paroi sous-endocardique. Le mouvement radiaire et l'épaississement de paroi ne sont pas concernés.
- Dans le cycle cardiaque choisi au sein de la boucle, on marque l'image correspondant à la fermeture de la valve aortique.
Le long-axe du VG est automatiquement divisé en 3 secteurs (basal, médian et apical) et l'évolution de leur déformation représentée par les courbes de strain et de strain rate de chacun. La synthèse des 3 vues mi-oesophagiennes est réalisable dans une carte polaire en carte polaire (bull's eye) des 17 segments du VG, dont la palette de couleur représente l'intensité de la contraction systolique (rouge maximal et bleu minimal) (Figure 25.31B).
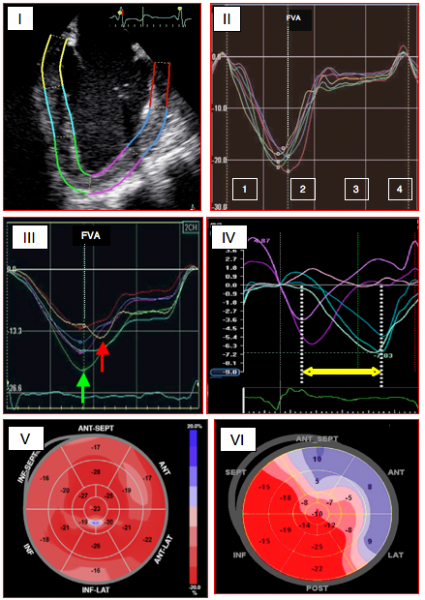
Figure 25.31 B: Courbes de déformation longitudinale (strain) obtenues dans 6 segments du VG en vue 4-cavités; chaque segment est représenté par un trait de couleur différente. I: schéma des 6 segments en vue long-axe. II: courbes de déformation longitudinale correspondant aux 6 segments; dans ce cas, la contraction est homogène. 1: contraction systolique. 2: relaxation. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique [10]. III: courbes de déformation longitudinale en cas d'ischémie myocardique aiguë; contraction post-systolique (flèche rouge) dans la zone ischémiée survenant après le pic systolique (flèche verte) de la paroi ventriculaire normale. Le degré de déformation est nettement diminué dans la zone ischémiée. IV : courbes de déformation du VG dans une insuffisance ventriculaire avec bloc de branche gauche et allongement du QRS; la flèche jaune démontre le délai entre la contraction septale et la contraction latérale [12]. V: carte polaire d'une contraction homogène [24]. VI: carte polaire d'une ischémie active dans le territoire de l'IVA [12].
La déformation longitudinale est la mesure la plus utilisée et la mieux corrélée au devenir de la fonction ventriculaire, car elle représente la fonction des fibres myocardiques longitudinales sous-endocardiques. La mesure des déformations radiale et circonférentielle est plus délicate et sa valeur pronostique est nettement inférieure, notamment parce qu'elle ne correspond pas à la contraction d'une couche précise du myocarde [37]. La déformation longitudinale globale (global longitudinal strain, GLS) est la moyenne de la déformation de toute la longueur de la paroi ventriculaire (moyenne des différentes courbes de déformation). Sa valeur normale est de - 20% ± 2% pour le VG [36], et de - 29% ± 4.5% pour le VD [2]. Elle augmente d'environ 2% de la base à l'apex [5]. Elle tend à diminuer avec l'âge, avec l'obésité et avec le diabète; elle est augmentée chez les athlètes [5,29]. C'est une mesure très performante et très sensible de la fonction systolique du ventricule, particulièrement utile dans les situations où le VG est déformé et la fraction d'éjection peu pertinente ou encore normale, comme les cardiomyopathies ou les valvulopathies (voir Indices myocardiques tissulaires) [29,31]. Le ST est également un excellent moyen d'investigation de la relaxation protodiastolique et de la dérotation du VG [26].
Bien que la variabilité inter- et intra-observateur soit faible, la corrélation est modeste entre l'imagerie transthoracique et transoesophagienne d'une part, et entre les différents systèmes présents sur le marché d'autre part [20]. Les variations entre ETT et ETO sont de l'ordre de 2.9-3.6%, avec une tendance à la surestimation par l'ETO; la corrélation reste acceptable pour la déformation longitudinale globale, mais devient faible pour les déformations circonférentielle et radiale [1,21]. Ces discordances sont dues aux différences de résolution entre les transducteurs, à la tendance de tronquer l'apex en ETO, aux plans de coupe non superposables et aux conditions particulières du peropératoire (ventilation en pression positive, pericardiotomie, etc) [1,7]. Entre les différents échographes, la variation est de 3.7% [9]. Pour le suivi d'un patient, il est préférable d'avoir recours à la même machine et au même logiciel.
En anesthésie ou aux soins intensifs, les conditions de charge varient considérablement. Or la déformation systolique est directement liée à la tension de départ, selon le principe de Frank-Starling. Cette mesure est donc dépendante de la précharge. La postcharge a davantage d'influence sur la déformation (strain) que sur la vitesse de déformation (strain rate); le pic systolique de cette dernière est la mesure la moins sensible aux conditions de charge [1,29]. L'accélération de la contraction isovolumétrique (Vmax/Δt, pente du trait violet dans la Figure 25.28C) est indépendante de la postcharge, puisque la mesure a lieu avant l'ouverture de la valve aortique.
Malgré ses avantages, la technologie du speckle-tracking bi-dimensionnel présente des limitations intrinsèques. Dans 20% des cas, au moins un segment est ininterprétable par le processeur [5]. Les boucles comprenant plus d'un segment illisible doivent être éliminées de l'analyse [35]. Les mouvements enregistrés dans le plan d'examen ne sont pas toujours dus à des structures parallèles ou perpendiculaires à l'endocarde, mais à des éléments spiralés obliques ayant une direction différente et coupant le plan avec un certain angle. L'utilisation du 3D peut corriger cette source d'erreur, mais au détriment rédibitoire de la résolution spatiale et de la fréquence d'image. Le bruit de fonds enregistré par les ultrasons peut rendre difficile l'identification des structures tissulaires composant les tachetures des parois (speckles); le réglage du gain et de la compression peut être ardu. Enfin, les microstructures identifiées comme speckles par les algorithmes de reconnaissance de forme ne sont pas stables et se déforment avec le temps, ce qui occasionne des erreurs aléatoires dont l'accumulation peut perturber l'examen [35].
Application clinique
Les applications cliniques de l'analyse de la déformation myocardiques (Doppler tissulaire et speckle-tracking) concernent déjà de nombreux domaines. Elles portent principalement sur la déformation longitudinale segmentaire et la déformation longitudinale globale (moyenne de tous les segments) [4,7,10,12,23]. Cette dernière entre progressivement dans la routine pour l'évaluation de la fonction systolique des ventricules.

Figure 25.31 B: Courbes de déformation longitudinale (strain) obtenues dans 6 segments du VG en vue 4-cavités; chaque segment est représenté par un trait de couleur différente. I: schéma des 6 segments en vue long-axe. II: courbes de déformation longitudinale correspondant aux 6 segments; dans ce cas, la contraction est homogène. 1: contraction systolique. 2: relaxation. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique [10]. III: courbes de déformation longitudinale en cas d'ischémie myocardique aiguë; contraction post-systolique (flèche rouge) dans la zone ischémiée survenant après le pic systolique (flèche verte) de la paroi ventriculaire normale. Le degré de déformation est nettement diminué dans la zone ischémiée. IV : courbes de déformation du VG dans une insuffisance ventriculaire avec bloc de branche gauche et allongement du QRS; la flèche jaune démontre le délai entre la contraction septale et la contraction latérale [12]. V: carte polaire d'une contraction homogène [24]. VI: carte polaire d'une ischémie active dans le territoire de l'IVA [12].
La déformation longitudinale est la mesure la plus utilisée et la mieux corrélée au devenir de la fonction ventriculaire, car elle représente la fonction des fibres myocardiques longitudinales sous-endocardiques. La mesure des déformations radiale et circonférentielle est plus délicate et sa valeur pronostique est nettement inférieure, notamment parce qu'elle ne correspond pas à la contraction d'une couche précise du myocarde [37]. La déformation longitudinale globale (global longitudinal strain, GLS) est la moyenne de la déformation de toute la longueur de la paroi ventriculaire (moyenne des différentes courbes de déformation). Sa valeur normale est de - 20% ± 2% pour le VG [36], et de - 29% ± 4.5% pour le VD [2]. Elle augmente d'environ 2% de la base à l'apex [5]. Elle tend à diminuer avec l'âge, avec l'obésité et avec le diabète; elle est augmentée chez les athlètes [5,29]. C'est une mesure très performante et très sensible de la fonction systolique du ventricule, particulièrement utile dans les situations où le VG est déformé et la fraction d'éjection peu pertinente ou encore normale, comme les cardiomyopathies ou les valvulopathies (voir Indices myocardiques tissulaires) [29,31]. Le ST est également un excellent moyen d'investigation de la relaxation protodiastolique et de la dérotation du VG [26].
Bien que la variabilité inter- et intra-observateur soit faible, la corrélation est modeste entre l'imagerie transthoracique et transoesophagienne d'une part, et entre les différents systèmes présents sur le marché d'autre part [20]. Les variations entre ETT et ETO sont de l'ordre de 2.9-3.6%, avec une tendance à la surestimation par l'ETO; la corrélation reste acceptable pour la déformation longitudinale globale, mais devient faible pour les déformations circonférentielle et radiale [1,21]. Ces discordances sont dues aux différences de résolution entre les transducteurs, à la tendance de tronquer l'apex en ETO, aux plans de coupe non superposables et aux conditions particulières du peropératoire (ventilation en pression positive, pericardiotomie, etc) [1,7]. Entre les différents échographes, la variation est de 3.7% [9]. Pour le suivi d'un patient, il est préférable d'avoir recours à la même machine et au même logiciel.
En anesthésie ou aux soins intensifs, les conditions de charge varient considérablement. Or la déformation systolique est directement liée à la tension de départ, selon le principe de Frank-Starling. Cette mesure est donc dépendante de la précharge. La postcharge a davantage d'influence sur la déformation (strain) que sur la vitesse de déformation (strain rate); le pic systolique de cette dernière est la mesure la moins sensible aux conditions de charge [1,29]. L'accélération de la contraction isovolumétrique (Vmax/Δt, pente du trait violet dans la Figure 25.28C) est indépendante de la postcharge, puisque la mesure a lieu avant l'ouverture de la valve aortique.
Malgré ses avantages, la technologie du speckle-tracking bi-dimensionnel présente des limitations intrinsèques. Dans 20% des cas, au moins un segment est ininterprétable par le processeur [5]. Les boucles comprenant plus d'un segment illisible doivent être éliminées de l'analyse [35]. Les mouvements enregistrés dans le plan d'examen ne sont pas toujours dus à des structures parallèles ou perpendiculaires à l'endocarde, mais à des éléments spiralés obliques ayant une direction différente et coupant le plan avec un certain angle. L'utilisation du 3D peut corriger cette source d'erreur, mais au détriment rédibitoire de la résolution spatiale et de la fréquence d'image. Le bruit de fonds enregistré par les ultrasons peut rendre difficile l'identification des structures tissulaires composant les tachetures des parois (speckles); le réglage du gain et de la compression peut être ardu. Enfin, les microstructures identifiées comme speckles par les algorithmes de reconnaissance de forme ne sont pas stables et se déforment avec le temps, ce qui occasionne des erreurs aléatoires dont l'accumulation peut perturber l'examen [35].
Application clinique
Les applications cliniques de l'analyse de la déformation myocardiques (Doppler tissulaire et speckle-tracking) concernent déjà de nombreux domaines. Elles portent principalement sur la déformation longitudinale segmentaire et la déformation longitudinale globale (moyenne de tous les segments) [4,7,10,12,23]. Cette dernière entre progressivement dans la routine pour l'évaluation de la fonction systolique des ventricules.
- Fonction systolique du VG: chaque diminution de 1% de la déformation longitudinale globale (DLG) augmente le risque de mortalité de 17% chez les patients en insuffisance cardiaque [25]. La DLG est le meilleur indice pour suivre l'apparition d'une défaillance ventriculaire sous chimiothérapie car elle est plus sensible que la FE [28].
- Fonction ventriculaire systolique périopératoire: le ST offre une meilleure évaluation du retentissement myocardique de la lésion valvulaire lorsque la fraction d'éjection est invalide ou encore normale, et une meilleure estimation de l'indication opératoire chez les patients asymptomatiques. Une faible déformation longitudinale (< 15%) est associée à un taux de dysfonction ventriculaire et de morbi-mortalité plus élevé après remplacement valvulaire aortique, chirurgie valvulaire mitrale ou pontage aorto-coronarien, indépendamment de la valeur de la FE [1,14,16,37].
- Fonction diastolique: la DLG est abaissée < 15% chez plus de la moitié des patients qui souffrent d'insuffisance cardiaque à FE préservée (insuffisance diastolique) [29]. Le rapport entre la vélocité du flux mitral E et la déformation diastolique globale (global diastolic strain) ou la vitesse de déformation diastolique (diastolic strain rate) donne une approximation fiable de la POG (r = 0.86) (voir Mesures non-invasives de la POG) [8,19].
- Cardiomyopathie dilatée: DT et ST permettent une mesure fine de la fonction systolo-diastolique avec une bonne valeur pronostique. La diminution de torsion systolique du VG (rotation horaire à la base et anti-horaire à l'apex) à < 0.6°/cm de long axe du VG (normal 8-15°) a une bonne valeur prédictive pour l'importance de l'IM et la décompensation ventriculaire [15,30].
- Cardiomyopathie hypertrophique: la DLG est fréquemment abaissée alors que la FE est encore normale; une réduction de la DLG < 10% quadruple le risque de complications cardiovasculaires [17].
- Ischémie myocardique: la déformation segmentaire (segmental strain) est typiquement abaissée à < 14% dans les segments ischémiques; une déformation > 21% exclut pratiquement une maladie ischémique, alors qu'une déformation < 4% est suspecte de non-viabilité [29]. La déformation segmentaire met également en évidence des éléments importants de l'ischémie: contraction post-systolique dans l'ischémie aiguë, modification de la vitesse de déformation (strain rate) lors d'écho de stress à la dobutamine, différentiation entre l'occlusion coronaire (hypokinésie segmentaire) et la lésion d'ischémie-reperfusion (hypokinésie globale, sidération) après une revascularisation, différentiation entre la contraction active et le mouvement passif par l'entrainement des segments voisins (voir Figure 25.31B).
- Resynchronisation: comme il autorise l'affichage de la déformation systolique simultanée dans six segments du VG sur une seule vue long-axe, le ST est un bon outil pour poser les indications à une thérapie de resynchronisation dans l'insuffisance cardiaque [11]. Un délai > 130 msec entre la contraction septale et la contraction postérieure ou latérale présente une bonne valeur prédictive pour une réponse positive à l'entraînement électrique [12].
- Fonction VD: bien que l'analyse de la déformation longitudinale du VD soit réalisée avec des systèmes conçus premièrement pour le VG (à l'exception du logiciel EchoInsight™ qui est spécifique au VD), la déformation systolique globale et la déformation systolique de la paroi libre en vue 4-cavités se révèlent être des indices sensibles et fiables de la fonction droite. Des valeurs respectives abaissées à -14% et -16% (normal – 29% ± 4.5%) sont liées à une augmentation de morbi-mortalité chez les patients souffrant d'hypertension pulmonaire (OR 5.4) [32] et à une défaillance droite après implantation d'assistance ventriculaire gauche [13]. La limite en-dessous de laquelle la fonction droite est affectée est de – 19% pour la paroi libre du VD, le septum étant trop influencé par la contraction du VG et la chambre de chasse étant physiologiquement hypercontractile [2].
Bien que sa mesure ne puisse pas être faite en temps réel, la déformation longidutinale globale est devenue le test de premier choix lorsqu'une estimation fonctionnelle plus fine que la FE est requise pour déterminer la performance des ventricules.
© CHASSOT PG, BETTEX D. Avril 2019; dernière mise à jour, Mars 2020
Références
| Déformation tissulaire |
| L'analyse de la déformation locale du myocarde permet d'évaluer la fonction de chaque segment du ventricule. La mesure comprend trois données: - Vmax du pic systolique de la déformation longitudinale (norme: 8-12 cm/s) - Déformation ou strain: ε = (L – L0) / L0 (déformation longitudinale normale: 20% pour le VG et 29% pour le VD) - Vitesse de déformation ou strain rate: SR = ε / Δt (norme: 1.1 - 1.5 sec-1) Deux techniques sont utilisées à cet effet: - Doppler tissulaire; mesure des vélocités au sein du myocarde après avoir filtré les échos du sang (haute vélocité et basse amplitude); dépend de l'angle entre le déplacement et l'axe des ultrasons - Speckle-tracking; suivi des hétérogénéités de la musculature cardiaque au moyen d'algorithmes de reconnaissance de forme; indépendant de l'angle déplacement/ultrasons La déformation longitudinale globale (global longitudinal strain, GLS) est la moyenne des valeurs mesurées dans les 6 segments dans lesquels sont divisées les parois du VG dans les 3 vues long-axe (0°, 60-90° et 120°). Elle correspond à la contraction de la couche myocardiaque sous-endocardique, très sensible à l'ischémie et à la pression. Elle s'impose progressivement comme routine pour l'évaluation fine de la fonction ventriculaire, notamment lorsque la FE est inadéquate ou encore normale (valvulopathie, cardiomyopathie hypertrophique, ischémie, etc). |
© CHASSOT PG, BETTEX D. Avril 2019; dernière mise à jour, Mars 2020
Références
- ABUELKASEM E, WANG DW, OMER MA; et al. Perioperative clinical utility of myocardial deformation imaging: a narrative review. Br J Anaesth 2019; 123:408-20
- CAMELI M, RIGHINI FM, LISI M, MONDILLO S. Right ventricular strain as a novel approach to analyze right ventricular performance in patients with heart failure. Heart Fail Rev 2014; 19: 603-10
- CAMELI M, SENGUPTA P, EDVARDSEN T. Deformation echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 35-41
- CHONG A, MacLAREN G, CHEN R, CONNELLY KA. Perioperative applications of deformation (myocardial strain) imaging with speckle-tracking echocardiography. J Cardiothorac Vasc Anesth 2014; 28:128-40
- COLLIER P, PHELAN D, KLEIN A. A test in context: myocardial strain measured by speckle-tracking echocardiography. J Am Coll Cardiol 2017; 69:1043-56
- D'HOOGE J, HEIMDAL A, JAMAL F, et al. Regional strain and strain rate measurements by cardiac ultrasound: principles, implementation, and limitations. Eur J Echocardiogr 2000; 1:154-70
- DUNCAN AD, ALFIREVIC A, SESSLER DI, et al. Peroperative assessment of myocardial deformation. Anesth Analg 2014; 118:525-44
- EBRAHIMI F, KOHANCHI D, GHAREDAGHI MH, et al. Intraoperative assessment of left ventricular diastolic function by two-dimensional speckle-tracking echocardiography: reltionship between pulmonary capillary wedge pressure and peak longitudinal strain rate during isovolumetric relaxation in patients undergoing coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth 2019; 33: 1014-21
- FARSALINOS KE, DARABAN AM, ÜNLÜ S, et al. Head-to-head comparison of global longitudinal strain measurements among nine different vendors: the EACVI/ASE Inter-Vendor Comparison study. J Am Soc Echocardiogr 2015; 28:1171-81
- FEIGENBAUM H, MASTOURI R, SAWADA S. A practical approach to using strain echocardiography to evaluate the left ventricle. Circ J 2012; 76:1550-5
- GORCSAN J, TANABE M, BLEEKER GB, et al. Combined longitudinal and radial dyssynchrony predicts ventricular response after resynchronisation therapy. J Am Coll Cardiol 2007; 50:1476-83
- GORCSAN J, TANAKA H. Echocardiographic assessment of myocardial strain. J Am Coll Cardiol 2011; 58:1401-13
- GRANT A, SMEDIRA N, STARLING R, MARWICK T. Independent and incremental role of quantitative right ventricular evaluation for the prediction of right ventricular failure after left ventricular assist device implantation. J Am Coll Cardiol 2012; 60: 521-8
- KIM HM, CHO GY, HWANG IC, et al. Myocardial strain in prediction of outcomes after surgery for severe mitral regurgitation. JACC Cardiovasc Imaging 2018; 11:1235-44
- KINOVA E, SPASOVA N, BORIZANOVA A, et al. Torsion mechanics as an indicator of more advanced left ventricular systolic dysfunction in secondary mitral regurgitation in patients with dilated cardiomyopathy: a 2D speckle-tracking analysis. Cardiology 2018; 139: 187-96
- KUMAR A, PURI GD, BAHL A. Transesophageal echocardiography, 3-dimensional and speckle-tracking together as sensitive markers for early outcome in patients with left ventricular dysfunction undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2017; 31:1695-701
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LIU H, POZIOS I, HALLESELASSIE B, et al. Role of global longitudinal strain in predicting outcomes in hypertrophic cardiomyopathy. Am J Cardiol 2017; 120:670-5
- MAGOON R, MALIK V, CHOUDHURY A, et al. A comparison of the strain and tissue Doppler-based indices as echocardiographic correlates of the left ventricular filling pressures. J Cardiothorac Vasc Anesth 2018; 32: 1297-304
- MARCUCCI C, JUNGWIRTH B, BURKHARD MACKENSEN G, MAHAJAN A. Emerging applications of perioperative echocardiography. In: MATHEW JP, SWAMINATHAN M, AYOUB CM. Clinical manual and review of transesophageal echocardiography, 2nd edition. New York: McGraw-Hill 2010,506-39
- MARCUCCI C, LAUER R, MAHAJAN A. New echocardiographic techniques for evaluating left ventricular myocardial function. Semin Cardiothorac Vasc Anesth 2008; 12:228-47
- MISSANT C, REX S, CLAUS P, et al. Load sensitivity of regional tissue deformation in the right ventricle isovolemic versus ejection-phase indices of contractility. Heart 2008; 94:e15
- MONDILLO S, GALDERISI M, MELE D, et al. Speckle-tracking echocardiography: a new technique for assessing myocardial function. J Ultrasound Med 2011; 30:71-83
- NEGISHI K, NEGISHI T, KUROSAWA K, et al. Practical guidance in echocardiographic assessment of global longitudinal strain. JACC Cardiovasc Imaging 2015; 8:489-92
- PARK JJ, PARK JB, CHO GY. Global longitudinal strain to predict mortality in patients with acute heart failure. J Am Coll Cardiol 2018; 71:1947-57
- PERRY R, DE PASQUALE CG, CHEW DP, et al. Assessment of early diastolic left ventricular function by two-dimensional echocardiogrphic speckle-tracking. Eur J Echocardiogr 2008; 9:791-5
- PISLARU C, ABRAHAM TP, BELOHLAVEK M. Strain and strain rate echocardiography. Curr Opin Cardiol 2002; 17:443-54
- PLANA JC, GALDERISI M, BARAC A, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2014; 27:911-39
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography. The case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11:260-74
- RADY M, ULBRICH S, HEIDRICH F, et al. Left ventricular torsion: a new echocardiographic prognosticator in patients with non-ischemic dilated cardiomyopathy. Circ J 2019; 83:595-603
- REISNER SA, LYSYANSKY P, AGMON Y, et al. Global longitudinal strain: a novel index of left ventricular systolic function. J Am Soc Echocardiogr 2004; 17:630-3
- SHUKLA M, PARK JH, THOMAS JD, et al. Prognostic value of right ventricular strain using speckle-tracking echocardiography in pulmonary hypertension: a systematic review and meta-analysis. Can J Cardiol 2018; 34:1069-78
- SKARVAN K, FILIPOVIC M, WANG J, et al. Use of myocardial tissue Doppler imaging for intraoperative monitoring of left ventricular function. Br J Anaesth 2003; 91:473-80
- VAN DE VEIRE NR, DE SUTTER J, BAX JJ, ROELANDT JR. Technological advances in tissue Doppler imaging echocardiography. Heart 2008; 94:1065-74
- VOIGT JU, PEDRIZZETTI G, LYSYANSKY P, et al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging 2015; 16:1-11
- YINGCHONCHAROEN T, AGARWAL S, POPOVIC ZB, et al. Normal ranges of left ventricular strain: a meta-analysis. J Am Soc Echocardiogr 2013; 26:185-91
- ZHANG K, SHEU R, ZIMMERMAN NM, et al. A comparison of global longitudinal, circonferential, and radial strain to predict outcomes after cardiac surgery. J Cardiothorac Vasc Anesth 2019; 33:1315-22
