L'incidence d'infarctus varie considérablement selon le type d'intervention chirurgicale [1] :
- 0.05% en chirurgie ambulatoire,
- 0.5% en chirurgie viscérale,
- 2.7% en orthopédie,
- 4.7-8.5% en chirurgie vasculaire.
L'incidence d'infarctus postopératoire varie aussi avec la manière de le définir. Selon que l'on utilise le taux de CK-MB, les critères de l'OMS, la troponine I (seuil 1.5 ng/L) ou la troponine T, il varie respectivement entre 1.4%, 3%, 12% ou 17% (voir Chapitre 9, Méthodes diagnostiques) [13]. La mortalité de l’infarctus postopératoire est de 8 à 25% [7,10,13].
La période en salle d'opération est un moment privilégié, car le malade est endormi, analgésié, pris en charge de manière optimale et étroitement surveillé; le taux d'ischémie et d'infarctus y est près de la moitié du taux périopératoire [13]. C’est la période postopératoire qui est la plus dangereuse ; le taux d’infarctus y est quatre fois plus élevé (Figure 3.10) [11].
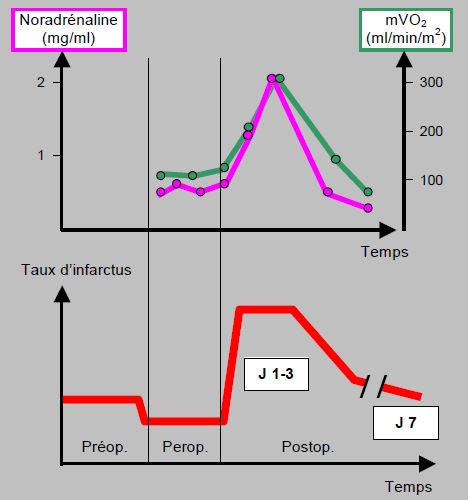
Figure 3.10 : Evolution du taux de noradrénaline, de la consommation d'oxygène du myocarde (mVO2) et représentation schématique de l’incidence d’infarctus dans la période périopératoire. La stimulation sympathique et la demande en oxygène sont abaissées pendant l'opération, mais très élevées dans le postopératoire. Le taux d’infarctus postopératoire est directement lié à l’incidence des épisodes ischémiques survenus dans les deux premiers jours après l’intervention ; l’incidence est maximale pendant les premières 24 – 72 heures, et reste élevée jusqu’au septième jours postopératoire [D’après : Metzler H. Perioperative myocardial ischemia. New aspects of incidence, pattern and risk factors. Paris: JEPU, Arnette Blackwell SA, 1995, 15-22].
Les épisodes ischémiques per- et post-opératoires sont liés à la survenue d’infarctus [7,8]. L'ischémie survient en général dans les premières heures après l’intervention (jusqu’à 72 heures) ; elle est le plus souvent précédée ou accompagnée de tachycardie. L’infarctus postopératoire est silencieux dans la grande majorité des cas : l'angor n'est présent que chez 14% des patients, et des symptômes clinique n'apparaissent que dans 53% des cas [7,8]. La période postopératoire précoce est particulièrement dangereuse parce qu'elle s’accompagne d’une triple vulnérabilité du patient.
- Augmentation de la demande myocardique en O2 (mVO2) (stress, douleur, tachycardie, hypertension, hypothermie) et diminution de l'apport en O2 (DO2) (anémie, hypotension, baisse des échanges gazeux) ;
- Déstabilisation de plaques athéromateuses coronariennes instables sous l'effet du stress et du syndrome inflammatoire liés à la chirurgie ;
- Hypercoagulabilité sanguine par augmentation de l'adhésivité plaquettaire et baisse de la fibrinolyse.
Dans le contexte chirurgical, on rencontre deux types d’infarctus : celui dû au déséquilibre DO2/VO2 sur sténose serrée et celui dû à la thrombose d’une plaque instable. Toutefois, ces deux phénomènes ont une répartition particulière. Alors que la rupture de plaque instable est à l’origine de 70% des infarctus aigus en cardiologie, elle ne représente que 45% des infarctus postopératoires [2,6]. (Figure 3.11).
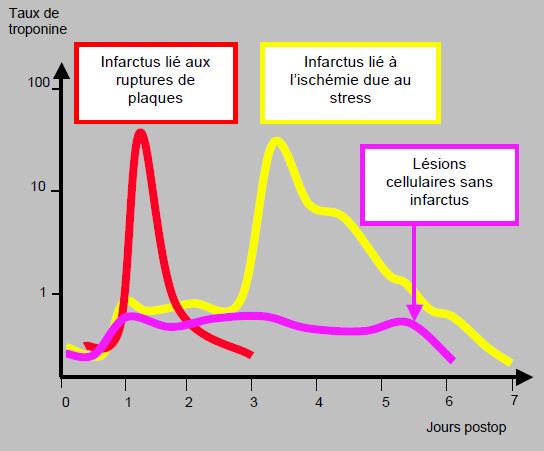
Figure 3.11 : Evolution du taux de troponine I (cTnI) après chirurgie de l'aorte abdominale dans une étude portant sur 1'152 patients [10] :
- Elévation de la cTnI inférieure au seuil de 1.5 ng/L chez 9% des patients (courbe violette) ; lésion myocardique sans infarcissement (mortalité 7%) ;
- Pic de cTnI (> 1.5 ng/L) à 74 heures chez 3% ; infarctus secondaire à une ischémie persistante sur déséquilibre de la demande et de l'apport myocardique en oxygène (courbe jaune), dont la stimulation sympathique est une cause majeure (douleur, tachycardie, stress, hypothermie, hypotension, anémie) ; la mortalité est de 21% ;
- Pic de cTnI (> 1.5 ng/L) à 37 heures chez 2% : infarctus probablement secondaire à des ruptures de plaques instables avec mortalité de 24% (courbe rouge).
De manière simplifiée, on peut différencier ces phénomènes en deux formes différentes.
- L’infarctus sur déséquilibre DO2/VO2 (55% des cas) est caractérisé par plusieurs éléments [8,9,10] :
- Il survient sur des sténoses serrées (> 75%) à l’angiographie ; les épreuves d’effort préopératoires sont en général positives.
- Il est de type non-Q, accompagné de sous-décalage du segment ST, correspondant à une lésion sous-endocardique. Il survient fréquemment chez des malades âgés, diabétiques, insuffisants cardiaques, ou souffrant d'angor avec modifications du segment ST et ancien infarctus à l'ECG. Son étendue est inversement proportionnelle au degré de collatéralisation.
- L’infarctus postopératoire est précédé dans 60% des cas de longs épisodes de tachycardie et de sous-décalage du segment ST ; la durée de ce sous-décalage est directement associée à la valeur du pic de troponine enregistré ultérieurement ; l’ascension des troponines est tardive (72 heures), et l’accident survient en général au 3ème ou 4ème jour.
- La meilleure prévention contre cet accident est le contrôle strict de l’hémodynamique : fréquence (60-65 batt/min par β-blocage) et PAM (> 60 mmHg).
- Un bas débit (hypotension sévère), une viscosité élevée (déshydratation) et/ou une vasoconstriction locale (endothéline) peuvent causer une thrombose aiguë lorsque la sténose est très serrée.
- L’infarctus sur rupture de plaque instable (45% des cas) est un phénomène différent [2,3,4,10] :
- Il apparaît en-dehors des sténoses les plus serrées à la coronarographie, mais en relation avec une rupture de plaque (45% des autopsies d’infarctus postopératoires) ; 80% des lésions coronariennes en relation avec ce type d'infarctus ne sont pas considérées comme significatives lors d'un examen préopératoire. Les tests d'effort ont une très faible valeur prédictive pour cet évènement, car ils sont le plus souvent objectivement négatifs.
- Il n’est pas précédé de modifications du segment ST mais accompagné d’une surélévation du segment ST et d'onde Q ; il correspond à une lésion transmurale.
- Il survient plus tôt, en général dans les 36 premières heures, mais il peut apparaître n’importe quand dans les dix jours qui suivent l’intervention.
- L’élévation des troponines est brusque et précoce.
- La seule prévention possible est les antiplaquettaires (aspirine, clopidogrel, prasugrel, ticagrelor), les anticoagulants et les statines.
- La rupture de plaque est facilitée par le stress de cisaillement (hyperdynamisme) et par l’hypertension ; la thrombose est liée à l'hyperaggrégabilité plaquettaire et au syndrome inflammatoire systémique (corrélation positive entre infarctus et CRP) ; tous ces phénomènes sont proportionnels à la stimulation sympathique et au stress opératoire.
Bien qu'il soit satisfaisant de trouver des correspondances entre la clinique, la pathologie et les examens de laboratoires, la répartition de l'infarctus périopératoire en deux catégories tranchées n'est pas absolument rigoureuse car il existe de nombreuses zones de superposition. Par exemple, 20-40% des syndromes coronariens aigus surviennent suite à des thromboses apparues au niveau de plaques non ulcérées, donc théoriquement stables [5]. Même sur une plaque rupturée, un thrombus peut rester mural est ne pas devenir occlusif si la fibrinolyse fonctionne normalement ou si l'adhésivité plaquettaire est diminuée [12]. La modulation du syndrome inflammatoire modifie l'évolution d'une lésion athéromateuse vers la stabilisation comme vers l'instabilité. La stimulation sympathique, déjà responsable de la tachycardie et de l'augmentation de la demande en O2, peut facilement induire un vasopasme chez le coronarien, dont l'endothélium vasculaire répond par une vasoconstriction paradoxale aux stimulations catécholaminergiques et métaboliques. Face à la multiplicité des mécanismes en jeu, il n'est pas étonnant que la survenue d'un infarctus soit hautement imprédictible. Il est donc d’autant plus important de faire profiter les patients du maximum de protection périopératoire.
| Infarctus postopératoire |
| La période postopératoire est plus à risque que la période peropératoire Il existe 2 types d’infarctus (répartition environ 50/50) Infarctus sur déséquilibre DO2/VO2 : - Sténose coronarienne serrée, angor d’effort - Infarctus non-STEMI, non-Q, précédé de sous-décalage ST - Lié à tachycardie, HTA, douleur, stress - Prévention : maintien de la stabilité hémodyamique, béta-bloqueurs Infarctus sur rupture/thrombose de plaque instable : - Sténose coronarienne < 60%, tests d’effort non-discriminants - Infarctus STEMI avec onde Q, survenue brutale et précoce - Lié au syndrome inflammatoire et à l’hyperactivité plaquettaire - Prévention : antiplaquettaires, anticoagulants, statines |
© CHASSOT PG, DELABAYS A, SPAHN D, Mars 2010, dernière mise à jour, Août 2019
Références
- BADNER NH. KNILL TL, BROWN JE, et al. Myocardial infarction after noncardiac surgery. Anesthesiology 1998; 88:572-8
- COHEN MC, ARETZ TH. Histological analysis of coronary artery lesions in fatal postoperative myocardial infarction. Cardiovasc Pathol 1999; 8:133-9
- DAWOOD MM, GUPTA DK, SOUTHERN J, et al. Pathology of fatal perioperative myocardial infarction: implications regarding physiopathology and prevention. Int J Cardiol 1996; 57:35-44
- ELLIS SG, HERTZER NR, YOUNG JR, et al. Angiographic correlates of cardiac death and myocardial infarction complicating major non-thoracic vascular surgery. Am J Cardiol 1996; 77:1126-28
- FORRESTER JS. Role of plaque rupture in acute coronary syndromes. Am J Cardiol 2000; 86(Suppl):J15-23
- GIROUD D, LI JM, URBAN P, et al. Relation of the site of acute myocardial infarction to the most severe coronary arterial stenosis at prior angiography. Am J Cardiol 1992; 69:729-32
- LANDESBERG G. The pathophysiology of perioperative myocardial infarction: Facts and perspectives. J Cardiothorac Vasc Anesth 2003; 17:90-100
- LANDESBERG G, MOSSERI M, ZAHGER D, et al. Myocardial infarction following vascular surgery: The role of prolonged, stress-induced, ST-depression type ischemia. J Am Coll Cardiol 2001; 37:1839-45
- LANDESBERG G, SHATZ V, AKOPNIK I, et al. Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term surviival after major vascular surgery. J Am Coll Cardiol 2003; 42:1547-54
- LE MANACH Y, PERREL A, CORIAT P, et al. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102:885-91
- MANGANO DT, HOLLENBERG M, FEGERT G, et al. Perioperative myocardial ischemia in patients undergoing non-cardiac surgery. J Am Coll Cardiol 1991; 17:843-57
- MANN J, DAVIES MJ. Mechanisms of progression in native coronary artery disease: role of healed plaque disruption. Heart 1999; 82:265-8
- PRIEBE HJ. Triggers of perioperative myocardial ischemia and infarction. Brit J Anaesth 2004; 93:9-20
