Malgré un demi-siècle de recherche sur la cardioplégie, de nombreuses questions restent irrésolues, et la solution idéale n’est toujours pas trouvée. Il existe de nombreuses variations dans ces perfusats.
- Solution cristalloïde hyperkalémique et hypotherme (5-10°);
- Sang additionné de solution potassique;
- Cardioplégie au sang hypotherme ou normotherme;
- Perfusion intermittente ou continue;
- Pompe et circuit séparés sur la machine de CEC ou distribution sous manchette à pression;
- Addition de substrat métabolique: glucose, acides aminés, ATP;
- Addition d’agents protecteurs.
Le but d’une cardioplégie est de remplir six exigences physiologiques: l'arrêt cardiaque immédiat, le frein du métabolisme, l'apport de substrat, le maintien du pH, la prévention de l'oedème, et la prévention des lésions de reperfusion [4].
Solutions cristalloïdes
La solution de cardioplégie cristalloïde est la plus simple et la moins coûteuse ; elle est efficace dans les cas standards. Les solutions les plus utilisées sont de type extracellulaire enrichi en potassium et pauvre en calcium, comme la solution de St. Thomas n° 2 (Plegisol™) (Tableau 24.2). La solution de del Nido (basée sur le Plasma-Lyte A™ additionné de K+, de Mg+, de bicarbonate et de mannitol, sans Ca2+) est également de type extracellulaire, mais on y ajoute 20% de sang. D’autres solutions miment la composition intracellulaire (basses en sodium et en calcium), comme la solution de Bretschneider, qui est aussi utilisée pour la préservation d'organes en transplantation [23]. On ajoute habituellement du magnésium pour diminuer l'augmentation de [Ca2+]i que provoque l'hyperkaliémie. L'avantage de la cardioplégie cristalloïde est la clarté du champ opératoire pour le chirurgien et la rhéologie favorable pour atteindre des zones distales à des obstructions coronariennes serrées, mais le désavantage est l'impossibilité de transporter de l'oxygène et le risque d'hémodilution. Elle est de plus en plus remplacée par la cardioplégie au sang.

Les solutions de type St Thomas sont administrées par une pompe séparée du circuit de CEC (Figure 24.5) sous une pression d'environ 70-150 mmHg et un débit de 200-300 mL/min pendant au moins 2 minutes, car il faut 2 mL de solution par gramme de coeur, soit environ 500 mL pour un adulte. Pour l’entretien de l’arrêt, il suffit de répéter la perfusion toutes les 30 minutes avec un débit de 150 mL/min pendant 1-2 minutes. La température est de 5-10°. Par voie rétrograde, la pression de perfusion est de 20-30 mmHg environ, avec une valeur maximale de 40 mmHg.
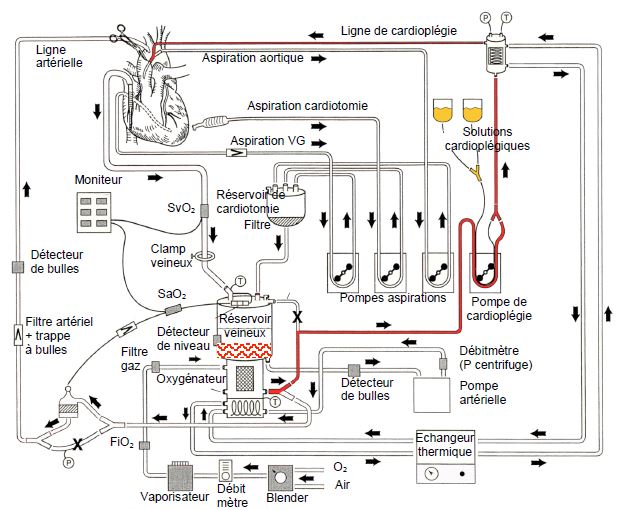
Figure 24.5 : Schéma d'un circuit de CEC. Le système de cardioplégie est représenté en rouge. Il aspire la solution de cardioplégie (en jaune), l'équilibre à la température désirée par un échangeur thermique et la propulse par une pompe dédiée dans la ligne de cardioplégie, implantée en l'occurrence dans la racine de l'aorte. Pour une cardioplégie au sang, il prend le sang à la sortie de l'oxygénateur, le mélange avec la solution électrolytique riche en potassium, et pompe le mélange dans la ligne de cardioplégie. La cardioplégie est administrée dans la racine de l'aorte, perfusée directement dans les coronaires en cas d'aortotomie, ou injectée à basse pression dans le sinus coronaire [d’après référence 10].
Une modification de la cardioplégie cristalloïde consiste à administrer un petit volume d'une solution hautement concentrée [2]. Ces très fortes concentrations, notamment en en K+, sont possibles parce que la quantité perfusée représente approximativement le volume de l'arbre coronarien; la majeure partie de la solution reste donc dans le cœur et ne se déverse pas dans la circulation générale. Ce petit volume ne permet pas des échanges thermiques significatifs; la protection, d'une durée de 30-60 minutes, est assurée par la composition de la solution mais non par l'hypothermie.
- Custodiol™, solution de Bretschneider hyperkaliémique pauvre en Na+ et en Ca2+ mais additionnée d’histidine, de kéto-glutarate et de mannitol, administrée en une seule dose de 5 mL/kg en 7-10 minutes.
- Cardioplexol™, solution hyperkaliémique (100 mmol/L) et hypermagnésémique (162 mmol/L) additionnée de xylitol et de procaïne; elle se donne en un bolus de 100 mL, ce qui représente 10 mmol de K+, 16.2 mmol de Mg2+ et 300 mg de procaïne; elle protège le cœur pour 45 minutes, quelle que soit la température.
Les données actuelles montrent que ces différentes solutions sont probablement équivalentes entre elles en terme d'incidence d'infarctus, de FA ou de fonction ventriculaire post-CEC, mais elles sont insuffisantes pour assurer leur efficacité dans les cas à haut risque coronarien ou dans les dysfonctions ventriculaires sévères [17,23].
Cardioplégie au sang
Le sang artériel prélevé sur le circuit de CEC par une pompe séparée est additionné d'une solution électrolytique riche en potassium dans une proportion cristalloïde/sang de 1:4. Il traverse un échangeur thermique indépendant (Figure 24.6). Le mélange est souvent additionée de mannitol, d'un tampon (THAM, Tris) et de solution citrate-phosphate-dextrose pour abaisser le calcium. Le but est de réduire la calcémie (chélation), d'accroître l'osmolarité, de tamponner, et de gérer la température. Le résultat est un perfusat alcalin (pH ≥ 7.6) et hyperosmolaire (≥ 330 mOsm), contenant 20-26 mmol/L de potassium et peu de calcium (≤ 1 mmol/L) (Tableau 24.3). On profite ainsi de la capacité du sang à transporter de l'oxygène, de son pouvoir tampon, et de ses qualités rhéologiques et oncotiques. Le sang, et tout particulièrement les érythrocytes, ont l'avantage d'apporter des antagonistes des radicaux libres (superoxide dismutase, glutathion, catalase). L'histidine des protéines du plasma fournit la majeure partie du pouvoir tampon, efficace quelle que soit la température. Par rapport aux solutions cristalloïdes à 4°C, la cardioplégie au sang oblige à de plus fréquentes reperfusions pour maintenir l'asystolie (toutes les 15-20 minutes) [26].

Figure 24.6 : Circuit de cardioplégie au sang avec ses différents composants.

La cardioplégie au sang offre une protection supérieure à celle des solutions cristalloïdes, notamment dans les cas à risque élevé (coronaropathie sévère, dysfonction ventriculaire): moins de lésions ischémiques et d'infarctus, reprise du rythme sinusal spontané plus fréquente, meilleure préservation des réserves d'ATP, meilleure fonction ventriculaire post-CEC, moindre libération d'enzymes (CK-MB, troponines) [8,25]. Ces données ne se traduisent cependant par aucun effet sur la morbi-mortalité [12,27]. Il existe même une tendance vers davantage de séquelles neurologiques chez les patients opérés en normothermie et perfusés avec une cardioplégie au sang normothermique [12].
Une variation dans la proportion solution/sang consiste à injecter par une pompe-seringue (à 45 mL/h) une solution cardioplégique concentrée contenant 16 mmol/L de KCl et 3 mmol/L de Mg2+ dans un débit de sang pris sur la ligne artérielle de CEC, dont la température est > 30°C [6]. Cette technique limite le degré d’hémodilution ("miniplégie").
La cardioplégie au sang peut être administrée sous trois températures différentes [8,26].
- L'arrêt est en général induit par une perfusion froide (5-10°C) de 2-4 minutes à 200-300 mL/min et sous une pression de 60-150 mmHg, riche en potassium (20-26 mmol/L); le maintien de l'immobilité mécanique est assuré par des perfusions itératives à 150 mL/min contenant moins de potassium (12-15 mmol/L) [3]. En hypothermie, l'oxygénation tissulaire est toutefois diminuée par le fait que la courbe de dissociation de l'hémoglobine est déplacée vers la gauche; à 20°, le sang ne libère que la moitié de l'O2 qu'il fournit à 37°. Les températures basses améliorent la protection et permettent un temps d'arrêt entre les perfusions (30-40 minutes), mais les lésions de reperfusion restent très importantes.
- Les malades qui souffrent d'angor instable aigu nécessitant une revascularisation d'urgence ont souvent des réserves d'ATP épuisées; on peut les améliorer en débutant par une cardioplégie hyperkaliémique chaude (37°) qui fournit du substrat métabolique (acides aminés), suivie ou non par des perfusions itératives de cardioplégie froide.
- On peut aussi utiliser exclusivement une perfusion de cardioplégie au sang normothermique, mais elle doit rester continue (> 80 mL/min) ou réitérée toutes les 10 minutes. Si la distribution intramyocardique est inadéquate (cardiopathie hypertrophique, coronaropathie sévère), le coeur est alors exposé à des lésions ischémiques parce que le métabolisme n'est pas freiné. Par rapport à la cardioplégie froide, la cardioplégie "chaude" tend à améliorer la fonction ventriculaire postopératoire et à diminuer les marqueurs ischémiques (troponines, CK-MB), essentiellement dans les cas où elle peut rester continue pendant toute l'intervention; cependant, elle ne modifie ni le devenir clinique ni la mortalité [1,9]. L'inconvénient de la perfusion continue lors de revascularisation coronarienne est le débit constant de sang sous pression par les anastomoses. L'administration continue par voie rétrograde est plus pratique car la pression de perfusion est basse [22].
- Un compromis est recherché dans une température intermédiaire tiède (27-30°C), qui s'est révélée efficace pour la protection myocardique, qui atténue les lésions de reperfusion et qui limite les dégâts en cas de défaut de perfusion [18,26].
- Avant la revascularisation, une perfusion de cardioplégie normothermique (hot shot) pendant 2-3 minutes à 50-80 mmHg, diminue les lésions de reperfusion [5].
Bien qu'il existe de multiples manières de gérer la protection myocardique, on peut faire quelques propositions de principe [3].
- Dans les cas standards à bas risque, la cardioplégie cristalloïde froide et la cardioplégie au sang hypotherme ou normotherme font jeu égal.
- La cardioplégie au sang est préférable pour les cas à risque élevé.
- L'arrêt initial est réalisé avec une solution froide (500 mL) hyperpotassique antérograde; dans les sténoses coronariennes sévères, elle est complétée par une perfusion rétrograde. La cardioplégie initiale chaude est plutôt réservée aux syndromes coronariens aigus ou instables chez qui elle constitue une forme de réanimation myocardique pré-pontage [22].
- La cardioplégie au sang normotherme doit subir le moins d'interruption possible et idéalement être continue (concentration en K+ 12-18 mmol/L).
- La cardioplégie au sang continue chaude ou intermittente froide par voie rétrograde est mieux adaptée à la chirurgie valvulaire; en cas d'insuffisance aortique, la voie intracoronarienne directe et/ou rétrograde est essentielle.
- Le VD étant plus difficile à protéger, il est judicieux de commencer les pontages par la coronaire droite et d'utiliser le greffon pour assurer la cardioplégie itérative de ce ventricule.
- Une fois l'anastomose distale réalisée, chaque greffon permet l'administration de cardioplégie itérative dans son territoire.
- Quelques minutes avant le déclampage aortique, une perfusion de sang normotherme (hot-shot de 500 mL) est administrée à une pression de 50-80 mmHg par voie antérograde.
Substances ajoutées
Les solutions de cardioplégie doivent être légèrement hyperosmolaires pour diminuer l'oedème, légèrement alcalines pour freiner l'acidose lactique, et contenir peu de calcium pour minimiser l'accumulation calcique intracellulaire et intra-mitochondriale. De nombreux additifs sont utilisés pour remplir ces fonctions et de nombreuses substances peuvent être ajoutées dans le but de réduire les lésions d'ischémie/reperfusion [14,16,26].
- Substances tampon: THAM, Tris, histidine (protéines). La modification de la constante de dissociation du bicarbonate de Na+ avec la température le rend impropre à alcaliniser une solution en hypothermie profonde.
- Agents hyperosmolaires: mannitol, albumine, colloïde.
- Antagonistes des radicaux libres: mannitol, déferoxamine.
- Antagoniste du Ca2+: magnésium.
- Précurseurs métaboliques: aspartate-glutamate (intermédiaires du cycle de Krebs), glucose-insuline (stimulation de la pyruvate-déshydrogénase).
- Précurseur du NO•: L-arginine (vasodilatation, réduction des effets du SIRS). A faible concentration, le NO préserve la fonction ventriculaire, mais il l'inhibe à forte concentration [11].
- Précurseur de l'ATP: adénosine; cette dernière a un effet vasodilatateur et préconditionnant.
- Substances pharmacologiques stabilisatrices des membranes: stéroïdes.
- Béta-bloqueurs: esmolol et landiolol (voir Tableau 4.26). Leur effet bénéfique en cas d'ischémie myocardique a incité à extrapoler leur activité à la protection du myocarde pendant l'arrêt circulatoire; l'esmolol semble en effet améliorer la reprise fonctionnelle après cardioplégie [7]. Protocole d'administration: esmolol 1 mg/kg iv avant le clampage aortique + 2 mg/kg dans la solution de cardioplégie.
- Antiplaquettaires: abciximab, tirofiban. Réduire l'agrégabilité plaquettaire diminue le risque de microthromboses et de non-reperfusion dans les lésions aiguës.
- Bloqueur de l’échangeur Na+/H+ : cariporide, amiloride, eniporide. L'acidose intracellulaire de l'ischémie active l'extrusion des ions H+ accumulés en échange de Na+; mais l'accumulation de ce Na+ active à son tour l'échangeur Na+/Ca++ qui importe du Ca++ en échange de la sortie de Na+. Le bilan est une surcharge calcique intracellulaire. Bien qu’améliorant les lésions de reperfusion, ces substances semblent augmententer le taux d’AVC et ne sont pour l’instant pas utilisées en clinique [19].
- Inhibition de l'entrée de Na+ par les canaux sodiques électrodépendants: procaïne (solutions de St Thomas et de Bretschneider), lidocaïne (solution de del Nido), ranolazine. Ces substances limitent l'accumulation de Ca+ en freinant l'échange Na+/Ca++ puisque le bilan sodique intracellulaire est négatif.
- Ouverture des canaux potassiques (KATP): nicorandil, pinacidil, diazoxide. L'entrée de K+ hyperpolarise la membrane, raccourcit le potentiel d'action et réduit l'entrée secondaire de Ca++.
- Fermeture du pore mitochondrial responsable de la fuite de peroxydes et du cytocgrome c dans le sarcoplasme cellulaire (MPTP: mitochondrial permeability transition pore): cyclosporine A. L'ouverture des canaux KATP referme également le pore MPTP.
- Inhibition du complément : le pexelizumab et le TP10, qui inhibent la chaîne du complément au niveau de C5a, atténuent la morbi-mortalité après chirurgie cardiaque dans des groupes sélectionnés de patients, sans pour l’instant faire preuve d’effets cliniques significatifs [24].
D'une manière générale, le passage des travaux expérimentaux chez l'animal aux applications cliniques chez l'homme s'est avéré décevant en raison de la complexité des facteurs en jeu, des nombreuses comorbidités et des traitements annexes qui interfèrent avec l'effet cardioprotecteur de ces substances.
Antioxydants
De nombreuses substances agissent comme détoxifiants des radicaux libres (ROS : reactive oxygen species). De multiples études expérimentales chez l’animal ont démontré leur utilité pour diminuer les lésions myocardiques de l’ischémie et de la reperfusion. Les études cliniques, en revanche, n’ont pas mis en évidence d’impact sur le devenir des patients, bien que certaines de ces substances réduisent significativement les dégâts cellulaires [15]. L’application clinique se heurte à trois problèmes : 1) les tissus ischémiques sont peu accessibles aux médicaments administrés, 2) ceux-ci ont un faible taux de pénétration intracellulaire, 3) les organes concernés (cœur, vaisseaux, reins) souffrent déjà d’affections modifiant leur réaction à ces substances.
Parmi les anti-oxydants, on peut citer plusieurs substances, malheureusement sans grand impact en clinique.
- La superoxyde-dismutase, enzyme intracellulaire physiologique;
- La deferoxamine, qui chélate le Fe2+ donneur de protons;
- Le mannitol est utilisé dans certaines solutions de cardioplégie, mais reste dans le liquide extracellulaire;
- L’allopurinol, qui inhibe la xanthine-oxydase et peut diminuer le taux de CK-MB lorsqu’on le rajoute à la cardioplégie;
- Les vitamines C (acide ascorbique) et E (alpha-tocophérol), qui ont donné des résultats très disparates;
- La N-acétylcystéine, précurseur du glutathion et détoxifiant intracellulaire de plusieurs ROS, qui a démontré un certain effet de protection myocardique et rénale.
Plusieurs agents d’anesthésie se trouvent avoir un certain effet protecteur intracellulaire face à l’ischémie, notamment le propofol et le thiopental, plus efficaces sur le système nerveux central que sur le myocarde ; les diazépines ont peu d’activité protectrice, et l’étomidate est dénué d’effet. Les halogénés exercent une protection efficace par préconditionnement, qui représente une double activité sur les radicaux libres : ils induisent la formation d’un petite quantité de ROS qui agit comme messager intracellulaire, puis diminuent le taux total de ROS massivement libérés pendant l’ischémie et la reperfusion [21]. De cette manière, ils atténuent les lésions biochimiques et structurelles de l’ischémie dans le cœur, les reins, le foie, les reins et le cerveau (voir Préconditionnement) [13,20].
| Solutions de cardioplégie |
|
Les solutions de cardioplégie peuvent être réparties en trois groupes :
- Solutions cristalloïdes hyperkaliémique et hypothermes, de type extracellulaire (St
Thomas) ou intracellulaire (Bretschneider, del Nido)
- Miniplégie: solution concentrée représentant le volume de l'arbre coronarien
- Cardioplégie au sang, avec addition de K+ ; avantages : apport d’O2 et d’ATP, tampon
(valences histidine); rapport sang/cristalloïde 4:1
L’arrêt est provoqué par une hyperkaliémie, en général froide (5-10°C). La durée de la protection est de 30-40 min avec les solutions cristallo!ides froides et de 20 minutes avec les solutions au sang hypotherme. Une solution de sang normotherme permet de réduire les lésions de reperfusion mais doit être continue.
De nombreuses substances peuvent être ajoutées selon les protocoles, entre autres :
- Tampon : Tris, THAM, histidine (le bicarbonate perd son effet tampon à froid)
- Agents hyperosomolaires (mannitol, albumine, colloïde)
- Magnésium, stéroïde, procaïne
- ATP, glucose
- Agents anti-oxydants
|
© CHASSOT PG, Juin 2008, dernière mise à jour, Juin 2018
Références
- ABAH U, ROBERTS PG, ISHAQ M, et al. Is cold or warm cardioplegia superior for myocardial protection ? Interact Cardiovasc Thorac Surg 2012 ; 14 :848-55
- ANGELI E. The crystalloid cardioplegia: advantages with a word of caution. Ann Fr Anesth Réan 2011; 30:S17-S19
- BOJAR RM. Myocardial protection. In: BOJAR RM. Manual of perioperative care in adult cardiac surgery. 5th edition. Blackwell Publishing Ltd, 2011, 265-78
- BUCKBERG GD. Strategies and logic of cardioplegic delivery to prevent, avoid and reverse ischemic and reperfusion damage. J Thorac Cardiovasc Surg 1987; 93:127-35
- BUCKBERG GD. Update on current techniques of myocardial protection. Ann Thorac Surg 1995; 60:805-14
- CALAFIORE AM, TEODORI G, MEZZETTI A, ET AL. Intermittent antegrade warm blood caredioplegia. Ann Thorac Surg 1995; 59:398-402
- DAHLE GO, SALMINEN PR, MOEN CA, et al. Esmolol added in repeated, cold, oxygenated blood cardioplegia improves myocardial function after cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2015; 29:684-93
- DECOENE C. La cardioplégie sanguine: avantages et inconvéniuents. Ann Fr Anesth Réan 2011; 30:S20-S22
- FAN Y, ZHANG AM, XIAO Y, et al. Warm versus cold cardioplegia for heart surgery: a meta-analysis. Eur J Cardiothorac Surg 2010; 37:912-9
- GRAVLEE GP, DAVIS RF, KURUSZ M, UTLEY JR. Cardiopulmonary bypass. Principles and practice. Philadelphia: Lippincott Williams & Wilkins, 2000, p 70
- HEUSCH G, BOENGLER K, SCHULTZ R. Cardioprotection. Nitric oxide, protein kinases, and mitochondria. Circulation 2008; 118:1915-9
- JACOB S, KALLIKOURDIS A, SELKE F, et al. Is blood cardioplegia superior to cristalloid cardioplegia? Interact Cardiovasc Thorac Surg 2008; 7:491-9
- JULIER K, DA SILVA R, GARCIA C, et al. Preconditioning by sevoflurane decreases biochemical markers for myocardial and renal dysfunction in coronary artery bypass graft surgery. Anesthesiology 2003; 98:1315-27
- KANE AE, HOWLETT SE. Novel cardioprotection strategies for the aged heart: evidence from pre-clinical studies. Clin Exp Pharmacol Physiol 2016; 43:1251-60
- KEVIN LG, NOVALIJA E, STOWE DF. Reactive oxygen species as mediators of cardiac injury and protection: the relevance to anesthesia practice. Anesth Analg 2005; 101:1275-87
- KLONER RA. Current state of clinical translation of cardioprotective agents for acute myocardial infarction. Circ Res 2013; 113:451-63
- LI Y, LIN H, ZHAO Y, et al. Del Nido cardioplegia for myocardial protection in adult cardiac surgery: a systematic review and meta-analysis. ASAIO J 2018; 64:360-7
- MALLIDI HR, SEVER J, TAMARIZ M, et al. The short-term and long-term effects of warm or tepid cardioplegia. J Thorac Cardiovasc Surg 2003; 125:711-20
- MENTZER RM, BATTELS C, BOLLI R, et al. Sodium-hydrogen exchange inhibition by cariporide to reduce the risk of ischemic cardiac events in patients undergoing coronary artery bypass grafting: results of the EXPEDITION study. Ann Thorac Surg 2008; 85:261-70
- MINGUET G, JORIS J, LAMY M. Preconditioning and protection against ischaemia-reperfusion in non-cardiac organs : a place for volatile anaesthetics ? Eur J Anaesthesiol 2007 ; 24 :733-45
- NOVALIJA E, VARADARAJAN SG, CAMARA AKS, et al. Anesthetic preconditioning : triggering role of reactive oxygen and nitrogen species in isolated hearts. Am J Physiol Heart Circ Physiol 2002 ; 283 :H44-52
- SALERNO TA. Warm heart surgery: reflections on the history of its development. J Card Surg 2007; 22:257-9
- SIDDIQI A, BLACKSTONE EH, BAKAEEN FG. Bretschneider and del Nido solutions: are they safe for coronary artery bypass grafting? If so, how should we use them? J Card Surg 2018; 33:229-34
- STAHL GL, SHERMAN SK, SMITH PK, LEVY JH. Complement activation and cardiac surgery : a novel target for improving outcomes. Anesth Analg 2012 ; 115 :759-71
- VERRIER ED, DABAL RJ, HAMPTON C, et al. Myocardial protection strategies: Present and future. In: NEWMAN MF, ed. Perioperative organ protection. 2003 SCA monograph. Lippincott Williams & Wilkins 2003, 75-88
- YAMAMOTO H, YAMAMOTO F. Myocardial protection in cardiac surgery: a historical review from the beginning to the current topics. Gen Thorac Cardiovasc Surg 2013; 61:485-96
- ZENG J, HE W, QU Z, et al. Cold blood versus crystalloid cardioplegia for myocardial protection in adult cardiac surgery: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth 2014; 28:674-81
