Introduction
La perfusion isolée d’un membre (ILP : Isolated Limb Perfusion) permet d’y administrer des quantités importantes d’antimitotiques tout en réduisant la toxicité systémique de ces substances. Cette technique autorise également le maintien du membre en hyperthermie (environ 40 °C), ce qui augmente l'efficacité cytolytique des agents. Elle s'adresse à des malades présentant des métastases en transit de mélanome ou de sarcome, isolées à un membre, sans dissémination systémique. La survie de ces patients est en général inférieure à 6 mois, même après désarticulation du membre. Le traitement permet le sauvetage du membre dans 80% des cas, avec une survie moyenne de 3 à 5 ans [3].
La machine de CEC est connectée aux vaisseaux iliaques ou fémoraux (respectivement axillaires pour le membre supérieur); elle comprend pompe, oxygénateur et réservoir comme une CEC standard, mais n'alimente que le membre isolé de la circulation générale de l'organisme (Figure 7.59).
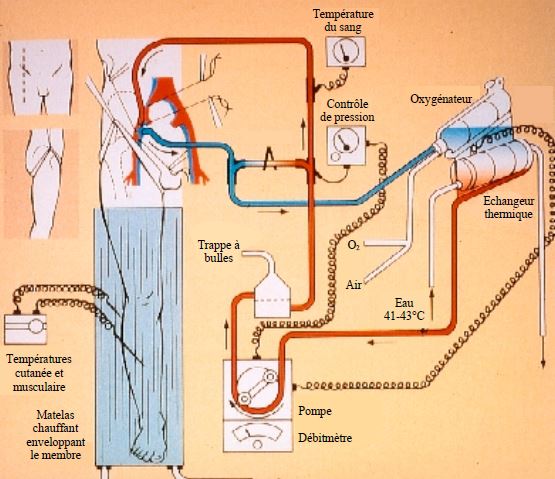
Figure 7.59 : Système de circulation extracorporelle pour une perfusion isolée du membre inférieur [203].
Les substances utilisées dans l’ILP varient selon les indications.
- Pour les mélanomes: TNFα + Interféron-gamma (IFN) + melphalan;
- Pour les mélanomes très distaux chez des personnes âgées: melphalan seul;
- Pour les sarcomes: TNFα + melphalan.
Les fuites systémiques à partir du membre isolé sont inévitables, mais leur importance dépend de la relative surpression créée dans le membre par le débit de la CEC; elles sont peu significatives lorsque ce débit est maintenu à 45 mL/min par litre de volume du membre. Ces fuites se soldent par des effets secondaires dont l’intensité est proportionnelle à leur importance et à la toxicité systémique de la substance utilisée, le plus violent étant le TNF.
- Echanges liquidiens entre le patient et la CEC;
- Hyperthermie systémique;
- Choc distributif par vasoplégie massive, en général accompagné d’hypertension pulmonaire;
- Fuite capillaire interstitielle (Capillary Leak Syndrome);
- SDRA (survient entre 6 et 24 heures post-op);
- Altérations hématologiques dues à la chimiothérapie;
- Dysfonctions organiques (insuffisance rénale, hépatique) dues au TNF.
Technique d'anesthésie
La technique est superposable à celle utilisée pour la chirurgie cardiaque mais le patient est en général endormi avant d’être équipé, sauf en cas de cardiopathie associée. Le monitorage et la prise en charge diffèrent selon que la perfusion contient du TNF ou non, car le risque de choc distributif et son intensité sont très différents dans les deux situations.
- Le monitorage comprend un cathéter artériel radial (très éventuellement fémoral contro-latéral) et un cathéter pulmonaire de Swan-Ganz pour les cas avec peprfusion de TNF, ou un cathéter artériel et une voie veineuse centrale pour les cas avec melphalan seul; voies veineuses de gros calibre.
- Antibiothérapie prophylactique.
- Induction : propofol ou etomidate selon le status cardiovasculaire.
- Entretion de l’anesthésie: propofol ou sevoflurane, fentanyl ou sufentanil.
- Mise en route de la CEC; le débit de pompe est de 45 mL/min par litre de volume du membre (mesuré en préopératoire). Des échanges liquidiens entre la CEC et le patient sont fréquents pendant cette phase, obligeant à remplir ou à vasodilater le malade à la demande; le perfusionniste peut tempérer ces variations en réglant le niveau de son réservoir veineux. Le liquide d’amorçage contient 200 mL de Ringer-lactate, 200 mL de colloïde et 50 mg héparine.
- Chauffage du membre à 40 °C (20-45 min), le patient étant posé sur le matelas à circulation d’eau à 42 °C et le membre recouvert par le matelas Bair-Hugger™ à 42 °C . Les températures monitorées sont: peau distale, muscle distal, peau proximale, muscle proximal, ligne artérielle de la CEC, rectum, œsophage, sang de l’artère pulmonaire en cas de Swan-Ganz. La CEC est débutée lorsque la température-seuil de 38°C tissulaire est atteinte.
- Injection de sérum-albumine marquée au Technécium par voie systémique (10 mCi) et dans la CEC (4 mCi). Après équilibration (10-15 min), la caméra placée sur la région précordiale estime les fuites entre le membre et la circulation systémique; on doit obtenir un plateau stable dans le comptage des isotopes, prouvant que ces fuites sont inférieures à 1 %, pour être autorisé à injecter le TNF.
- Injection dans le réservoir de CEC des substances selon le protocole choisi: TNF et ou melphalan. Circulation pendant 60 minutes (melphalan) ou 90 minutes (TNF).
- En fin de pompe, remplacement et rinçage du volume de CEC par 2000 mL de Rhéomacrodex-saline® et de Ringer-lactate vierges de tout produit (jusqu’à 6000 mL lors de perfusion avec TNF); lavage du membre par exsanguination jusqu’à ce que le liquide de rinçage soit clair.
- Fin de la CEC; décanulation, protamine selon ACT, reconstruction vasculaire et réveil du patient.
Problèmes hémodynamiques
L’intervention chirurgicale présente un risque hémorragique important, nécessitant la plupart du temps des transfusions sanguines. Pendant la CEC, des échanges liquidiens interviennent entre le membre perfusé et la circulation systémique; ils aboutissent à des surcharges ou à des spoliations de la circulation-patient. D’autre part, la toxicité propre des substances utilisées provoque un état de choc distributif caractérisé par un syndrome inflammatoire systémique massif (SIRS), une extravasation liquidienne interstitielle importante (Capillary Leak Syndrome) et une diminution sévère des résistances systémiques conduisant à une hypotension artérielle (choc distributif). Elle s’accompagne en général d’une hypertension pulmonaire et d’un haut débit cardiaque. Le relâchement du garrot en fin de CEC est le moment des plus grandes perturbations hémodynamiques, même pour les cas sans TNF. Toutefois, il est évident que le TNF est le principal responsable des effets hémodynamiques, car l’importance du choc distributif est proportionnel aux taux de TNF circulant, les résistances systémiques sont bien plus basses dans les cas avec TNF que lors du simple relâchement du garrot (effet tourniquet), et le débit cardiaque est significativement plus élevé [1]. Le rinçage du membre contribue également à la spoliation sanguine. Bien que les taux de TNF enregistrés aient pu être 10'000 fois supérieurs à ceux observés dans les chocs septiques létaux, tous les épisodes de choc distributif, quelle qu’en soit l’importance, ont été entièrement réversibles [2].
Une tachycardie soutenue est souvent le premier signe du choc distributif. La vasodilatation survient en général en fin d’intervention, après la CEC; elle peut s’installer de manière très brusque. L’administration de stimulant alpha (bolus de phényléphrine, perfusion de noradrénaline) doit commencer dès les premiers symptômes. Une diurèse forcée est recommandée pendant plusieurs heures (Vu > 1 mL/kg/heure). Des ESV multifocales peuvent êtres induites par le TNF et/ou par l’hypokaliémie; elles répondent à la lidocaïne.
Le traitement est fonction de l’intensité des symptômes.
- Remplissage: cristalloïdes et colloïdes, sang (maintenir Hb > 80 g/L); les besoins peuvent être considérables (4-10 litres).
- Noradrénaline: perfusion 2-5 mcg/min ou plus, à titrer selon les RAS; maintenir une PAM de 70-80 mm Hg pour un patient normotendu.
- Dobutamine: 3-15 mcg/kg/min si défaillance ventriculaire; maintenir un index cardiaque > 3.0 L/min/m2.
- Maintenir un débit urinaire supérieur à 1mL/kg/heure (perfusions, mannitol, éventuellement furosemide si normovolémie).
Soins postopératoires
L’évolution postopératoire est simple s’il n’y a pas eu de relargage significatif de substance. Cependant, il a été montré que, malgré un lavage extensif, une recirculation du TNF se produit dans la plupart des cas. On observe un état fébrile et un état circulatoire hyperdynamique modéré, avec élévation des besoins liquidiens. Lorsque le relargage est important, l’évolution est caractérisée par la persistance ou l’apparition dans les 12 premières heures d’un choc distributif, d’une augmentation généralisée de la perméabilité capillaire et d’un SDRA. Les patients peuvent également développer une insuffisance rénale, une CIVD et des surinfections (baisse des résistances immunitaires) [3]. Ces symptômes ne se manifestent que dans les cas d’administration de TNF. Le membre perfusé doit faire l’objet d’une surveillance attentive, vu les risques de syndrome de loge, d’ischémie ou de thrombose vasculaire.
| Perfusion isolée de membres |
|
Une CEC à volume réduit permet de perfuser un membre en circuit fermé avec de hautes concentrations d’antimitotique (TNF-α, melphalan) et en le réchauffant à 38-40°C. Indications: mélanomes et sarcomes envahissant un membre mais sans métastases à distance.
Malgré les clamps et le garrottage du membre, des fuites systémiques se produisent, entraînant:
- Vasoplégie massive (premier signe : tachycardie réfractaire)
- Syndrome inflammatoire massif
- Syndrome de détresse respiratoire (capillary leak syndrome)
Les effets hémodynamiques sont maximaux au relâchement du garrot.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- CHRISTOFORIDIS D, CHASSOT PG, MOSIMANN F, et al: Isolated limb perfusion: distinct tourniquet and tumor necrosis factor effects on the early hemodynamic response. Arch Surg 2003; 138:17-25
- EGGIMANN P, CHIOLERO R, CHASSOT PG, et al: Systemic and hemodynamic effects of recombinant tumor necrosis factor alpha in isolation perfusion of the limbs. Chest 1995; 107:1074-82
- LEJEUNE FJ, KROON BB, DI FILIPPO F, et al: Isolated limb perfusion: the European experience. Surg Oncol Clin N Am 2001; 10:821-32
