La quantification de l’IA est moins bien établie que celle de l’IM, et les critères numériques doivent être intégrés dans l’ensemble de l’image échocardiographique et de la présentation clinique du malade. Aucun d'entre eux n'a suffisamment de sensibilité ou de spécificité pour être déterminant à lui seul dans le diagnostic de l'IA. L’étendue du jet dans la chambre de chasse et dans le VG est un moyen intuitif pratique pour estimer l’importance de la fuite ou pour l'exclure, mais elle est trop dépendante des conditions hémodynamiques, des réglages de l’appareil et de l’angle d’analyse pour permettre une quantification précise. L’extension du jet dépend de sa Vmax, qui est fonction du ΔP entre l’aorte et le VG en diastole; elle augmente ou diminue parallèlement à la pression diastolique aortique. Elle varie également avec la compliance de l’aorte et du VG [1]. Le Doppler couleur est par contre utile pour repérer l'axe de la fuite et pour quantifier l’IA au moyen du PISA et de la vena contracta.
Le jet de l'IA apparaît toujours plus important en vue transgastrique (0° ou 120°), car il est situé dans l'axe du faisceau Doppler alors qu'il lui est perpendiculaire dans les vues mi-oesophagiennes. Les mesures de flux sont habituellement exécutées en protodiastole lorsque le gradient transvalvulaire est maximal. Seule la présence simultanée à l'image de la zone de convergence, du passage transvalvulaire, de la vena contracta et du jet distal assurent que le plan de coupe correspond bien à celui de la fuite [11].
Lorsque l’IA est liée à une dilatation de l’anneau aortique, un orifice de régurgitation central est bien visible en vue court axe 40° (voir Figure 26.78B). Comme les cuspides sont normales, la surface de cet orifice est dans le plan de la valve. Sa mesure est une quantification fiable de l’IA parce qu’indépendante de l’hémodynamique. Il mesure > 0.3 cm2 dans une IA sévère. En cas de lésion des cuspides (prolapsus, déchirure), il devient plus difficile de réaliser correctement cette mesure car la surface de fuite a une forme complexe dans l’espace.
PISA
La présence d’une zone d'accélération concentrique (PISA, proximal isovelocity surface area) bien visible sur le versant aortique de la valve signe une IA modérée à sévère. La surface de l’orifice de régurgitation (SORIA) peut être calculée à partir du rayon de l’hémisphère de 1er aliasing de ce PISA au moyen de l’équation de continuité, comme pour la valve mitrale (échelle du flux couleur réglée à environ 0.4 m/s):
SORIA = (6.28 • r2 • Valias) / VmaxIA
Une SOR > 0.3 cm2 signe une IA sévère. La limite de Nyquist est ajustée pour obtenir le PISA le plus hémisphérique possible en protodiastole. Cette mesure est peu utilisée en ETO parce que l’axe du PISA est très différent de celui du Doppler en vues mi-oesophagiennes et parce que l’image est très imprécise en vues transgastriques à cause de la profondeur. D’autre part, la géométrie de la valve est telle que le PISA n’est hémisphérique que dans les IA centrales sur dilatation de l’anneau; dans les IA excentrique, sa configuration ne permet pas de mesure précise et sa taille devient une appréciation qualitative (Figure 26.88).
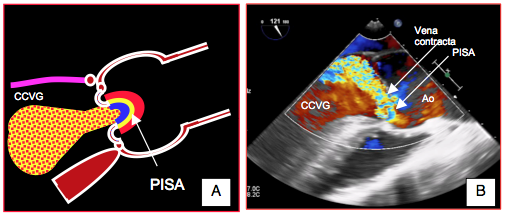
Figure 26.88 : PISA dans l'insuffisance aortique. A: sa forme hémisphérique n'est visible que dans les IA centrales majeures. B: la zone d'accélération concentrique est très déformée dans les IA excentriques.
La valve se présente souvent comme un entonnoir; le résultat doit donc être corrigé pour l'angle formé par la surface non-planaire de la valve (α/180), sans quoi la surface de régurgitation est surestimée: S = (2 π r2 • Valias) / VIA • α/180. Dans les cas de biscupidie ou de sténose combinée, la valve se présente avec un cône dirigé vers l'aorte; le flux de l'IA l'aborde donc par son petit orifice, et le PISA devient plus grand qu'un hémisphère. Le calcul tend alors à sous-estimer la surface réelle de l'orifice de régurgitation. Dans les IA modérées, enfin, le PISA est faible, aplati et inutilisable pour une quantification.
Le volume régurgité par battement est obtenu en multipliant la surface de l'orifice de régurgitation (SOR) par l'intégrale des vélocités du flux diastolique de l'IA: Vrég (cm3) = SORIA (cm2) • ITVIA (cm). Un volume ≥ 60 mL est caractéristique d'une IA sévère.
Vena contracta
Le diamètre de la vena contracta (VC) à son origine, juste distalement à la valve, là où le jet est le plus étroit, est une bonne manière de quantifier l’IA, car la surface de la VC reproduit fidèlement celle de l'orifice de régurgitation. Toutefois, le calcul de cette surface par celle de la VC mesurée par son diamètre présuppose que la section du jet est circulaire, ce qui est une approximation souvent douteuse (Figure 26.89). Le diamètre mesure 0.3-0.6 cm dans une IA modérée et > 0.6 cm dans une IA sévère (limite de Nyquist 0.6 m/s, image avec zoom). La mesure de la vena contracta est facile dans les IA centrales dont le jet est symétrique ; elle est plus délicate dans les IA excentriques et asymétriques. Dans ces conditions, il est important de visualiser le jet dans au moins 2 plans différents, si possible orthogonaux, parce que la section de la vena contracta varie d’un ovale à une fente (Vidéo). Il faut donc l'observer à 0°, 40° et 120° en vues oesophagiennes pour en déterminer sa géométrie exacte. L'IA est sévère si la surface de section de la VC est > 0.35 cm2. La mesure de la VC est la mesure la plus sensible et la plus fiable pour quantifier une IA en imagerie bidimensionnelle [5].
Vidéo: vue long-axe 120° d'une insuffisance aortique sévère; cette IA centrale liée à une maladie ectasiante de la racine aortique présente une section approximativement circulaire qui permet sa quantification par la mesure de la vena contracta.
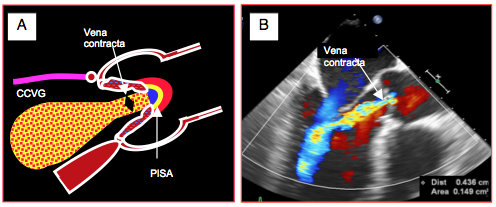
Figure 26.89 : Vena contracta et insuffisance aortique. La vena contracta est mesurée par le diamètre du jet à son origine. Dans le cas illustré, il mesure 0.4 cm.
Pour tenir compte de la taille du coeur, le diamètre du jet en long axe peut être rapporté à celui de la CCVG mesuré au même endroit (3-4 mm en amont de la valve) (Figure 26.90) ; le rapport est de 0.3-0.5 dans une IA modérée est de > 0.6 dans une IA sévère. Le calcul est plus précis s’il est réalisé en mode TM à travers la chambre de chasse à 120° (Figure 26.91) [8]. Pour être plus adéquat dans l'évaluation de la CCVG, ce diamètre est mesuré un peu plus loin que la vena contracta et n'en est pas équivalent. Un jet excentrique ou très divergent ne permet pas d'établir un rapport correct.

Figure 26.90 : Rapport entre le diamètre du jet d'IA et celui de la chambre de chasse du VG. Dans le cas illustré, le premier est de 0.8 cm et le deuxième de 2.5 cm; le rapport est de 0.3, ce qui en fait une IA modérée.
Figure 26.91 : Mesures du diamètre du jet d'IA et du diamètre de la chambre de chasse du VG en mode TM sur une vue long axe 120°. Dans cette illustration, le diamètre du jet est de 0.6 cm et celui de la CCVG de 2.1 cm; le rapport est de 0.3.
Temps de demi-pression
Le flux de l’IA enregistré au Doppler continu en vue transgastrique donne une trace spectrale dirigée vers le capteur, dont la silhouette est caractéristique. La densité de la trace est peu fonction de l’importance de l’IA [2]. Depuis sa vélocité maximale de 3-4 m/s en protodiastole, il subit une décélération progressive au cours de la diastole. La pente de cette décélération est directement fonction de la vitesse avec laquelle s’égalisent les pressions entre l’aorte et le VG. Si l’orifice de régurgitation est petit (IA mineure), le ΔP entre l’aorte et le ventricule diminue peu en cours de diastole et la pente est faible. Si l’orifice est grand (IA sévère), le ΔP baisse rapidement au fur et à mesure que le VG se remplit ; la pente est très forte (> 3 m/s2) [2,4].
La pente de décélération de l’IA permet d’en calculer le temps de demi-pression (Pt1/2), qui est le temps nécessaire pour que la pression décroisse de 50% ou la Vmax de 0.7 (voir Chapitre 25, Temps de demi-pression) [2]. Un Pt1/2 de > 500 msec correspond à une IA mineure et un Pt1/2 de < 250 msec à une IA sévère. La compliance du VG modifie considérablement le Pt1/2: il est raccourci dans une insuffisance diastolique sévère à cause de la pression diastolique élevée du VG et surestime donc l'importance de l'IA (Figure 26.92) [1].
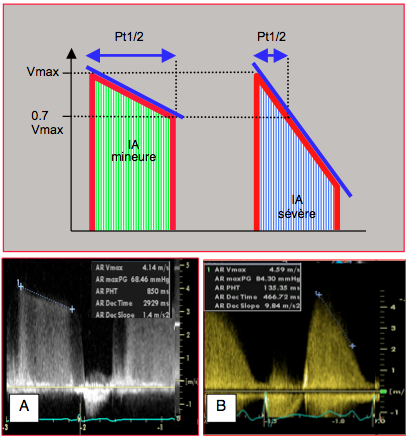
Figure 26.92 : Calcul du temps de demi-pression (Pt1/2) dans deux cas d'insuffisance aortique. A: IA mineure; le Pt1/2 est de 850 ms. B: IA sévère; le Pt1/2 est de 135 ms. Dans les deux cas, la Vmax de l'IA est > 4 m/s.
Volumétrie
Le volume régurgité (Vrég) en diastole par l'IA doit être ré-éjecté en systole par le VG. Le volume systolique (VS) mesuré dans la CCVG est donc la somme du VS systémique et du Vrég. En l'absence d'autre insuffisance ou de shunt, le VS systémique est l'égal du VS éjecté par le VD. Comme le VS est le produit de la surface du conduit par l'intégrale des vélocités (VS = S • ITV), on peut calculer le Vrég de l'IA par la formule [10]:
VrégIA = VSCCVG – VSCCVD
VrégIA = (SCCVG • ITVCCVG) – (SCCVD • ITVCCVD)
De cette équation, on peut ensuite trouver la surface de l'orifice de régurgitation (SOR) en divisant la Vrég de l'IA par l'ITV du jet d'IA:
SORIA = VrégIA / ITVIA
L'ITVIA est mesurée par le dessin du pourtour de l'image spectrale du jet diastolique de l'IA au Doppler continu par voie transgastrique (voir Figure 26.85). Toutefois, ces mesures sont pénalisées par les incertitudes qui règnent sur la quantification de la chambre de chasse.
Le jet de l'IA apparaît toujours plus important en vue transgastrique (0° ou 120°), car il est situé dans l'axe du faisceau Doppler alors qu'il lui est perpendiculaire dans les vues mi-oesophagiennes. Les mesures de flux sont habituellement exécutées en protodiastole lorsque le gradient transvalvulaire est maximal. Seule la présence simultanée à l'image de la zone de convergence, du passage transvalvulaire, de la vena contracta et du jet distal assurent que le plan de coupe correspond bien à celui de la fuite [11].
Lorsque l’IA est liée à une dilatation de l’anneau aortique, un orifice de régurgitation central est bien visible en vue court axe 40° (voir Figure 26.78B). Comme les cuspides sont normales, la surface de cet orifice est dans le plan de la valve. Sa mesure est une quantification fiable de l’IA parce qu’indépendante de l’hémodynamique. Il mesure > 0.3 cm2 dans une IA sévère. En cas de lésion des cuspides (prolapsus, déchirure), il devient plus difficile de réaliser correctement cette mesure car la surface de fuite a une forme complexe dans l’espace.
PISA
La présence d’une zone d'accélération concentrique (PISA, proximal isovelocity surface area) bien visible sur le versant aortique de la valve signe une IA modérée à sévère. La surface de l’orifice de régurgitation (SORIA) peut être calculée à partir du rayon de l’hémisphère de 1er aliasing de ce PISA au moyen de l’équation de continuité, comme pour la valve mitrale (échelle du flux couleur réglée à environ 0.4 m/s):
SORIA = (6.28 • r2 • Valias) / VmaxIA
Une SOR > 0.3 cm2 signe une IA sévère. La limite de Nyquist est ajustée pour obtenir le PISA le plus hémisphérique possible en protodiastole. Cette mesure est peu utilisée en ETO parce que l’axe du PISA est très différent de celui du Doppler en vues mi-oesophagiennes et parce que l’image est très imprécise en vues transgastriques à cause de la profondeur. D’autre part, la géométrie de la valve est telle que le PISA n’est hémisphérique que dans les IA centrales sur dilatation de l’anneau; dans les IA excentrique, sa configuration ne permet pas de mesure précise et sa taille devient une appréciation qualitative (Figure 26.88).

Figure 26.88 : PISA dans l'insuffisance aortique. A: sa forme hémisphérique n'est visible que dans les IA centrales majeures. B: la zone d'accélération concentrique est très déformée dans les IA excentriques.
La valve se présente souvent comme un entonnoir; le résultat doit donc être corrigé pour l'angle formé par la surface non-planaire de la valve (α/180), sans quoi la surface de régurgitation est surestimée: S = (2 π r2 • Valias) / VIA • α/180. Dans les cas de biscupidie ou de sténose combinée, la valve se présente avec un cône dirigé vers l'aorte; le flux de l'IA l'aborde donc par son petit orifice, et le PISA devient plus grand qu'un hémisphère. Le calcul tend alors à sous-estimer la surface réelle de l'orifice de régurgitation. Dans les IA modérées, enfin, le PISA est faible, aplati et inutilisable pour une quantification.
Le volume régurgité par battement est obtenu en multipliant la surface de l'orifice de régurgitation (SOR) par l'intégrale des vélocités du flux diastolique de l'IA: Vrég (cm3) = SORIA (cm2) • ITVIA (cm). Un volume ≥ 60 mL est caractéristique d'une IA sévère.
Vena contracta
Le diamètre de la vena contracta (VC) à son origine, juste distalement à la valve, là où le jet est le plus étroit, est une bonne manière de quantifier l’IA, car la surface de la VC reproduit fidèlement celle de l'orifice de régurgitation. Toutefois, le calcul de cette surface par celle de la VC mesurée par son diamètre présuppose que la section du jet est circulaire, ce qui est une approximation souvent douteuse (Figure 26.89). Le diamètre mesure 0.3-0.6 cm dans une IA modérée et > 0.6 cm dans une IA sévère (limite de Nyquist 0.6 m/s, image avec zoom). La mesure de la vena contracta est facile dans les IA centrales dont le jet est symétrique ; elle est plus délicate dans les IA excentriques et asymétriques. Dans ces conditions, il est important de visualiser le jet dans au moins 2 plans différents, si possible orthogonaux, parce que la section de la vena contracta varie d’un ovale à une fente (Vidéo). Il faut donc l'observer à 0°, 40° et 120° en vues oesophagiennes pour en déterminer sa géométrie exacte. L'IA est sévère si la surface de section de la VC est > 0.35 cm2. La mesure de la VC est la mesure la plus sensible et la plus fiable pour quantifier une IA en imagerie bidimensionnelle [5].
Vidéo: vue long-axe 120° d'une insuffisance aortique sévère; cette IA centrale liée à une maladie ectasiante de la racine aortique présente une section approximativement circulaire qui permet sa quantification par la mesure de la vena contracta.

Figure 26.89 : Vena contracta et insuffisance aortique. La vena contracta est mesurée par le diamètre du jet à son origine. Dans le cas illustré, il mesure 0.4 cm.
Pour tenir compte de la taille du coeur, le diamètre du jet en long axe peut être rapporté à celui de la CCVG mesuré au même endroit (3-4 mm en amont de la valve) (Figure 26.90) ; le rapport est de 0.3-0.5 dans une IA modérée est de > 0.6 dans une IA sévère. Le calcul est plus précis s’il est réalisé en mode TM à travers la chambre de chasse à 120° (Figure 26.91) [8]. Pour être plus adéquat dans l'évaluation de la CCVG, ce diamètre est mesuré un peu plus loin que la vena contracta et n'en est pas équivalent. Un jet excentrique ou très divergent ne permet pas d'établir un rapport correct.

Figure 26.90 : Rapport entre le diamètre du jet d'IA et celui de la chambre de chasse du VG. Dans le cas illustré, le premier est de 0.8 cm et le deuxième de 2.5 cm; le rapport est de 0.3, ce qui en fait une IA modérée.

Figure 26.91 : Mesures du diamètre du jet d'IA et du diamètre de la chambre de chasse du VG en mode TM sur une vue long axe 120°. Dans cette illustration, le diamètre du jet est de 0.6 cm et celui de la CCVG de 2.1 cm; le rapport est de 0.3.
Temps de demi-pression
Le flux de l’IA enregistré au Doppler continu en vue transgastrique donne une trace spectrale dirigée vers le capteur, dont la silhouette est caractéristique. La densité de la trace est peu fonction de l’importance de l’IA [2]. Depuis sa vélocité maximale de 3-4 m/s en protodiastole, il subit une décélération progressive au cours de la diastole. La pente de cette décélération est directement fonction de la vitesse avec laquelle s’égalisent les pressions entre l’aorte et le VG. Si l’orifice de régurgitation est petit (IA mineure), le ΔP entre l’aorte et le ventricule diminue peu en cours de diastole et la pente est faible. Si l’orifice est grand (IA sévère), le ΔP baisse rapidement au fur et à mesure que le VG se remplit ; la pente est très forte (> 3 m/s2) [2,4].
La pente de décélération de l’IA permet d’en calculer le temps de demi-pression (Pt1/2), qui est le temps nécessaire pour que la pression décroisse de 50% ou la Vmax de 0.7 (voir Chapitre 25, Temps de demi-pression) [2]. Un Pt1/2 de > 500 msec correspond à une IA mineure et un Pt1/2 de < 250 msec à une IA sévère. La compliance du VG modifie considérablement le Pt1/2: il est raccourci dans une insuffisance diastolique sévère à cause de la pression diastolique élevée du VG et surestime donc l'importance de l'IA (Figure 26.92) [1].

Figure 26.92 : Calcul du temps de demi-pression (Pt1/2) dans deux cas d'insuffisance aortique. A: IA mineure; le Pt1/2 est de 850 ms. B: IA sévère; le Pt1/2 est de 135 ms. Dans les deux cas, la Vmax de l'IA est > 4 m/s.
Volumétrie
Le volume régurgité (Vrég) en diastole par l'IA doit être ré-éjecté en systole par le VG. Le volume systolique (VS) mesuré dans la CCVG est donc la somme du VS systémique et du Vrég. En l'absence d'autre insuffisance ou de shunt, le VS systémique est l'égal du VS éjecté par le VD. Comme le VS est le produit de la surface du conduit par l'intégrale des vélocités (VS = S • ITV), on peut calculer le Vrég de l'IA par la formule [10]:
VrégIA = VSCCVG – VSCCVD
VrégIA = (SCCVG • ITVCCVG) – (SCCVD • ITVCCVD)
De cette équation, on peut ensuite trouver la surface de l'orifice de régurgitation (SOR) en divisant la Vrég de l'IA par l'ITV du jet d'IA:
SORIA = VrégIA / ITVIA
L'ITVIA est mesurée par le dessin du pourtour de l'image spectrale du jet diastolique de l'IA au Doppler continu par voie transgastrique (voir Figure 26.85). Toutefois, ces mesures sont pénalisées par les incertitudes qui règnent sur la quantification de la chambre de chasse.
- La mesure du diamètre doit se faire en méso-systole entre le septum et le feuillet antérieur de la valve mitrale dans les 2-5 premiers millimètres en amont de la valve aortique. La précision de cette mesure laisse souvent à désirer, comme toutes celles réalisées dans un plan parralèle à un conduit; il faut modifier l'orientation du plan afin d'obtenir le plus grand diamètre et éviter une mesure tangentielle.
- L'obtention de la surface par la mesure du diamètre présuppose que la section est circulaire; or la CCVG est ovale. Comme la vue ETO ne donne accès qu'au petit diamètre de l'ellipse, la surface calculée est plus petite que la réalité et le volume systolique inférieur au VS réel d'environ 20% [7].
- L'axe du faisceau Doppler pulsé doit passer au milieu de la chambre de chasse afin d'éviter les vélocités accélérées proches du septum et celles ralenties au voisinage de la mitrale.
- Il n'est pas aisé d'obtenir un bon alignement avec la chambre de chasse droite en ETO; les vues transgastriques sont les plus adéquates (voir Figure 26.70), mais elles sont parfois difficiles à réaliser. Comme les dimensions de la CCVD varient considérablement entre la systole et la diastole, il est capital de faire les mesures en systole avec le plus grand diamètre.
Le volume régurgité dépend de la durée de la diastole, représentée dans les équations ci-dessus par l'ITV qui est l'intégrale des vélocités par rapport au temps. Lorsque la diastole se raccourcit par tachycardie, le Vrég diminue, alors que la surface de l'orifice de régurgitation ne change pas. La SOR est donc le critère le plus stable de l'importance de l'IA. En hémodynamique systémique, un débit cardiaque > 10 L/min au repos est pathognomonique d'une IA majeure.
Synthèse
Comme l’IM, l’IA est quantifiée par des critères spécifiques, des critères d’appoint et des paramètres structuraux [9,11,12,13]. Une IA modérée est caractérisée par :
Synthèse
Comme l’IM, l’IA est quantifiée par des critères spécifiques, des critères d’appoint et des paramètres structuraux [9,11,12,13]. Une IA modérée est caractérisée par :
- Dilatation modérée du VG (diamètre en court-axe < 6 cm);
- Orifice de régurgitation 0.2 cm2;
- Jet d’IA atteignant l’extrémité du feuillet antérieur de la mitrale;
- Diamètre de la vena contracta 0.3 – 0.5 cm;
- Rapport vena contracta/CCVG : 30-60%;
- Temps de demi-pression 250-500 msec;
- Fraction de régurgitation < 30%.
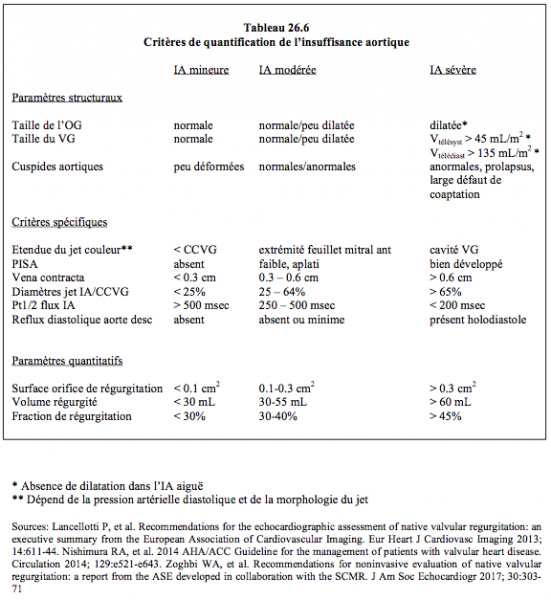
Les critères échocardiographiques définissant l’IA sévère sont les suivants (Tableau 26.6) [4,6,11]:
- Hypertrophie dilatative du VG (diamètre télédiastolique > 6.5 cm ou > 4 cm/m2) ; absent en cas d’IA aiguë;
- Jet de régurgitation s’étendant jusqu’à mi-ventricule;
- Diamètre de la vena contracta > 0.6 cm;
- Rapport diamètre jet de l’IA/diamètre CCVG > 0.6;
- Pt1/2 du flux diastolique < 250 msec;
- Volume régurgité ≥ 60 mL (fraction de régurgitation ≥ 45%);
- Surface de l’orifice de régurgitation > 0.3 cm2;
- Reflux diastolique dans l’aorte descendante.
Lors d‘une IA aiguë (endocardite, dissection A, traumatisme), le remodelage est inexistant, les cavités gauches ne sont pas dilatées. L’extension et la Vmax du jet sont réduites à cause de l’hypotension, de la tachycardie et de l’élévation de la Ptd du VG. Le diamètre de la vena contracta et la planimétrie de l’orifice de régurgitation sont les seules quantifications fiables. Dans les IA chroniques, un VG de taille normale exclut pratiquement une IA sévère.
Fonction du VG
Le VG subit une hypertrophie et une sévère dilatation à cause de la surcharge de volume à la pression diastolique de l'aorte. Jusqu'à la phase de décompensation, la précharge reste haute et la postcharge s’élève ; la fraction d'éjection (FE) tend à surestimer la fonction réelle du VG, et ne traduit pas la baisse progressive de sa contractilité. Dans ces conditions, une valeur de 0.5 signe déjà une atteinte significative. Comme c'est le cas pour l'insuffisance mitrale, les dimensions télésystoliques sont un meilleur critère de la fonction du VG ; la fonction est altérée lorsque le Dts est > 4 cm ou > 2.5 cm/m2, et le volume télésystolique (Vts) > 50 mL/m2. La souplesse de la paroi est assez bien conservée, mais la courbe de compliance diastolique est redressée à cause de la tension excessive exercée sur cette paroi.
L’écho permet également de calculer des indices de contractilité qui dépendent moins des conditions de charge et de fréquence ou de la géométrie du VG dilaté, comme la vélocité de raccourcissement circonférentiel (Vcf), l'indice de Tei ou la déformation (strain) longitudinale globale.
Vcf = (Cdiast – Csyst) / Cdiast • Téj où : C = circonférence
Téj = durée de l’éjection
Indice de Tei = (tCI + tRI) / téj où: tCI: durée de contraction isovolumétrique
rRI: durée de la relaxation isovolumétrique
téj: durée d'éjaction
Un Vcf < 1.1, un indice de Tei > 0.4 et une déformation longitudinale ≤ 15% signent une atteinte fonctionnelle du VG, même si la FE est encore normale et le patient paucisymptomatique [3].
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
Le VG subit une hypertrophie et une sévère dilatation à cause de la surcharge de volume à la pression diastolique de l'aorte. Jusqu'à la phase de décompensation, la précharge reste haute et la postcharge s’élève ; la fraction d'éjection (FE) tend à surestimer la fonction réelle du VG, et ne traduit pas la baisse progressive de sa contractilité. Dans ces conditions, une valeur de 0.5 signe déjà une atteinte significative. Comme c'est le cas pour l'insuffisance mitrale, les dimensions télésystoliques sont un meilleur critère de la fonction du VG ; la fonction est altérée lorsque le Dts est > 4 cm ou > 2.5 cm/m2, et le volume télésystolique (Vts) > 50 mL/m2. La souplesse de la paroi est assez bien conservée, mais la courbe de compliance diastolique est redressée à cause de la tension excessive exercée sur cette paroi.
L’écho permet également de calculer des indices de contractilité qui dépendent moins des conditions de charge et de fréquence ou de la géométrie du VG dilaté, comme la vélocité de raccourcissement circonférentiel (Vcf), l'indice de Tei ou la déformation (strain) longitudinale globale.
Vcf = (Cdiast – Csyst) / Cdiast • Téj où : C = circonférence
Téj = durée de l’éjection
Indice de Tei = (tCI + tRI) / téj où: tCI: durée de contraction isovolumétrique
rRI: durée de la relaxation isovolumétrique
téj: durée d'éjaction
Un Vcf < 1.1, un indice de Tei > 0.4 et une déformation longitudinale ≤ 15% signent une atteinte fonctionnelle du VG, même si la FE est encore normale et le patient paucisymptomatique [3].
| Quantification de l’insuffisance aortique |
| Critères bidimensionnels (indépendants de l’hémodynamique) - Planimétrie de l’orifice de régurgitation en court-axe 40° (IA sévère : > 0.3 cm2) - Dilatation et sphéricisation du VG Doppler couleur (dépendant de l’hémodynamique) - Etendue du jet diastolique IA sévère: jusqu’à mi-ventricule - Diamètre de la vena contracta IA sévère: ≥ 0.6 cm - Rapport diamètre jet/CCVG IA sévère: ≥ 60% Doppler spectral - Pt1/2 de la pente IA IA sévère: < 250 msec - Reflux diastolique dans l’aorte descendante |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- CHERRY SV, JAIN P, RODRIGUEZ-BLANCO YF, FABBRO M. Noninvasive evaluation of native valvular regurgitation: a review of the 2017 American Society of Echocardiography Guidelines for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2018; 32:811-22
- GRAYBURN PA, HANDSHOE R, SMITH MD, et al. Quantitative assessment of the hemodynamic consquences of aortic regurgitation by means of continuous wave Doppler recordings. J Am Coll Cardiol 1987; 10:135-41
- KUSUNOSE K, AGARWAL S, MARVICK TH, et al. Decision making in asymptomatic aortic regurgitation in the era of guidelines: incremental values of resting and exercise cardiac dysfunction. Circ Cardiovasc Imaging 2014; 7:352-62
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- MESSIKA-ZEITOUN D, DETAINT D, LEYE M, et al. Comparison of semi-quantitative and quantitative assessment of severity of aortic regurgitation: clinical implications. J Am Soc Echocardiogr 2011; 24:1246-52
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- O'BRIAN B, et al. Integration of 3D imaging data in the assessment of aortic stenosis: impact on classification of disease severity. Circ Cardiovasc Imaging 2011; 4:566-73
- PERRY GJ, HELMCKE F, NANDA NC, et al. Evaluation of aortic insufficiency by Doppler color flow mapping. J Am Coll Cardiol 1987; 9:952-9
- VAHANIAN A, BAUMGARTNER H, BAX J, et al. Guidelines on the management of valvular heart disease: The task force on the management of valvular heart disease of the European Society of Cardiology. Eur Heart J 2007; 28:230-68
- VON HOMEYER P, OXORN DC. Aortic regurgitation: echocardiographic diagnosis. Anesth Analg 2016; 122:37-42
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
- ZOGHBI WA, ENRIQUEZ-SARANO M, FOSTER E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. Eur J Echocardiogr 2003; 4:237-61
- ZOGHBI WA, ENRIQUEZ-SARANO M, FOSTER E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003; 16:777-802
