De nombreux dispositifs calculent le débit cardiaque à partir de la surface sous la courbe artérielle. Certains se basent sur la courbe fournie par un cathéter artériel (PiCCO™, VolumeView™, FlowTrac/Vigileo™), d'autres sur celle obtenue de manière non-invasive par photopléthysmographie digitale (ClearSight™, Finapres™) ou applanation tonométrique (T-line™). Certains systèmes ont besoin d'un étalonnage par thermodilution ou dilution transpulmonaire (PiCCO™ et LidCO™, respectivement), d'autres sont auto-étalonnés par des algorithmes fondés sur les données physiologiques du patient. Les premiers sont nettement plus performants que les seconds (Tableau 6.6).

Avant d'aborder chacun de ces appareils, la thermodilution transpulmonaire mérite quelques explications préalables.
Thermodilution transpulmonaire
La thermodilution transpulmonaire consiste en une injection en voie veineuse centrale de 15 mL NaCl à < 8°C et en une mesure de la température au niveau de l'artère fémorale par un thermistor; ce dernier doit être le plus près possible de l'aorte. Elle permet de mesurer le débit du cœur gauche et le volume sanguin de distribution, inclus le volume intrathoracique et l'eau pulmonaire extravasculaire. Le temps de circulation étant plus long que dans un échantillonage en artère pulmonaire, la mesure présente l’avantage d’être indépendante du cycle ventilatoire, mais, la dissipation de chaleur étant plus grande, le système tend à sous-estimer la valeur réelle du débit cardiaque (Figure 6.29).
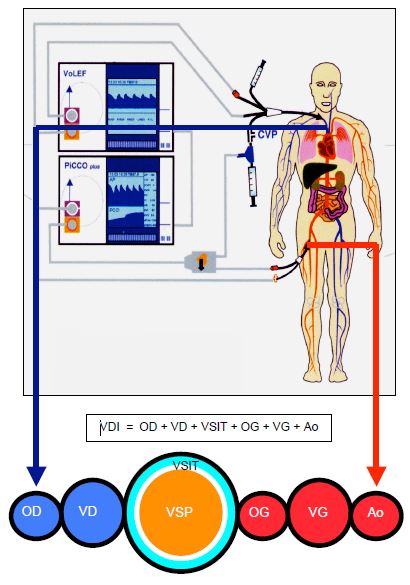
Figure 6.29 : Moniteur PiCCO. Un injectat froid (15 mL à < 8°C) est administré rapidement par une voie centrale (en bleu); les variations thermiques sont mesurées dans un cathéter artériel fémoral (en rouge). Le temps de circulation étant plus long que dans un échatillonage en artère pulmonaire, la mesure est indépendante de la ventilation. Le volume de distribution de l'injectat (VDI) est celui contenu entre le site d'injection et le site de mesure: VDI = OD + VD + VSIT + OG + VG + Ao. VSIT: volume sanguin intrathoracique. VSP: volume sanguin pulmonaire.
Le volume de distribution de l'injectat (VDI) est le volume contenu entre le site d'injection et le site de mesure:
VDI = OD + VD + VSIT + OG + VG + Ao
VSIT est le volume sanguin intrathoracique. Le volume de l'aorte est considéré comme représentant 50 mL/m2 chez un adulte; il est automatiquement soustrait par l'appareil. Le volume de distribution de l'indicateur est égal au produit du débit cardiaque (DC) et du temps de transit moyen (MTt) : VDI = DC • MTt (Figure 6.30).
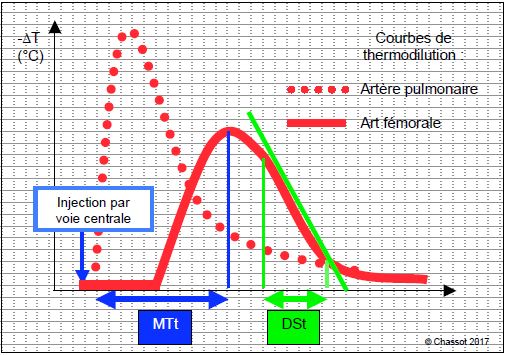
Figure 6.30 : Courbe de thermodilution obtenue en artère fémorale, comparée à la courbe en artère pulmonaire (pointillé), après une injection de liquide froid en PVC (OD). MTt: temps de transit moyen; la moitié de l'indicateur a passé le point de détection. DSt: temps de décroissance exponentielle de la courbe de thermodilution. L’intégration de la courbe rouge, ou courbe de Stewart-Hamilton, permet de calculer le débit cardiaque (DC). Le débit cardiaque est inversément proportionnel à la chute de température du sang et au temps de transit du bolus froid (surface sous la courbe); plus la surface est faible, plus le débit est élevé.
Le calcul du débit cardiaque (DC) par thermodilution transpulmonaire se fait selon une modification de la formule de Stewart-Hamilton puisque l’indicateur est une température et non une concentration [33]:
DC = [Vinj (T°s – T°inj) • K1 • K2] / ∫ ΔT°s (t) • dt
Où: Vinj: volume de l'injectat (V0)
T°s: température du sang
T°inj: température de l'injectat
K1: rapport de la densité et de la chaleur spécifiques de l'injectat et du sang
K2: constante de calcul tenant compte de l'espace mort du cathéter, du réchauffement de l'injectat dans cet espace, et de la vitesse d'injection
T°s(t): changement (Δ) de température du sang en fonction du temps
Le volume de la plus grande chambre de distribution, qui est le volume sanguin pulmonaire (VSP), est calculé par la formule: VSP = DC • DSt (DSt: temps de décroissance exponentielle). De là, on peut tirer une série de renseignements que calcule le moniteur [39,44].
- Volume télédiastolique global du coeur (VtdG), qui est le volume des oreillettes et des ventricules: VtdG = VDI - VS. C'est un bon indice de précharge global, dont la valeur normale est 600-800 mL/m2 chez l'adulte.
- Volume sanguin intrathoracique (VSIT): VSIT = 1.25 • VtdG ; le VSIT est un indicateur de précharge cardiaque sensible (valeur normale: 850-1'000 mL/m2).
- Eau pulmonaire extravasculaire (EPEV): EPEV = VTIT – VSIT. Le VTIT est le volume thermique intrathoracique total, somme du volume intra- et extra-vasculaire. L'EPEV augmente en cas d'insuffisance gauche ou de trouble de la perméabilité capillaire ; dans les conditions normales, sa valeur est < 7 mL/kg.
- Indice de fonction cardiaque (IFC): IFC = DC / VTdG (valeur normale : 4.5-6.5); lorsqu'il est inférieur à 4.0, la fraction d'éjection est inférieure à 0.5.
L’EPEV est un excellent prédicteur de mortalité chez les malades souffrant de lésions pulmonaires ou de surcharge liquidienne : la mortalité double entre < 10 mL/kg et > 15 mL/kg [44]. La présence d’un shunt modifie la forme de la courbe de thermodilution, qui devient bifide en présence de shunt droite-gauche. Un shunt gauche-droite, par contre, surestime l’EPEV comme en présence d’œdème pulmonaire, alors que les échanges gazeux sont normaux [44]. L'indice de fonction cardiaque est corrélé à la fraction d'éjection du VG pour autant que la fonction du VD soit normale, car il mesure la performance globale des deux ventricules simultanément. Il ne peut en aucun cas différencier une dysfonction droite d'une dysfonction gauche et ne remplace jamais un examen échocardiographique. L'eau pulmonaire extravasculaire ne peut pas faire la différence entre un œdème hydrostatique dû à une défaillance gauche et un œdème lésionnel du parenchyme pulmonaire, ce que le cathéter pulmonaire fait aisément (PAOP > 18 mmHg dans le premier cas) [34].
La thermodilution transpulmonaire est une mesure fiable qui présente une excellente corrélation avec la thermodilution pulmonaire de la Swan-Ganz (r > 0.9), bien que les valeurs de la première soient en général un peu supérieures à celles de la seconde. Plusieurs raisons peuvent expliquer cette différence. La thermodilution transpulmonaire mesure le débit du cœur gauche, alors que la thermodilution pulmonaire mesure celui du cœur droit, qui est davantage influencé par les mouvements respiratoires. D'autre part, le temps écoulé entre l'injection et la mesure est plus long dans la première, ce qui la rend moins dépendante des variations induites par la ventilation. Par ailleurs, la perte d'indicateur sur le trajet entre l'OD et l'artère fémorale est plus grande qu'entre l'OD et l'AP [39,40].
Surface sous la courbe artérielle
La surface sous la partie systolique de la courbe de pression artérielle est proportionnelle au volume systolique (VS) du VG. Toutefois, l'aorte élastique stocke momentanément une partie du volume systolique en se dilatant en systole et le restitue lorsqu'elle reprend sa forme en diastole. De ce fait, le volume qui transite en systole dans une artère périphérique est inférieur au volume éjecté par le VG. Cette différence s'atténue lorsque les vaisseaux se rigidifient avec l'âge ou l'artériosclérose (Figure 6.31).
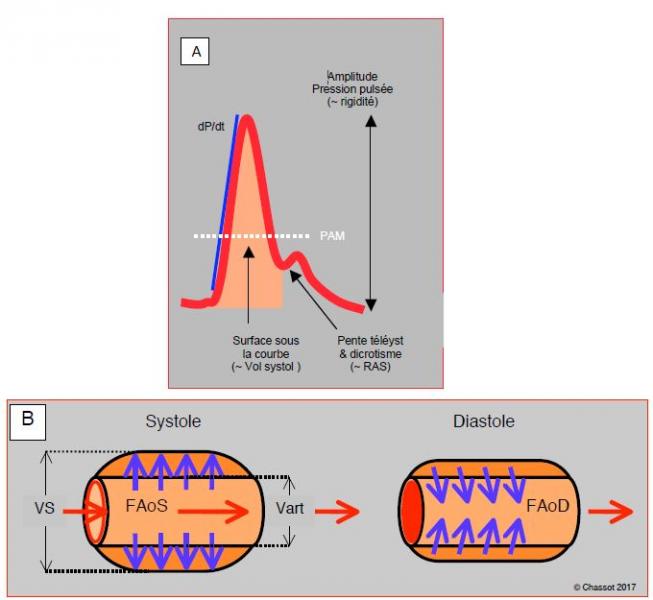
Figure 6.31 : Surface sous la courbe artérielle. A : Silhouette d'une courbe artérielle périphérique. La pente ascensionnelle est fonction du dP/dt intraventriculaire (pour autant qu’il n’y ait pas de pathologie valvulaire aortique et que les RAS soient normales); la valeur normale est environ 1'000 mmHg/s. La surface sous la courbe systolique est proportionnelle au volume systolique (VS), la pente télésystolique et le niveau du dicrotisme sont fonction des résistances artérielles périphériques (RAS), l’amplitude est fonction de la rigidité des parois mais aussi de la volémie, de la compliance aortique et des RAS. La pression artérielle moyenne (PAM) est calculée selon la formule : PAM = (PAsyst + 2 PAdiast) / 3. B: Elasticité artérielle. En systole, l'aorte et les grandes artères se dilatent sous l'effet du volume éjecté par le VG et emmagasinent une partie du volume systolique (flèches bleues); grâce à leur élasticité, elles le restituent en diastole et augmentent d'autant le flux diastolique. Le VS calculé par la surface sous la courbe systolique dans une artère périphérique (Vart) ne tient pas compte de ce volume stocké en systole et rendu en diastole; il est donc inférieur au VS réel du VG. FAoS: flux aortique systolique. FAoD: flux aortique diastolique.
Si elle est directement proportionnelle au volume éjecté (VS), la surface sous la courbe artérielle systolique (Sc) est aussi inversément reliée à la compliance vasculaire (Ca). On obtient : VS ≈ Sc/Ca. Cette proportionalité est étalonnée par la thermodilution transpulmonaire ; l’étalonnage doit être répété à chaque modification importante des RAS, ou toutes les 4-6 heures. Le débit cardiaque (DC) est calculé selon la formule suivante [14,17,22,33]:
DC = Kcal • F • ∫ [P(t) / RAS + Ca • dP/dt] dt
Où: Kcal: facteur de calibration du flux aortique obtenu par thermodilution transpulmonaire
F: fréquence cardiaque
P(t): pression artérielle systolique
RAS: résistance artérielle totale (résistance périphérique + impédance aortique)
P(t)/RAS: surface sous la courbe
Ca: compliance artérielle (VS/PAdiff)
dP/dt: représente la forme de la courbe de pression
P(t) / RAS: surface sous la courbe
dP/dt] dt: pente de la courbe
P(t) / RAS: surface sous la courbe
dP/dt] dt: pente de la courbe
Les algorithmes des nouveaux modèles analysent plus finement la forme de la courbe de pression (pulse pressure contour method, pulse waveform analysis) et repèrent le dicrotisme et la pente qui lui succède, ce qui permet de mieux tenir compte de la compliance artérielle et des résistances périphériques. Ces algorithmes tentent d’intégrer les quatre comnposantes de la résistance à l’éjection (voir Chapitre 5, Détermninants de la fonction systolique, La postcharge) [14,42].
- Impédance aortique liée à la pulsatilité : Zao = Pression instantanée / flux instantané ; vu les difficultés de ce calcul, peut être remplacée par : Zao = Pression pulsée / volume systolique (10% des résistances totales). La pression pulsée (PP) ou pression différentielle est la différence PAsyst – PAdiast.
- Résistances périphériques fixes : RAS = (PAM – PVC) / DC (loi d'Ohm).
- Onde réfléchie : 10% de la postcharge du VG ; non quantifiable en clinique mais évaluable par la forme du pic de pression systolique.
- Compliance artérielle globale : Ca = VS / PP ; c’est l’inverse de l’impédance simplifiée. La compliance est une valeur non-linéaire qui décroit lorsque la pression augmente.
- Physiologiquement, il existe une cinquième composante, la viscosité sanguine, mais celle-ci n’entre pas dans le calcul de ces moniteurs, car elle est supposée rester normale et stable.
La surface sous la courbe artérielle représente le volume systolique pour autant que Zao, Ca et RAS restent stables. Pour que l’appareil puisse suivre l’évolution du DC, il doit connaître à quel débit correspond quelle surface. A cet effet, il existe trois méthodes d’étalonnage :
- Courbe de thermodilution transpulmonaire (PiCCO™);
- Courbe de dilution d’un traceur (lithium dans le cas du LiDCO™);
- Nomogramme et algorithme (FloTrac Vigileo™, ProAQT™).
Si l’impédance et les résistances artérielles se modifient de manière significative, l’appareil doit être ré-étalonné, sans quoi il interprétera incorrectement le rapport entre la surface sous la courbe et le volume systolique. Toute variation importante des RAS diminue la précision de la mesure du DC. Par exemple, le biais (± SD) entre la mesure par analyse du contour de la courbe artérielle et la mesure par thermodilution (Swan-Ganz), qui est de 0.16 L/min dans la situation de base, passe à 3.25 L/min après une injection de phényléphrine qui augmente les RAS de 60% (Figure 6.32) [41].
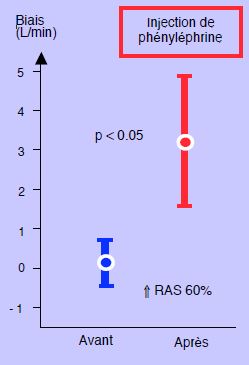
Figure 6.32 : Variation des biais sur la mesure de débit cardiaque par la technique de la surface sous la courbe artérielle en fonction des résistances artérielles systémiques (RAS) [d’après réf 41]. Le biais (± SD) entre la mesure par analyse du contour de la courbe artérielle et la mesure par thermodilution (Swan-Ganz), qui est de 0.16 L/min dans la mesure de base, passe à 3.25 L/min après injection de phényléphrine (augmentation des RAS de 60%) (10 patients).
Ce graphique illustre bien la nécessité de recalibrer les systèmes d’analyse de la courbe artérielle chaque fois que les RAS se modifient significativement, sous peine d’obtenir des résultats de débit cardiaque non fiables: si les RAS changent de > 15%, la valeur calculée du DC est modifiée jusqu'à 40% [8,14]. La recalibration est particulièrement nécessaire en sortant de CEC. Ces technologies ne sont pas adaptées aux situations qui modifient le flux aortique et la forme de la courbe de pression (insuffisance valvulaire aortique, anévrysme, CPIA), ni aux opérations sur l’aorte thoraco-abdominale. La précision des mesures peut également varier en fonction du site d’analyse, par exemple entre l’artère radiale et l’artère fémorale : la mesure en artère radiale peut sous-estimer la pression aortique réelle et donner une valeur de DC trop basse [21,50].
Le rapport entre les variations (Δ) de la pression pulsée (ΔPP) et celles du volume systolique (ΔVS) peut indiquer l’état des RAS parce que la vasoplégie augmente les ΔVS davantage que les ΔPP (rapport ΔPP/ΔVS bas), alors que la vasoconstriction augmente les ΔPP plus que les ΔVS (rapport ΔPP/ΔVS > 1) [10]. Le calculateur du moniteur en tient compte pour évaluer les RAS. Mais si celles-ci se modifient trop, l’appareil doit être ré-étalonné avec une thermodilution transpulmonaire. De toute manière, la précision du DC calculé diminue considérablement si les RAS sont très basses ou très élevées. Dans ces deux situations, le calcul du DC par la Swan-Ganz est préférable. Les nouveaux algorithmes des systèmes PiCCO™ ou VolumeView™ ont amélioré la prise en compte des variations de résistance et de compliance artérielle. Le -dP/dt de la descente de pression diastolique après le dicrotisme aortique est proportionnel au produit de la compliance et des RAS, lesquelles sont le rapport entre la PAM et le DC. Le calcul est répété en continu à partir d'une valeur de RAS estimée normale pour les données du patient (âge, sexe, poids, PA, forme de la courbe). Chaque calcul reprenant les données trouvées dans le précédant, le résultat est peu à peu affiné pour arriver à des valeurs de plus en plus proches de la réalité [14]. Il va sans dire que la précision de ces calculs dépend de la qualité de la courbe artérielle; dès que celle-ci s'amortit, les données sont de plus en plus fausses.
Les variations de la pression artérielle simultanée à la ventilation en pression positive s’accompagnent d’une variation dans le même sens de la surface sous la courbe artérielle. Les systèmes de mesure du contour de la courbe peuvent donc suivre les variations du volume systolique (ΔVS) en fonction de l’IPPV (Figure 6.33).
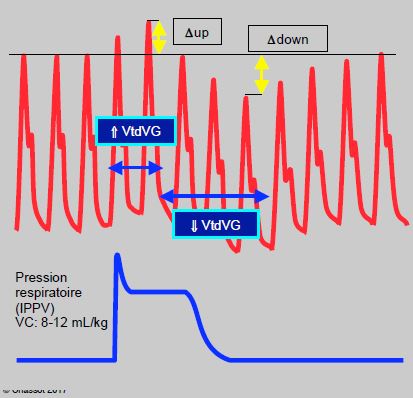
Figure 6.33 : Variations ventilatoires de la pression artérielle (en rouge) par rapport à la pression des voies aériennes (en bleu) lors de ventilation en pression positive. Lorsque la pression intrathoracique (Pit) s’élève à l’inspirium, la pression artérielle est augmentée (Δup) puisque le volume systolique du VG est plus grand (augmentation du retour à l’OG) et que la Pit s’additionne à la pression que génère ce dermier. Mais 2 à 5 cycles cardiaques plus tard, la pression artérielle baisse (Δdown) parce que la diminution du retour veineux au cœur droit, qui a baissé le volume éjecté dans l’artère pulmonaire, arrive maintenant à l’OG et diminue la précharge du VG. Cet enchaînement provoque une oscillation ventilatoire de la pression artérielle (normal < 12%). Le Δup est prédominant lors d’insuffisance ventriculaire gauche, parce que le VG congestif bénéficie grandement de l’aide que représente la compression par la Pit ; c’est l’équivalent d’une baisse de postcharge. Le down est prédominant en hypovolémie, parce que le volume systolique est très dépendant de la précharge lorsque le malade se trouve sur la partie gauche très verticale de la courbe de Frank-Starling. VtdVG : volume télédiastolique du VG. VC : volume courant.
L'importance des ΔVS est inversément proportionnelle au volume de la précharge cardiaque ; plus la surface est respiro-dépendante, plus le patient est hypovolémique. Cette technique offre une manière de le quantifier : une hypovolémie se caractérise par un ΔVS ventilatoire de plus de 15% lorsque le volume courant est > 8 mL/kg [2,29,38]. Les ΔVS sont mesurées en pourcent sur les 30 dernières secondes par la formule: ΔVS = (VSmax - VSmin) / VSmoy • 100 (où VSmoy = (VS min + VS max) / 2) (voir Monitorage de la volémie).
PiCCO™ et VolumeView™
La technologie du PiCCO™ (Pulse index Continuous Cardiac Output) et du VolumeView™ est basée sur ces deux principes, qui évaluent respectivement le volume de la précharge et l'éjection ventriculaire systémique : la thermodilution transpulmonaire et le suivi en continu de la surface sous la courbe artérielle (voir ci-dessus Figure 6.29) [22].
La technique de PiCCO™, qui est utilisable chez les enfants, n'est guère moins invasive que le cathétérisme pulmonaire mais plus rapide et grevée de moins de complications. Le PiCCO™ et le VolumeView™ nécessitent une voie centrale et la pose d’un cathéter spécial dans une artère de grande taille telle la fémorale ou l'humérale ; le calibre de l’artère radiale est en général trop faible pour l'accepter. D'autre part, la radiale est trop éloignée de l'aorte pour donner des résultats de DC fiables. La méthode a été bien validée par rapport à la Swan-Ganz pour la mesure du débit cardiaque (r = 0.91-0.97) [41,43] et par rapport à la technique de double dilution pour la mesure de l'EPEV [45]. Le biais est de l’ordre de 0.16 L/min [41] et le pourcentage d'erreur de 15-20% [33]. Le PiCCO mesure le débit cardiaque systémique et non pulmonaire ; il n’est pas fiable en cas d’anévrysme de l’aorte thoracique (surestimation du VSIT) ni en cas de clampage de l’aorte thoraco-abdominale, ni de contre-pulsion intra-aortique. D’autre part, il ne permet pas de mesurer la PAP, la PAPO ni la SvO2.
Pour l’évaluation de la volémie, la technique du PiCCO offre deux avantages [36].
- Le VtdG est un indice de remplissage adéquat quel que soit le mode de ventilation (contrôlée, assistée, spontanée, PEEP) ; il n’est pas dépendant de la compliance des cavités cardiaques, ce qui le rend supérieur aux mesures de PVC et de PAPO [27,45] ;
- La variation du VS avec la ventilation mécanique est un indice dynamique de la volémie plus pertinent que les mesures statiques, mais restreint aux malades sous respirateur avec un volume courant élevé (8-12 mL/kg) [2,29] ; la valeur prédictive pour l’hypovolémie et la réponse au remplissage est d’autant meilleure que les patients sont plus hypotendus [7].
La thermodilution transpulmonaire utilisée pour l'étalonnage du PiCCO est aussi fiable que la thermodilution pulmonaire de la Swan-Ganz. Une recalibration fréquente est requise lorsque les RAS varient fortement ou sont anormalement hautes (vasopresseurs) ou basses (vasoplégie). Le système VolumeView™ présente des caractéristiques identiques et des résultats aussi satisfaisants [33].
Le LidCO™
Une technologie sensiblement différente permet d'analyser la courbe artérielle à partir d'un cathéter normal (LidCO-Plus™). L’algorithme évalue la totalité de la courbe artérielle, et non sa seule portion systolique [22]. L’étalonnage est effectué par dilution transpulmonaire au moyen d’une injection de 0.2 mmol de lithium dans une veine centrale ou périphérique et par un prélèvement dans l’artère au moyen d’une petite pompe et d’une électrode Li-sensible branchées sur un cathéter standard. Vu la toxicité du lithium, l’étalonnage ne peut pas être répété plus de 10 fois en 24 heures [11]. La courbe de dilution au Li est une manière très précise de calculer le débit cardiaque (r = 0.96) [11]. La corrélation du DC par la dilution transpulmonaire mesurée au LidCO avec celle du PiCCO est excellente (r = 0.94) [35]. La corrélation avec la débitmétrie électromagnétique aortique (r = 0.95) est même meilleure que celle de la Swan-Ganz (r = 0.87) [13]. Toutefois, la corrélation du DC mesuré en continu par la surface sous la courbe artérielle est nettement moins satisfaisante, puisque le taux d'erreur est de 46% [33].
Ce dispositif n'est pas utilisable chez les malades sous lithium; il est contrindiqué pendant le premier trimestre de la grossesse [39]. D'autre part, les curares non-dépolarisants interfèrent avec le senseur du lithium [46]. Comme le lithium injectable n’est pas disponible sur le marché dans de nombreux pays occidentaux, l’application clinique de cette technologie, pourtant excellente, est limitée. Le LidCOrapid™ est une variante qui ne réclame pas de calibration externe mais s’étalonne par référence à un algorithme interne comme le FloTrac/Vigileo™.
Le FloTrac/Vigileo™
Pour éviter les problèmes de calibration et pour pouvoir utiliser un cathéter artériel standard, le FloTrac/Vigileo™ s’auto-étalonne au moyen d'un algorithme d'autocorrélation basé sur la pulsatilité de la courbe artérielle et le rapport entre la pression pulsée et la PAM. Celle-ci est calculée en utilisant la déviation standard de l’onde de pression artérielle sur 20 secondes (échantillonnage à 100 Hz) et un coefficient (κ) représentant la compliance (Ca) et les résistances artérielles (RAS). Ce coefficient est basé sur l’âge, la taille et le poids du malade à partir de données sur la compliance et l’élasticité aortique de cadavres [15]. Il est également fondé sur une opération mathématique renouvelée toutes les minutes et tenant compte de la pression moyenne, du déplacement relatif de la courbe vers la droite ou la gauche (obliquité des pentes) et de son aplatissement (curtose) [19,20,21]. La 3ème génération de l’appareil contient en mémoire des tracés de patients avec des RAS très basses ou très hautes et leurs DC correspondants ; elle peut ainsi partiellement tenir compte des variations de résistance et de compliance artérielles dans son calcul du débit [52]. Le calcul lui-même est une propriété industrielle non publiée.
Les premières évaluations cliniques ont révélé une corrélation satisfaisante mais variable entre la mesure du DC par FloTrac™ et celle par thermodilution : r = 0.66, [6], r = 0.74 [4], r = 0.85 [31]. Les biais sont de l’ordre de 0.26 L/min. L’appareil affiche une certaine association avec la valeur de la pression artérielle moyenne, et des résultats sensiblement différents selon que le site de mesure est l’artère radiale ou l’artère fémorale (biais 0.55 L/min) [20,50]. Il tend à surestimer les bas débits et sous-estimer les débits élevés, mais lit un DC anormalement haut lorsque les RAS augmentent rapidement [4], ou trop bas lorsqu’elles s’abaissent avec un vasodilatateur [20]. Des perfectionnements de l’algorithme et la mémorisation de tracés vasoplégiques ou vasoconstrictés (3ème génération) ont permis d’améliorer la corrélation avec les mesures de thermodilution (r = 0.92, biais 0.19 L/min) dans la plage normale du débit cardiaque [23,51], où le pourcentage d’erreur est de 15-34% [24,50], mais l’appareil reste peu performant lors des situations hémodynamiques extrêmes (vasoplégie, vasoconstriction, hypovolémie) [21,25,52]. Sous hautes doses de vasopresseur, l’erreur est de 27-35%, même avec l’algorithme de 3ème génération [26]. Malgré les progrès réalisés avec l'algorithme de 4ème génération, la mesure du DC reste entachée d'un pourcentage d'erreur excessif (59%) chez les malades en bas débit et avec des RAS très élevées ou très basses [9]. Le FloTrac/Vigileo™ demeure très sensible à la forme de la courbe artérielle et perd sa fiabilité en cas de sténose aortique serrée, d’insuffisance aortique sévère, de shunt (cirrhose hépatique) ou de contrepulsion intra-aortique, parce que la forme de la courbe est trop anormale pour qu’il puisse l’interpréter correctement [18,25]. Il est utile et fiable pour tracer les variations du DC liées aux modifications de la volémie (taux de concordance 85-96%) pour autant que les résistances artérielles se maintiennent dans une fourchette normale [12,51,52].
Le ProAQT™ Pulsioflex et le PRAM-CO™
Ces systèmes analysent la forme de la courbe artérielle en temps réel comme le PiCCO mais à travers n’importe quel cathéter et sans calibration externe. Ils fournissent une évaluation du VS et du DC ; ils calculent les variations de pressions pulsée et de volume systolique, et ils construisent un index des résistances artérielles et de la contractilité [37]. Bien que partiellement évaluée, la précision des mesures du Pulsioflex™ est plutôt décevante : le coefficient de corrélation avec la thermodilution oscille entre 0.5 et 0.7 selon que les variations sont liées aux résistances artérielles (r = 0.53) ou à la volémie (r = 0.73). L’appareil suit correctement les variations du DC liées à la précharge, mais sa lecture en valeur absolue est peu fiable [30]. Le PRAM-CO™ est basé entièrement sur l'analyse de la forme de la courbe artérielle: surface sous la courbe systolique et diastolique, position du dicrotisme, pente d'accélération et de décélération (+dP/dt et –dP/dt) et onde réfléchie en périphérie, à une cadence d'échantillonnage de 1'000 par seconde [32]. Malheureusement, le pourcentage d'erreur s'élève jusqu'à 87%, particulièrement à haut débit cardiaque [42].
Le CombiQ™
Un nouvel appareil (CombiQ™) combine un système d'analyse du contour de la courbe artérielle et un Doppler oesophagien qui sert de méthode d'étalonnage; le prototype dispose de plusieurs algorithmes différents selon le niveau des RAS pour afficher le DC en continu. Sa marge d'erreur varie de 26 à 43% [5].
Les systèmes Portapres™, CNAP™ et ClearSight™ (anciennement Nexfin™)
La technologie du clamp volumétrique (Volume clamp method ou principe de Peñáz) consiste à gonfler une manchette qui entoure un doigt avec une pression variant au cours du cycle cardiaque de manière à maintenir stable le volume de l'artère digitale; celui-ci est contrôlé par des photo-détecteurs LED infra-rouges. De cette manière, la pression de la manchette reproduit celle de l'artère. Par analogie avec celle de la courbe de pression artérielle, l’analyse de la courbe de photo-pléthysmographie du doigt permet d’évaluer le débit cardiaque (Figure 6.34) [47,48].
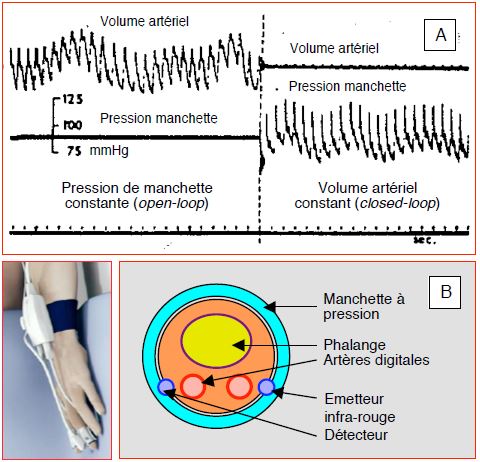
Figure 6.34 : Mesure continue non-invasive de la pression artérielle (Volume clamp method) et du débit cardiaque (système ClearSight™) par photo-pléthysmographie digitale. A : La manchette miniaturisée qui entoure le doigt est gonflée de manière à maintenir en permanence le volume de l’artère identique ; dès lors, la pression enregistrée dans la manchette est celle de l’artère en continu (d’après Peñáz J, Voigt A, Teichmann W. Contribution to the continuous indirect blood pressure measurement. Z Gesamte Inn Med 1976 ; 31 :1030-3). B : Le système ClearSight™ comprend deux capteurs digitaux, qui enregistrent chacun la pression en continu et analysent la surface sous la courbe de photopléthysmographie, analogue à une courbe de pulsoxymétrie. Ils fonctionnent en alternance de manière à éviter une ischémie du doigt. Une source de lumière infra-rouge détermine en permanence le volume de l’artère et en tire la courbe de photopléthysmographie. Le volume systolique est calculé en divisant la surface sous la courbe systolique du pléthysmographe par l’impédance/résistance artérielle globale calculée par l’algorithme de la machine sur la base de la pression artérielle. Un repère électronique connecté au doigt et placé au niveau du cœur sur la cage thoracique permet d’ajuster la mesure de pression en fonction de l’éventuel déplacement de la main et maintient les valeurs correspondant au niveau de référence malgré les mouvements.
Les trois composantes vasculaires de la compliance, de l’impédance et de la résistance périphérique sont estimées d’après l’âge, le genre, la taille et le poids du patient ainsi que par l’analyse en continu de la pression artérielle. Le volume systolique est alors calculé en divisant la surface sous la courbe systolique du pulsemètre par la l’impédance/résistance artérielle globale calculée par l’algorithme [37]. L’avantage principal est de disposer d’un moyen d’apprécier le débit cardiaque de manière totalement non-invasive et de pouvoir suivre les variations du volume systolique en IPPV pour la détection précoce de l’hypovolémie. Mais le système présente des faiblesses majeures : inexactitude en cas de haut ou de bas débit, sensibilité à l’état de vasoconstriction ou de vasoplégie artérielle, perte du signal lorsque le doigt est hypotherme ou oedématié, meilleure capacité à estimer les variations du DC que la valeur réelle de celui-ci. Le pourcentage d'erreur est de 22% sur la mesure de la pression artérielle, mais il est de l'ordre de 45-50% sur le calcul du débit cardiaque [3,47,49].
Le système esCCO™
La mesure du temps de transit (Pulse wave transit time) entre l’ECG et l’onde de pouls pléthysmographique (ECG-SpO2) permet d’estimer le DC si l’on connaît la relation entre celui-ci et la compliance artérielle : le temps s’allonge lorsque le débit cardiaque baisse. Cette dernière est évaluée par l’analyse de la pression pulsée (sphygmomanomètre) et par les données du patient (âge, sexe, taille et poids). Le système actuellement sur le marché (esCCO™, Nihon-Kohden) est toutefois peu performant. Son degré de concordance avec la mesure de référence du DC est de 0.61-0.63, et le pourcentage d’erreur de 49-54% [1]. Le biais est lié principalement aux résistances artérielles périphériques [47].
Les systèmes T-line™ et DMP-Life™
La tonométrie radiale par applanation enregistre la forme de la courbe artérielle selon un algorithme propre au moyen d'un capteur placé avec précision sur l'artère et la comprimant contre l'os pour obtenir une pression transmurale nulle. Certains appareils se calibrent avec une manchette à pression. L'enregistrement est très sensible à la position du capteur qu'il est souvent difficile de maintenir suffisamment stable. Lorsque la courbe est bien analysable, la marge d'erreur est supposée être faible (23-34%) [3,47,48].
Appréciation
La thermodilution transpulmonaire du PiCCO™ et la dilution transpulmonaire du LidCO™ sont aussi précises que la thermodilution pulmonaire de la Swan-Ganz, mais cette dernière est la seule à mesurer le DC du cœur droit, la PAP, la PAPO et la SvO2. Un peu moins invasif à cause de la voie centrale au lieu du cathéter pulmonaire, le PiCCO™ et le VolumeView™ offrent la possibilité d'évaluer la précharge (volume télédiastolique global, volume sanguin intrathoracique), le volume liquidien intrapulmonaire et la fonction ventriculaire (fraction d'éjection globale). A l'exception de la Swan-Ganz, tous permettent de suivre les variations respiratoires de la pression artérielle en ventilation contrôlée (évaluation de la volémie) (Tableau 6.6).
D'une manière générale, les systèmes non-invasifs s'avèrent décevants par leur manque de fiabilité lorsque les RAS sont très élevées ou très basses, lorsqu'elles varient brusquement, ou lorsque le débit cardiaque est bas [9]. Les dispositifs sans cathéter artériel ne sont pas interchangeables avec les systèmes de thermodilution, car ils ont une trop grande marge d'erreur (45-50%) dès que les conditions hémodynamiques sortent de la normalité [12]. S'ils ne sont fiables que dans les limites physiologiques, leur utilité pour l'anesthésie cardiovasculaire est douteuse ! Leur principal point d'application est l'administration liquidienne dirigée et l'optimisation hémodynamique dans les cas à risque bas et intermédiaire, lorsque le débit cardiaque varie à l'intérieur des limites physiologiques (2.5-10 L/min) [48]. Dans cette situation, ils réduisent les complications digestives et cardiovasculaires en chirurgie générale, sans toutefois affecter la mortalité [28]. La même remarque s'applique à un moindre degré au FlowTrac/Vigileo™. Les dispositifs sans calibration sont toujours moins fiables que ceux qui sont étalonnés, car ces derniers peuvent prendre en compte les variations des RAS par le biais d'un ré-étalonnage [53].
La précision et la fiabilité d'un dispositif sont évidemment tributaires de la technique à laquelle il est comparé. Il s'agit en général de la mesure du débit cardique par thermodilution pulmonaire (Swan-Ganz) ou transpulmonaire (PiCCO™), mais beaucoup d'études ont utilisé le Doppler oesophagien ou l'échocardiographie. Or chacune de ces techniques présente son propre taux d'erreur et de variabilité, et aucune ne peut être considérée comme une réelle mesure-étalon (gold standard). Dans ces conditions, un système est déclaré imprécis par rapport à un autre qui l'est aussi [16]. Il est donc prudent de garder à l'esprit la relativité fondamentale de ces jugements. D'autre part, le but d'un moniteur est d'alerter et d'objectiver une situation hémodynamique anormale pour en tirer des conclusions thérapeutiques. Des appareils qui perdent leur fiabilité en-dehors des situations physiologiques sont sans intérêt en chirurgie cardiaque.
| Analyse du contour de la courbe artérielle |
|
La forme de la courbe artérielle dépend du volume systolique, de la compliance artérielle, de la résistance artérielle (impédance + RAS) et de l'onde réfléchie. La surface sous la courbe artérielle systolique est proportionnelle au volume systolique (VS). Après étalonnage par thermodilution transpulmonaire (PiCCO™), dilution d’un traceur (LiDCO™) ou algorithme de calcul (FloTrac/Vigileo™), elle permet de calculer le VS et le débit cardiaque. L’appareil doit être recalibré en cas de variation des RAS.
La thermodilution transpulmonaire et l’analyse de la courbe artérielle du PiCCO™ permettent en outre de calculer le volume télédiatolique global du cœur, le volume sanguin intrathoracique et l’eau pulmonaire extravasculaire. Le PiCCO™ nécessite un cathéter spécial (voie fémorale) et une voie veineuse centrale.
Le LiDCO™ s’étalonne par injection de lithium (voie périphérique) et s’accomode d’un cathéter artériel standard. La toxicité du lithium limite le nombre d’étalonnages par 24 heures.
Le FloTrac/Vigileo™ s’auto-étalonne au moyen d'un algorithme d'autocorrélation et ne réclame aucun cathétérisme particulier (cathéter standard par voie fémorale ou radiale). Toutefois, il tend à surestimer les bas débits et sousestimer les débits élevés ; il surestime de DC si les RAS augmentent et le sousestime lorsqu’elles baissent. Il est peu fiable lors de vasoconstriction prononcée, de vasoplégie ou de bas débit cardiaque.
Le système ClearSight™ utilise le principe de la surface sous la courbe pour analyser celle de la pléthysmographie digitale et en déduire le DC de manière non-invasive. Une manchette miniaturisée qui entoure le doigt est gonflée de manière à maintenir en permanence le volume de l’artère identique ; la pression enregistrée dans la manchette est celle de l’artère en continu. Le dispositif est très sensible aux variations de résistances artérielles et reste peu précis en-dehors d’une hémodynamique normale.
Tous les systèmes déduisant le débit cardiaque de la surface sous la courbe artérielle sont sensibles aux RAS et à la compliance vasculaire. Ils doivent être ré-étalonnés lorsque celles-ci se modifient. En cas de variations extrêmes des RAS (vasoplégie, vasoconstriction intense, CPIA), seul le cathéter pulmonaire donne des valeurs fiables. Les dispositifs étalonnés sont plus fiables que les systèmes sans étalonnage.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2019
Références
- BATAILLE B, BERTUIT M, MORA M, et al. Comparison of esCCO and transthoracic echocardiography for non-invasive measurement of cardiac output intensive care. Br J Anaesth 2012; 109:879-86
- BERKENSTADT H, MARGALIT N, HADANI M, et al. Stroke volume variations as a predictor of fluid responsiveness in patients undergoing brain surgery. Anesth Analg 2001; 92:984-9
- BERNARDS J, MEKEIRELE M, HOFFMANN B, et al. Hemodynamic monitoring: to calibrate or not to calibrate ? Part 2 – Non-calibrated techniques. Anaesthesiol Intens Ther 2015; 47:501-16
- BREUKERS RM, SEPEHRKHOUY S, SPIEGELENBERG S, GROENEVELD ABJ. Cardiac output measured by a new arterial pressure waveform analysis method without calibration compared with thermodilution after cardiac surgery. J Cardiothorac Vasc Anesth 2007; 21:632-5
- CAILLARD A, GAYAT E, TANTOT A, et al. Comparison of cardiac output measured by oesophageal Doppler ultrasonography or pulse pressure contour wave analysis. Br J Anaesth 2015; 114:893-900
- CANNESSON M, ATTOF Y, ROSAMEL P, et al. Comparisopn of FloTrac™ cardiac output monitoring system in patients undergoing coronary artery bypass grafting with pulmonary artery cardiac output measurements. Eur J Anaesthesiol 2007; 24:832-9
- DALIBON N, GUENOUN T, JOURNOIS D, et al. The clinical relevance of systolic pressure variations on anesthetized nonhypotensive patients. J Cardiothorac Vasc Anesth 2003; 17:188-92
- HAMZAOUI O, MONNET X, RICHARD C, et al. Effects of changes in vascular tone on the agreement between pulse contour and transpulmonary thermodilution cardiac output measurements within an up to 6-hour calibration-free period. Crit Care Med 2008; 36:434-40
- HATTORI K, MAEDA T, MASUBUCHI T, et al. Accuracy and trending ability of the fourth-generation FloTrac/Vigileo system in patients with low cardiac index. J Cardiothorac Vasc Anesth 2017; 31:99-104
- HOLDER AL, PINSKY MR. Applied physiology at the bedside to drive resuscitation algorithms. J Cardiothorac Vasc Anesth 2014; 28:1642-59
- JONAS MM, TANZER SJ. Lithium dilution measurement of cardiac output and arterial pulse waveform analysis: an indicator dilution calibrated beat-by-beat system for continuous estimation of cardiac output. Curr Opin Crit Care 2002; 8:257-61
- JOOSTEN A, DESEBBE O, SUEHIRO K, et al. Accuracy and precision of non-invasive cardiac output monitoring devices in perioperative medicine: a systematic review and meta-analysis. Br J Anaesth 2017; 118:298-310
- KURITA T, MORITA K, KATO S, et al. Comparison of the accuracy of the lithium dilution technique with the thermodilution technique for measurement of cardiac output. Br J Anaesth 1997; 79:770-5
- LAIGHT NS, LEVIN AI. Transcardiopulmonary thermodilution-calibrated arterial waveform analysis: a primer for anesthesiologists and intensivists. J Cardiothorac Vasc Anesth 2015; 29:1051-64
- LANGEWOUTERS GJ, WESSELING KH, GOEDHARD WJ. The pressure dependent dynamic elasticity of 35 thoracic and 16 abdominal human aortas in vitro described by a five component model. J Biomech 1985; 18:613-20
- LE MANACH Y, COLLINS GS. Disagreement between cardiac output measurement devices: which device is the gold standard ? Br J Anaesth 2016; 116:453-5
- LINTON NW, LINTON RA Estimation of changes in cardiac output from the arterial blood pressure waveform in the upper limb. Brit J Anaesth 2001; 86:486-96
- LORSOMRADEE S, LORSOMRADEE S, CROMHEECKE S, DE HERT SG. Uncalibrated arterial pulse contour analysis versus continuous thermodilution technique: effects of alterations in arterial wave. J Cardiothorac Vasc Anesth 2007; 21: 636-43
- MANECKE GR. Cardiac output from the arterial catheter: deceptively simple. J Cardiothorac Vasc Anesth 2007; 21:629-31
- MANECKE GR, AUGER WR. Cardiac output determination from the arterial pressure wave: Clinical testing of a novel algorithm that does not require calibration. J Cardiothorac Vasc Anesth 2007; 21:3-7
- MARIK PE. Noninvasive cardiac output monitors: a state-of-the-art review. J Cardiothorac Vasc Anesth 2013; 27:121-34
- MAUS TM, LEE DE. Arterial pressure-based cardiac output measurement. J Cardiothorac Vasc Anesth 2008; 22:468-73
- MAYER J, BOLDT J, WOLF MW, et al. Cardiac output derived from arterial pressure waveform analysis in patients undergoing cardiac surgery: validity of a second generation device. Anesth Analg 2008; 106:867-72
- MAYER J, BOLDT J, BESCHMANN R, et al. Uncalibrated arterial pressure waveform analysis for less-invasive cardiac output determination in obese patients undergoing cardiac surgery. Brit J Anesth 2009; 103:185-90
- MAYER J, BOLDT J, POLAND R, et al. Continuous arterial pressure waveform-based cardiac output using the FloTrac/Vigileo: A review and meta-analysis. J Cardiothorac Vasc Anesth 2009; 23:401-8
- METZELDER S, COBURN M, FRIES M, et al. Performance of cardiac output measurement derived from arterial pressure waveform analysis in patients requiring high-dose vasopressor therapy. Br J Anaesth 2011; 106:776-84
- MICHARD F, ALAYA S, ZARKA V, et al. Global end-diastolic volume as an indicator of cardiac preload in patients with septic shock. Chest 2003; 124:1900-8
- MICHARD F, GIGLIO MT, BRIENZA N. Perioperative goal-directed therapy with uncalibrated pulse contour methods: impact on fluid management and postoperative outcome. Br J Anaesth 2017; 119:22-30
- MICHARD F, TEBOUL JL. Predicting fluid responsiveness in ICU patients. A critical analysis of evidence. Chest 2002; 121:2000-8
- MONNET X, VAQUER S, ANGUEL N, et al. Comparison of pulse contour analysis by Pulsioflex and Vigileo to measure and track changes of cardiac output in critically ill patients. Br J Anaesth 2015; 114:235-43
- OPDAM HI, WAN L, BELLOMO R. A pilot assessment of the FloTrac™ cardiac output monitoring system. Intensive Care Med 2007; 33:344-9
- PAARMANN H, GROESDONK HV, SEDEMUND-ADIB B, et al. Lack of agreement between pulmonary arterial thermodilution cardiac output and the pressure recording analytical method in postoperative cardiac surgery patients. Br J Anaesth 2011; 106:475-81
- PEETERS Y, BERNARDS J, MEKEIRELE M, et al. Hemodynamic monitoring: to calibrate or not to calibrate ? Part 1 – Calibrated techniques. Anaesthesiol Intens Ther 2015; 47:487-500
- PERNY J, KIMMOUN A, PEREZ P, et al. evaluation of cardiac function as measured by transpulmonary thermodilution as an indicator of left ventricular ejection fraction in cardiogenic shock. Biomed Res Int 2014; 598029
- PITTMAN J, BAR-YOSEF S, SUMPING J, et al. Continuous cardiac output monitoring with pulse contour analysis: A comparison with lithium indicator dilution cardiac output measurement. Crit Care Med 2005; 33:2015-21
- REKIK N, BROCHARD L, RAUSS A, et al. Prospective assessment of the benefit and risk of Swan-Ganz catheter in critically ill patients. Am Rev Respir Dis 1989; 139:A17
- RENNER J, SCHOLZ J, BEIN B. Monitoring cardiac function: echocardiography, pulse contour analysis and beyond. Best Practice Res Clin Anaesthesiol 2013; 27:187-200
- REUTER DA, FELBINGER TW, KILGER E, et al. Optimizing fluid therapy in mechanically ventilated patients after cardiac surgery by on-line monitoring of left ventricular stroke volume variations. Brit J Anaesth 2002; 88:124-6
- REUTER DA, HUANG C, EDRICH T, et al. Cardiac output monitoring using indicator-dilution techniques: basics, limits, and perspectives. Anesth Analg 2010; 110:700-811
- RICHARD C, MONNET X, TEBOUL JL. Pulmonary artery catheter monitoring in 2011. Curr Opin Crit Care 2011; 17:296-302
- RÖDIG G, PRASSER C, KEYL C, et al. Continuous cardiac output measurement: pulse contour analysis vs thermodilution technique in cardiac surgical patients. Br J Anaesth 1999; 82:525-30
- ROMANO S, PISTOLESI M. Assessment of cardiac output from systemic arterial pressure in humans. Crit Care Med 2002; 30:1834-41
- SAKKA SG, REINHART K, MEIER-HELLMANN A. Comparison of pulmonary artery and arterial thermodilution cardiac output in critically ill patients. Intesive Care Med 1999; 25:843-6
- SAKKA SG, REUTER DA, PEREL A. The transpulmonary thermodilution technique. J Clin Monit Comput 2012; 26:347-53
- SAKKA SG, RUHL CC, PFEIFFER UG, et al. Assessment of cardiac preload and extravascular lung water by single transpulmonary thermodilution. Intensive Care Med 2000; 26:180-7
- SANGKUM L, LIU GL, YU L, et al. Minimally invasive or noninvasive cardiac output measurement: an update. J Anesth 2016; 30:461-80
- SAUGEL B, CECCONI M, HAJJAR LA. Noninvasive cardiac output monitoring in cardiothoracic surgery: available methods and future directions. J Cardiothorac Vasc Anesth 2019; 33:1742-52
- SAUGEL B, CECCONI M, REUTER DA. Noninvasive continuous cardiac output monitoring in perioperative and intensive care medicine. Br J Anaesth 2015; 114:562-75
- SAUGEL B, DUECK R, WAGNER JY. Measurement of blood pressure. Best Practice Res Clin Anaesthesiol 2014; 28:309-22
- SCHRAMM S, ALBRECHT E, FRASCAROLO P, CHASSOT PG, SPAHN DR. Validity of an arterial pressure waveform analysis device: Does the puncture site play a role in the agreement with intermittent pulmonary artery catheter thermodilution measurements ? J Cardiothorac Vasc Anesth 2009; 23:250-6
- SLAGT C, MALAGON I, GROENEVELD ABJ. Systematic review of uncalibrated arterial pressure waveform analysis to determine cardiac output and stroke volume variation. Br J Anaesth 2014; 112: 626-37
- SUEHIRO K, TANAKA K, MATSUURA T, et al. The Vigileo-Flotrack™ system: arterial waveform analysis for measuring cardiac output and predicting fluid responsiveness: a clinical review. J Cardiothorac Vasc Anesth 2014; 28: 1361-74
- THIELE RH, BARTELS K, GAN TJ. Cardiac output monitoring: a contemporary assessment review. Crit Care Med 2015; 43:177-85
