Les éléments prédicteurs de risque cardiaques propres au patient sont en général classés en trois catégories, basées sur les données de la clinique: prédicteurs mineurs, intermédiaires et majeurs [8]. A cela s'ajoutent des facteurs comme l'âge, l'anémie ou la tachycardie [33].
Facteurs de risque mineurs
Les prédicteurs mineurs sont des marqueurs de maladies cardiovasculaires qui indiquent la présence d’un terrain favorable à une cardiopathie ou une coronaropathie, mais ne sont pas en eux-mêmes des prédicteurs indépendants du risque opératoire. Ces patients ne présentent aucune évidence clinique de cardiopathie et sont asymptomatiques sans traitement particulier. Le taux d'accident cardiaque périopératoire est en moyenne de 0.7%. Ces facteurs mineurs sont les suivants.
- Anamnèse familiale de coronaropathie ou de cardiopathie;
- Age > 70 ans (voir ci-dessous);
- Status polyvasculaire;
- Hypertension artérielle traitée;
- Tabagisme;
- Hypercholestérolémie, CRP élevée;
- Hypertrophie ventriculaire gauche et/ou bloc de branche à l’ECG;
- Syndrome métabolique; état prédiabétique qui consiste en : périmètre abdominal > 100 cm, triglycérides > 150 mmol/L, PA > 135/85 mmHg, glycémie > 11 g/L, âge > 45 ans (hommes) ou > 55 ans (femmes);
- HIV: les porteurs ont un risque d’infarctus 1.5 fois supérieur à celui de la population correspondante non-infectée [38].
Facteurs de risque intermédiaires
Les prédicteurs intermédiaires comprennent 6 facteurs de risque qui signent la présence d’une cardiopathie ou d’une affection médicale stable et contrôlée [26]. La présence de ces éléments implique un taux de complications cardiaques de 1-5%, qui augmente proportionnellement au nombre de facteurs.
- Coronaropathie stable ;
- Angor stable (stade I-II) ;
- Patient asymptomatique sous traitement médicamenteux optimal ;
- Ancien infarctus asymptomatique ;
- Episodes d’ischémie silencieuse documentés ;
- Evènement coronarien aigu depuis > 6-12 mois (SCA), ou > 3 mois si infarctus simple sans complication;
- Revascularisation par PAC ou stents passifs depuis > 6 semaines;
- Revascularisation par stents actifs depuis > 3 mois (DES 2ème et 3ème génération), ou depuis > 6 mois (DES 1ère génération);
- Insuffisance cardiaque compensée ;
- Maladie cérébro-vasculaire (anamnèse d’AVC) ;
- Diabète insulino-requérant ;
- Insuffisance rénale (créatininémie > 200 μmol/L) ;
- Sténose aortique serrée asymptomatique.
Facteurs de risque majeurs
Les prédicteurs majeurs sont les indicateurs d'une cardiopathie décompensée et/ou d’une coronaropathie instable.
- Syndrome coronarien aigu, angor instable (stade IV) ;
- Angor résiduel malgré un traitement médical maximal ;
- Evénement coronarien (infarctus ou revascularisation) datant de < 6 semaines ;
- Stents actifs datant de < 3 mois (2ème-3ème génération) à < 6 mois (1ère génération) ;
- Insuffisance cardiaque décompensée ;
- Sténose aortique ou mitrale symptomatique, valvulopathie décompensée ;
- Arythmies malignes.
Ces facteurs multiplient le risque opératoire par un facteur de cinq ; le risque de complications cardiaques lors d’interventions majeures est alors ≥ 15%. Ces malades réclament des investigations complémentaires et une prise en charge intensive pour rééquilibration préopératoire. Seules des interventions vitales sont justifiées dans cette catégorie de patients.
Age
L'âge en soi est un facteur mineur, mais il est un marqueur de la durée d'exposition de l'individu à des pathologies affectant les organes-cibles: hypertension artérielle, polyvasculopathie, insuffisance rénale, hépatique ou cardiaque [6]. Ceci fait que l'âge physiologique n'est pas l'équivalent de l'âge chronologique, car la vieillesse en soi a moins de poids que les comorbidités médicales qui lui sont associées [7]. Or un tiers des malades de > 65 ans souffre d'au moins une affection chronique [24]. Le risque d'infarctus postopératoire double entre 50 et 80 ans [19]. Du point de vue hémodynamique, la vieillesse est caractérisée par une dysfonction diastolique et une rigidification de l'arbre artériel (voir Chapitre 21 Le patient âgé). La sénescence est caractérisée par une dégradation de la réserve de performance, car les organes subissent une perte fonctionnelle d'environ 1% par an au-delà de 40 ans [13]. Alors que la capacité de base est bien maintenue, la capacité maximale s'érode inexorablement, si bien que la réserve en cas d'effort ou de stress devient de plus en plus faible. Cet état de fait a trois conséquences.
- L'état clinique au repos ne prédit pas le comportement sous stress;
- Aucune compensation n'est possible au-delà des conditions de base ou de la situation d'un effort minimal (≤ 4 MET);
- Une chirurgie majeure est envisageable pour autant que l'hémostase soit rigoureusement maintenue et que ne survienne aucune complication.
La fragilité (frailty) est une vulnérabilité extrême liée à l'effet cumulatif du déclin de nombreux systèmes avec l'âge. Sa prévalence est de 16% entre 80 et 84 ans, et de 26% au-delà de 85 ans [12]. Cette perte de la résilience entame tellement les réserves physiologiques que des stresseurs minimes peuvent déclencher des altérations disproportionnées de l'état clinique. Le diagnostic de fragilité est très important parce que ces patients sont gravement péjorés par le stress majeur d'une intervention chirurgicale, quand bien même leur âge chronologique n'est pas en soi une contre-indication [9]. L'association avec les maladies cardiovasculaires est élevée (OR 4.1), et sa présence triple la mortalité en chirurgie non-cardiaque majeure (OR 3.1) [2]. La fragilité est constituée de différents éléments: faiblesse, fatigabilité, chutes répétitives, inactivité, perte pondérale, malnutrition, rapetissement corporel, dépendance, lenteur de la marche (> 6 sec pour 5 m), dépression, altérations cognitives, épisodes de délire, anémie, immunodéficience, dont on peut constituer un indice. Il est alors un prédicteur indépendant du risque opératoire, augmentant de 2 à 4 fois la mortalité [3]. Il existe plusieurs indices de fragilité utilisés principalement en gériatrie, sans qu'aucun ne paraisse clairement supérieur aux autres.
Autres facteurs
L'anémie préopératoire est un élément majeur dans la survenue des complications postopératoires et de la mortalité hospitalière. Elle touche environ 30% des patients. Elle est considérée comme modérée lorsque le taux d'Hb est situé entre 100 et 120 g/L et sévère lorsqu'il est inférieur à 100 g/L. Dans une série de 39'309 patients avec un risque cardiaque de base de 0.7%, l'anémie modérée double le risque opératoire (OR 1.99) et l'anémie sévère le triple (OR 2.82) [4]. Elle multiplie par cinq le taux de transfusion [25] et augmente la mortalité de toutes les opérations [32]. Comme elle est souvent le marqueur de comorbidités graves, les maladies qui lui sont associées péjorent encore le pronostic (OR 4.69) [36]. Il est donc inacceptable qu'un patient qui ne saigne pas soit laissé anémique avant une opération élective, car la prévention de ce taux de complication est simple: administration de fer, de vitamine B12 et d'acide folique, éventuellement d'érythropoïétine (voir Chapitre 28 Phase préopératoire) [10].
Le nombre de battements cardiaques étant limité à environ 2 milliards au cours de l'existence humaine, il est logique que la tachycardie soit un facteur de risque à long terme ou lors d'évènements stresseurs comme la chirurgie [14,29]. Effectivement, la fréquence de base en préopératoire est directement associée à l'ischémie myocardique, à l'infarctus et à la mortalité postopératoire à 30 jours. Sur un collectif de 15'087 patients, un nombre de battements/minute > 96 au repos augmente significativement le taux de souffrance myocardique (OR 1.48), d'infarctus (OR 1.71) et de mortalité (OR 3.16) [1]. Un rythme < 60 batt/min, au contraire, diminue la mortalité postopératoire (OR 0.50). Le contrôle de la fréquence par un agent bloqueur β1-sélectif prend ici tout son sens car il vise à rétablir un équilibre perturbé (voir béta-bloqueurs).
Capacité fonctionnelle
La capacité fonctionnelle (CF) est divisée en trois catégories : excellente (> 9 MET), modérée (4-8 MET) ou faible (< 4 MET) (voir Tableau 3.3) [20,21]. Le niveau de discrimination entre faible et bonne tolérance à l'effort est situé entre 4 et 5 MET, ce qui correspond à la limite située entre le franchissement de un ou de deux étages d'escaliers (VO2 11-15 mL/kg/min, correspondant au seuil anaérobique). En dessous du seuil de 4 MET, la mortalité opératoire augmente significativement : une CF < 4 MET a une valeur predictive positive pour les complications cardio-pulmonaires de 89% [17]. Le taux d’ischémie myocardique, d’insuffisance cardiaque et d’événements cérébro-vasculaires passe de 10% au-dessus de 5 MET à 20% en dessous de 4 MET [35]. Le risque de complications cardiaques augmente de 2.7 fois entre un patient indépendant et un patient totalement dépendant [35].
A défaut de pouvoir pratiquer une ergométrie et de déterminer le seuil anaérobique (voir ECG d’effort), on peut calculer la distance parcourue pendant 6 minutes de marche. Les patients parcourant > 560 mètres ne réclament aucune investigation préopératoire, alors que ceux qui franchissent < 400 m en 6 minutes sont à risque opératoire élevé et réclament une prise en charge adaptée [37].
Intervention chirurgicale
Le risque lié à l'opération varie en fonction de sa gravité, de sa durée et des délabrements tissulaires ou des altérations hémodynamiques/volémiques qui lui sont associées. On peut classer les interventions chirurgicales en trois catégories de risque (majeur, intermédiaire et mineur), et par ordre d’importance décroissant au sein de chaque catégorie (Tableau 3.5) [8].

La chirurgie majeure est associée à une mortalité cardiaque de 1.5% et à un taux de complications cardiovasculaires de 3.5% [8]. La mortalité opératoire des malades polyvasculaires est plus élevée, aussi bien en chirurgie vasculaire (5-9%) qu'en chirurgie cardiaque (3-6%) ; le taux d'infarctus varie en fonction du site opératoire : 5-14% en chirurgie de l'aorte abdominale, 4-6% en chirurgie vasculaire périphérique, 1.4% en chirurgie carotidienne [5,11,15,27,31]. Les interventions en urgence sont toujours grevées d'un risque plus élevé. La répartition des procédures en trois catégories de risque est une approximation qui ne rend pas compte de la variation très large et très continue du risque cardiaque opératoire selon l'opération. En collectant les 200 interventions les plus fréquemment pratiquées dans un échantillon de plus de 3 millons, il est possible de définir le risque intrinsèque de chacune d'entre elles. Ce risque, défini par la survenue d'un infarctus ou d'un arrêt cardiaque, va de 0.01% pour la biopsie excisionnelle du sein à 4.1% pour la cure d'anévrysme de l'aorte abdominale [30]. Au lieu de n'avoir que 3 classes de risque (< 1%, 1-4%, > 4%), on dispose alors de la mortalité cardiaque propre de chaque intervention, ce qui permet d'affiner l'évaluation et la stratification préopératoire des patients.
Les risques liés à l'intervention chirurgicale ne doivent pas être mesurés en valeur absolue, mais doivent être mis en balance avec le pronostic de l'affection sans intervention, et avec la qualité de la vie sans la thérapeutique proposée. L'alternative sans opération peut être dramatique: évolution rapide d'un cancer, accidents hémorragiques ou thrombotiques, alitement strict, douleurs, iléus, étouffement par lésion de la sphère ORL, etc. Pour équilibrer les risques, il peut être nécessaire de réduire l'importance de l'intervention : se limiter à une opération de confort, par nature palliative, permet de soulager un malade sans lui faire courir de risques excessifs, mais sans lui dénier le droit à toute thérapeutique au nom du danger opératoire. En traumatologie, par exemple, une ostéosynthèse rapide est souvent le seul moyen de permettre la physiothérapie et la mobilisation, d'éviter l'encombrement respiratoire, les lésions de décubitus ou l’embolie pulmonaire, et de calmer la douleur. En chirurgie aortique, l’endoprothèse réduit significativement le risque opératoire par rapport à la cure ouverte, mais donne de moins bons résultats à long terme.
Bien qu’apparemment moins invasive que la laparotomie, la laparoscopie ne présente pas d’avantage par rapport au risque cardiaque, à cause des effets hémodynamiques majeurs du pneumopéritoine et de la position de Trendelenburg: baisse du retour veineux, élévation de la PVC et de la PAP, augmentation de la PAM et des RAS. Le risque cardiaque en peropératoire est plus élevé que celui de la laparotomie [24,28]. Son intérêt réside essentiellement dans la facilitation des suites postopératoires. La chirurgie endovasculaire de l'aorte et des grandes artères présente moins de risque immédiat que la chirurgie à ciel ouvert et abaisse de près de trois fois la morbi-mortalité à court terme [16,24]. La mortalité à longue échéance n'est pas différente. Comme le problème est lié ici au taux de complications et de reprises à long terme qui est supérieur à celui de la voie ouverte, la voie endovasculaire est particulièrement bien adaptée aux personnes âgées dont l'espérance de vie est plus courte [18].
Les performances propres de l’institution peuvent également introduire une variation dans l’estimation du risque chirurgical [23]. Des facteurs marginaux prennent toute leur importance chez des malades compromis: qualité de l'opérateur et de l'anesthésiste, accélération du tempo opératoire, hémorragie minimale, chirurgie peu délabrante, positionnement ne compromettant pas l'hémodynamique, voie d'abord interférant peu avec la ventilation spontanée, disponibilité de soins intensifs postopératoires. En effet, certains facteurs peropératoires sont des prédicteurs indépendants des accidents cardiaques postopératoires au même titre que les facteurs de risque clinique préopératoires. Ce sont [22] :
- Durée opératoire > 3.8 heures ;
- Transfusion de > 1 flacon de sang ;
- Episode d’hypotension artérielle (pression moyenne < 50 mmHg ou abaissée de > 40%) ;
- Episode de tachycardie > 100 batt/min pendant > 15 minutes.
L’association d’une hémorragie nécessitant une transfusion de > 3 flacons, d’une hypotension sévère (PAM < 40 mmHg pendant > 15 minutes) et d’une tachycardie rebelle (> 100 batt/min pendant > 15 minutes) est liée à une augmentation de onze fois des risques de complications cardio-vasculaires [34].
La prise en charge préopératoire en fonction des facteurs de risque est illustrée dans la Figure 3.8 qui montre le cheminement dans le cas de patients souffrant de coronaropathie [8].
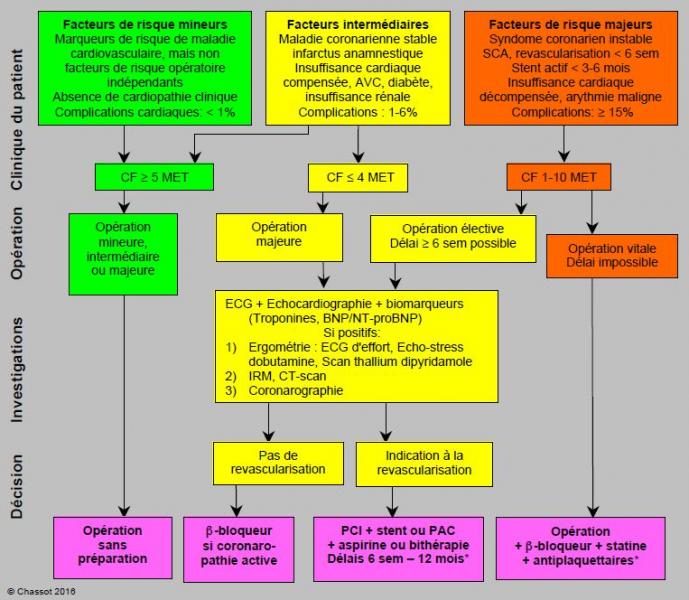
Figure 3.8 : Algorithme d'évaluation du patient ischémique ou à risque coronarien pour la chirurgie non-cardiaque (modifié d'après référence 8). Les patients à risque mineur et intermédiaire avec une bonne capacité à l'effort peuvent subir une intervention sans investigation ni préparation particulière. Des investigations cardiologiques sont indiquées chez les patients à risque intermédiaire avec une mauvaise performance à l'effort lors d'opération majeure, et chez les patients à risque majeur (cardiopathie instable), pour autant que les délais le permettent. L'ECG, l'échocardiographie et les biomarqueurs sont une étape intermédiaire qui permet de sélectionner les malades chez qui les investigations cardiologiques sont le plus utiles. La revascularisation coronarienne impose des délais importants (variables selon le mode de revascularisation) avant de procéder à la chirurgie. Complications cardiaques: ischémie myocardique, infarctus, défaillance ventriculaire, arythmie grave, décès cardiovasculaire. Dans le syndrome coronarien instable, le risque de thrombose coronarienne à l'arrêt des antiplaquettaires (aspirine + clopidogrel/prasugrel/ticagrelor) est en général plus grave que celui d'hémorragie chirurgicale sur continuation de ces derniers. MET: équivalent métabolique. PCI: Percutaneous Coronary Intervention. PAC: pontage aorto-coronarien. SCA: syndrome coronarien aigu. *: voir Tableaux 3.9A et 3.9B, et Antiplaquettaires.
| Facteurs de risque opératoire |
|
Facteurs mineurs : marqueurs de risque cardiovasculaire mais non facteurs de risque opératoire. Taux de complications cardiaques postopératoires identique à celui de la population générale (0.7%)
Facteurs intermédiaires : coronaropathie stable, insuffisance cardiaque compensée, accident cérébro-vasculaire, diabète insulino-requérant, insuffisance rénale (créat > 200 μmol/L), sténose aortique asymptomatique, chirurgie majeure. Risque cardiaque opératoire : 1-6%.
Facteurs majeurs : coronaropathie instable, stent coronarien non encore endothélialisé, insuffisance cardiaque décompensée, sténose aortique ou mitrale serrée symptomatique, arythmies malignes. Risque cardiaque opératoire : ≥ 15%.
L'âge est facteur aggravant dans la mesure où il est un marqueur de la durée d'exposition aux pathologies. L'anémie pénalise lourdement le pronostic de toutes les interventions; il est inacceptable qu'un malade qui ne saigne pas soit anémique avant une intervention élective. Une capacité fonctionnelle < 4 MET est un facteur de risque supplémentaire.
Facteurs chirurgicaux: les interventions sont classées en 3 catégories selon leur gravité, leur durée, le degré de délabrement tissulaire et les altérations hémodynamiques/volémiques. Le risque cardiaque peropératoire de la laparoscopie est supérieur à celui de la laparotomie équivalente. La chirurgie endovasculaire de l'aorte est au contraire mieux tolérée que la voie ouverte.
Les patients à risque mineur et intermédiaire avec une bonne capacité à l'effort peuvent subir une intervention sans investigation ni préparation particulière. Des investigations cardiologiques sont indiquées chez les patients à risque intermédiaire avec une mauvaise performance à l'effort lors d'opération majeure, et chez les patients à risque majeur (cardiopathie instable), pour autant que les délais le permettent. L'ECG, l'échocardiographie et les biomarqueurs permettent de sélectionner les malades chez qui les investigations cardiologiques sont le plus utiles. La revascularisation coronarienne impose des délais importants (variables selon le mode de revascularisation) avant de procéder à la chirurgie.
|
© CHASSOT PG, DELABAYS A, SPAHN DR, Mars 2010, dernière révision Août 2019
Références
- ABBOTT TEF, ACKLAND GL, ARCHBOLD RA, et al. Preoperative heart rate and myocardial injury after non-cardiac surgery: results of a predefined secondary analysis of the VISION study. Br J Anaesth 2016; 117:172-81
- AFILALO J, ALEXANDER KP, MACK MJ, et al. Frailty assessment in the cardiovascular care of older adults. J Am Coll Cardiol 2014; 63:747-62
- BAGNALL NM, FAIZ O, DARZI A, ATHANASIOU T. What is the utility of preoperative frailty assessment for risk stratification in cardiac surgery ? Interact Cardiovasc Thorac Surg 2013; 17:398-402
- BARON DM, HOCHRIESER H, POSCH M, et al. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. Br J Anaesth 2014; 113:416-23
- BEATTIE WS, ABDELNAEM E, WIJEYSUNDERA DN, BUCKLEY DN. A meta-analytic comparison of preoperative stress echocardiography and nuclear scintigraphy imaging. Anesth Analg 2006; 102:8-16
- BICCARD BM, RODSETH R. Utility of clinical risk predictors for perioperative cardiovascular risk prediction. Br J Anaesth 2011; 107:133-43
- BOEHM O, BAUMGARTEN G, HOEFT A. Preoperative patient assessment: identifying patients at high risk. Best Pract Res Clin Anaesthesiol 2016; 30:131-43
- CHASSOT PG, DELABAYS A, SPAHN DR. Preoperative evaluation of patients with, or at risk of, coronary artery disease undergoing non-cardiac surgery. Brit J Anaesth 2002; 89:747-59
- CLEGG A, YOUNG J, ILIFFE S, et al. Frailty in elderly people. Lancet 2013; 381:752-62
- CLEVENGER R, RICHARDS T. Preoperative anaemia. Anaesthesia 2015; 70(Suppl 1): 20-8,e6-e8
- COHEN MC, ARETZ TH. Histological analysis of coronary artery lesions in fatal postoperative myocardial infarction. Cardiovasc Pathol 1999; 8:133-9
- COLLARD RM, BOTER H, SCHOEVERS RA et al. Prevalence of frailty in community-dwelling older persons: a systematic review. J Am Geriatr Soc 2012; 60:1487-92
- COOK DJ, ROOKE GA. Priorities in perioperative geriatrics. Anesth Analg 2003; 96:1823-36
- COOK S, TOGNI M, SCHAUB MC, WENEWESER P, HESS OM. High heart rate: a cardiovascular risk factor ? Eur Heart J 2006; 27:2387-93
- FERGUSON GG, ELIASZIV M, BARR HW, et al. The North American Symptomatic Carotid Endarterectomy Trial.: Surgical results in 1415 patients. Stroke 1999; 30(9):1751
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GIRISH M, TRAYNER E, DAMMANN O, et al. Symptom-limited stair climbing as a predictor of postoperative cardiopulmonary complications after high-risk surgery. Chest 2001; 120:1147-51
- GRAILEY K, MARKAR SR, KARTHIKESALINGAM A, et al. Laparoscopic vs open colorectal resection in the elderly population. Surg Endosc 2013; 27:19-30
- GUPTA PK, GUPTA H, SUNDARAM A, et al. Development and validation of a risk calculator for prediction of cardiac risk after surgery. Circulation 2011; 124:381-7
- HLATKY MA, BOINEAU RE, HIGGINBOTHAM MB, et al. A brief self-administered questionnaire to determine functional capacity (the Duke Activity Status Index). Am J Cardiol 1989; 64:651-4
- KAISER HA, ZURRON N, BEILSTEIN CM, et al. Evaluation préopératoire du risque cardiaque avant des interventions chirurgicales non cardiaques. Forum Méd Suisse 2018; 18:725-32
- KHETERPAL S, O’REILLY M, ENGLESBE MJ, et al. Preoperative and intraoperative predictors of cardiac adverse events after general, vascular, and urological surgery. Anesthesiology 2009; 110:58-66
- KHURI SF, DAKEY J, HENDERSON W, et al. The National Veterans Administration Surgical Risk Study: risk adjustment for the comparative assessment of the quality of surgical care. J Am Coll Surg 1995; 180:519-31
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- LASOCKI S, KRAUSPE R, VON HEYMANN C, ET AL. PREPARE: the prevalence of perioperative anaemia and need for patient blood management in elective orthopaedic surgery. Eur J Anaesthesiol 2015; 32:160-7
- LEE TH, MARCANTONIO ER, MANGIONE CM, ET AL. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LE MANACH Y, PERREL A, CORIAT P, et al. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102:885-91
- LESTAR M, GUNNARSSON L, LAGERSTRAND L, et al. Hemodynamic perturbations during robot-assisted laparoscopic radical prostatectomy in 45° Trendelenburg position. Anesth Analg 2011; 113: 1069-75
- LEVINE HJ. Rest heart rate and life expectancy. J Am Coll Cardiol 1997; 30:1104-6
- LIU JB, LIU Y, COHEN ME, et al. Defining the intrinsic cardiac risks of operations to improve preoperative cardiac risk assessments. Anesthesiology 2018; 128:283-92
- McFALLS EO, WARD HB, MORITZ TE, et al. Coronary artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351:2795-804
- MUSALLAM KM, TAMIM HM, RICHARDS T, et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. Lancet 2011; 378:1396-407
- PATEL AY, EAGLE KA, VAISHNAVA P. Cardiac risk of noncardiac surgery. J Am Coll Cardiol 2015; 66:2140-8
- REGENBOGEN SE, EHRENFELD JM, LIPSITZ SR, et al. Utility of the surgical Apgar Score. Validation in 4119 patients. Arch Surg 2009; 144:30-6
- REILLY DF, McNEELY MJ, DOERNER D, et al. Self-reported exercise tolerance and the risk of serious perioperative complications. Arch Intern Med 1999; 159:2185-92
- SAAGER L, TURAN A, REYNOLDS LF, et al. The association between preoperative anemia and 30-day mortality and morbidity in noncardiac surgical patients. Anesth Analg 2013; 117:909-15
- SINCLAIR RCF, BATTERHAM AM, DAVIES S, et al. Vakidity of the 6-min walk test in prediction of the anaerobic threshold before major non-cardiac surgery. Br J Anaesth 2012; 108:30-5
- ZANNI MV, SCHOUTEN J, GRINSPOON SK, REISS P. Risk of coronary artery disease in patients with HIV infection. Nat Rev Cardiol 2014; 11:728-41
