L'évaluation préopératoire commence par une anamnèse dirigée sur les problèmes de saignement du patient et de sa famille, ainsi que sur son éventuelle consommation d'anticoagulants. Un questionnaire spécifique aux questions hémorragiques est un dépistage plus efficace que les tests de coagulation habituels (TP, TPT, etc) qui ont une très faible valeur prédictive pour le risque hémorragique [29]. Pour être adéquate, l'évaluation préopératoire doit avoir lieu 4-6 semaines avant une intervention élective, de manière à avoir le temps nécessaire pour une restauration de la masse érythrocytaire chez les patients qui en seraient déficitaires (environ 30% des cas) [10].
Médications antiplaquettaires
L’inhibition de l’agrégation plaquettaire, qui augmente le risque d’hémorragie spontanée, est un facteur aggravant pour le saignement peropératoire. La question centrale est de déterminer dans chaque situation quel est le danger le plus menaçant pour le patient : la thrombose coronarienne si l’on interrompt les antiplaquettaires, ou l’hémorragie chirurgicale si on les maintient. Ceci est d’autant plus important que 12-15% de la population des pays industrialisés consomme des antiplaquettaires de manière chronique, et que 5-11% des patients qui bénéficient d’une revascularisation coronarienne vont subir une intervention de chirurgie non-cardiaque dans l’année qui suit la pose de leurs stents [25]. Toutefois, les antiplaquettaires ne sont pas tout-puissants et n’offrent qu’une protection relative, puisque environ 10% des patients manifestent des complications cardio- et cérébro-vasculaires alors qu’ils sont sous antiplaquettaires. Ces derniers n’abaissent le risque cardiaque que de 20% en moyenne (réduction absolue : 1-3%) [19]. Par contre, ces substances accroissent le risque hémorragique : + 1.2% pour l’aspirine, + 2.1% pour la combinaison aspirine - clopidogrel, et + 2.4% pour la combinaison aspirine – prasugrel (en augmentation absolue).
Bien que le risque de transfusion diminue si on interrompt les antiplaquettaires, il est capital de bien peser le risque hémorragique par rapport à celui qui est lié à l'arrêt du médicament. En chirurgie générale, les données actuelles démontrent clairement que le risque d’infarctus et de décès à l’arrêt des antiplaquettaires est 5 à 10 fois plus élevé que celui d’hémorragie peropératoire lorsque le traitement est maintenu [9,29]. Il est recommandé de ne jamais interrompre la bithérapie dans les 12 premiers mois après un syndrome coronarien aigu ou pendant la phase de réendothélialisation des stents (6 semaines pour les stents passifs, 6-12 mois pour les stents actifs) (Tableau 28.4).
Les opérations électives doivent être renvoyées au-delà de ces délais. Les interventions qui ne peuvent pas tolérer ce report doivent se dérouler sous bithérapie ininterrompue [9,29,31]. L'aspirine est maintenue lors de toutes les opérations de chirurgie générale, d'endoscopie et d'orthopédie, mais de préférence interrompue 3-5 jours lors de neurochirurgie intracrânienne ou intrarachidienne. La bithérapie est maintenue si la situation cardiologique l'exige, sauf dans les opérations en espace clos. En chirurgie cardiaque, la situation est plus délicate à cause de l’héparinisation complète lors de CEC. Dans ce cas particulier, la prise de clopidogrel dans les 5 jours qui précèdent des pontages aorto-coronariens est un prédicteur indépendant du risque hémorragique (OR 1.8-4.7), des besoins transfusionnels (OR 2.2 – 5.7), des reprises chirurgicales pour hémostase (OR 4.6) et du séjour en soins intensifs (OR 3.14), mais non de la mortalité [26,47]. La recommandation habituelle est d’interrompre le clopidogrel ou le ticagrelor 5 jours et le prasugrel 7 jours avant des interventions électives en CEC [8,14,29,31]. La durée de l'arrêt doit être aussi brêve que possible, puisque le risque d’évènement coronarien est augmenté de 1%/jour pendant l'interruption chez les patients souffrant de syndrome coronarien aigu. Trois jours peuvent être suffisants si l'activité plaquettaire est contrôlée par un test d'agrégométrie [18]. Lors d'interventions sous antiplaquettaires, les antifibrinolytiques permettent de réduire les pertes sanguines [1]. Pour davantage de détails, voir Chapitre 29 Antiplaquettaires en périopératoire.
Anticoagulants
De manière simplifiée, le taux sérique d’un médicament baisse à 12.5% de sa valeur initiale après 3 demi-vies et à 3% après 5 demi-vies. La demi-vie d’élimination des substances conditionne donc le délai qu’il faut prévoir entre l’interruption du traitement et l’acte chirurgical. Alors qu’il existe des recommandations pour les délais à respecter lors de traitement avec les héparines et les agents anti-vitamine K (AVK), on ne dispose pas de suffisamment de données sur les nouveaux anticoagulants pour pouvoir promulguer des règles concernant leur gestion préopératoire. Pour l’instant, on est contraint de se satisfaire de propositions formulées par des groupes d’experts ; elles sont basées sur la pharmacocinétique de ces substances. Les délais d’interruption préopératoire habituellement proposés sont les suivants (fonctions hépatique et rénale normales) (Tableau 28.5) (voir Chapitre 8, Tableau 8.7A).
- Héparine non-fractionnée 4-6 h
- HBPM prophylactique 12 h (24 heures si clairance créatinine < 50 mL/min)
- HBPM thérapeutique 24 h (48 heures si clairance créatinine < 50 mL/min)
- Fondaparinux (Arixtra®) 48 h (4-6 jours si clairance créatinine < 50 mL/min)
- Dabigatran (Pradaxa®) 48 h (3-5 jours si clairance créatinine < 50 mL/min)
- Apixaban (Eliquis®) 48 h (3-4 jours si clairance créatinine < 50 mL/min)
- Edoxaban (Savaysa®, Lixiana®) 48 h (3-5 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 5-10 mg/j 24 h (3 jours si clairance créatinine < 50 mL/min)
15-20 mg/j 48 h (3-4 jours si clairance créatinine < 50 mL/min) - Warfarine (Coumadine®) 5 jours (contrôle INR à J-5 et J-1)
- Acénocoumarol (Sintrom®) 5 jours (contrôle INR à J-5 et J-1)
- Phenprocoumone (Marcoumar®) 10 jours (contrôle INR à J-10 et J-1)
- Désirudine (Iprivask®) 10 h
- Bivalirudine (Angiox®) 4-10 h
- Danaparoïde (Orgaran®) 48 h
- Argatroban (Argatroban Inj®) 4 h
Ces délais sont basés sur une attente correspondant à 3 demi-vies d’élimination; en cas d’insuffisance rénale, ils sont au moins doublés pour les substances éliminées par les reins. A cause des risques inhérents à l’anesthésie loco-régionale, il est préférable d’attendre 5 demi-vies avant une ponction neuraxiale pour s’assurer d’une élimination complète du produit [13,20,24].
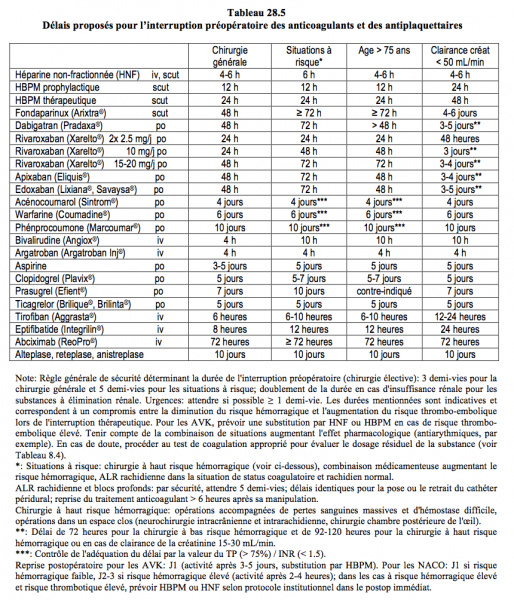
L'arrêt préopératoire des agents anti-vitamine K (AVK) est de 5 jours (warfarine, acénocoumarol) à 10 jours (phenprocoumone). Une valeur d’INR < 2.0 est en général suffisante pour procéder à une chirurgie à risque hémorragique modéré, alors qu’un INR < 1.5 est requis pour une chirurgie majeure. Contrôler l’INR 24 heures avant la chirurgie. L’arrêt des AVK n’est pas nécessaire avant la chirurgie dermatologique, la chirurgie de surface, la dentisterie, l’ophthalmologie (cataracte), l’endoscopie ou la pose de pace-maker. Pour un acte chirurgical majeur, par contre, leur interruption pendant ≥ 5 jours est requise [11,31]. Leur substitution dépend du risque thrombo-embolique encouru par le patient (voir Tableaux 8.6A et Figure 8.15).
- Substitution si risque thrombo-embolique élevé: HNF iv (≥ 20'000 U/24 h) ou HBPM (≥ 20'000 U/24 h) dès 48-72 heures après la dernière dose d'AVK; stop respectivement 4 heures ou 24 heures préop.
- Substitution (HBPM (10'000 U/24 h) dès 48-72 heures après la dernière dose d'AVK; stop 12 heures préop; substitution non requise si risque thrombo-embolique modéré.
- Antidote spécifique: vitamine K (Konakion®) 2.5-5 mg iv/12 h en cas d’urgence; l’effet n’est obtenu qu’après 12 heures. Si opération élective et INR 1.5 - 2.0 : 1-2 mg vitamine K per os.
- Antidote non-spécifique: complexe prothrombinique (PCC prothrombin complex concentrate) (20-40 UI/kg); réservé aux situations d'urgence hémorragique.
Bien qu’elle soit traditionnellement considérée comme une règle de l’art, la substitution par une héparine est actuellement remise en question, particulièrement pour les nouveaux anticoagulants. En effet, les études récentes démontrent qu’elle augmente 3 à 5 fois le risque hémorragique sans mettre à l’abri des complications thrombotiques (incidence inchangée) [7,12,31]. Elle n’est donc formellement indiquée que chez les malades à très haut risque thrombotique (score CHADS2 > 4, thrombo-embolie récidivante < 3 mois, prothèse valvulaire mécanique) qui sont sous AVK (définition du score CHA2DS2-VASc, voir Tableaux 8.6A et 8.6B). Dans les autres situations, elle est n’offre probablement aucun bénéfice et relève d’une décision au cas par cas. Elle n’est pas justifiée pour les nouveaux anticoagulants oraux (rivaroxaban, apixaban, dabigatran, etc). Pour davantage de détails sur les anticoagulants, voir Chapitre 8 Gestion périopératoire.
Prédonation
La prédonation de sang autologue est indiquée si l'Hb est supérieure à 120 g/L et si le malade ne présente pas de coronaropathie, ni d'insuffisance ventriculaire, ni de pathologie respiratoire; elle est programmée sur 3-4 semaines préopératoires, avec une supplémentation en fer et en acide folique, éventuellement en EPO (3 x 150-300 U/kg). Elle demande une infrastructure coûteuse, équivalente à celle d'un centre de transfusion, et une date opératoire fixe. Elle présente un risque d'erreurs de flacon et de contamination bactérienne analogue à celui de la transfusion allologue. De plus, tout ou partie du sang prélevé n'est jamais retransfusé au patient dans plus d'un tiers des cas. Ce sont les raisons pour lesquelles la prédonation est actuellement tombée en désuétude dans de nombreux centres hospitaliers parce que son rapport coût/bénéfice est trop faible [16]. Elle reste justifiée dans les cas où les patients sont porteurs de très nombreux allo-anticorps (cross-match impossible avec les donneurs) ou de groupes sanguins très rares [15].
Correction de l’anémie
L'anémie est une affection sérieuse, potentiellement dangereuse en peropératoire, et facilement corrigible. Elle est définie par une valeur d’Hb < 120 g/L (Ht < 36%) chez la femme et < 130 g/L (Ht < 39%) chez l’homme [23]. Elle est fréquente chez les malades chirurgicaux, particulièrement chez les femmes (16 à 45 ans) et les personnes âgées (plus de 70 ans). Son incidence varie de 5-20% chez l'adulte à 35% chez le patient âgé, et jusqu'à 40% chez le patient cancéreux [32]. Son origine est le plus souvent ferriprive. Les syndromes de manque de fer sont de trois ordres [21].
- Déficience nutritionnelle; la plus fréquente chez la femme menstruée et chez la personne âgée, elle répond bien à l'administration orale de fer.
- Déficience fonctionnelle; lorsque l'érythropoïèse est sur-stimulée (EPO, hémochromatose, phlébotomies itératives), l'apport de fer devient insuffisant.
- Séquestration par l'hepcidine; celle-ci bloque la libération du fer stocké dans les hépatocytes et les macrophages, et en freine l'absorption digestive dans le duodénum. Ce processus est important dans les maladies inflammatoires chroniques, les infections et les néoplasies. L'administration intraveineuse de fer est plus efficace que la voie orale.
Les conséquences cliniques de l'anémie préopératoire sont rédhibitoires. En chirurgie non-cardiaque, la mortalité et la morbidité à 30 jours augmentent de 40% chez les patients anémiques (OR 1.42-1.44 et OR 1.35-1.56, respectivement) [40]. La présence d’une anémie modérée (90-110 g/L) ou d’une anémie sévère (< 90 g/L) multiplie la mortalité hospitalière par un facteur de 2 (OR 1.99) et de presque 3 (OR 2.82), respectivement [5]. Cette dernière s'élève de 16% par 10 g/L de baisse dans la concentration d'Hb [28]. Les risques d'être transfusé sont presque triplés (OR 2.75) [27]. Or, même une seule poche de sang suffit à augmenter significativement les risques de mortalité et de complications postopératoires [33,46] (voir Risques liés à la déplétion érythrocytaire, Anémie préopératoire).
L'administration de fer (sulfate, gluconate ou fumarate, 100-200 mg/j per os) est un appoint majeur et peu onéreux dans la préparation des malades, particulièrement s’ils sont anémiques et sidéro-déficients. En chirurgie colique, par exemple, un traitement de 2 semaines avec 200 mg/jour permet d'augmenter le taux d'Hb de 20 g/L et de diminuer le taux de transfusion de 27% à 9% [42]. La forme orale entraînant souvent une irritation digestive, il peut être préférable d'utiliser une administration intraveineuse, ou de procéder à une augmentation très graduelle des doses. L'adjonction d’une dose de vitamine B12 (1 mg im ou scut), suivie d'acide folique (5 mg/jour) et de vitamine C (500 mg/jour) potentialise le traitement [6]. Les nombreuses formules intraveineuses du Fe (100-300 mg/j selon poids et Hb, en 3 doses les 2-3 jours préopératoires) permettent de refournir rapidement les réserves en fer sans présenter de risque particulier et de court-circuiter le tube digestif en cas d'excès d'activité de l'hepcidine [36,39]. La possible association entre la prescription de fer et les infections nosocomiales postopératoires a été largement surestimée; celles-ci sont principalement liées à l'anémie et aux transfusions, mais non au traitement de fer ou d'EPO [4,38,49]. Toutefois, la prudence recommande d'éviter l'administration de fer moins de 2 semaines avant l'opération [34].
Lorsqu'une déficience nutritionnelle a été exclue ou ne répond pas à l'administration de fer, la reconstitution de la masse érythrocytaire est facilitée par un traitement d'érythropoïétine (EPO): EPO humaine (Eprex®, Recormon®) ou rEPO obtenue par génie génétique (darbopoïétine Aranesp®). Un traitement de 3 doses de 600 U/kg (Eprex®, Recormon®) ou 0.45 mcg/kg (Aranesp®) en 3 semaines (jour -21, -14 et -7) permet de gagner l'équivalent d'une poche de sang par semaine [22]; il doit être accompagné d'une supplémentation en fer (100-200 mg/j po ou 1 g/sem iv). Ce traitement permet de réduire de 10% le nombre de patients transfusés et de 20-50% le nombre de poches administrées [30,37]. Il est destiné premièrement à des populations ciblées: malades dialysés ou cancéreux, insuffisants cardiaques ou respiratoires anémiques, patients refusant les transfusions (Témoins de Jéhovah). Il est étendu à la préparation d'opérations majeures (orthopédie lourde, chirurgie délabrante, chirurgie cardio-vasculaire) chez des patients anémiques (Hb 100-120 g/L). Il diminue le risque d’exposition à des transfusions peropératoires (RR 0.44-0.53), mais il présente un certain risque de thrombose veineuse et artérielle si l'hématocrite obtenu est élevé (RR 1.66) [2,23]. Il est recommandé de ne pas dépasser une Hb de 130 g/L et d'adjoindre une prophylaxie anti-thrombotique par HBPM [35,43,44]. Comme leur incidence est rare, les thromboses artérielles coronariennes, cérébrales ou périphériques présentent un risque difficile à évaluer ; la revue des essais cliniques randomisés ne semble pas montrer de différence par rapport à un placebo, sauf chez les patients en insuffisance rénale ou souffrant de cancer avancé chez qui le risque est augmenté [3,17,18,44]. Le problème du prix de la substance est relatif: un traitement complet (3 injections de 600 U/kg) coûte de CHF 1'000.- à 2'200.- selon la substance choisie (800-1'800 € selon les pays). Il est donc du même ordre de grandeur que la transfusion de 2-3 poches de sang. Dans la plupart des pays industrialisés, l'EPO est admise et remboursée (au moins partiellement) dans cette indication si le patient est anémique et si l'intervention est très hémorragique.
Il est évident que la correction d'une anémie préopératoire n'est efficace que si l'on dispose du temps nécessaire pour la corriger. Le pic d'effet sur l'érythropoïèse d'une perfusion de fer n'apparaît qu'au bout de 3 semaines et dure environ 2 mois [34]. De ce fait, l'évaluation préopératoire des malades à risque pour une chirurgie élective (orthopédie, chirurgie cardiovasculaire) doit avoir lieu 4-6 semaines avant l'intervention [10]. Lorsque les délais sont trop brefs (chirurgie du cancer), on peut tout de même envisager un traitement de courte durée.
- EPO 14'000 UI/jour sous-cut les 2 jours qui précèdent l’opération (OPCAB), 8'000 UI/jour le jour opératoire et les deux premiers jours postop ; au 4ème jour, le taux d’Hb est 15.5% plus élevé dans le groupe EPO que dans le groupe contrôle ; la diminution du sang transfusé est de presque 60% (RR 0.43) [45].
- EPO 500 UI/kg iv et fer 200 mg iv la veille de l’intervention (chirurgie cardiaque valvulaire) ; bien que les malades soient encore anémiques au moment de l’intervention, le taux de transfusion sur 4 jours postopératoires passe de 86% (groupe contrôle) à 59% (groupe EPO) et le nombre d’unités transfusées de 3.7 à 1.6 [48].
- EPO 3'000 UI sous-cut et fer 200 mg iv administrés le jour opératoire (arthroplastie du genou) et répétés pendant 2 jours si l’Hb est < 70 g/L ; cette modeste dose d’EPO suffit à diminuer le taux de transfusion de 53.7% à 20.4% et le nombre d’unités transfusées par patient de 0.8 à 0.2 [41].
La prise en charge d’une anémie préopératoire est schématisée dans l’algorithme de la Figure 28.14 qui résume les recommandations du Network for Advancement of Transfusion Alternatives (NATA) [23].
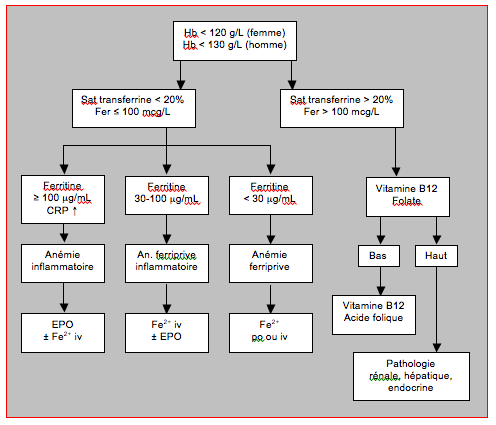
Figure 28.14 : Algorithme résumant la prise en charge d’un anémie découverte dans le préopératoire [23,39]. L’EPO est associée à des accidents cardiovasculaires thrombotiques chez les patients en insuffisance rénale.

Figure 28.14 : Algorithme résumant la prise en charge d’un anémie découverte dans le préopératoire [23,39]. L’EPO est associée à des accidents cardiovasculaires thrombotiques chez les patients en insuffisance rénale.
En sus de ces traitements symptomatiques, il est important de corriger les éventuelles perturbations de la coagulation: hypoprothrombinémie (cirrhose hépatique), coagulopathie congénitale, etc.
| Epargne sanguine : phase préopératoire |
|
Consultation préopératoire suffisamment en avance de l'opération (4-6 semaines préop)
Arrêt des antiplaquettaires et/ou anticoagulants (selon possibilités)
Correction des coagulopathies
Correction de l’anémie, qui est une affection grave dans le cadre chirurgical car elle augmente de 2 à 3 fois le risque de morbi-mortalité:
- Fer (per os ou iv) si carence nutritionnelle (la plus fréquente)
- Acide folique, vitamine B12
- Erythropoïétine si le fer seul est inefficace (utile même 2 jours avant l’intervention)
La masse sanguine du malade doit être reconstituée avant l'opération: Hb ≥ 120 g/L (femme), Hb ≥ 130 g/L (homme), car l'anémie est affection médicale grave et corrigible.
|
© CHASSOT PG, MARCUCCI C, SPAHN DR. Juin 2011; dernière mise à jour, Novembre 2018
Références
- AKOWUAH E, SHRIVASTAVA V, JAMNADAS B, et al. Comparison of two strategies for the management of antiplatelet therapy during urgent surgery. Ann Thorac Surg 2005; 80:149-52
- ALGHAMDI AA, ALBANNA MJ, GURU V, et al. Does the use of erythropoietin reduce the risk of exposure to allogeneic blood transfusion in cardiac surgery ? A systematic review and meta-analysis. J Cardiac Surg 2006; 21:320-6
- ALSALEH K, ALOTAIBI GS, ALMODAIMEGH HS, et al. The use of preoperative erythropoiesis-stimulating agents (ESAs) in patients who underwent knee or hip arthroplasty: a meat-analysis of randomised clinical trials. J Arthroplasty 2013; 28:1463-72
- AVNI T, BIEBER A, GROSSMAN A, et al. The safety of intravenous iron preparations: systematic review and meta-analysis. Mayo Clin Proc 2015; 90:12-23
- BARON DM, HOCHRIESER H, POSCH M, et al. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. Br J Anaesth 2014; 113:416-23
- BERIS P. The use of iron to increase red cell mass. Can J Anaesth 2003; 50:S3-9
- BEYER-WESTENDORF J, GELBRICHT V, FORSTER K, et al. Peri-interventional management of novel oral anticoagulants in daily care : results from prospective Dresden NOAC registry. Eur Heart J 2014 ; 35:1888-96
- CARREL T, ENGLBERGER L. Coronary bypass surgery in patients treated with clopidogrel. Is it safe? Curr Opin Cardiol 2009; 24:539-43
- CHASSOT PG, MARCUCCI C, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy. Am Fam Physician 2010; 82:1484-9
- DESAI N, SCHOFIELD N, RICHARDS T. Perioperative patient blood management to improve outcomes. Anesth Analg 2018; 127:1211-20
- DOUKETIS JD. Perioperative management of patients who are receiving warfarin therapy: an evidence-based and practical approach. Blood 2011; 117:5044-9
- DOUKETIS JD, HEALEY JS, BRUECKMANN M, et al. Perioperative bridging anticoagulation during dabigatran or warfarin interruption among patients who had an elective surgery ot procedure. Thromb Haemost 2015 ; 113:625-32
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy :Antit-hrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ;141(2 suppl) : e326S-50S
- DUNNING J, VERSTEEGH M, FABBRI A, et al. Guidelines on antiplatelet and anticoagulation management in cardiac surgery. Eur J Cardiothorac Surg 2008; 34:73-92
- ENGELBRECHT S, WOOD EM, COLE-SINCLAIR MF. Clinical transfusion practice update: haemovigilance, complications, patient blood management and national standards. Med J Aust 2013; 199:397-401
- ETCHASON J, PETZ L, KEELER E, et al. The cost effectiveness of preoperative autologous blood donation. N Engl J Med 1995; 332:719-24
- FERGUSSON DA, HUTTON B, MANIATIS A, et al. Use of recumbinant human erythropoietin in orthopaedic surgery: a systematic review. 2012; 00:00-00.
- FERRARIS VA, BROWN JR, DESPOTIS GJ, et al. 2011 update to the Society of Thoracic Surgeons and the Society of Cardiovascular Anesthesiologists blood conservation clinical practice guidelines. Ann Thorac Surg 2011; 91:944-82
- FINTEL DJ. Oral antiplatelet therapy for atherothrombotic disease: overview of current and emerging treatment options. Vasc Health Risk Manag 2012; 8:77-89
- GOGARTEN W, VANDERMEULEN E, VAN AKEN H, et al. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999-1015
- GOODNOUGH LT. Iron deficiency syndromes and iron.-restricted erythropoiesis. Transfusion 2012; 52:1584-92
- GOODNOUGH LT. The use of erythropoietin to increase red cell mass. Can J Anaesth 2003; 50:S10-8
- GOODNOUGH LT, MANIATIS A, EARNSHAW P, et al. Detection, evaluation, and management of preoperative anaemia in the elective orthopaedic surgical patient: NATA guidelines. Br J Anaesth 2011; 105:13-22
- HARROP-GRIFFITHS W, COOK T, GILL H, et al. Regional anaesthesia and patients with abnormalities of coagulation. The Association of Anaesthetists of Great Britain & Ireland, the Obstetric Anaesthetists' Association. Anaesthesia 2013; 68:966-72
- HAWN MT, GRAHAM LA; RICHMAN JS, et al. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013; 310:1462-72
- KAPETANAKIS EI, MEDLAM DA, BOYCE SW, et al. Clopidogrel administration prior to coronary artery bypass grafting surgery: the cardiologist's panacea or the surgeon's headache? Eur Heart J 2005; 26: 576-83
- KARKOUTI K, WIJEYSUNDERA DN, BEATTIE S, et al. Risk associated with preoperative anaemia in cardiac surgery. A multicenter cohort study. Circulation 2008; 117:478-84
- KLEIN AA, COLLIER TJ, BRAR MS, et al. The incidence and importance of anaemia in patients undergoing cardiac surgery in the UK: the first Association of Cardiothoracic Anaesthetists national audit. Anaesthesia 2016; 71:627-35
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105: 743-9
- KOSMADAKIS N, MESSARIS E, MARIS A, et al. Perioperative erythropoietin administration in patients with gastrointestinal tract cancer: Prospective randomized double-blind study. Ann Surg 2003; 237:417-21
- KOZEK-LANGENECKER SA, AHMED AB, AFSHARI A, ALBALADEJO P, et al. Management of severe perioperative bleeding : Guidelines from the European Society of Anaesthesiology. First update 2016. Eur J Anaesthesiol 2017; 34: 332-95
- KULIER A, LEVIN J, MOSER R, et al. Impact of preoperative anemia on outcome in patients undergoing coronary artery bypass surgery. Circulation 2007; 116:471-9
- LEAL-NOVAL SR, MUÑOZ-GOMEZ M, JUMENEZ-SANCHEZ M, et al. Red blood cell transfusion in non-bleeding critically ill patients with moderate anemia: is there a benefit ? Intensive Care Med 2013; 39:45-53
- LIM J, MILES L, LITTON E. Intravenous iron therapy in patients undergoing cardiovascular surgery: a narrative review. J Cardiothorac Vasc Anesth 2018; 32:1439-51
- LIN DM, LIN ES, TRAN MH. Efficacy and sefety of erythroproietin and intravenous iron in perioperative blood management: A systematic review. Transfus Med Rev 2013; 27:221-34
- LITTON E, XIAO J, HO KM. Safety and efficacy of intravenous iron therapy in reducing requirements for allogeneic blood transfusion: systematic review and meta-analysis of randomised clinical rials. BMJ 2013; 347:f4822
- MONK TG, GOODNOUGH LT, BRECHER ME, et al. A prospective, randomized trial of three blood conservation strategies for radical prostatectomy. Anesthesiology 1999; 91:24-33
- MUÑOZ M, GOMEZ-RAMIREZ S, CUENCA J, et al. Very short-term perioperative intravenous iron administration and postoperative outcome in major orthopedic surgery: a pooled analysis of observational data from 2547 patients. Transfusion 2014; 54:289-99
- MUÑOZ M, GOMEZ-RAMIREZ S, KOZEK-LANGENEKER S, et al. “Fit-to-fly”: overcoming barriers to preoperative haemoglobin optimization in surgical patients. Br J Anaesth 2015; 115:15-24
- MUSALLAM KM, TAMIM HM, RICHARDS T, et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. Lancet 2011; 378:1396-407
- NA HS, SHIN SY, HWANG JY, et al. Effects of intravenous iron combined with low-dose recombinant human reythropoietin on transfusion requirements in iron-deficient patients undergoing bilateral total knee replacement arthroplasty. Transfusion 2011; 51:118-24
- PHILLIPS LE, McLINTOCK C, POLLOCK W, et al. Recombinant activated factor VII in obstetric hemorrhage: expériences from the Australian and New Zealand Haemostasis Registry. Anesth Analg 2009; 109:1908-15
- RINEAU E, STOYANOV A, SAMSON E, et al. Patient blood management in major orthopedic surgery: less erythopoietin and more iron ? Anesth Analg 2017; 125:1597-9
- TRAN DHD, WONG GTC, CHEE YE, IRWIN MG. Effectiveness and safety of erythropoiesis-stimulating agent use in the perioperative period. Expert Opin Biol Ther 2014; 14:51-61
- WELTERT L, D’ALESSANDRO S, NARDELLA S, et al. Preoperative very short-term, high-dose erythropoietin administration diminishes blood transfusion rate in off-pump coronary artery bypass: a randomized blind controlled study. J Thorac Cardiovasc Surg 2010; 139:621-7
- WHITLOCK EL, KIM H, AUERBACH AD. Harms associated with single unit perioperative transfusion: retrospective population-based analysis. BMJ 2015; 350: h3037
- YENDE S, WUNDERINK RG. Effect of clopidogrel on bleeding after coronary artery bypass surgery. Crit Care Med 2001; 29:2271-5
- YOO YC, SHIM JK, KIM JC, et al. Effect of single recombinant human erythropoietin injection on transfusion requirements in preoperative anemic patients undergoing valvular heart surgery. Anesthesiology 2011; 115:929-37
- ZACHAROWSKI K, SPAHN DR. Patient blood management equals patient safety. Best Pract Res Clin Anaesthesiol 2016; 30:159-69

