Définition automatique des contours
Une amplification électronique du contraste entre le myocarde et le sang permet d’affiner la définition de l’endocarde, qu’un système informatique permet ensuite de suivre en continu par quantification acoustique (Automatic Border Detection). L’évolution de la surface du VG peut ainsi être enregistrée en permanence (Vidéo et Figure 25.38A).
Vidéo: exemple de définition automatique des contours. Dans la zone d'intérêt définie par le cercle blanc, le processeur suit l'interface sang-tissu en continu (court-axe du VG); la courbe en bas de l'écran est l'évolution dans le temps de la fraction de raccourcissement de surface (en l'occurence 46-47%).
Couplé à un enregistrement artériel, ce système peut être utilisé pour la construction de boucles pression-volume ventriculaires (voir Figure 25.180). La définition automatique des contours peut être complétée par l’attribution d’un jeu de couleurs au déplacement systolique de l’endocarde (Color Kinesis™) ; en fonction de l’ECG, la systole est divisée en dix portions auxquelles correspondent des couleurs différentes (Vidéo et Figure 25.38B).
Vidéo: technologie de ColorKinesis; le déplacement concentrique au cours de la systole est coloré selon une échelle allant de l'orange au bleu et indiquant la position de l'endocarde au cours de la systole.
On peut ainsi plus facilement repérer les variations de la cinétique segmentaire en cas d’ischémie [5]. Ces systèmes sont extrêmement sensibles au réglage du gain et sont assez instables en salle d’opération.
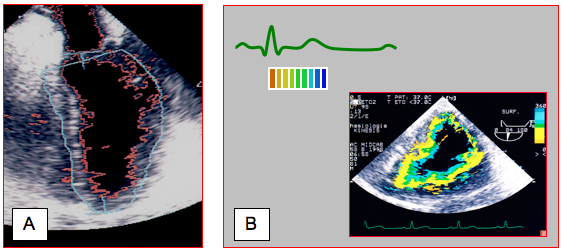
Figure 25.38 : Technologies particulières. A : définition automatique des contours. L’endocarde est représenté en permanence par le trait rouge à l’intérieur de la région d’intérêt (trait bleu). Le processeur calcule en continu la surface délimitée par l’endocarde. B : Color Kinesis™. Une colorisation de la limite sang - tissu synchronisée avec l’ECG met en évidence le degré de déplacement de l’endocarde au cours de la systole.
Harmonique et écho de contraste
Les ultrasons (US) sont sujets à une atténuation et à une distorsion au fur et à mesure qu’ils avancent dans les tissus ; leurs échos sont progressivement contaminés par de nouvelles ondes coaxiales au rayon principal dont la fréquence est un multiple de la fréquence d’émission originale. Ce sont des harmoniques. La deuxième harmonique (H2, 4-8 MHz) a une fréquence qui est le double de la fréquence d’émission (f0, 2-4 MHz). En filtrant f0 à la réception, le processeur peut reconstruire des images sur la base de H2 seulement. L’avantage est une image plus précise, plus contrastée et moins sujette aux artéfacts. En effet, la plupart de ces derniers sont générés dans les régions proches du transducteur, alors que l’importance des harmoniques est directement proportionnelle à la profondeur. Ce système est surtout utilisé sur les sondes transthoraciques, où il élimine les effets de la cage thoracique, mais il n’apporte que peu d’amélioration par voie transoesophagienne (Figure 25.39).
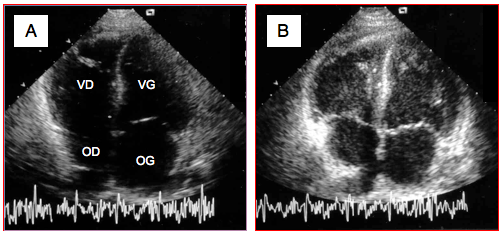
Figure 25.39 : Amélioration de l'image transthoracique (vue apicale 4-cavités) par la technique de la 2ème harmonique. A: image standard. B: image avec harmonique; la qualité de l'image et la précision des structures sont nettement supérieures.
La deuxième harmonique est surtout nécessaire à l’échocardiographie de contraste, qui est basée sur la diffraction des ultrasons (US) par des microbulles. Lorsqu’elles sont heurtées par des US, qui sont des ondes vibratoires de pression, les microbulles sont alternativement comprimées et ré-expendues. Pour des microbulles de 3-7 μm, la fréquence de résonance est d'environ 3 MHz, soit celle des sondes transthoraciques. Si la puissance d’émission des US est basse (index mécanique < 0.2), les microbulles vibrent de manière linéaire, mais lorsque la puissance augmente, leur expansion devient plus importante que leur compression. Elles vibrent alors de manière non-linéaire et émettent des harmoniques (Figure 25.40A). A très haute énergie (index mécanique > 0.5), elles éclatent en donnant un jaillissement d'harmoniques de courte durée mais suffisamment fort pour permettre une image hautement contrastée. En filtrant la fréquence de base à la réception, on obtient une image due aux seules harmoniques. Lorsque celles-ci sont produites par des microbulles, on dispose alors d'un système qui fonctionne comme un produit de contraste [2].
Les produits de contraste utilisés actuellement sont des gaz inertes de haut poids moléculaire comme le perfluoropropane (Optison®), l'octafluoropropane (Definity®, Luninity®) ou l’hexafluoride de soufre (Lumason®, SonoVue®) encapsulés dans un phospholipide ou dans l'albumine humaine; leurs microbulles mesurent de 1.5 à 8 microns, se comportent comme les globules rouges et traversent les capillaires. Elles sont produites par sonication, processus qui crée des microbulles par cavitation dans un solvant [1]. Leur demi-vie dans la circulation est de plusieurs minutes. Les produits de contraste sont administrés par voie intraveineuse en bolus pour améliorer la délimitation des cavités ou en perfusion continue pour évaluer la perfusion myocardique et mettre en évidence les zones non vascularisées. On proscrit les robinets, les angulations et les voies veineuses de faible calibre pour éviter la disruption des microbulles. On enregistre des boucles de 10 à 20 cycles cardiaques pendant lesquelles sont produites plusieurs impulsions à haute énergie pour faire éclater les microbulles; en-dehors de ces brefs instants, la puissance réduite de l'émission des ultrasons permet de visualiser la reperfusion myocardique par le produit de contraste. Le retour de l'image est ralenti est cas d'hypoperfusion et des lacunes apparaissent dans les zones mal vascularisées. Les images digitalisées sont ensuite analysées par densitométrie pour déterminer la quantité de contraste présente dans les tissus (Figure 25.40B) [2,6,9].
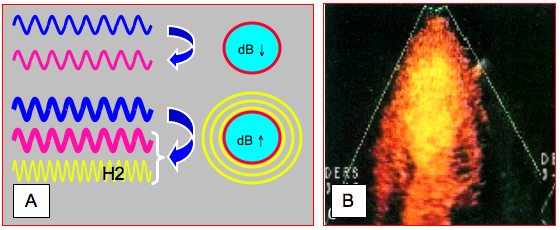
Figure 25.40 : Echocardiographie de contraste. A : à basse puissance (dB ↓), la microbulle heurtée par des US (onde bleue) vibre de manière linéaire et renvoie un écho simple (onde violette). Lorsque la puissance augmente (dB ↑), la microbulle vibre de façon non-linéaire et émet des harmoniques (H2) en plus de l’écho standard. B : image de la perfusion myocardique à l’écho de contraste. La cavité du VG est remplie de contraste (jaune clair) ; la paroi est perfusée (orange), mais présente une zone sans flux (noire) [7].
L'échocardiographie de contraste offre plusieurs applications cliniques [6,9].
Une amplification électronique du contraste entre le myocarde et le sang permet d’affiner la définition de l’endocarde, qu’un système informatique permet ensuite de suivre en continu par quantification acoustique (Automatic Border Detection). L’évolution de la surface du VG peut ainsi être enregistrée en permanence (Vidéo et Figure 25.38A).
Vidéo: exemple de définition automatique des contours. Dans la zone d'intérêt définie par le cercle blanc, le processeur suit l'interface sang-tissu en continu (court-axe du VG); la courbe en bas de l'écran est l'évolution dans le temps de la fraction de raccourcissement de surface (en l'occurence 46-47%).
Couplé à un enregistrement artériel, ce système peut être utilisé pour la construction de boucles pression-volume ventriculaires (voir Figure 25.180). La définition automatique des contours peut être complétée par l’attribution d’un jeu de couleurs au déplacement systolique de l’endocarde (Color Kinesis™) ; en fonction de l’ECG, la systole est divisée en dix portions auxquelles correspondent des couleurs différentes (Vidéo et Figure 25.38B).
Vidéo: technologie de ColorKinesis; le déplacement concentrique au cours de la systole est coloré selon une échelle allant de l'orange au bleu et indiquant la position de l'endocarde au cours de la systole.
On peut ainsi plus facilement repérer les variations de la cinétique segmentaire en cas d’ischémie [5]. Ces systèmes sont extrêmement sensibles au réglage du gain et sont assez instables en salle d’opération.

Figure 25.38 : Technologies particulières. A : définition automatique des contours. L’endocarde est représenté en permanence par le trait rouge à l’intérieur de la région d’intérêt (trait bleu). Le processeur calcule en continu la surface délimitée par l’endocarde. B : Color Kinesis™. Une colorisation de la limite sang - tissu synchronisée avec l’ECG met en évidence le degré de déplacement de l’endocarde au cours de la systole.
Harmonique et écho de contraste
Les ultrasons (US) sont sujets à une atténuation et à une distorsion au fur et à mesure qu’ils avancent dans les tissus ; leurs échos sont progressivement contaminés par de nouvelles ondes coaxiales au rayon principal dont la fréquence est un multiple de la fréquence d’émission originale. Ce sont des harmoniques. La deuxième harmonique (H2, 4-8 MHz) a une fréquence qui est le double de la fréquence d’émission (f0, 2-4 MHz). En filtrant f0 à la réception, le processeur peut reconstruire des images sur la base de H2 seulement. L’avantage est une image plus précise, plus contrastée et moins sujette aux artéfacts. En effet, la plupart de ces derniers sont générés dans les régions proches du transducteur, alors que l’importance des harmoniques est directement proportionnelle à la profondeur. Ce système est surtout utilisé sur les sondes transthoraciques, où il élimine les effets de la cage thoracique, mais il n’apporte que peu d’amélioration par voie transoesophagienne (Figure 25.39).

Figure 25.39 : Amélioration de l'image transthoracique (vue apicale 4-cavités) par la technique de la 2ème harmonique. A: image standard. B: image avec harmonique; la qualité de l'image et la précision des structures sont nettement supérieures.
La deuxième harmonique est surtout nécessaire à l’échocardiographie de contraste, qui est basée sur la diffraction des ultrasons (US) par des microbulles. Lorsqu’elles sont heurtées par des US, qui sont des ondes vibratoires de pression, les microbulles sont alternativement comprimées et ré-expendues. Pour des microbulles de 3-7 μm, la fréquence de résonance est d'environ 3 MHz, soit celle des sondes transthoraciques. Si la puissance d’émission des US est basse (index mécanique < 0.2), les microbulles vibrent de manière linéaire, mais lorsque la puissance augmente, leur expansion devient plus importante que leur compression. Elles vibrent alors de manière non-linéaire et émettent des harmoniques (Figure 25.40A). A très haute énergie (index mécanique > 0.5), elles éclatent en donnant un jaillissement d'harmoniques de courte durée mais suffisamment fort pour permettre une image hautement contrastée. En filtrant la fréquence de base à la réception, on obtient une image due aux seules harmoniques. Lorsque celles-ci sont produites par des microbulles, on dispose alors d'un système qui fonctionne comme un produit de contraste [2].
Les produits de contraste utilisés actuellement sont des gaz inertes de haut poids moléculaire comme le perfluoropropane (Optison®), l'octafluoropropane (Definity®, Luninity®) ou l’hexafluoride de soufre (Lumason®, SonoVue®) encapsulés dans un phospholipide ou dans l'albumine humaine; leurs microbulles mesurent de 1.5 à 8 microns, se comportent comme les globules rouges et traversent les capillaires. Elles sont produites par sonication, processus qui crée des microbulles par cavitation dans un solvant [1]. Leur demi-vie dans la circulation est de plusieurs minutes. Les produits de contraste sont administrés par voie intraveineuse en bolus pour améliorer la délimitation des cavités ou en perfusion continue pour évaluer la perfusion myocardique et mettre en évidence les zones non vascularisées. On proscrit les robinets, les angulations et les voies veineuses de faible calibre pour éviter la disruption des microbulles. On enregistre des boucles de 10 à 20 cycles cardiaques pendant lesquelles sont produites plusieurs impulsions à haute énergie pour faire éclater les microbulles; en-dehors de ces brefs instants, la puissance réduite de l'émission des ultrasons permet de visualiser la reperfusion myocardique par le produit de contraste. Le retour de l'image est ralenti est cas d'hypoperfusion et des lacunes apparaissent dans les zones mal vascularisées. Les images digitalisées sont ensuite analysées par densitométrie pour déterminer la quantité de contraste présente dans les tissus (Figure 25.40B) [2,6,9].

Figure 25.40 : Echocardiographie de contraste. A : à basse puissance (dB ↓), la microbulle heurtée par des US (onde bleue) vibre de manière linéaire et renvoie un écho simple (onde violette). Lorsque la puissance augmente (dB ↑), la microbulle vibre de façon non-linéaire et émet des harmoniques (H2) en plus de l’écho standard. B : image de la perfusion myocardique à l’écho de contraste. La cavité du VG est remplie de contraste (jaune clair) ; la paroi est perfusée (orange), mais présente une zone sans flux (noire) [7].
L'échocardiographie de contraste offre plusieurs applications cliniques [6,9].
- Optimalisation du contour des cavités ventriculaires pour la mesure du volume, de la fraction d'éjection ou des altérations de la cinétique segmentaire [4].
- Délimitation de l'endocarde dans le diagnostic de thrombus apical, de non-compaction, d'anévrysme ou de Takotsubo.
- Mise en évidence de masses intacardiaques; les thrombi et les fibroélastome sont avasculaires, les tumeurs malignes sont hypervascularisées alors que les myxomes sont moins vascularisés que le myocarde. La technique est très utile pour la détection de défauts de remplissage en présence de contraste spontané dans l'AAG (thrombus).
- Mise en évidence de défaut de perfusion fixe (infarctus) ou transitoire sous stress (ischémie active); la sensibilité et la spécificité sont de l'ordre de 80% [8].
- Différentiation de la membrane, de la vraie et de la fausse lumière dans la dissection aortique; diagnostic différentiel avec des artéfacts.
- En salle d’opération, la technique pourrait permettre l’évaluation de la cardioplégie ou de la revascularisation après pontage aorto-coronarien, mais la voie transoesophagienne est limitée aux vues transgastriques car l'interposition de l'OG remplie de microbulles dans toutes les vues oesophagiennes obcurcit complètement l'image des ventricules [3]. D'autre part, les programmes informatiques qui gèrent l'émission des ultrasons de haute et basse intensité ne sont pas tous compatibles avec les sondes ETO.
Les contre-indications sont les shunts D-G importants, l'hypersensibilité aux produits de contraste, la grossesse et l'insuffisance hépatique [1]. En cas d'ECMO, les microbulles sont détectées par les systèmes de surveillance et peuvent provoquer un arrêt circulatoire du système [9]. La dose de produit pour un examen coûte environ $ 140.
| Technologies particulières |
| La définition automatique des contours permet de suivre automatiquement les mouvements de l'endocarde (FE en continu, par exemple). La colorisation de ces mouvements améliore la lecture des altérations de la cinétique segmentaire (ischémie). La lecture des harmoniques générées par la progression des ultrasons dans les tissus (multiples de la fréquence de base émise par le transducteur) permet d'améliorer l'image et de réduire les artéfacts. Elle permet également l'utilisation de produit de contraste (microbulles encapsulées) qui améliorent la définition des contours endocavitaires et peuvent réaliser une imagerie de la perfusion myocardique. |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
Références
- AHMED A, GALIUTO L, MONOGHAN M, SENIOR R. Contrast echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017,70-78
- BULTE CSE, SLIKKERVEER J, MEIJER RI, et al. Contrast-enhanced ultrasound for myocardial perfusion imaging. Anesth Analg 2012; 114:938-45
- MARCUCCI C, JUNGWIRTH B, BURKHARD MACKENSEN G, MAHAJAN A. Emerging applications of perioperative echocardiography. In: MATHEW JP, SWAMINATHAN M, AYOUB CM. Clinical manual and review of transesophageal echocardiography, 2nd edition. New York: McGraw-Hill 2010,506-39
- MARCUCCI C, LAUER R, MAHAJAN A. New echocardiographic techniques for evaluating left ventricular myocardial function. Semin Cardiothorac Vasc Anesth 2008; 12:228-47
- PODGOREANU MV, DJAIANI GN, DAVIS F, et al. Quantitative echocardiographic assessment of regional wall motion and left ventricular asynchrony with color kinesis in cardiac surgery patients. Anesth Analg 2003; 96:1294-300
- PORTER RT, MULVAGH SL, ABDELMONEIM SS, et al. Clinical applications of ultrasonic enhancing agents in echocardiography: 2018 American Society of Echocardiography Guidelines Update. J Am Soc Echocardiogr 2018; 31:241-74
- PORTER RT, NOLL D, XIE F. Myocardial contrast echocardiography. In: OTTO CM. The practice of clinical echocardiography, 2nd edition. Philadelphia: WB Saunders Co, 2002, 159-82
- SENIOR R, BECHER H, MONOGHAN N, et al. Contrast echocardiography: evidence-based recommendations by the European Association of Echocardiography. Eur J Echocardiogr 2009; 10:194-212
- SHEU R, PETERSON C; HALL M, et al. Ultrasonic enhancing agents fort the cardiothoracic anesthesiologist: a focused review of the 2018 American Society of Echocardiography Guidelines Update. J Cardiothorac Vasc Anesth 2019; 33:755-67
