Le pontage aorto-coronarien (PAC), imaginé en premier par Kolesov à Leningrad en 1964 [32], est l'opération cardiaque la plus fréquemment réalisée, bien qu'elle ait décliné de 30% à partir des années 2000 à cause du développement de la revascularisation percutanée. Toutefois, cette chute a cessé ces dernières années face à l'évidence de sa supériorité dans les coronaropathies complexes. Les PAC sont réalisés en moyenne chez 44 patients pour 100'000 habitants (en Suisse: 49:100'000) [44]. Ils peuvent se pratiquer de plusieurs manières : sous CEC par sternotomie (technique la plus courante), sans CEC à coeur battant (OPCAB, Off-Pump coronary artery bypass), de façon minimalement invasive (minithoracotomie, système robotique, système HeartPort™), ou en procédure hybride. Le but de l'intervention est une revascularisation complète (tous les vaisseaux épicardiques de ≥ 1.5 mm sténosés à > 50%), ou au moins de toutes les lésions présentant une faible réserve de flux (FFR < 0.8) [59].
Conduits pour pontages
Les pontages aorto-coronariens sont réalisés au moyen de conduits autologues. Plusieurs possibilités techniques se présentent (Figure 9.38) [22,25].
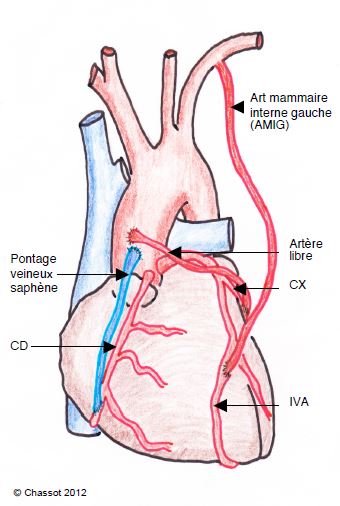
Figure 9.38 : Pontages aorto-coronariens. Trois types de pontages aorto-coronariens sont représentés ici : 1) un pontage veineux (veine saphène interne) entre l’aorte ascendante et la coronaire droite (CD), 2) un pontage artériel libre (artère radiale) entre l’aorte ascendante et la circonflexe (CX) ; et 3) un pontage avec l’artère mammaire interne gauche (AMIG) anastomosée à l’interventriculaire antérieure (IVA). Contrairement aux veines, les artères sont prélevées avec le pédicule vasculaire qui les entoure pour ménager leur vascularisation.
- Pontage veineux: on prélève une longueur variable de la veine saphène interne sur une ou sur les deux jambes, par voie directe ou endoscopique; la délicatesse du prélèvement et des manipulations conditionne la perméabilité ultérieure du greffon. Le pontage relie la face antérieure de l’aorte ascendante à la coronaire distalement à son obstruction. Rapides et faciles à réaliser, les pontages veineux ont cependant le plus haut taux d'obstruction secondaire (voir ci-dessous).
- Artère mammaire interne: une longueur maximale d’artère mammaire interne est libérée à la face interne de la paroi thoracique antérieure ; l’artère mammaire interne (AMI) gauche est anastomosée à l’IVA ; l’AMI droite est anastomosée sur la coronaire droite (voie directe) ou sur la circonflexe (voie rétro-aortique par le sinus transverse) lorsque leurs sténoses sont critiques [29,30]. La prise des deux mammaires fait courir un danger de dévascularisation du sternum et augmente le risque d'infection sternale et de retard de consolidation (1.9% au lieu de 0.6%); on l'évite chez les malades de > 70 ans, les obèses, les diabétiques, les patients souffrant de BPCO et ceux placés sous traitement de stéroïde ou d'immunosuppresseur [56]. Certaines mesures sont recommandées pour réduire les risques de complications sternales: dévascularisation réduite lors de la prise de mammaire, cessation de la fumée, contrôle rigoureux de la glycémie et stabilisation renforcée du sternum [3].
- Artère radiale: on prélève une longueur maximale de l'artère, qui est utilisée comme pontage libre entre l’aorte et la coronaire. On choisit en général le côté non-dominant. Le contrôle de la perméabilité de l'arcade palmaire nourrie par la seule cubitale est essentiel: test d'Allen avec évaluation par ultrasons (Doppler) ou pulsoxymétrie. La radiale utilisée pour le cathétérisme de la coronarographie donne des résultats nettement inférieurs à ceux d'une artère vierge [43]. L'anesthésiste doit éviter tout cathéter sur le bras concerné et préférer un monitorage artériel par une artère fémorale.
- Artère gastro-épiploïque: un prolongement de l'incision sternale à la région épigastrique permet de disséquer l'artère gastro-épiploïde droite par une mini-laparotomie haute et de l'amener dans le péricarde par une petite incision diaphragmatique. Elle est utlilisée pour la revascularisation des territoires postéro-inférieurs (CD distale, interventriculaire postérieure, circonflexe distale) [55].
- D'autres artères sont plus rarement utilisées, telles la cubitale ou l'épigastrique.
- Pontage tout-artériel (total arterial Y-graft): des éléments d’artères libres sont branchés en "Y" entre une artère mammaire et une coronaire ; chaque AMI peut ainsi être anastomosée à une coronaire et à un greffon artériel implanté sur un autre site coronarien (Y-graft) (Figure 9.39). Pratiquée à coeur battant sur les deux mammaires, cette technique évite de manipuler et de clamper l’aorte ascendante, ce qui réduit le risque d’embolie liée à l’athéromatose aortique et diminue considérablement le taux d'AVC (-78%), au point de le ramener à celui de la PCI (0.4-0.6%) [17,26,41,67]. L'échographie épiaortique peropératoire permet d'identifier aisément les athéromes et les infiltrations pariétales dangereuses (aorte porcelaine) et ainsi d'objectiver les dangers du clampage aortique [50].
- Pontage séquentiel: on peut réaliser plusieurs anastomoses successives avec le même greffon artériel ou veineux ; le risque est une extension du territoire ischémié en cas de thrombose proximale de ce greffon vascularisant plusieurs vaisseaux coronariens.
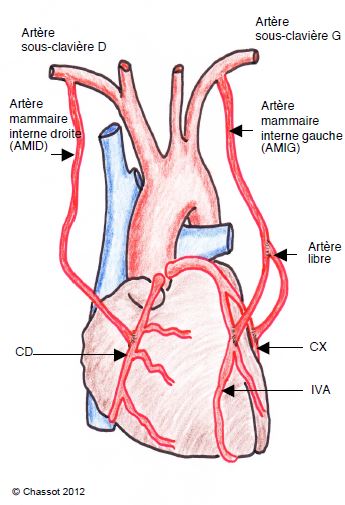
Figure 9.39 : Pontages aorto-coronariens tout-artériels. Pour éviter toute manipulation de l’aorte (clampage pour la CEC, clampage latéral pour les anastomoses sur sa face antérieure), on peut réaliser des pontages mammaires bilatéraux à cœur battant : anastomose de l’AMIG sur l’IVA et de l’AMID sur la coronaire droite (CD) ou sur la circonflexe (CX) par voie rétro-aortique. Des pontages supplémentaires sont réalisés par un greffon artériel libre anastomosé entre une mammaire et la coronaire concernée (pontage en Y), en l’occurrence entre l’AMIG et la CX. En CEC ou à cœur battant, la technique tout-artérielle garantit une meilleure perméabilité des greffons à long terme que les pontages veineux.
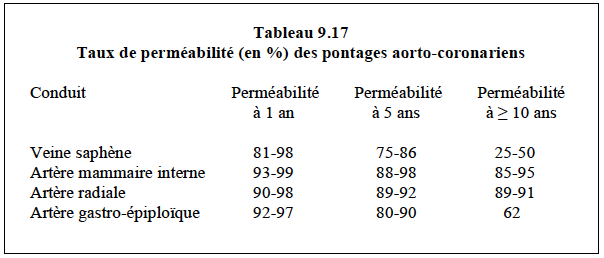
D'une manière générale, les occlusions précoces sont liées à des problèmes techniques, à des lésions endothéliales ou à une dysfonction de l'endothélium secondaire à l'activation inflammatoire de la chirurgie. A long terme, l'échec du greffon tient aux facteurs de risque cardiovasculaires habituels: fumée, diabète, insuffisance rénale, calcifications étendues, progression de la maladie athéromateuse, coronaire déjà stentée, sexe féminin [22]. Le taux de perméabilité des pontages est très variable selon les vaisseaux utilisés (Tableau 9.17) [22,25].
- Pontages veineux: ils ont malheureusement un taux d'échec élevé: 20% d’occlusion à 1 an et 50% à 10 ans, ce qui est 4 fois plus important que celui des pontages artériels [20]. La perte s'accélère particulièrement à partir de 5 ans [28]. Le prélèvement endoscopique et la préservation dans du NaCl (au lieu de solution tamponnée) sont des facteurs aggravants. La taille du vaisseau sur lequel est anastomosée la veine est importante: lorsqu'elle est < 2 mm, le taux de perméabilité tombe à 50% [22]. Sous pression artérielle, la veine subit une hyperplasie intimale puis une artériosclérose rapide dès 1 an. Bien que l'aspirine soit prescrite de routine après les PAC, l'addition d'un antiplaquettaire inhibiteur du récepteur P2Y12 pendant 12 mois semble améliorer la perméabilité des greffons veineux, mais au prix d'une augmentation du risque hémorragique [33]. Les statines (atorvastatine 40-80 mg, rosuvastatine 20-40 mg) sont essentielles car elles freinent le remodelage artériosclérotique des greffons veineux [9]. La plupart des occlusions secondaires sont asymptomatiques [38].
- Artères mammaires internes: l’AMI est la seule artère périphérique à paroi élastique de l’organisme; elle est pratiquement sans composante musculaire, et sa susceptibilité à l'athéromatose extrêmement réduite. Sa perméabilité à long terme (> 90% à 10 ans, > 80% à 20 ans) est la meilleure de tous les vaisseaux utilisés [66]. Le pontage de l'AMI sur l'IVA offre un gain considérable en terme de mortalité par rapport au greffon veineux; ce gain est encore augmenté par l'utilisation des deux mammaires [62]. Toutefois, ceci présente le risque de dévasculariser le sternum, de retarder sa cicatrisation et de doubler son taux d'infection (3.5% versus 1.9%), particulièrement chez les diabétiques [68].
- Artère radiale: facile à prélever sur une grande longueur, son taux de perméabilité est excellent (près de 90% à 10 ans, 75% à 20 ans), mais elle est sujette à des spasmes vasculaires parce qu'elle est une artère musculaire. Une perfusion d'anticalcique (diltiazem 0.1 mg/kg/heure) avec ou sans nitrés peut diminuer la constriction de manière aiguë en periopératoire, mais n'a pas d'avantage à long terme [3]. L'application locale de papavérine ou de phénoxybenzamine est efficace. Par contre, l'administration de Ca2+ en sortant de CEC favorise la vasoconstriction artérielle; elle devrait être évitée lorsque la radiale est utilisée. Le spasme est souvent lié au flux compétitif entre le greffon et l'artère native lorsque la sténose pontée est ≤ 80% [6]. L'artère radiale devrait être réservée à des sténoses serrées (> 90%) [30].
- Artère gastro-épiploïque: pratique pour la revascularisation des territoires inférieurs, elle impose un temps opératoire abdominal supplémentaire; peu sujette à l'artériosclérose, elle affiche une excellente perméabilité à 5 ans mais une perméabilité décevante à long terme (62% à 10 ans) [55].
Comme on le voit, les pontages artériels ont une bien meilleure perméabilité à long terme que les greffons veineux; ils offrent également au patient un avantage en terme de survie sans revascularisation secondaire (> 20% à 10 ans, HR 1.3) [24]. A l'exception du pontage AMIG-sur-IVA, ils restent néanmoins largement sous-utilisés dans la pratique courante (< 15% des cas en moyenne) [25,26]. Comme leur taux d'attrition est directement lié à la présence d'un flux compétitif avec une coronaire dont la lésion est hémodynamiquement peu significative, leurs sites d'implantation est plus adéquatement détermniné par la réserve fonctionnelle de flux (FFR, fractional flow reserve) que le simple aspect angiographique de la sténose [6,58]. Le pontage veineux devrait être restreint aux situations qui ne se prêtent pas aux greffons artériels, telles les sténoses modérées, les artères inutilisables, les urgences ou les opérations de sauvetage. Les recommandations actuelles vont dans le sens d'une utilisation différenciée des greffons selon la position de l'anastomose [3,28,29,47,63,64].
- IVA: artère mammaire interne gauche (AMIG);
- CD: veine saphène si sténose 70-90%, artère radiale si sténose > 90%;
- CX: seconde artère mammaire interne ou veine saphène si sténose 70-90%, artère radiale si sténose > 90%.
En général, on réalise en premier lieu les anastomoses distales des greffons libres, puis celle de l’AMI, et enfin les anastomoses proximales sur l'aorte ; ces dernières sont exécutées pendant la phase de réchauffement, voir après le déclampage de l’aorte (clampage latéral). Pour offrir un maximum de protection au myocarde ischémié, on peut perfuser de la cardioplégie par les pontages libres dès la réalisation de leur anastomose distale. Pour les greffons mammaires, la revascularisation a lieu dès que l’anastomose est complétée. L’état local de la coronaire nécessite parfois une thrombendarterectomie ; cette manoeuvre augmente le risque d’embolisation de matériel athéromateux et d’obstruction distale.
Il est fréquent que des bulles d'air se glissent dans les pontages et dans la coronaire droite, qui émergent à la face antérieure de l'aorte ascendante ; ce phénomène provoque une ischémie transmurale transitoire caractérisée par une surélévation du segment ST (voir Figure 9.22). Une ponction directe des pontages à l’aiguille, une augmentation de la pression artérielle (vasoconstricteur) et une stimulation inotrope résolvent en général le problème en < 10 minutes. Toute altération électrique persistante doit faire suspecter une obstruction : coudure ou torsion d'un pontage, défaut sur une anastomose, thrombose, embolisation de matériel athéromateux. Dans ce cas, une hypokinésie sévère ou une akinésie prolongée sont visibles à l'échocardiographie transoesophagienne (Vidéo). Il peut aussi s'agir d’un spasme coronarien ou d'une vasoconstriction de greffon artériel; le traitement est une perfusion de diltiazem (Dilzem® 0.1 mg/kg/heure). Le Ca2+ administré en sortant de pompe pour combattre l'hyperkaliémie résiduelle est un facteur aggravant majeur pour la survenue de spasmes artériels. Les greffons artériels libres sont sujets au spasme d'origine humorale, mais non à la vasoconstriction sympathique parce qu’ils sont dénervés.
Vidéo: Akinésie totale de la paroi latérale du VG (vue mi-oesophage 4-cavités 0°) après des pontages aorto-coronariens, due à une thrombose de l'anastome sur l'artère circonflexe.
Vidéo: Akinésie totale de la paroi latérale du VG (vue mi-oesophage 4-cavités 0°) après des pontages aorto-coronariens, due à une thrombose de l'anastome sur l'artère circonflexe.
Pontages à cœur battant
Le débat sur le rôle de la chirurgie à cœur battant (OPCAB, off-pump coronary artery bypass) dans l'occlusion secondaire des greffons n’est toujours pas clos. Il est certain que cette chirurgie demande davantage d'habileté technique de la part de l'opérateur, davantage de cohérence entre ce dernier et l'anesthésiste et davantage de coordination entre le bloc opératoire et les soins intensifs. Elle ne donne de bons résultats qu'entre des mains expérimentées, sinon le taux de revascularisation incomplète est important. Comme elles mélangent les résultats de plusieurs centres, les méta-analyses sont en général pessimistes; leur tendance est de trouver davantage d'occlusion vasculaire dans les OPCAB (OR 1.51) [12]. Néanmoins, les dernières études randomisées comparatives entre OPCAB et PAC en CEC issues de centres spécialisés ne mettent en évidence aucune différence dans la mortalité ni le taux d’infarctus, mais une diminution de l’hémorragie, des transfusions et des complications pulmonaires ou rénales avec l’OPCAB, ainsi qu'une baisse des AVC avec la technique tout-artérielle (no aortic touch); de plus, le taux de re-pontages secondaires pour obstruction ou revascularisation incomplète n'est que marginalement différent (voir Chapitre 10 Résultats chirurgicaux) [14,34,35]. Pourtant, à peine 20% de l'ensemble des pontages sont réalisés à cœur battant [7].
Perméabilité des pontages
Le contrôle du flux dans les pontages en fin d’intervention par un système analysant le temps de transit des ultrasons est un avantage incontestable pour s'assurer que le résultat immédiat est optimal (Figure 9.40). Le flux doit être pulsatile et biphasique, avec deux composantes antérogrades, l'une brève en protosystole (S), et l'autre longue en diastole (D). La vélocité du flux diastolique doit être > 15 cm sec-1, et le flux moyen > 20 ml min-1. En cas de sténose, le tracé du flux est très pointu et essentiellement systolique. La pulsatilité du flux est décrite par l'index de pulsatilité (IP), que l'on obtient en divisant la différence entre le flux maximal et le flux minimal par le flux moyen : IP = (Fmax – Fmin) / Fmoy. L'IP optimal est situé entre 1 et 5. Une basse vélocité, une prédominance du flux systolique et un IP > 5 commandent une révision immédiate de l'anastomose. Il est important que l'hémodynamique du patient soit normale au moment de la mesure. La précision de l'évaluation d'une anastomose peut être améliorée par l'utilisation simultanée de l'imagerie Doppler couleur du flux au moyen d'un capteur épicardique [15].
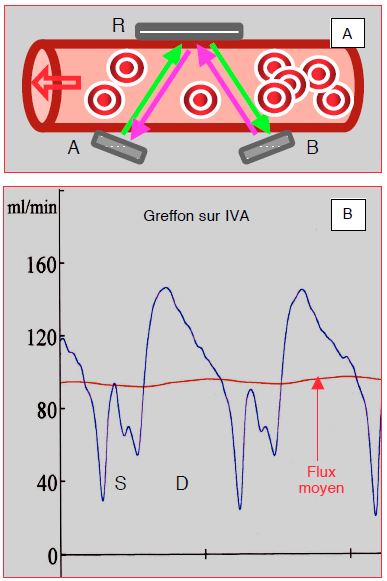
Figure 9.40 : Enregistrement du flux dans un greffon implanté sur l'IVA. A : capteur placé autour du pontage. Les ultrasons (US) sont émis par 2 cristaux (A et B) situés d’un côté du vaisseau et réfléchis par un réflecteur (R) situé de l’autre ; le temps de transit des US est plus long lorsqu’ils se propagent à contre-courant (flèche verte) que lorsqu’ils se propagent dans le sens du flux (flèche violette) ; la différence entre le temps mis de A à B et celui mis de B à A est proportionnelle au flux et permet de le calculer. B : enregistrement d’un flux normal. Le flux doit être pulsatile et biphasique, avec deux composantes antérogrades, l'une brève en protosystole (S), et l'autre longue en diastole (D). La vélocité du flux diastolique doit être > 15 cm sec-1, et le flux moyen > 20 ml min-1. En cas de sténose, le tracé du flux est très pointu et essentiellement systolique. La pulsatilité du flux est décrite par l'index de pulsatilité (IP), que l'on obtient en divisant la différence entre le flux maximal et le flux minimal par le flux moyen : IP = (Fmax – Fmin) / Fmoy. L'IP optimal est situé entre 1 et 5. Une basse vélocité, une prédominance du flux systolique et un IP > 5 commandent une révision immédiate de l'anastomose.
Comme déjà mentionné, les greffons veineux ont un taux de perméabilité de 90% à 1 an et de ≤ 50% à 10 ans [20]. Ce taux d'attrition est lié aux manipulations peropératoires de la veine saphène, à l'hyperplasie intimale, aux lésions athéromateuses et au remodelage pariétal sous l'effet de la haute pression de perfusion [61]. Les greffons artériels restent perméables beaucoup plus longtemps : > 90% à 10 ans [13,57]. Le pontage tout-artériel utilisant les deux mammaires (AMIG sur IVA et AMID sur CD ou CX), quoique techniquement plus exigeant, offre incontestablement de meilleurs résultats à long terme que le pontage veineux conventionnel [25,56,66]. Dans les cas urgents et instables, on ne greffe en général que des veines, afin de raccourcir le temps opératoire puisqu'il s'agit d'une opération de sauvetage. Il en est de même chez les patients très âgés qui n’ont aucune chance de bénéficier de la longue survie des greffons artériels.
L'administration d'aspirine dans les premières heures qui suivent les PAC réduit les risques d'infarctus, d'ictus, d'insuffisance rénale et d'ischémie digestive par un facteur de 50%; la mortalité est diminuée de 68% [39]. Il est recommandé de donner 75-325 mg/j d'aspirine à vie, à commencer 6 heures après l'intervention [33,53,54]. Une bi-thérapie avec du clopidogrel pendant 12 mois semble améliorer la perméabilité des greffons veineux, mais le degré d'évidence est trop faible pour en faire une routine [11]. Outre son indication générale comme prévention de la FA périopératoire, un béta-bloqueur est recommandé à long terme chez les patients qui ont eu un infarctus récent, chez ceux qui sont en insuffisance cardiaque et lors de revascularisation incomplète [33,53]. Tous les patients sont placés sous statine à dose élevée (atorvastatine 40-80 mg/j, rosuvastatine 20-40 mg/j) et doivent modifier leur style de vie en faveur d'une diète équilibrée, d'un arrêt de la fumée et d'un exercice physique adapté. On évite les anti-COX-2 pour l’antalgie postopératoire [29,33].
Indications aux PAC
Par rapport au traitement médical ou à la revascularisation percutanée (PCI et stent), les PAC sont essentiellement recommandés dans les situations suivantes, où ils donnent des résultats supérieurs aux autres modes de prise en charge (voir Comparaison des thérapeutiques) [18,29,42,60,64].
- Maladie tritronculaire (multivessel disease);
- Sténose sévère du tronc commun ou de l'IVA proximale avec maladie bitronculaire;
- Situations anatomiques impropres à la PCI ou score SYNTAX de haute complexité (> 32);
- Dysfonction ventriculaire gauche (cardiomyopathie ischémique);
- Diabète;
- Complications mécaniques de l'infarctus: CIV, rupture pariétale, rupture de pilier mitral.
Dans le cadre de la cardiomyopathie ischémique, la revascularisation chirurgicale est efficace surtout lorsque les tests préopératoires (écho dobutamine, PET-scan, angio-IRM) démontrent la présence d'une masse suffisante de myocarde viable susceptible de récupération. Si ce n'est pas le cas, un traitement médical optimal de l'insuffisance cardiaque et de l'ischémie est préférable [5,60]. Cependant, l'ischémie induit tout un spectre de lésions allant de l'hibernation au remodelage et à la cicatrice fibreuse; les tests n'offrent donc pas une réponse binaire simple à la question de la récupération fonctionnelle possible [5]. D'une manière générale, les PAC sont profitables aux coronariens en insuffisance gauche une fois passée la période périopératoire à risque; ils diminuent la mortalité à long terme, particulièrement dans la classe d'âge < 67 ans [46].
Différents scores ont été mis au point pour permettre une stratification du risque interventionnel: scores cliniques comme l'EuroSCORE II (la première version n'est plus conseillée) et le score STS (voir Evaluation préopératoire), ou scores incluant l'anatomie coronarienne comme les scores SYNTAX ou ASCERT. Le score SYNTAX, le plus utilisé, est basé sur l'anatomie angiographique; il quantifie le nombre, la localisation, la complexité et la fonctionnalité des lésions coronariennes en totalisant le nombre de points attribués aux différentes lésions (Tableau 9.18, Figure 9.41) [52,64].

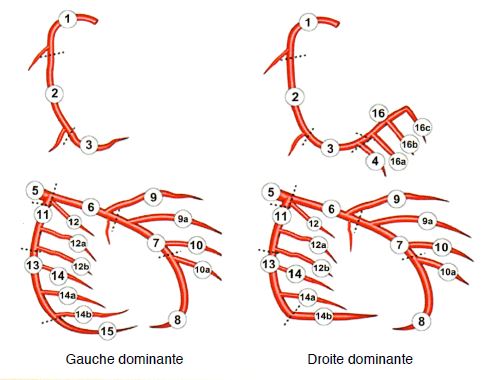
Figure 9.41: Classification modifiée des segments coronariens dans le système SYNTAX [65].
Le nombre de points accordé à chaque segment varie de 0.5 pour les lésions périphériques à 5-6 pour le tronc commun (5 en cas de dominance droite, 6 en cas de dominance gauche). Il est multiplié par 2 en cas de sténose de 50-99% et par 5 en cas d'occlusion totale, avec 1 point supplémentaire pour chaque situation que comprend cette rubrique. Les particularités des bi- ou trifurcations ajoutent de 1 à 10 points. Calcification et tortuosité valent chacune 2 points. Lésion ostiale, longueur > 20 mm, thrombus et nombre de segments diffusément sténosés comptent chacun pour 1 point. Un score de ≤ 22 points indique un faible degré de complexité, un score de 23-32 un degré intermédiaire, et un score ≥ 33 un degré majeur [52,64].
D'une manière générale, les malades souffrant de lésions complexes sur 2-3 vaisseaux ou sur le tronc commun bénéficient de la chirurgie par rapport à la PCI, qui est par contre plus performante pour les scores bas (< 22) [4]. Dans l'étude SYNTAX, 1'800 patients souffrant de maladie tritronculaire ou de tronc commun ont été randomisés entre PAC et PCI (DES de 1ère génération) et suivis à 5 ans. Chez les malades avec des scores élevés, le taux d'infarctus, de revascularisation secondaire et d'AVC est clairement inférieur dans le groupe de revascularisation chirurgicale (27% versus 44%), alors qu'il est superposable pour le tronc commun; il n'est que légèrement bénéficiaire pour les tritronculaires dans le groupe avec des scores bas ou intermédiaires [42].
Comme il est purement angiographique, le score SYNTAX a été combiné à des données cliniques pour en augmenter la puissance discriminative par l'inclusion de la réserve de flux coronarien (FFR functional flow reserve) ou du score de risque clinique EuroSCORE (Figure 9.42).
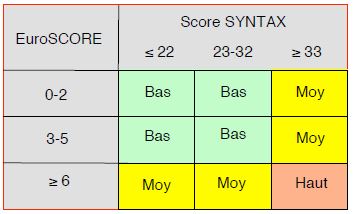
Figure 9.42: Combinaison du score SYNTAX et de l'EuroSCORE pour déterminer la catégorie de risque clinique du patient lors d'une revascularisation coronarienne: faible (Bas), intermédiaire (Moy) ou élevé (Haut).
Finalement, le score SYNTAX II associe sept variables cliniques et leur attribue des points qui s'additionnent à ceux de la complexité angiographique: âge, clairance de la créatinine, fraction d'éjection du VG, présence d'un tronc commun non-protégé, maladie vasculaire périphérique, sexe féminin et BPCO. On en tire un nomogramme qui permet d'estimer la mortalité à 4 ans (Figure 9.43) [19].
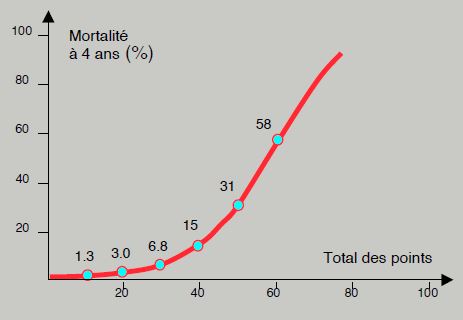
Figure 9.43: Courbe de mortalité estimée d'après le score SYNTAX II construit à partir du score angiographique et de 7 variables cliniques. Un calculateur en ligne permet d'obtenir la mortalité probable d'un patient pour une PCI ou pour des PAC à partir de ses données coronarographiques et cliniques, qui n'ont pas la même valeur de pondération selon que l'option thérapeutique envisagée est angioplastique ou chirurgicale [19].
Revascularisation hybride
Les procédures hybrides tentent d’allier les excellents résultats à long terme du pontage mammaire sur l’IVA (jusqu'à 98% de perméabilité à 10 ans) avec les avantages de l’angioplastie et des stents sur les autres vaisseaux, où le taux annuel d'occlusion des stents de nouvelles générations est probablement inférieur à celui des greffons veineux [45]. La réussite dépend évidemment de l’anatomie des vaisseaux: sténose complexe de l'IVA proximale avec bonne reprise périphérique, et lésions des autres troncs compatibles avec une pose de stents. D'autres conditions interviennent: absence de contre-indications aux antiplaquettaires, artériosclérose de l'aorte ascendante la rendant impropre au clampage, patient à haut risque pour une opération en CEC, manque de conduits pour des pontages, interventions antérieures, irradiation thoracique [27]. L'intervention peut se dérouler selon plusieurs modalités [23].
- Procédure en un seul temps. Si l'on bénéficie d'une salle hybride disposant de tout l'équipement radiologie nécessaire à l'angioplastie et permettant une intervention de chirurgie cardiaque à ciel ouvert, il est possible de réaliser les deux interventions en une étape. En général, on commence par le pontage chirurgical de l'AMI sur l'IVA par une minithoracotomie gauche à cœur battant (voir Chapitre 10, MIDCAB). Puis, sous protection de cette première revascularisation, on procède à l'angioplastie et à la pose de stents par voie percutanée dans les autres territoires. Ceci présente l’avantage de pouvoir contrôler angiographiquement l’anastomose sur l’IVA, mais implique d'administrer la dose de charge de la bithérapie antiplaquettaire en cours d'opération (en général aspirine + clopidogrel), avec un risque hémorragique évident [51]. Chez les malades souffrant de néphropathie, le risque d'insuffisance rénale lié à la chirurgie est doublé de l'utilisation simultanée de produits de contraste.
- Procédure en deux temps, séparés par quelques heures à quelques jours. La tendance est de commencer par le MIDCAB, pour éviter de courir le danger d'une hémorragie sous antiplaquettaires et d'une thrombose de stent lors d'un acte chirurgical si proche de l'angioplastie [37].
La mortalité varie de 0.1-2.6% à 30 jours et de 5-15% à 5 ans, avec un taux d'accident cardiovasculaire et de réopération de 15-25% à 5 ans [2,21,49]. Ce type d'intervention donne des résultats à court terme équivalents à ceux des pontages classiques dans une population sélectionnée de patients avec un degré de complexité coronarien intermédiaire [45]. Il n'y a donc pas de gain majeur dans cette tentative de combiner le meilleur de deux techniques différentes, mais une opportunité d'intervenir de manière peu invasive, avec un séjour hospitalier abrégé et une reprise d'activité précoce.
Complications
La morbi-mortalité des PAC est représentée par un certains nombre de complications [28].
- Mortalité 1-2%;
- Délire postopératoire 5-50%;
- Fibrillation auriculaire 15-30%;
- Infarctus myocardique 2-4%;
- Reprise pour hémostase 2-4%;
- Ictus 1-3%;
- Médiastinite 0.5-3%;
- Insuffisance rénale (dialyse) 1%.
Certaines caractéristiques augmentent les risques associés à la chirurgie: antécédents d'ictus, maladie cérébrovasculaire, chirurgie cardiaque préalable, irradiation thoracique, fragilité ou grand âge [4]. La présence d'athéromatose massive de l'aorte ascendante ou d'aorte porcelaine, où le clampage aortique a des conséquences neurologiques catastrophiques, est une indication à procéder à une opération à cœur battant (OPCAB) et à une revascularisation tout-artérielle [17,41]. Les béta-bloqueurs sont efficaces pour réduire l'incidence de FA et devraient être administrés pendant 3 mois en postopératoire. Si la FA se prolonge au-delà de 48 heures, une anticoagulation (anti-vitamine K ou nouvel anticoagulant oral) doit être prévue pour une durée dépassant d'au moins 4 semaines la restoration du rythme sinusal [31]. La résection chirurgicale de l'appendice auriculaire gauche peut réduire le risque de complication neurologique chez les malades qui ont une anamnèse de FA.
Une ischémie récurrente sur un pontage occlus ou sténosé peut être gérée par la pose d'un stent lorsqu'il s'agit d'un greffon artériel, mais les stents sont déconseillés sur les pontages veineux et au niveau des anastomoses. Malheureusement, les réopérations en CEC ou à cœur battant sont des interventions à risque élevé. La mortalité est triplée (2-10%), et le risque d'infarctus s’élève à 10% [64].
- Risque hémorragique : une hémorragie majeure est à craindre dès l'ouverture du sternum, particulièrement si le péricarde n'a pas été refermé lors de la précédente opération. Les adhérences péricardiques laissent une zone cruentée qui est une source d'hémorragie postopératoire.
- Risque ischémique : si le coeur est perfusé par un greffon mammaire encore perméable, une ischémie aiguë peut s’installer dans le territoire concerné par coudure du vaisseau lorsque l'écarteur sternal rétracte la cage thoracique. D’autre part, l’ouverture du sternum peut léser des greffons veineux encore fonctionnels, puisqu’ils sont situés sur la face antérieure de l’aorte ascendante. La surveillance du segment ST doit être permanente ; en cas de surélévation soudaine, l’anesthésiste en avertit immédiatement l’opérateur pour qu’il puisse adapter sa technique aux exigences de la perfusion myocardique. Un CT-scan multibarrette est un bon moyen de visualiser l’anatomie des pontages avant l’intervention [16].
- Protection du myocarde : la persistance du flux mammaire pendant la CEC empêche une cardioplégie efficace. Il faut alors soit clamper le greffon, ce qui implique de le disséquer et de prendre le risque de le léser, soit descendre la température du sang à 20-24°C (hypothermie profonde systémique) pour éviter le réchauffement du coeur.
- Une réaction majeure à la protamine est plus fréquente parce que les patients y ont été sensibilisés lors de la précédente opération ; un délai de 2 à 6 mois entre les deux interventions présente le risque maximal. Une prévention possible est l'administration de méthylprédnisolone (Solu-Médrol® 500-1000 mg) dans la CEC.
Opérations combinées
La maladie calcifiante inflammatoire de la sénescence est une étiologie commune à la sténose aortique et à la sténose coronarienne. Il n'est donc pas étonnant que le RVA soit souvent combiné aux PAC.
Une plastie ou un remplacement valvulaire est prévu simultanément à des PAC dans les situations suivantes (voir Chapitre 11, IM secondaire sur ischémie) [8,10,30,36].
- Sténose aortique serrée (symptomatique ou non) : remplacement valvulaire aortique (RVA).
- Sténose aortique modérée-à-sévère, même asymptomatique : RVA si le degré de calcification suggère une évolution rapide.
- IM ischémique sévère : plastie (PVM) ou remplacement (RVM) ; le taux de reprise pour récidive est plus élevé après plastie qu’après remplacement [1].
- IM ischémique modérée-à-sévère : la présence et la persistance d’une IM affecte négativement le pronostic de la revascularisation chirurgicale, alors que la plastie l’améliore significativement (HR 0.55). La plastie est recommandée si la réduction de l’IM avec la revascularisation simple est peu probable ou absente (ETO post-CEC) et si la mortalité opératoire probable de l’intervention combinée est < 5% [48].
- IM modérée: pas d'intervention [40].
- IM sur pathologie valvulaire mitrale : selon indications propres.
| Pontages aorto-coronariens |
|
Différents types de pontages:
- Veineux: rapides et faciles, mais faible taux de perméabilité (50% à 10 ans)
- Artère mammaire interne (AMIG sur l'IVA): excellente perméabilité (95% à 10 ans)
- Double mammaire: excellents résultats, mais risque de dévascularisation sternale (infection, retard de consolidation)
- Artère radiale: bonne perméabilité à 10 ans (90%)
- Artère gastro-épiploïque: pontage à la face inférieure du coeur, rarement utilisée
- Pontages tout-artériels à coeur battant: réduction du taux d'AVC (pas de clampage aortique)
- Contrôle de perméabilité au flux Doppler en fin d'intervention
- Aspirine et statine à vie (aspirine dès les premières heures postopératoires)
Pontages à coeur battant (OPCAB): techniquement plus difficiles, tendance à moins de revascularisation complète, mais résultats equivalents aux PAC en CEC dans les centres specialisés. Avantages: pontages tout-artériels, diminution du taux d'AVC, d'hémorragie, de transfusion, tendance vers moins de complications pulmonaires et d'insuffisance rénale.
Indications aux PAC:
- Maladie tritronculaire
- Score SYNTAX élevé, anatomie impropre à la PCI
- Sténose complexe du tronc commun ou de l'IVA proximale
- Dysonction ventriculaire gauche, diabète
- Complications mécaniques de l'infarctus
Complications des PAC
- Mortalité: 1-2%
- Infarctus: 2-4%
- Ictus: 1-3%
- Fibrillation auriculaire: 15-30%
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- ACKER MA, PARIDES MK, PERRAULT LP, et al. Mitral-valve repair versus replacement for severe ischemic mitral regurgitation. N Engl J Med 2014; 370:23-32
- ADAMS C, BURNS DJ, CHU MW, et al. Single-stage hybrid coronary revascularization with long-term follow-up. Eur J Cardio-Thorac Surg 2014; 45:438-42
- ALDEA GS, BAKAEEN FG, PAL J, et al. The Society of Thoracic Surgeons Clinical Practice Guidelines on arterial conduits for coronary artery bypass grafting. Ann Thorac Surg 2016; 101:801-9
- ALEXANDER JH, SMITH KP. Coronary-artery bypass grafting. N Engl J Med 2016; 374:1954-64
- ANAVEKAR NS, CHAREONTHAITAWEE P, NARULA J, GERSH BJ. Revascularization in patients with severe left ventricular dysfunction. Is the assessment of viability still viable? J Am Coll Cardiol 2016; 67:2874-87
- BAIBHAV B, GEDELA M, MOULTON M, et al. Role of invasive functional assessment in surgical revascularization of coronary artery disease. Circulation 2018; 137:1731-9
- BAKAEEN FG, SHROYER AL, GAMMIE JS, et al. Trends in use of off-pump coronary artery bypass grafting: results from the Society of Thoracic Surgeons Adult Cardiac Surgery Database. J Thorac Cardiovasc Surg 2014; 148:856-63
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- COLLINS R, REITH C, EMBERSON J; et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016; 288:2532-61
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- DEO SV, DUNLAY SM, SHAH IK, et al. Dual antiplatelet therapy afetr coronary artery bypass grafting: is there any benefit ? A systematic review and méta-analysis. J Card Surg 2013; 28:109-16
- DEPPE AC, ARBASH W, KUHN EW, et al. Current evidence of coronary artery bypass grafting off-pump versus on-pump: a systematic review with meta-analysis of over 16'000 patients investigated in randomized controlled trials. Eur J CardioThorac Surg 2016; 49:1031-41
- DESAY ND, COHEN EA, NAYLOR CD et al. A randomized comparison of radial artery and saphenous vein coronary bypass grafts. N Engl J Med 2004; 351:2302-9
- DIEGLER A, BÖRGERMANN J, KAPPERT U, et al. Off-pump versus on-pump coronary artery bypass grafting in elderly patients. N Engl J Med 2013; 368:1189-98
- DIGIAMMARCO G, CANOSA C, FOSCHI M, et al. Intraoperative graft verification in coronary surgery: increased diagnostic accuracy adding high-resolution epicardial ultrasonography to transit-time flow measurement. Eur J Cardio-Thorac Surg 2014; 45:e41-e45
- DURST R, BOGOT N, GILON D, DRENGER B. Potential role for coronary computerized angiography for assessing preoperative ischemic risk. J Cardiothorac Vasc Anesth 2010; 24:348-55
- EMMERT MY, SEIFERT B, WILHELM M; et al. Aortic no-touch technique makes the difference in off-pump coronary artery bypass grafting. J Thorac Cardiovasc Surg 2011; 142:1499-506
- FARKOUH ME, DOMANSKI M, SLEEPER LA, et al (FREEDOM trial investigators). Strategies for multivessel revascularization in patients with diabetes. N Engl J Med 2012; 367:2375-84
- FAROOQ V, VAN KLAVEREN D, STEYERBERG EW, et al. Anatomical and clinical characteristics to guide decision-making between coronary artery bypass surgery and percutaneous coronary intervention for individual patients: development and validation of SYNTAX score II. Lancet 2013; 381:639-50
- FITZGIBBON GM, KAFKA HP, LEACH AJ, eet al. Coronary bypass fate and patient outcome: Angiographic follow-up of 5,065 grafts related to survival and reoperation in 1,388 patients during 25 years. J Am Coll Cardiol 1996; 28:616-26
- GAROT P, MORICE C, TRESURKOSOL D, et al, for the LEADERS FREE Invsetigators. 2-year outcomes of high bleeding risk patients after polymer-free drug-coated stents. J Am Coll Cardiol 2017; 69:162-71
- GAUDINO M, ANTONIADES C, BENEDETTO U, et al. Mechanisms, consequences, and prevention of coronary graft failure. Circulation 2017; 136:1749-64
- GAUDINO M, BAKAEEN F, DAVIERWALA P, et al. New strategies for surgical myocardial revascularization. Circulation 2018; 138:2160-8
- GAUDINO M, BAKAEEN F, BENEDETTO U, et al. Arterial grafts for coronary bypass. A critical review after the publication of ART and RADIAL. Circulation 2019; 140:1273-84
- GAUDINO M, TAGGART D, SUMA H, et al. The choice of conduits in coronary artery bypass surgery. J Am Coll Cardiol 2015; 66:1729-37
- GLINEUR D, GAUDINO M, GRAU J. The evolution of coronary bypass surgery will determine ist relevance as the standard of care for the treatment for multivessel coronary artery disease. Circulation 2016; 134:1206-8
- GOSEV I, LEACCHE M. Hybrid coronary revascularization. The future of coronary artery bypass surgery or an unfulfilled promise? Circulation 2014; 130:869-71
- HEAD SJ, MILOJEVIC M, TAGGART DP, PUSKAS JD. Current practice of state-of-the-art surgical coronary revascularization. Circulation 2017; 136:1331-45
- HILLIS LD, SMITH PK, ANDERSON JL, et al. 2011 ACCF/AHA Guideline for coronary artery bypass graft surgery: Executive summary. Anesth Analg 2012; 114:11-45
- HILLIS LD, SMITH PK, ANDERSON JL, et al. 2011 ACCF/AHA Guideline for coronary artery bypass graft surgery: a report of the American College of Cardiology Foudation/American Heart Association task force on Practice Guidelines. Circulation 2011; 124:e652-e735
- KIRCHHOF P, BENUSSI S, KOTECHA D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37:2893-962
- KOLESOV VI. Mammary artery-coronary artery anastomosis as method of treatment for angina pectoris. J Thorac Cardiovasc Surg 1967; 54: 535-44
- KULIK A, RUEL M; INEID H, et al. Secondary prevention after coronary artery bypass graft surgery: a scientific statement from the American Heart Association. Circulation 2015; 131:927-64
- LAMY A, DEVEREAUX PJ, PRABHAKARAN D, et al. Off-pump or on-pump coronary artery bypass grafting at 30 days. N Engl J Med 2012; 366:1489-97
- LAMY A, DEVEREAUX PJ, PRABHAKARAN D, et al. Five years outcomes after off-pump or on-pump coronary artery bypass grafting. N Engl J Med 2016; 375:2359-68
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- LEACCHE M, ZHAO DX, UMAKANTHAN R, BYRNE JG. Do hybrid procedures have proven clinical utility and are they the wave of the future? Circulation 2012; 125:2504-10
- LOPEZ RD, MEHTA RH, HAFLEY GB, et al. Relationship between vein graft failure and subsequent clinical outcomes after coronary artery bypass surgery. Circulation 2012; 366:250-7
- MANGANO DT. Aspirin and mortality from coronary bypass surgery. N Engl J Med 2002; 347:1309-17
- MICHLER RE, SMITH PK, PARIDES MK, et al. Two-year outcomes of surgical treatment of moderate ischemic mitral regurgitation. N Engl J Med 2016; 374:1932-41
- MISFELD M, BRERETON RJ, SWEETMAN EA, et al. Neurologic complications after off-pump coronary artery bypass grafting with and without aortic manipulation: meta-analysis of 11,398 cases from 8 studies. J Thorac Cardiovasc Surg 2011; 142:e11-e17
- MOHR FW, MORICE MC, KAPPETEIN AP, et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three vessel disease and left main coronary disease. 5-year follow-up of the randomized, clinical SYNTAX trial. Lancet 2013; 381:629-38
- MOUNSEY CA, MAWHINNEY JA, WERNER RS, et al. Does previous transradial catheterization preclude use of the radial artery as a conduit in coronary artery bypass surgery ? Circulation 2016; 134:681-8
- Organisation for Economic Cooperation and Development. Health at a glance 2015. Paris: OECD Publishing, 2015
- PANOULAS VF, COLOMBO A, MARGONATO A, MAISANO F. Hybrid coronary revascularization. Promising, but yet to take off. J Am Coll Cardiol 2015; 65:85-97
- PETRIE MC, JHUND PS, SHE L, et al. Ten-year outcomes after coronary artery bypass grafting according to age in patients with heart failure and left ventricular systolic dysfunction. Circulation 2016; 134:1314-24
- PICCOLO R, GIUSTINO G, MEHRAN R, WINDECKER S. Stable coronary artery disease: revascularisation and invasive strategies. Lancet 2015; 386:702-13
- RAMAKRISHNA H, GHADIMI K, AUGOUSTIDES JGT. Incidental moderate mitral regurgitation in patients undergoing coronary artery bypass grafting: update on guidelines and key randomized trials. J Cardiothorac Vasc Anesth 2014; 28:189-93
- REPOSSINI A, TESPILI M, SAINO A, et al. Hybrid revascularization in multivessel coronary artery disease. Eur J Cardio-Thorac Surg 2013; 44:288-93
- ROSENBERGER P, SHERNAN SK, LÖFFLER M, et al. The influence of epiaortic ultrasonography on intraoperative surgical management in 6051 cardiac surgical patients. Ann Thorac Surg 2008; 85:548-53
- SHANNON J, COLOMBO A, ALFIERI O. Do hybrid procedures have proven clinical utility and are they the wave of the future? Circulation 2012; 125:2492-503
- SIANOS G, MOREL MA, KAPPETEIN AP, et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. EurIntervention 2005; 1:219-27
- SOUSA-UVA M, HEAD SJ, MILOJEVIC M, et al. 2017 EACTS Guidelines on perioperative medication in adult cardiac surgery. Eur J Cardio-Thorac Surg 2018; 53:5-33
- STEIN PD, SCHÜNEMANN HJ, DALEN JE, GUTTERMAN d. Antithrombotic therapy in patients with saphenous vein and internal mammary bypass grafts. The seventh ACCP conference on antithrombotic and thrombolytic therapy. Chest 2004; 126:600S-608S
- SUMA H. Gastroepiploic artery graft in coronary artery bypass grafting. Ann Cardiothorac Surg 2013; 2:493-8
- TAGGART DP, ALTMAN DG, GRAY AM, et al. Randomized trial to compare bilateral vs single internal mammary coronary artery bypass grafting: 1-year results of the Arterial Revascularization Trial (ART). Eur Heart J 2010; 31:2470-81
- TATOULIS J, BUXTON BF, FULLER JA. Patencies of 2’127 arterial to coronary conduits after 15 years. Ann Thorac surg 2004; 77:93-101
- TORINO PA, FEARON WF, DE BRUYNE B, et al. Angiographic versus functional severity of coronary artery stenoses in the FAME study: fractional flow reserve versus angiography in multivessel evaluation. J Am Coll Cardiol 2010; 55:2816-21
- TOTH GG, DE BRUYNE B, CASSELMAN F, et al. Fractional flow reserve-guided vs angiographic-guided coronary artery bypass graft surgery. Circulation 2013; 128:1405-11
- VELAZQUEZ EJ, LEE KL, JONES RH; et al. Coronary-artery bypass surgery in patients with ischemic cardiomyopathy. N Engl J Med 2016; 374:1511--20
- VRIES DE MR, SIMONS KH, JUKEMA JW, et al. Vein graft failure: from pathophysiology to clinical outcomes. Nat Rev Cardiol 2016; 13:451-70
- WEISS AJ, ZHAO S, TIAN DH, et al. A meta-analysis comparing bilateral internal mammary artery with left internal mammary artery for coronary artery bypass grafting. Ann Cardiothorac Surg 2013; 2:390-400
- WIJNS W, KOHL P, DANCHIN N, et al. Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010; 31:2501-55
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
- YADAV M, PALMERINI T, CAIXETA A, et al. Prediction of coronary risk by SYNTAX and derived scores. J Am Coll Cardiol 2013; 62:1219-30
- ZACHARIAS A, SCHWANN TA, RIORDAN CJ, et al. Late results of conventional versus all-arterial revascularization based on internal thoracic and radial artery grafting. Ann Thorac Surg 2009; 87:19-26.e2
- ZHAO DF, EDELMAN JJ, SECO M, et al. Coronary artery bypass grafting with and without manipulation of the ascending aorta: a network meta-analysis. J Am Coll Cardiol 2017; 69:924-36
- ZHOU P, ZHU P, NIE Z, et al. Is the era of bilateral internal thoracic artery grafting coming for diabetic patients ? An updated meta-analysis. J Thorac Cardiovasc Surg 2019; 158:1559-70
