Les études des années quatre-vingt-dix avaient montré que la meilleure protection périopératoire pour la chirurgie non-cardiaque est une revascularisation complète, parce que dans ce cas, l'incidence de complications ischémiques (infarctus 0.8%, mortalité cardiaque 1.7%) est équivalente à celle de la population générale présentant les facteurs de risque équivalents mais sans maladie coronarienne [12]. Il existe toutefois des limites à ces données (voir Figure 3.12A).
- Toute manipulation coronarienne transforme momentanément une sténose ou une plaque en lésion instable ; cette période d'instabilité correspondant à la durée nécessaire à la ré-endothélialisation (6 semaines à 12 mois selon le type de revascularisation), pendant laquelle le risque de thrombose et d'infarctus est augmenté de 5-10 fois.
- La mortalité de la chirurgie non-cardiaque à < 3 semaines, à 6 semaines et à > 3 mois après PAC est respectivement de 21%, 4% et < 1% [3,12,23].
- La mortalité de la chirurgie non-cardiaque après angioplastie percutanée et pose de stents passifs est superposable : elle est de 26%, 4% et < 1% à < 3 semaines, à 6 semaines et à > 3 mois, respectivement [32].
- Le bénéfice de la revascularisation n’est complet qu’après 3 mois, lorsque l’incidence d’accident cardiovasculaire devient identique à celle des patients non coronariens; il est donc logique d’attendre au moins 3 mois après PCI + stents passifs ou PAC pour toute chirurgie élective. Ce délai est de 3 à 6 mois avec les stents actifs de dernière génération.
- Les mortalités de la chirurgie non-cardiaque et de la revascularisation sont additionnelles. La revascularisation a une certaine mortalité (PAC 1.7%; PCI 0.1%) et fait courir un risque d'infarctus (PAC 2-4%; PCI 0.9%); chez les polyvasculaires, la mortalité des PAC est de 3-5%, celle de la PCI de 0.5-1%. Si l'on ajoute cette mortalité à celle de la chirurgie majeure ou vasculaire (1-5%), on trouve un résultat supérieur à celui de l'intervention sous préparation médicale optimale (béta-bloqueur, antiplaquettaires, statines) mais sans revascularisation [3,12,23,27].
- La revascularisation, lorsqu'elle est réussie, a un effet limité dans le temps; la protection offerte par des pontages aorto-coronariens (PAC) dure plus longtemps (6 ans, puis diminution progressive) que celle d'une angioplastie percutanée (< 3 ans). D’autre part, la moitié des récidives survient dans un territoire différent de celui qui avait été revascularisé, traduisant ainsi la progression de la maladie de base [36].
- Le bénéfice de la revascularisation préopératoire est également limité par le fait que la moitié des infarctus périopératoires survient sur des plaques instables (sténose < 60%) non dépistables par les épreuves d’effort ni par la coronarographie [7]. D’autre part, la corrélation entre la localisation des ACS survenue à l’écho de stress et celles survenues à l’ETO peropératoire est faible [28].
Les études comparant des malades souffrant de coronaropathie stable revascularisés en vue d'une intervention de chirurgie vasculaire majeure à des malades non revascularisés mais traités médicalement (béta-bloqueurs, antiplaquettaires, statines) n'ont pas montré de différence dans l'incidence d’infarctus et de décès cardiaque postopératoires, même si l’écho de stress est très significativement positif [10,21,29]. Par contre, il est impératif que la fréquence cardiaque soit maintenue à 60-65 batt/min pendant et après l’intervention. La revascularisation préopératoire n’est donc pas indiquée en cas d’angor stade I ou II (coronaropathie stable); elle n'a de sens que si certaines conditions sont remplies [26,41] :
- L'indication est liée à la présence d’un syndrome coronarien instable.
- L'ischémie est liée à un déséquilibre du rapport DO2/VO2 dû à une sténose serrée.
- Les délais imposés entre la revascularisation et l'opération non-cardiaque (6 semaines à 12 mois) doivent être compatibles avec l'évolution de l'affection chirurgicale (tumeur, anévrysme, fracture, etc).
- Les risques de la revascularisation sont plus élevés chez les malades polyvasculaires (mortalité des PAC : 3-5% au lieu de 1.7%) qui sont les plus fréquemment concernés par ce débat.
- Les risques additionnés de la revascularisation (PAC ou PCI) et de la chirurgie non-cardiaque doivent être inférieurs au risque de l'intervention sous simple protection médicamenteuse (béta-bloqueurs, antiplaquettaires, statines). Or la revascularisation augmente le risque de complications cardiaques dans le postopératoire immédiat ; à long terme, les PAC diminuent le risque cardiaque chez les polyvasculaires (OR 0.6), alors que la PCI ne le modifie pas [1].
L’étude COURAGE, réalisée en-dehors d’un contexte chirurgical, a analysé la survie et les récidives d’ischémie chez deux groupes de patients souffrant de coronaropathie stable strictement randomisés entre traitement médical optimal et traitement médical avec PCI ; elle n’a révélé aucune différence entre les deux groupes ni dans la mortalité, ni dans l’incidence d’infarctus, ni dans le taux d’ictus au cours d’un suivi de 3 ans [2,39]. L’analyse d’un sous-groupe de cette étude comprenant des malades souffrant d’angor stade III n’a pas non plus démontré de différences [18]. On peut en conclure que la revascularisation ne fait partie ni du traitement initial ni de la préparation préopératoire de l’angor stable à fonction ventriculaire conservée [26,41].
Il reste néanmoins que le bénéfice à long terme de la revascularisation est évident, puisqu'elle traite la maladie de base du coronaropathe. En préopératoire, les indications à une revascularisation sont donc les mêmes qu'en dehors du contexte chirurgical [26,41].
- Indications générales : syndrome coronarien aigu ou instable (stade III-IV), ischémie étendue ou symptomatique malgré un traitement médical optimal, tests d’effort significativement positifs.
- Indications aux PAC : sténose du tronc commun, maladie tritronculaire sévère, angor subintrant, maladie bi- ou tritronculaire avec dysfonction ventriculaire et/ou diabète, score SYNTAX élevé (voir Tableau 9.18) ; les résultats à moyen terme (> 2 ans) sont supérieurs à ceux de la PCI pour les tritronculaires.
- Indications à la PCI avec stents : infarctus avec surélévation ST/onde Q, maladie mono- ou bi-tronculaire, maladie tritronculaire si FE > 0.4 et anatomie favorable; l’IVA proximale est une indication possible selon les circonstances (score SYNTAX bas).
- Coronaropathie stable: PCI en cas de maladie mono- ou bi-tronculaire sans IVA proximale, score SYNTAX bas, PAC préférable dans les autres cas.
Délais après revascularisation
Après des PAC, le risque opératoire est d'autant plus élevé qu'on est proche de la revascularisation; il est nettement dégressif au-delà de 6 semaines, mais il faut attendre 3 mois pour bénéficier du plein effet de l’intervention et rejoindre le taux de mortalité des malades non-coronariens. Le taux de complications ischémiques en cas de chirurgie non-cardiaque est de 30% (mortalité opératoire: 20%) pendant 4-6 semaines; il est d'environ 4% entre 2 et 3 mois, et de < 1% au-delà de 3 mois. On peut donc considérer un délai de 6 semaines comme le minimum pour envisager une opération non cardiaque nécessaire ou vitale; le délai de sécurité pour une intervention élective est de 3 mois [3].
Après PCI et pose de stent, la durée du délai est liée à celle de la réendothélialisation du stent. Dans un stent métallique simple, ou stent passif (BMS), il faut attendre 6 semaines pour que l’armature soit recouverte par une couche cellulaire et 3 mois pour être complètement endothélialisée [11]. Tant que le stent n’est pas entièrement recouvert, le risque de thrombose par adhésion des thrombocytes nécessite une double thérapie antiplaquettaire par aspirine et clopidogrel (ou prasugrel, ou ticagrelor). Le taux de thrombose est ainsi inférieur à 2% pendant le premier mois et < 0.1% au-delà. Cependant, le néo-endothélium tend à proliférer, ce qui provoque un taux de resténose de 12-20% à 9-12 mois [31]. Après PCI et pose de stent, le risque opératoire est directement lié au délai entre la revascularisation et la chirurgie. Durant les 6 premières semaines, les risques de thrombose et d’infarctus sont d’environ 35% (mortalité opératoire: 18-26%) ; avec les BMS, l’incidence décroît à 3-5% dès 6 semaines et devient inférieure à 1% au-delà de 3 mois; mais il faut se garder d'attendre plus de 12 mois, sans quoi on risque d'opérer pendant la phase de resténose du BMS [32,33]. Ces résultats s’entendent pour des malades maintenus sous bithérapie pendant 6 semaines.
Avec les stents à élution, ou stents actifs (DES), le taux de resténose est passé à 3% à 1 an et 6% à 3 ans, mais ce progrès s’accompagne d’un ralentissement considérable de la réendothélialisation [31]. En effet, l’endothélialistion des stents à élution de 1ère génération ne dépasse pas 60% de leur surface jusqu’à 40 mois, alors que le 95% de la surface des stents passifs est entièrement recouverte à 3 mois [14]. Cette situation requiert une double thérapie antiplaquettaire prolongée (12 mois) (voir Traitement interventionnel). Les DES de 2ème et 3ème générations bénéficient d'une endothélialisation plus rapide et d'un taux de thrombose très inférieur. La durée de la bithérapie est raccourcie à 3-6 mois selon les types de stent; elle peut même être limitée à 1 mois en cas de très haut risque hémorragique. Avec ces nouveaux DES, une opération vitale peut être réalisée après 1-3 mois et une opération élective après 6 mois. Lorsque le traitement antiplaquettaire est suspendu, la mortalité devient directement liée au délai entre la revascularisation et la chirurgie; le premier mois après PAC ou stents est la période proscrite pour la chirurgie (Figure 9.34) [37].
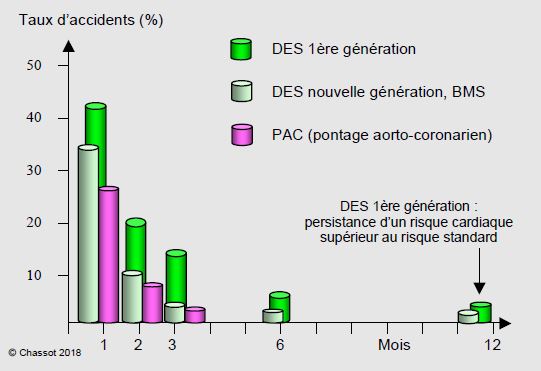
Figure 9.34 : Evolution du risque d’accidents cardiaques périopératoires (mortalité, infarctus, thrombose de stent) chez les malades revascularisés, en fonction du délai entre la revascularisation et l’opération non-cardiaque. Le risque est d’autant plus grand que le délai est plus bref. Une opération vitale peut être conduite dès 1 mois après BMS ou PAC, 1-3 mois après DES 2ème-3ème générations et 6 mois après DES 1ère génération (sous bithérapie) (environ 5% d’accidents cardio-vasculaires). Le délai de sécurité pour une operation élective est respectivement de 3 mois, 6 mois et 12 mois [16,30,38,40].
Les délais recommandés entre la revascularisation coronarienne et une intervention non-cardiaque sont donc fonction de ces différentes situations (Tableau 9.14) (voir Chapitre 29, Arrêt des antiplaquettaires) [4,6,8,15,17].
- Dilatation simple, sans pose de stent 2-4 semaines (ballon simple) 3 mois (ballon à élution)
- Stent métallique simple (stent passif, BMS)
- Opération vitale 6 semaines
- Opération élective 3 mois
- Stent à élution (stent actif, DES 1ère generation, DES biorésorbable)
- Opération vitale 6 mois (sous bithérapie)
- Opération élective 12 mois
- Stent à élution (stent actif, DES 2ème – 3ème génération)
- Opération vitale 1-3 mois (sous bithérapie)
- Opération élective 3-6 mois
- Pontage aorto-coronarien (patient asymptomatique sans traitement)
- Opération vitale 6 semaines
- Opération élective 3 mois

Comme le risque thrombotique est aggravé par la phase d'hypercoagulabilité postopératoire et par l'effet rebond sur l'agrégabilité plaquettaire lors de l'interruption des antiplaquettaires [20,22], il est prudent de prévoir un délai minimum d'un mois entre la fin programmée d'une bithérapie et une intervention chirurgicale élective.
Les études sur le devenir des stents actifs de 1ère génération ont démontré une diminution du taux de revascularisation secondaire quatre fois plus bas que pour les stents passifs, mais une augmentation du risque de thrombose tardive de 0.6%/an (2.2% à 4 ans) lorsque les patients ne sont plus sous bi-thérapie [35]. Le problème tient au fait que la thrombose de stent a un taux d’infarctus allant jusqu’à 50% et une mortalité de 11-45% (moyenne 25%), alors que la resténose est un événement bénin dont la mortalité est < 1%. En effet, la thrombose de stent correspond à l’occlusion abrupte d’un vaisseau dont le flux était normal et la collatéralisation faible. Les prédicteurs de la thrombose de stent sont par ordre décroissant d’importance [5,9,13,19,25,34] :
- La durée du traitement antiplaquettaire (voir Arrêt des antiplaquettaires). Le délai entre la revascularisation et l’interruption de la bithérapie est probablement l’élément le plus important, notamment lorsqu’il est inférieur à 6 mois. Il est prohibitif en-dessous de 1 mois.
- La chirurgie non-cardiaque. L’acte chirurgical s’accompagne d’un syndrome inflammatoire systémique et d’un état hypercoagulable, particulièrement importants lors d’intervention majeure. D’autre part, le risque est d’autant plus élevé que le délai entre la pose de stent et l’opération est plus bref ou que l’intervention est réalisée en urgence ; cependant, il reste faible pour les interventions mineures.
- Le status cardiaque: présence de syndrome coronarien aigu (SCA) au moment de la revascularisation, persistance d’un syndrome coronarien instable.
- Le degré de recouvrement endothélial. Entre 1 et 3 ans après la PCI, les zones non recouvertes représentent 2.6% de la surface du stent avec les DES de 2ème génération, mais 19% avec les DES de 1ère génération [24].
- La progression de la maladie coronarienne. Seule la moitié des complications au-delà d’une année après revascularisation coronarienne survient dans le vaisseau incriminé; l'autre moitié apparaît dans un autre vaisseau sous forme d’une progression de la maladie athéromateuse [36].
- L’anatomie coronarienne. Les stents très proximaux et ceux situés dans les vaisseaux dominants ou dans le seul vaisseau perméable sont considérés comme à haut risque. Les stents sous-dimensionnés dans de petits vaisseaux ont une haute incidence de thrombose.
- Les problèmes techniques : malapposition, dissection, emboîtement de stents, etc. Ils sont une cause prédominante de thrombose dans les 30 premiers jours après l’implantation.
- Les indications hors recommandations (off-label indications): une partie importante des DES sont placés dans des situations qui ne correspondent pas aux indications formelles pour lesquels ils ont été conçus : stents multiples, emboîtés, situés à des bifurcations, situations très proximales ou très distales. Avec les DES de 1ère génération, l'utilisation off-label va jusqu'à doubler le risque de thrombose (HR 2.3), ce qui n'est plus le cas avec les nouveaux DES [19].
- Les comorbidités : diabète, insuffisance rénale, dysfonction ventriculaire, maladie cancéreuse (hypercoagulabilité, syndrome paranéoplasique), âge avancé.
- Une inhibition plaquettaire inadéquate. Vu l’incidence de faibles répondeurs à l’aspirine et au clopidogrel, environ 20% des patients revascularisés ne bénéficient pas d’un traitement optimal. Cet aspect est négligeable avec le ticagrelor et le prasugrel.
Ces données concernent en majeure partie les stents actifs de première génération. Les progrès techniques (armature et matrice biorésorbables) et les nouvelles substances antiprolifératives (zotarolimus, everolimus, biolimus) accélèrent l'endothélialisation et diminuent la thrombogénicité. Il s'ensuit un raccourcissement dans la durée de la bithérapie: 3 mois lorsque le risque thrombotique est faible et 6 mois lorsqu'il est plus élevé. Toutefois, l’absence de recul à long terme et d’expérience dans le périopératoire avec les stents actifs de deuxième et troisième génération doit rendre prudent dans la formulation des délais de sécurité pour la chirurgie, même s'ils sont raccourcis, et doit tenir compte des différents prédicteurs de risque pour une éventuelle thrombose.
|
Revascularisation coronarienne préopératoire
|
|
La mortalité de la revascularisation et de la chirurgie sont additionnelles
Le risque cardiaque est très augmenté pendant 4-6 semaines après la revascularisation (mortalité 25%)
Le bénéfice n’apparaît qu’après 3 mois (mortalité < 1%)
Pour les stents actifs (DES), le bénéfice n’apparaît qu’après 6 à 12 mois (selon la génération)
L’angor stable (I-II) n’est pas une indication à la revascularisation
|
| Délais pour la chirurgie après revascularisation |
|
Dilatation simple 2-4 semaines (ballon simple)
3 mois (ballon à élution)
Stent métallique simple (BMS, stent passif) ou pontages aorto-coronariens (PAC)
Opération vitale 6 semaines
Opération élective 3 mois
Stents à élution (DES, stent actif) de 1ère génération
Opération vitale 6 mois (sous bithérapie)
Opération élective 12 mois
Stents à élution (DES, stent actif) de 2éme – 3éme génération
Opération vitale 1-3 mois (sous bithérapie)
Opération élective 3-6 mois
|
| Recommandations pour la durée du traitement antiplaquettaire après évènement coronarien |
|
Aspirine (75-325 mg/jour): à vie sans interruption
Clopidogrel (75 mg/jour), ticagrelor (2 x 90 mg/j) ou prasugrel (10 mg/j):
- Angioplastie (ballon simple) 2 semaines
- Angiopastie (ballon à élution) 3 mois
- Stents passifs électifs 4-6 semaines
- Stents passifs en cas de SCA 12 mois
- Infarctus 3-6 mois
- Stents actifs 3-12 mois selon la génération
(> 12 mois si stent à très haut risque)
- SCA (traitement médic ou revasc) 12 mois
|
| Recommandations pour les délais d'interruption préopératoire des antiplaquettaires |
|
Aspirine: en principe pas d'interruption; si nécessaire: stop 5 jours
Clopidogrel: stop 5 jours
Prasugrel: stop 7 jours
Ticagrelor: stop 5 jours; si nécessaire, stop 3 jours
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Octobre 2018
Références
- BICCARD BM, RODSETH R. A meta-analysis of the prospective randomised trials of coronary revascularisation before noncardiac vascular surgery with attention to the type of coronary revascularisation performed. Anaesthesia 2009; 64:1105-13
- BODEN WE, O’ROURKE RA, TEO KK, et al. Optimal medical therapy with or without PCI for stable coronary artery disease. N Engl J Med 2007; 356:1503-16
- BREEN P, LEE JW, POMPOSELLI F, PARK KW. Timing of high-risk vascular surgery following coronary artery bypass surgery: A 10-year experience from an academic medical centre. Anaesthesia 2004; 59:422-7
- CHASSOT PG, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy: The case for continuing therapy in patients at risk of myocardial infarction. Brit J Anaesth 2007; 99:316-28
- D’ASCENZO F, BOLLATI M, CLEMENTI F, et al. Incidence and predictors of coronary stent thrombosis: Evidence from an international collaborative meta-analysis including 30 studies, 221’066 patients, and 4276 thromboses. Int J Cardiol 2013; 167: 575-84
- EBERLI D, CHASSOT PG, SULSER T, et al. Urologic surgery and anti-platelet drugs after cardiac and cerebrovascular accidents. J Urology 2010; 183:2128-36
- ELLIS SG, HERTZER NR, YOUNG JR, et al. Angiographic correlates of cardiac death and myocardial infarction complicating major non-thoracic vascular surgery. Am J Cardiol 1996; 77:1126-28
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GAGLIA MA, WAKSMAN R. Systematic review of thienopyridine discontinuation and its impact upon clinical outcomes. Eur Heart J 2011; 32:2358-64
- GODET G, RIOU B, BERTRAND M, et al. Does preoperative coronary angioplasty improve perioperative cardiac outcome ? Anesthesiology 2005; 102:739-46
- GREWE PH, DENEKE T, MACHRAOUI A, et al. Acute and chronic tissue response to coronary stent implantation: Pathologic findings in human specimen. J Am Coll Cardiol 2000; 35:157-63
- HASSAN SA, HLATCKY MA, BOOTHROYD DB, et al. Outcomes of noncardiac surgery after coronary bypass surgery or coronary angioplasty in the Bypass Angioplasty Revascularisation Investigation (BARI). Am J Med 2001; 110:260-6
- HAWN MT, GRAHAM LA; RICHMAN JS, et al. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013; 310:1462-72
- JONER M, FINN AV, FARB A, et al. Pathology of drug-eluting stents in humans. J Am Coll Cardiol 2006 ; 48 :193-202
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105: 743-9
- KOVACIC JC, LEE P, KARAJGIKAR R, et al. Safety of temporary and permanent suspension of antiplatelet therapy after drug eluting stent implantation in contemporary "real-world" practice. J Interven Cardiol 2012; 25:482-92
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- MARON DJ, SPERTUS JA, MANCINI J, et al. Impact of an initial strategy of medical therapy without percutaneous coronary intervention in high-risk patients from the Clinical Outcomes Utilizing Revascularization and Agressive druG Evaluation (COURAGE) trial. Am J Cardiol 2009; 104:1055-62
- MARROQUIN OC, SELZER F, MULUKUTLA SR, et al. A comparison of bare-metal and drug-eluting stents for off-label indications. N Engl J Med 2008; 358:342-52
- MAURI L, KEREIAKES DJ, YEH RW, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371:2155-66
- McFALLS EO, WARD HB, MORITZ TE, et al. Coronary artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351:2795-804
- MEHRAN R, BABER U, STEG PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary interventions. PARIS: 2 years results from a prospective observational study. Lancet 2013; 382:1879-88
- NALYSNYK L, FAHRBACH K, REYNOLDS MW, ZHAO SZ, ROSS S. Adverse events in coronary artery bypass graft (CABG) trials: a systematic review and analysis. Heart 2003; 89:767-72
- OTSUKA F, VORPAHI M, NAKANO M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation 2014; 129:211-23
- PALMERINI T, BIONDI-ZOCCAI G, DELLA RIVA D, et al. Stent thrombosis with drug-eluting stents. J Am Coll Cardiol 2013; 62:1915-21
- PATEL MR, DEHMER GJ, HIRSHFELD JW, et al. ACCF/SCAI/STS/AATS/AHA/ASNC 2009 appropriateness criteria for coronary revascularization, J Am Coll Cardiol 2009; 53:530-53
- POLDERMANS D, BOERSMA E, BAX JJ, et al. The effect of bisoprolol on perioperative mortality and myocardial infarction in high-risk patients undergoing vascular surgery. N Engl J Med 1999; 341:1789-94
- POLDERMANS D, BOERSMA E BAX JJ, et al. Correlation of location of acute myocardial infarct after non-cardiac vascular surgery with preoperative dobutamine echocardiographic findings. Am J Cardiol 2001; 88:1413-4
- POLDERMANS D, SCHOUTEN O, VIDAKOVIC R, et al. A clinical randomized trial to evaluate the safety of a non-invasive approach in high-risk patients undergoing major vascular surgery. J Am Coll Cardiol 2007; 49:1763-9
- SAVONITTO S, CARACCIOLO M, CATTANEO M, DE SERVI S. Management of patients with recently implanted coronary stents on dual antiplatelet therapy who need to undergo major surgery. J Thromb Haemost 2011; 9:2133-42
- SERRUYS PW, KUTRYK MJB, ONG ATL. Coronary artery stents. N Engl J Med 2006; 354:483-95
- SHARMA AK, AJANI AE, HAMWI SM, ET AL. Major noncardiac surgery following coronary stenting: When is it safe to operate ? Catheter Cardiovasc Interv 2004; 63:141-5
- SHOUTEN O, VON DOMBURG RT, BAX JJ, et al. Noncardiac surgery after coronary stenting: Early surgery and interruption of antiplatelet therapy are associated with an increase in major adverse cardiac events. J Am Coll Cardiol 2007; 49:122-4
- SIDDIQI O, FAXON DP. Very late stent thrombosis: current concepts. Curr Opin Cardiol 2012; 27:634-41
- STETTLER C, WANDEL S, ALLEMAN S, et al. Outcomes associated with drug-eluting and bare-metal stents: A collaborative netwoek meta-analysis. Lancet 2007; 370:937-48
- STONE GW, MAEHARA A, LANSKY AJ, et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med 2011; 364:226-35
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39:213-54
- VAN KUIJK JP, FLU WJ, SCHOUTEN O, et al. Timing of noncardiac surgery after coronary artery stenting with bare metal or drug-eluting stents. Am J Cardiol 2009; 104:1229-34
- WEINTRAUB WS, SPERTUS JA, KOLM P, et al. Effect of PCI on quality of life in patients with stable coronary disease. N Engl J Med 2008; 359:677-87
- WIJEYSUNDERA DN, WIJEYSUNDERA HC, YUN L, et al. Risk of elective major noncardiac surgery after coronary stent insertion. A population-based study. Circulation 2012; 126:1355-62
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
