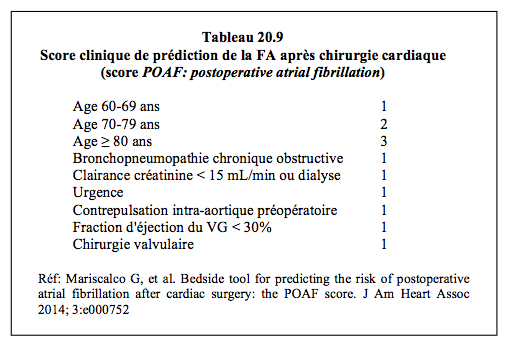
L’incidence de fibrillation auriculaire (FA) après chirurgie cardiaque est élevée : 10 – 40% selon les études [21,27]. Elle survient plus fréquemment après chirurgie valvulaire (40-50% des cas) qu’après chirurgie coronarienne (moyenne 28%). Elle apparaît en général aux 2ème – 4ème jours postopératoires, au pic de la réaction inflammatoire, et dure < 48 heures chez 50% des patients [29]. Lorsqu’elle persiste, elle rallonge la durée du séjour hospitalier, élève les coûts, augmente le risque d’ictus de 2.5 fois et celui de mortalité de 1.2 fois [18,24]. Souvent, la FA n’est que le marqueur d’un état à risque, et non elle-même la cause de ces complications. Le principal facteur incriminé dans son déclenchement est l’âge : l’incidence est de 18% à 60 ans et de 50% à 80 ans [1]. Mais d’autres facteurs entrent en ligne de compte : principalement la dilatation de l’OG et les valvulopathies, mais aussi l'anamnèse de FA, l’hypertension, le diabète, le sexe masculin, l’hypo- ou l'hyperthyroïdisme, l'obésité, l'alcoolisme, l'insuffisance cardiaque, les facteurs génétiques, etc (voir Types d'arythmies). A cela s'ajoutent des facteurs liés à l'intervention: l’hypomagnésémie, le syndrome inflammatoire systémique, la stimulation sympathique, les catécholamines, le type de canulation auriculaire, l'atriotomie, la durée du clampage aortique [12,16,22,23]. Plusieurs indices de risque pour la survenue d'une FA après chirurgie cardiaque ont été imaginés dans l'idée de pouvoir cibler la prophylaxie. Aucun d'entre eux ne présente une bonne corrélation avec l'incidence de FA. Le plus satisfaisant (r = 0.65) prend en compte l'âge, les comorbidité rénale et respiratoire, l'insuffisance ventriculaire, l'urgence et la présence de valvulopathie (Tableau 20.9) [6]; cet indice purement clinique ne mentionne pas la taille de l'OG, qui est une donnée échocardiographique. Néanmoins, elle est bien corrélée à la FA postopératoire et mériterait probablement 1-2 points dans l'échelle du score [28].
Le déclenchement de la FA est lié à deux phénomènes :
- Un substrat électrophysiologique caractérisé par l’hétérogénéité de la repolarisation induisant des réentrées au sein de l’oreillette ; il est aggravé par l’inflammation et la fibrose.
- Un événement déclenchant, souvent une extrasystole supraventriculaire, des manipulations chirurgicales, une activation sympathique ou la distension aiguë de l’oreillette.
Lorsqu’elle s’installe, la FA induit un remodelage électrophysiologique de l’oreillette (réduction des canaux calciques lents) tendant à perpétuer l’arythmie, qui devient d’autant plus difficile à interrompre qu’elle dure depuis plus longtemps et que l’oreillette est plus dilatée. De plus, l’activité contractile après cardioversion est altérée en fonction de la durée de la FA ; l’oreillette perd jusqu’à 75% de sa capacité propulsive [25]. Il n'est donc nullement certain que le maintien à tout prix d'un rythme sinusal dans le postopératoire offre un avantage hémodynamique chez les malades dont les oreillettes sont dilatées et dont la contractilité auriculaire est faible. L’examen du flux mitral à l’échocardiographie permet d’évaluer l’importance de la composante auriculaire (flux A) et de décider si la contraction de l’OG propulse suffisamment de volume pour persévérer dans le maintien du rythme sinusal [31].
D'une manière générale, un contrôle de la fréquence avec un béta-bloqueur accompagné d'une anticoagulation est le traitement recommandé lorsque le patient est asymptomatique ou que l'hémodynamique est stable; un bloqueur calcique non-dihydropyridine peut également être prescrit. Un contrôle du rythme est préférable en cas d'instabilité hémodynamique: cardioversion, amiodarone; le vernakalant n'est utilisable qu'en l'absence de dysfonction ventriculaire, d'hypotension et de sténose aortique [12,27]. Une étude randomisée sur des patients en fibrillation auriculaire après chirurgie cardiaque a comparé la stratégie de contrôle du rythme (amiodarone) avec celle de contrôle de la fréquence cardiaque; elle n'a pas mis en évidence de différence en terme de complications cardiovasculaires ni de réadmission hospitalière sur un suivi de 60 jours; le taux de persistence de la FA est resté bas dans les deux groupes (13% et 16%) [13]. Chez les patients asymptomatiques, l'option du contrôle de la fréquence cardiaque et la cardioversion reportée après une période d'anticoagulation efficace sont toutes deux des stratégies raisonnables. Chez les patients symptomatiques, la cardioversion est recommandée (Figure 20.23) [21].
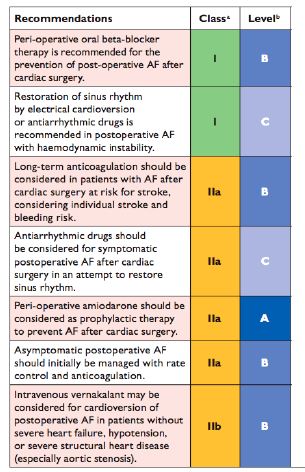
Figure 20.23 A: Recommandations pour la prise en charge de la FA postopératoire selon les Guidelines de l'European Society of Cardiology [21]. AF: fibrillation auriculaire. Class: classe des recommandations. Level: degré d'évidence.
La salle d'opération est un endroit idéal pour une cardioversion d'urgence lorsque survient une FA ou un flutter (50-150 J par voie externe, 5-10 J par voie intrapéricardique). De plus, l'ETO en place permet de confirmer rapidement l'absence de thrombus auriculaire. Si la FA récidive et si l'arythmie est mal supportée du point de vue hémodynamique, l'adjonction d'amiodarone en perfusion s'impose [31]. Le vernakalant est probablement la substance de choix pour interrompre une FA aiguë, mais l'expérience de ce médicament en chirurgie cardiaque est encore trop faible pour s'en faire une opinion.
Prophylaxie
Les béta-bloqueurs réduisent le risque de FA et la survenue de tachycardies supraventriculaires dans le postopératoire. Les médicaments les plus étudiés sont le propanolol (Indéral®) et le métoprolol (Lopresor®, Beloc®); ils réduisent de moitié l'incidence de FA (16.3% comparé à 31.7% dans le groupe contrôle) [2,9,10]. Le carvedilol (Dilatrend®) et le sotalol (Sotalex®) ont également été étudiés en association avec le magnésium et ont démontré une bonne efficacité [2,21]. Une revue des 10 derniers essais randomisés montre que les béta-bloqueurs réduisent en moyenne l'incidence de la FA de 33% (groupe contrôle) à 20% (groupe béta-bloqué) après les pontages aorto-coronariens [20]. Par contre, les anti-calciques, la procaïnamide, la digitale, la quinidine et le propafénone ne paraisse pas avoir d’effet protecteur [17,29].
L’amiodarone en dose prolongée pré- et postopératoire diminue de moitié l’incidence de FA (OR 0.5), mais l’effet sur la mortalité à long terme n’est pas prouvé [3,14,33]. Bien que l'évidence penche en faveur de son efficacité [12], son administration uniquement pendant les deux premiers jours postopératoires est insuffisante pour prévenir la FA dans la chirurgie valvulaire [4]. Alors que les β-bloqueurs sont en général bien supportés, l’impact de l’amiodarone est limité par sa toxicité (incidence 10%) : hypotension, bradycardie, insuffisance hépatique, hypothyroïdisme, aggravation de l’insuffisance ventriculaire, toxicité oculaire. D’une manière générale, la prévention de la FA ne semble pas modifier significativement le devenir des patients à long terme [10]. D’autre part, la résolution spontanée de la moitié des épisodes de FA postopératoire oblige à bien peser les risques d’une prophylaxie systématique par rapport à ceux de l’arythmie [29].
Le magnésium, dont le taux sérique est réduit après CEC, peut supprimer la sensibilité exagérée à l’effet arythmogène des catécholamines et réduire ainsi l’incidence des FA postopératoires [26]. Comme l’hypomagnésémie postopératoire dure environ 4 jours, l’apport de Mg2+ doit durer au moins 4-5 jours pour être efficace. Le traitement est facile, comporte très peu de risque et peut être remarquablement efficace (en l'absence de béta-bloqueur ou d'amiodarone): l’incidence des tachyarythmies supraventriculaires est réduite jusqu’à 10 fois selon les études (21% versus 2%) [12,26]. Dans le cas du magnésium, le bénéfice potentiel de la prophylaxie est donc largement supérieur au risque [29].
D’autres substances qui ne sont pas en elles-mêmes des anti-arythmiques peuvent influencer l’incidence de la FA en chirurgie cardiaque. L’atorvastatine débutée 7 jours avant l’intervention diminue de 61% l’incidence de FA postopératoire (35% versus 57%) [30] et réduit l’impact du syndrome inflammatoire postchirurgical [5,7]. Une méta-analyse démontre une réduction de presque moitié de l’incidence de FA (OR 0.57) chez les patients sous statines de manière continue en préopératoire [8]. Contrairement à ces données, une étude randomisée portant sur 1'922 patients n'a pas démontré que le traitement préopératoire avec la rosuvastatine soit efficace dans la prévention de la FA postopératoire (OR 1.04) [36]. Les stéroïdes (100 mg d’hydrocortisone, 500-1'000 mg de prednisolone) en dose unique préopératoire diminuent également l’importance de la réponse inflammatoire systémique et l’incidence de la FA postopératoire (baisse de 37%) [15]. Là encore toutefois, deux grands essais contrôlés multicentriques n’ont pas décelé d’effet cardiovasculaire bénéfique à l’utilisation prophylactique de stéroïdes avant la CEC [11,34].
L’anesthésie combinée avec une péridurale thoracique haute (> D6) tend à diminuer le taux de FA par sympathicolyse cardiaque centrale. Dans une étude, on a enregistré une diminution du taux de tachycardies supraventriculaires de 22% à 10% [32], mais ces résultats ne se retrouvent pas systématiquement [19]. Bien qu’elle n’élimine pas complètement le problème de la FA, la chirurgie à cœur battant (OPCAB : off-pump coronary artery bypass) en diminue l’incidence de 27% en moyenne (0% à 75% selon les études) [17]. Le préconditionnement par les halogénés (voir Chapitre 5 Préconditionnement) offre une certaine protection contre la FA lors de pontage aorto-coronarien [35].
En résumé, la prophylaxie de la FA postopératoire repose essentiellement sur les β-bloqueurs, secondairement sur les les statines, le magnésium et éventuellement l'amiodarone, substances qui sont de toute manière recommandées en pré- et post-opératoire chez tous les malades subissant une intervention de chirurgie cardiaque et n’y présentant aucune contre-indication (Figure 20.23B) [27]. Les autres substances (amiodarone, par exemple) ne sont indiquées que dans les cas à haut risque (âge > 75 ans, anamnèse de FA ou d’AVC, valvulopathie, dilatation de l'OG), car la moitié des épisodes de FA se résolvent spontanément chez les malades à bas risque.
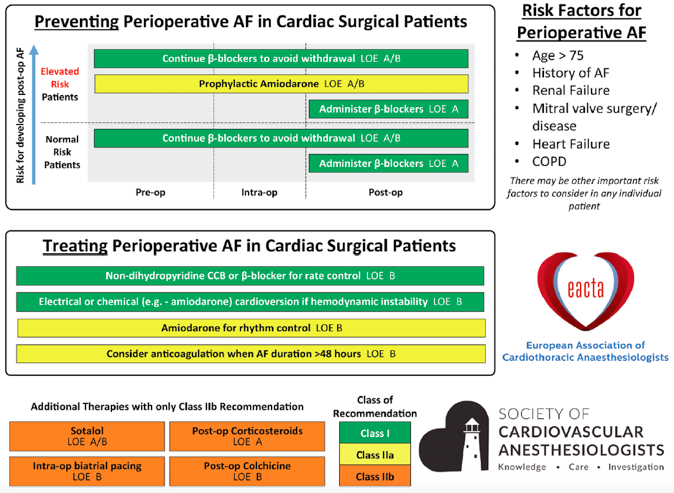
Figure 20.23 B: Recommandations pour la prise en charge de la FA. selon les recommandations conjointes de l'European Association of Cardiothoracic Anaesthesiologists et de la Society of Cardiovascular Anesthesiologists [27].

Figure 20.23 B: Recommandations pour la prise en charge de la FA. selon les recommandations conjointes de l'European Association of Cardiothoracic Anaesthesiologists et de la Society of Cardiovascular Anesthesiologists [27].
| FA postopératoire en chirurgie cardiaque |
|
Fréquence : 25% après pontages aorto-coronariens, 50% après chirurgie valvulaire. Prédominance aux 2ème – 4ème jours postopératoires. Résolution spontanée dans la moitié des cas.
Prophylaxie :
- β-bloqueurs, magnésium; ces substances sont recommandées chez tous les patients subissant une intervention de chirurgie cardiaque car
elles diminuent la mortalité opératoire
- Amiodarone dans les catégories à haut risque; âge > 75 ans, anamnèse de FA, chirurgie valvulaire, dilatation de l'OG
- Discuté : stéroïdes (?), statines (?), péridurale thoracique
Traitement aigu en salle d'opération: cardioversion, amiodarone; esmolol pour ralentir la fréquence (si FE > 0.5). Pas de digoxine.
Traitement postopératoire: 1) β-bloqueur 2) amiodarone 3) cardioversion 4) anticoagulation 5) statine, bloqueur calcique non-dihydropyridine |
© CHASSOT PG, RANCATI V, Mars 2008, dernière mise à jour, Décembre 2019
Références
- ARANKI SF, SHAW DP, ADAMS DH, et al. Predictors of atrial fibrillation after coronary artery surgery: current trends and impact on hospital resources. Circulation 1996; 94:390-7
- ARSENAULT KA, YUSUF AM, CRYSTAL E, et al. Interventions for preventing postoprative atrial fibrillation in patients undergoing heart surgery. Cochrane Database Syst Rev 2013; CD003611
- BAGSHAW SM, GALBRAITH PD, MITCHELL LB, et al. Prophylactic amiodarone for prevention of atrial fibrillation after cardiac surgery: a meta-analysis. Ann Thorac Surg 2006; 82:1927-37
- BEAULIEU Y, DENAULT AY, COUTURE P, et al. Perioperative intravenous amiodarone does not reduce the burden of atrial fibrillation in patients undergoing cardiac valvular surgery. Anesthesiology 2010; 112:128-37
- BLANCHARD L, COLLARD CD. Non-antiarrhythmic agents for prevention of postoperative atrial fibrillation: role of statins. Curr Opin Anaesthesiol 2007; 20:53-6
- CAMERON MJ, TRAN DTT, ABBOUD J, et al. Prospective external validation of three preoperative risk scores for prediction of new onset atrial fibrillation after cardiac surgery. Anesth Analg 2018; 126:33-8
- CHELLO M, PATTI G, CANDURA D, et al. Effects of atorvastatin on systemic inflammatory response after coronary bypass surgery. Crit Care Med 2006; 34:660-7
- CHEN WT, KRISHNAN GM, SOOD N, et al. Effect of statins on atrial fibrillation after cardiac surgery: a duration and dose-response meta-analysis. J Thorac Cardiovasc Surg 2010; 140:364-72
- CRYSTAL E, CONNOLLY SJ, SLEIK LK. Interventions on prevention of postoperative atrial fibrillation in patients undergoing heart surgery: A meta-analysis. Circulation 2002; 106:75-80
- CRYSTAL E, HEALEY J, CONNOLLY SJ. Atrial fibrillation after cardiac surgery: Update on the evidence on the available prophylactic interventions. Card Electrophysiol Rev 2003; 7:189-92
- DIELMAN JM, NIERICH AP, ROSSEEL PM, et al. Intraoperative high-dose dexamethasone for cardiac surgery: a randomized controlled trial. JAMA 2012; 308:1761-7
- DOBREV D, AGUILAR M, HEIJMAN J, et al. Postoperative atrial fibrillation: mechanisms, manifestions and management. Nat Rev Cardiol 2019; 16:417-36
- GILLINOV AM, BAGIELLA E, MOSKOWITZ AJ, et al. Rate control versus rhythm control for atrial fibrillation after cardiac surgery. N Engl J Med 2016; 374:1911-21
- GUARNIERI T, NOLAN S, GOTTLIEB SO, et al. Intravenous amiodarone for the prevention of atrial fibrillation after open heart surgery: the Amiodarone Reduction in Coronary Heart (ARCH) trial. J Am Coll Cardiol 1999; 34:343-7
- HALONEN J, HALONEN P, JARVINEN O, et al. Corticosteroids for the prevention of atrial fibrillation after cardiac surgery: A randomized controlled trial. JAMA 2007; 297:1562-7
- HILL LL, KATTAPURAM M, HOGUE CW. Management of atrial fibrillation after cardiac surgery – Part I: Pathophysiology and risks. J Cardiothorac Vasc Anesth 2002; 16:483-94
- HILL LL, KATTAPURAM M, HOGUE CW. Management of atrial fibrillation after cardiac surgery – Part II: Prevention and treatment. J Cardiothorac Vasc Anesth 2002; 16:626-37
- HORWICH P, BUTH KJ, LÉGARÉ JF. New onset postoperative atrial fibrillation is associated with a long-term risk for stroke and death following cardiac surgery. J Card Surg 2013; 28:8-13
- JIDEUS L, JOACHIMSSON PO, STRIDSBERG M, et al. Thoracic epidural anaesthesia does not influence the occurrence of postoperative sustained atrial fibrillation. Ann Thorac Surg 2001; 72:65-71
- KHAN MF, WENDEL CS, MOVAHED MR. Prevention of post-coronary artery bypass grafting (CABG) atrial fibrillation: efficacy of prophylactic beta-blockers in the modern era: a meta-analysis of latest randomized controlled trials. Ann Noninvasive Electrocardiol 2013; 18:58-68
- KIRCHHOF P, BENUSSI S, KOTECHA D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37:2893-962
- KOKKONEN L, MAJAHALME S, KÖÖBI T, et al. Atrial fibrillation in elderly patients after cardiac surgery: postoperative hemodynamics and low postoperative serum triiodothyronine. J Cardiothorac Vasc Anesth 2005; 19:182-7
- MAESEN NIJS J, MAESSEN J, et al. Postoperative atrial fibrillation: a maze of mechanisms. Europace 2012; 14:159-74
- McMURRY SA, HOGUE CW. Atrial fibrillation and cardiac surgery. Curr Opin Anaesthesiol 2004; 17:63-70
- MANNING WJ, SILVERMANN DI KATZ SE, et al. Impaired left atrial mechanical function after cardioversion: relation to the duration of atrial fibrillation. J Am Coll Cardiol 1994; 23:1535-40
- MILLER S, CRYSTAL E, GARFINKLE M, et al. Effects of magnesium on atrial fibrillation after cardiac surgery: A meta-analysis. Heart 2005; 91:618-23
- MUEHLSCHLEGEL JD, BURRAGE BS, NGAI JY, et al. Society of Cardiovascular Anesthesiologists / European Association of Cardiothoracic Anesthetists Practice Advisory for the management of perioperative atrial fibrillation in patients undergoing cardiac surgery. Anesth Analg 2019; 128:33-42
- OSRANEK M, FATEMA K, QADDOURA F, et al. Left atrial volume predicts the risk of atrial fibrillation after cardiac surgery: a prospective study. J Am Coll Cardiol 2006; 48:779-86
- PASSANNANTE AN. Prevention of atrial fibrilation in cardiac surgery. Curr Opin Anesthesiol 2011; 24:58-63
- PATTI G, CHELLO M, CANDURA D, et al. Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery. Circulation 2006; 114:1455-61
- PHILIP I, BERROËTA C, LEBLANC I. Perioperative challenges of atrial fibrillation. Curr Opin Anesthesiol 2014; 27:344-52
- SCOTT NB, TURFREY DJ, RAY DA, et al. A prospective randomized study of the potential benefits of thoracic epidural aesthesia and analgesia in patients undergoing coronary artery bypass grafting. Anesth Analg 2001; 93:528-35
- STAMOU SC, HILL PC, SAMPLE GA, et al. Prevention of atrial fibrillation after cardiac surgery – the significance of postoperative oral amiodarone. Chest 2001; 120:1936-41
- WHITLOCK RP, DEVEREAUX PJ, TEOH KH, et al. Methylprednisolone in patients undergoing cardiopulmonary bypass (SIRS): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 26:1243-53
- WU ZK, IIVAINEN T, PEHKONEN E, et al. Fibrillation in patients subjected to coronary artery bypass grafting. J Thorac Cardiovasc Surg 2003; 126:1477-82
- ZHENG Z, JAYARAM R, JIANG L, et al. Perioerative rosuvastatin in cardiac surgery. N Engl J Med 2016; 374:1744-53
