Le point important pour l'anesthésiste est de savoir comment gérer les antiplaquettaires en périopératoire en fonction de leurs indications, du risque thrombotique et du risque hémorragique. Depuis la première publication alertant sur les dangers de la conjonction "stent récent – antiplaquettaires – chirugie non-cardiaque" il y a 18 ans [35], l'attitude recommandée a évolué avec l'expérience clinique et les progrès technologiques. Toutefois, le problème de la thrombose coronarienne ne peut pas avoir de réponse univoque dans un contexte aussi multifactoriel que celui d'un malade ischémique au cours d'une intervention chirurgicale dont la gravité va de la simple excision cutanée à la résection hépato-pancréatique. Dans ce domaine, il n'existe aucune causalité linéaire directe, mais de nombreuses relations de probabilités dont l'expression est variable selon les circonstances. La multiplicité des situations possibles rend illusoire la formulation d'une règle générale, et toutes les directives mentionnent que la décision thérapeutique devrait être in fine le fruit d'une consultation commune entre cardiologue, chirurgien, hématologue et anesthésiste visant la meilleure solution pour chaque cas particulier [40,59]. Ce genre de conciliabule n'est évidemment pas envisageable pour chaque patient. Il est donc impératif que l'anesthésiste puisse disposer de certaines directives fondées sur la meilleure évidence du moment, doublée du principe de précaution (Figure 29.25). Tout en tenant compte des recommandations les plus récentes [40,59], ce chapitre tente de proposer une attitude qui offre la meilleure marge de sécurité pour le patient; il conserve une position très prudente face au raccourcissement des délais que permettent les nouveaux stents.
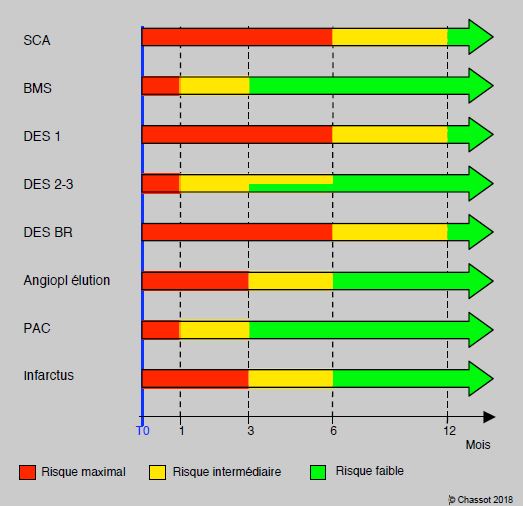
Figure 29.25: Représentation graphique des périodes à risque après un événement coronarien sur une durée de 12 mois. En rouge: période à risque maximal; aucune intervention n'est programmée pendant cette période, qui dure au minimum un mois. En jaune: période à risque intermédiaire; seules sont prévues des interventions qui modifient le pronostic vital du patient et qui peuvent se dérouler sous bithérapie continue. En vert: période à risque faible; interventions électives, possibilité d'interrompre la bithérapie. Dans la période entre 3 et 6 mois après des DES 2-3, le statut dépend du type de stent et du contexte clinique. SCA: syndrome coronarien aigu. BMS: stent métallique nu. DES 1: stent à élution de la 1ère génération. DES 2-3: stent à élution de 2ème-3ème génération. DES BR: stent à élution biorésorbable. Angiopl élution: angioplastie avec un ballon à élution. PAC: pontage aorto-coronarien.
Algorithme décisionnel
Un algorithme décisionnel pour les situations chirurgicales les plus fréquentes en fonction du traitement antiplaquettaire doit répondre à une quadruple contrainte: le risque de thrombose coronarienne, le risque d'hémorragie peropératoire, le risque du renvoi de l'intervention et le maintien d'une marge de sécurité suffisante (Figure 29.26) [8,9,21,25,29,36,36a,37,40,45,56,59,66].
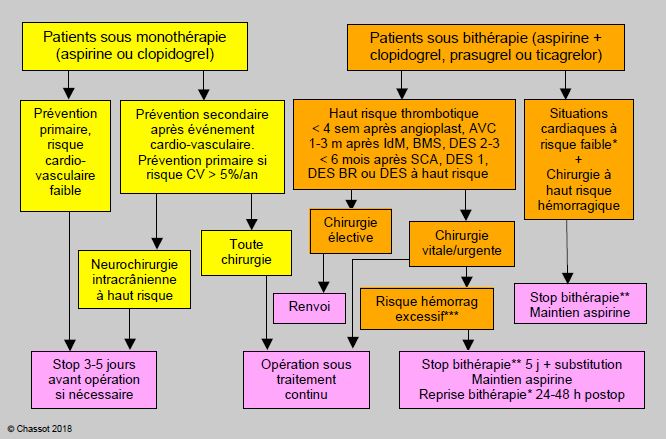
Figure 29.26 : Proposition d'algorithme de prise en charge des patients sous traitement antiplaquettaire préopératoire [modifié de: 16,17,22,36]. Angioplast: angioplastie simple. BMS : bare metal stent (stent passif). DES : drug-eluting stent (stent actif). DES 1: DES de 1ère génération. DES 2-3: 2ème-3ème génération. DES BR: biorésorbable. AVC : accident vasculaire cérébral. IdM: infarctus du myocarde. SCA: syndrome coronarien aigu. PCI: Percutaneous Coronary Intervention. CV : cardiovasculaire. Le clopidogrel seul est l’équivalent de l’aspirine seule. Dosage de l’aspirine : 50-325 mg/j. * : Exemples de situations à risque faible: > 12 mois après SCA, > 1-3 mois après stents passifs ou PCI sans stents, > 3-6 mois après DES 2ème génération, infarctus ou ictus non compliqués, > 6-12 mois après DES 1ère génération ou DES biorésorbables. ** : délais d’interruption : ticagrelor 3-5 jours, clopidogrel 5 jours, prasugrel 7 jours; maintien de l'aspirine. *** : Risque hémorragique excessif : chirurgie en espace clos (neurochirurgie intracrânienne, chirurgie du canal médullaire, chirurgie de la chambre postérieure de l'œil), présence de coagulopathie, chirurgie invasive accompagnée d’hémorragie massive et d’hémostase difficile. Dans ces situations, le rapport risque / bénéfice doit être évalué cas par cas.
Stents à haut risque: stents proximaux, malapposés, bifurqués ou en succession, situations où le vaisseau stenté dessert un vaste territoire myocardique ou est le seul vaisseau perméable, thrombose de stent précédant.
Substitution du clopidogrel/prasugrel/ticagrelor : perfusion d’eptifibatide ou de tirofiban 3-5 jours préop, stop 6 heures avant l’opération, reprise dans les 6-12 heures postopératoires; ou perfusion de cangrelor, stop 1 heure préop, reprise selon risque hémorragique. Maintien de l’aspirine en continu.
En cas d’arrêt, les antiplaquettaires doivent être repris dans les 24-48 heures après l’intervention, éventuellement avec une dose de charge pour le clopidogrel (300 mg), mais non pour le prasugrel ni le ticagrelor.
On peut aussi construire l'algorithme en fonction du degré d’urgence de la chirurgie (Figure 29.27) [65,66].
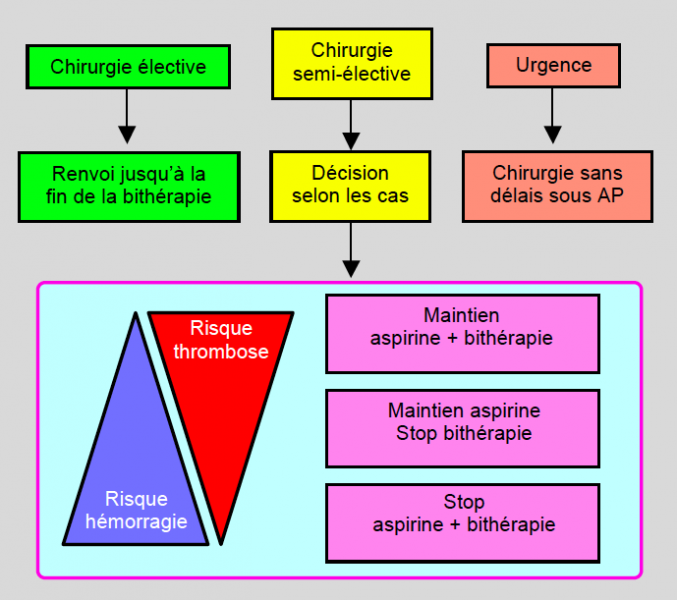
Figure 29.27 : Algorithme de prise en charge des patients sous traitement antiplaquettaire pré-opératoire en fonction du degré d’urgence de la chirurgie. Par urgence, on entend une opération devant être réalisée dans les 24-48 heures. La chirurgie semi-élective concerne tous les cas qui ne relèvent pas d’une urgence mais qui ne peuvent pas attendre la fin de la bithérapie : chirurgie oncologique, anévrysme menaçant de rompre, fracture invalidante, etc. Le maintien ou l’arrêt des antiplaquettaires (AP) est fonction du risque représenté par l’hémorragie et par la thrombose en fonction de la situation particulière de chaque cas [d’après référence 65].
L'efficacité modérée du clopidogrel et la haute thrombogénicité des DES de 1ère génération pendant les premiers mois après leur implantation ont déterminé des recommandations très restrictives pendant une dizaine d'années, parce que le risque très élevé de thrombose de stent contraignait à des délais de 6 à 12 mois pour pouvoir opérer les malades avec suffisamment de sécurité [16,17,22,36,65]. Les DES de 2ème et 3ème génération utilisés actuellement, plus rapidement endothélialisés et moins thrombogènes, et les nouveaux agents antiplaquettaires comme le ticagrelor et le prasugrel, plus puissants et plus fiables, permettent de raccourcir significativement la durée de la bithérapie et les délais pour la chirurgie [50,59]. En se fondant sur les évidences disponibles, relativement modestes, et sur les opinions d’experts, on peut formuler des recommandations qui tiennent compte de cette double situation (Figure 29.28).
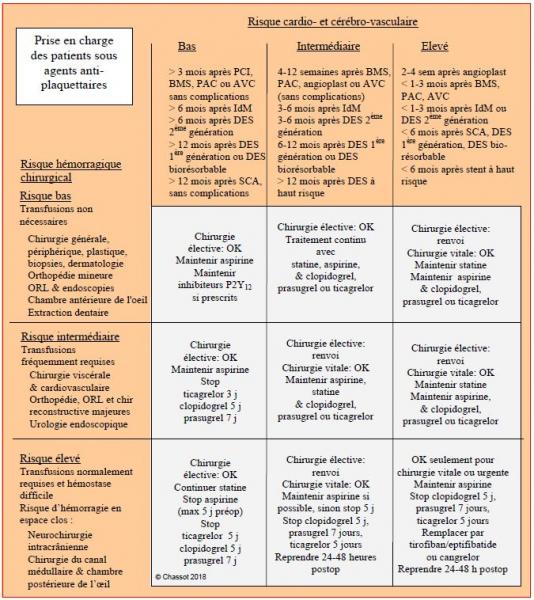
Figure 29.28 : Proposition détaillée pour la prise en charge des patients sous antiplaquettaires en chirurgie non-cardiaque [modifié de 16]. Angioplast: angioplastie simple (sans ballon à élution). BMS : stents passifs. DES : stents actifs. IdM : infarctus du myocarde. PCI : percutaneous coronary intervention. SCA : syndrome coronarien aigu. Ce libellé représente une attitude globale qui doit être affinée pour chaque spécialité chirurgicale [voir référence 50].
- Patient sous aspirine en prévention primaire simple:
- Stop aspirine 5 j avant l’intervention, si nécessaire.
- Patient sous aspirine (ou clopidogrel seul) en prévention primaire à haut risque (diabète I, risque d’accident cardiovasculaire > 7.5%/10 ans) ou en prévention secondaire après accident vasculaire cérébral (AVC), infarctus du myocarde (IdM), stent coronarien, artériopathie des membres inférieurs, pontage aorto-coronarien (PAC), syndrome coronarien aigu (SCA); bithérapie déjà interrompue depuis > 1 mois:
- Poursuivre sans interruption le traitement d’aspirine (ou de clopidogrel).
- Patients sous aspirine/dipyridamole après AVC : poursuivre les deux médicaments.
- Exception: cas à haut risque hémorragique (neurochirurgie intracrânienne, chirurgie complexe et hémostase difficile).
- Patient sous aspirine + clopidogrel/prasugrel/ticagrelor, mais risque cardio- et cérébro-vasculaire modéré (4-12 semaines après AVC, angioplastie coronaire, stent passif ou PAC, 3-6* mois après IdM sans complications ou stent actif (DES) 2ème génération, 6-12* mois après SCA, DES 1ère génération ou DES biorésorbable):
- Poursuivre le traitement d’aspirine.
- Opération à faible risque hémorragique: continuer la bithérapie en périopératoire.
- Opération à haut risque hémorragique: stop ticagrelor 3-5 jours**, clopidogrel 5 jours, prasugrel 7 jours avant l’intervention.
- Reprendre la bi-thérapie dans les 24-48 heures, si possible avec une dose de charge***: Aspegic™ 250 mg + 150 mg/j ; clopidogrel 300 mg + 75 mg/j ; prasugrel 10 mg/j ; ticagrelor 90 mg 2x/j.
- Patient sous aspirine + clopidogrel/prasugrel/ticagrelor, avec risque cardio- et cérébro-vasculaire élevé (< 4 semaines après AVC ou angioplastie simple, 4-12* semaines après IdM, stent passif, PAC ou stent actif 2ème génération, < 6 mois après SCA, stent actif 1ère génération, DES biorésorbable, ou davantage si stent à très haut risque).
- Chirurgie élective:
- Renvoi à 1 mois après angioplastie simple.
- Renvoi à 3 mois après AVC, angioplastie au ballon à élution, stent passif ou PAC.
- Renvoi à 6 mois après IdM ou stent actif 2ème génération.
- Renvoi à 12 mois après SCA, stent actif 1ère génération, DES biorésorbable ou IdM avec complications.
- Après ces délais : maintenir l’aspirine ; si clopidogrel/prasugrel/ticagrelor encore prescrits, discuter avec le cardiologue pour l’arrêt ou le maintien avant l’intervention en fonction du risque thrombotique et du risque hémorragique de la chirurgie.
- Chirurgie urgente ou vitale:
- Maintien de l'aspirine et du clopidogrel/prasugrel/ticagrelor.
- Renvoi à 1 mois après DES de 2ème-3ème génération.
- Renvoi à 3-6 mois* après SCA, DES de 1ère génération, DES biorésorbable.
- Après AVC/AIT, maintien de l’aspirine/dipyridamole, mais arrêt du clopidogrel (sauf < 1 mois après stents carotidiens).
- Substitution du clopidogrel/prasugrel/ticagrelor par tirofiban, eptifibatide ou cangrelor en cas d’intervention à risque hémorragique très élevé ou de coagulopathie (voir ci-après).
- L’héparine est inefficace comme substitution des antiplaquettaires.
- Patient avec stent (quel qu'en soit le type) ou SCA depuis < 4 semaines: aucune opération envisageable.
*: délai variable selon le risque cardiologique et selon la menace que représente la maladie qui justifie l'opération.
**: deux grandes études en chirurgie cardiaque ont démontré que l'interruption du ticagrelor pour 3 ou 5 jours ne fait pas de différence dans le risque de saignement périopératoire [30,57]. Proposition: stop ticagrelor 3 jours préopératoires avant les interventions à risque hémorragique faible ou modéré et 5 jours avant les interventions à risque hémorragiques élevé avec probabilité de transfusion plaquettaire; stop 5 jours avant une anesthésie loco-régionale rachidienne.
***: la dose de charge postopératoire est rarement praticable pour le clopidogrel à cause du risque hémorragique ; son indication devrait se fonder sur un test de réactivité plaquettaire. Elle est vivement déconseillée pour le ticagrelor et contre-indiquée pour le prasugrel.
Le maintien de l'aspirine en prévention secondaire est en fait la seule recommandation de classe I [59]. Lorsqu’elle est en cours, la bithérapie doit être maintenue inchangée dans les opérations mineures car le risque hémorragique y est faible, et dans les opérations majeures parce que le stress chirurgical et le risque d’activation plaquettaire sont élevés. La chirurgie mineure, comme la chirurgie de paroi, la dentisterie, l’ORL, la dermatologie ou l’ophtalmologie, s’accompagne de peu de réaction inflammatoire et fait courir moins de risque cardiovasculaire que la chirurgie viscérale, vasculaire ou orthopédique. L’aspirine en prévention secondaire (ou primaire chez le diabétique à risque) n’est jamais interrompue, sauf dans certaines interventions en espace clos ou à risque hémorragique excessif comme la stéréotaxie intracrânienne. Les mêmes recommandations s’appliquent au clopidogrel, au prasugrel et au ticagrelor, à l’exception des délais d’interruption (ticagrelor 3-5 jours, clopidogrel 5 jours, prasugrel : 7 jours). Toutefois, les expériences chirurgicales récentes montrent que le risque hémorragique sous prasugrel est bien plus élevé que sous clopidogrel ou ticagrelor. Ce dernier a un impact majeur lorsqu'une transfusion plaquettaire est nécessaire en cours d'intervention; ayant une liaison réversible avec les thrombocytes, le ticagrelor diffuse sur les plaquettes fraîches qui deviennent aussi peu efficaces que celles du malade. Dans la conjonction malheureuse d'une intervention hémorragique chez un patient à haut risque thrombotique, la solution la plus logique est une substitution momentanée de la bithérapie par un anti-GP IIb/IIIa ou du cangrelor (voir ci dessous), mais le degré d'évidence de cette option est modeste (degré C) [9,25,37].
Après un événement coronarien, toute chirurgie élective doit être renvoyée jusqu’à une période où le risque cardiovasculaire est le plus bas (1-5%), c'est-à-dire jusqu'à la fin de la bithérapie prévue; il est judicieux d'attendre encore 1 mois entre celle-ci et l'opération pour échapper à l'effet rebond qui survient lorsqu'on arrête le clopidogrel, le ticagrelor ou le prasugrel [43]. L'aspirine est continuée sans changement [49,51,59,64,66]. Beaucoup de pathologies ne peuvent pas souffrir de tels délais : tumeurs malignes, fractures invalidantes, anévrysmes menaçants, etc. Mais les opérer plus tôt ne signifie pas les opérer trop tôt. L’idéal est d’attendre que soit passée la phase à haut risque (taux d’accident cardiovasculaire ≥ 35%), et de procéder à l’intervention lorsque le malade est entré dans la phase à risque intermédiaire (taux d’accident CV 3-6% [39]), soit dès 4 semaines après des BMS ou des PAC, 3 mois après des DES de 2ème - 3ème génération et 6 mois après un SCA ou des DES biorésorbables ou de 1ère génération (Tableau 29.8, voir ci-dessus Figure 29.25) [54].

Les chiffres donnés pour ces délais ont forcément une part d’arbitraire. Il est capital de les relativiser en fonction d’autres déterminants du risque cardiovasculaire : présence d’un SCA au moment de la revascularisation, degré d’instabilité de la coronaropathie, masse du myocarde à risque, types de stents, facteurs de risque liés au stent lui-même (voir Tableau 29.6), comorbidités (diabète, cancer), risque hémorragique spontané, etc. Le type de chirurgie et l’importance de la réaction inflammatoire qui lui est associée ont un impact majeur. Par exemple, un acte chirurgical mineur pratiqué pendant la première année après la pose de DES n’entraîne que 0.6% de complications cardiaques [11], alors que ce taux voisine 20% lors de chirurgie majeure [60]. De ce fait, la manière dont sont gérés les antiplaquettaires en périopératoire (arrêt versus continuation) modifie peu le devenir des patients dans les collectifs qui contiennent une majorité de patients subissant des interventions mineures en ambulatoire [23,32,55], alors qu’elle a des effets considérables dans les séries constituées de patients, de stents et d’opérations à haut risque, dans lesquelles l’incidence de thrombose de stent est élevée et la mortalité des accidents cardiovasculaires dramatique [44,49,53,54].
Le risque de thrombose augmente de 2 à 3 fois dans les semaines qui suivent la fin prévue de la bithérapie à cause de l'effet rebond sur l'aggrégabilité plaquettaire lors de cette interruption, même en cas de continuation de l'aspirine [43]. La période qui suit l'arrêt du clopidogrel, du prasugrel ou du ticagrelor est un moment dangereux, même lorsque la prescription respecte les recommandations en vigueur. De ce fait, il est prudent de prévoir un délai d'au moins un mois entre la fin programmée d'une bithérapie et une intervention chirurgicale élective.
Il n’y a pas lieu de réintroduire le clopidogrel chez les malades qui l’ont déjà cessé parce que considérés comme au-delà de la période à risque. A cet effet, l’utilisation routinière de tests d’activité thrombocytaire (Multiplate™, VerifyNow™, etc) devrait permettre de mieux cibler la thérapeutique optimale en fonction du risque opératoire et du risque thrombogène [18,38,46]. Ces tests ont, par exemple, une meilleure valeur prédictive que le délai entre l’opération et la dernière prise de clopidogrel [34,47]. Un faible répondeur souffrira moins de l’interruption du clopidogrel qu’un malade qui y est très sensible, mais il peut bénéficier d’une augmentation momentanée du dosage pour pallier à l’hyperactivité plaquettaire périopératoire. D’autre part, la durée d’interruption peut être réduite car un faible répondeur saigne moins qu’un individu normal sous antiplaquettaire. Ainsi, le délai d’attente moyen avant des PAC a pu être abaissé à 2.7 jours sans augmentation du risque hémorragique chez les patients qui ont une agrégabilité résiduelle satisfaisante [41]. Cependant, tous les travaux ne sont pas aussi optimistes, et certains ne trouvent aucune relation entre le degré d'inhibition plaquettaire préopératoire et l'incidence d'accident cardiaque postopératoire chez les porteurs de stents sous bithérapie [62]. Ces discordances sont peut-être le fait du clopidogrel, car les variations individuelles sont mineures avec le prasugrel et le ticagrelor.
| Antiplaquettaires en périopératoire (chirurgie non-cardiaque) |
|
Aspirine ou clopidogrel en prévention primaire : stop 5 jours
Aspirine ou clopidogrel en prévention secondaire : pas d’interruption
Aspirine + clopidogrel/ticagrelor/prasugrel, risque cardiovasculaire bas : continuer aspirine, interrompre clopidogrel/ticagrelor 5 jours, prasugrel 7 jours
Aspirine + bithérapie, risque cardiovasculaire élevé, chirurgie élective :
- Renvoi à 3 mois après AVC, stents passifs (BMS) ou pontage aorto-coronarien (PAC)
- Renvoi à 6-12 mois après infarctus
- Renvoi à 6 mois après stents actifs (DES) de nouvelles générations
- Renvoi à 12 mois après DES de 1ère génération ou syndrome coronarien aigu (SCA)
- Continuer l’aspirine sans interruption
Aspirine + bithérapie, risque cardiovasculaire élevé, chirurgie vitale :
- Renvoi à 6 semaines après BMS ou PAC
- Renvoi à 6 mois après DES 1ère génération, à 3 mois après DES 2ème-3ème génération
- Maintenir aspirine + bithérapie
- Si arrêt du clopidogrel/prasugrel, éventuelle substitution avec eptifibatide, tirofiban, cangrelor
Risque du clopidogrel seul = risque de l'aspirine seule
Ticagrelor: arrêt 3-5 jours selon risque hémorragique
Clopidogrel: arrêt 5 jours préopératoires
Prasugrel : arrêt 7 jours préopératoires
Prasugrel et ticagrelor : vu l'augmentation du risque hémorragique dans les interventions majeures, il est préférable d’éviter une opération sous bithérapie ou de privilégier la substitution avec un anti-GPIIb/IIIa. Lorsque la bithérapie est terminée, il est prudent d'attendre au minimum un mois avant de procéder à une opération élective pour éviter la période de l'effet rebond sur l'agrégativité plaquettaire.
|
Certains malades peuvent se trouver dans la combinaison malheureuse d’un risque thrombogène élevé (stents ou SCA récents, par exemple) et d’une pathologie grave nécessitant une opération très hémorragique ne souffrant pas de longs délais (néoplasie viscérale, anévrysme en voie de rupture, fracture invalidante, par exemple). Dans ces conditions, il est nécessaire de substituer les antiplaquettaires irréversibles à longue demi-vie par des agents plus manipulables en périopératoire.
L’héparine, qui est un anti-thrombine, n’a pas d’activité antiplaquettaire. Or sur une surface étrangère ou sur une plaque instable, le thrombus démarre par une agrégation de thrombocytes ("clou plaquettaire"). D’autre part, la combinaison d’héparine et d’aspirine augmente l’agrégabilité des plaquettes ; on ne dispose d’aucune étude prouvant l’efficacité de cette combinaison comme substitut à une bithérapie [44]. Ni l’héparine non-fractionnée ni celles de bas poids moléculaire n’offrent donc une protection adéquate en remplacement d’un antiplaquettaire [19].
La seule substitution adéquate est un agent antiplaquettaire de courte durée d’action. Le tirofiban (Aggrastat®, 0.1 mcg/kg/min) et l’eptifibatide (Integrilin®, 1-2 mcg/kg/min) sont des anti-GP-IIb/IIIa avec une demi-vie de 2 heures et 2.5 heures, respectivement. Après avoir stoppé le clopidogrel 5 jours, ou le prasugrel 7 jours avant l’intervention, le tirofiban ou l’eptifibatide sont administrés en perfusion dès le 3ème ou le 5ème jour préopératoire, et sont arrêtés 4-8 heures avant l’opération [13,15,52]. Celle-ci a lieu pendant la fenêtre de récupération fonctionnelle des plaquettes, ce qui réduit le risque hémorragique. La perfusion est redémarrée dans les 6-12 heures postopératoires, et le clopidogrel, le ticagrelor ou le prasugrel prennent le relai dès que possible, en général dans les 24-48 heures. Le tirofiban et l'eptifibatide étant éliminés par voie rénale, leur dose doit être réduite de moitié lorsque la clairance de la créatinine est < 50 mL/min. L’aspirine n’est pas interrompue. Cette stratégie n’a pour l’instant fait l’objet que d’études observationnelles qui ont prouvé sa faisabilité, mais elle n’est pas une recommandation formelle (recommandation classe IIb) car le degré d'évidence clinique est faible [61]. Elle ne supprime pas le risque de thrombose de stent, qui reste de 1.3% à 3.9%, mais augmente le risque hémorragique: saignements majeurs 7.4%, chute moyenne de l'Hb 28 g/L [2,61].
Le cangrelor (Kengrexal®) intraveineux (voir Cangrelor) sera une alternative très intéressante, puisque sa demi-vie est de 9 minutes et que son activité disparaît en < 1 heure. Commencée 3-5 jours auparavant, la perfusion (0.75 mcg/kg/min) n’est interrompue que 1-2 heures avant l’opération [14,31,33]. L’étude BRIDGE a démontré que les patients sous cangrelor présentent une intense inhibition plaquettaire pendant la perfusion, mais une récupération totale de la fonction plaquettaire au moment de l’intervention ; leur risque hémorragique peropératoire n’est pas significativement différent de celui des malades sans antiplaquettaires [3]. L’elinogrel serait une possibilité plus flexible, mais les essais cliniques ont été interrompus [6,14].
Le risque thrombotique étant plus élevé en postopératoire qu'en préopératoire, il est logique de reprendre la perfusion de substitution après l'intervention jusqu'à ce que l'antiplaquettaire oral puisse être administré [24]. Cette attitude doit bien sûr être mise en balance avec le risque hémorragique.
La substitution de l’aspirine par des AINS, même si elle est logique en terme d’effets antalgique et anti-inflammatoire, est un non-sens en terme de protection cardiovasculaire : d’une part, les AINS sont des compétiteurs de l’aspirine et en diminuent les effets protecteurs ; d’autre part, ils sont eux-mêmes associés à une augmentation du risque cardiovasculaire (infarctus, AVC, tachyarythmies et décès) dans la période périopératoire (HR 1.9 – 3.7) [27].
Reprise postopératoire
Comme le syndrome inflammatoire et l’hypercoagulabilité sont maximaux dans la période postopératoire immédiate, il importe de reprendre le traitement antiplaquettaire le plus rapidement possible après l’intervention. Si la voie orale est contre-indiquée, l’aspirine peut s’administrer par voie intraveineuse (Aspégic® 250 mg) et le clopidogrel, le prasugrel ou le ticagrelor par sonde gastrique. Si ces derniers ont été interrompus pendant quelques jours, une dose de charge (300 mg) est peut-être souhaitable avec le clopidogrel pour rétablir l’effet rapidement et contrebalancer la baisse de réponse aux antiplaquettaires typique du postopératoire [48]. Mais cette manière de procéder est rarement praticable à cause du risque hémorragique. Elle est vivement déconseillée pour le prasugrel et le ticagrelor. L’indication à une dose de charge devrait se fonder sur un test de réactivité plaquettaire. Le délai pour la reprise des antiplaquettaires dépend de la balance entre le risque thrombotique et le risque hémorragique. Il est évidemment bref (< 24 heures) lorsque le danger de thrombose de stent est élevé, et prolongé (48-72 heures) lorsque l’hémostase est douteuse. Les saignements postopératoires, qui sont importants jusqu’au 5ème jour après l’intervention, dépendent davantage de la présence d’une anticoagulation héparinique prophylactique (OR 4.6) ou thérapeutique (OR 7.2) que du délai d’interruption et de reprise de la bithérapie (OR 1.6) [1]. Chez les malades à risque de thrombose artérielle cardio-cérébrale, la priorité est au traitement antiplaquettaire ; l’héparine n’est administrée que si l’hémostase chirurgicale est satisfaisante.
Dans le postopératoire, la thrombose de stent ou la rupture de plaque instable se caractérisent par l’apparition d’un infarctus de type STEMI (sus-décalage du segment ST), le plus souvent accompagnée d’un choc cardiogène. Cette pathologie réclame un traitement agressif et rapide, à savoir une angioplastie dans les 90 minutes. C’est la raison pour laquelle les cas à haut risque doivent être pris en charge dans des institutions qui ont la capacité de procéder à une PCI à n’importe quelle heure du jour et de la nuit [5]. Mais la pose de stent est problématique, car on est au pic de la réactivité plaquettaire et du syndrome inflammatoire. D’autre part, la thrombolyse est exclue à cause du risque hémorragique. Les résultats de la revascularisation coronarienne en urgence dans le postopératoire immédiat sont dramatiques, puisque le taux d’infarctus et de mortalité voisine 35% [7,10]. Ceci plaide en faveur d’un maintien des antiplaquettaires en préopératoire.
Stratégies pour prévenir la thrombose de stent
La première stratégie est de ne pas interrompre le traitement antiplaquettaire en cours, quel qu’il soit, et de le reprendre au plus vite dans le postopératoire ; ceci implique d’accepter un risque hémorragique accru au profit d’une plus grande sécurité sur le plan cardiaque. La deuxième consiste à ne pas revasculariser le malade. En effet, les patients souffrant de coronaropathie stable (angor stade I-II), même sévère, ne bénéficient pas d’une revascularisation en terme de mortalité mais seulement par l’amélioration immédiate de l’angor [63]. En chirurgie vasculaire majeure, la mortalité et la survie des patients ne sont pas modifiées par la revascularisation par rapport à un traitement médical optimal avec un contrôle strict de la fréquence cardiaque [28,42]. En cas d’opération urgente ou semi-urgente, l’intervention est moins dangereuse sous simple protection médicale (béta-bloqueurs, antiplaquettaires) que dans un délai trop court après revascularisation (< 6 à 12 semaines). Mais certains patients souffrent de syndrome coronarien instable requérant une revascularisation rapide et d’une pathologie nécessitant une intervention vitale dans de brefs délais. Dans cette dangereuse situation, quatre solutions sont possibles (Figure 29.29) [10,16,20,22,25].
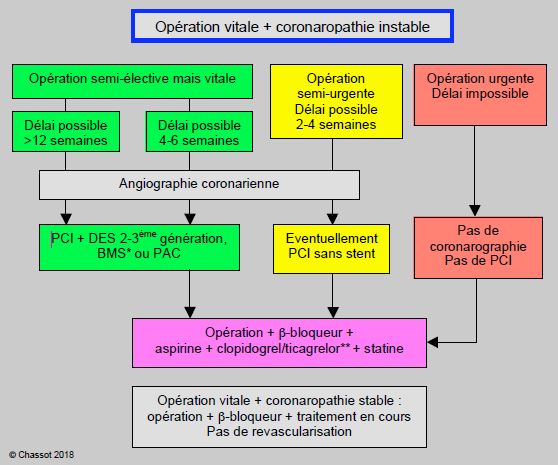
Figure 29.29 : Algorithme d'évaluation du patient souffrant de maladie coronarienne instable devant subir une intervention urgente ou vitale (exemples: anévrysme, tumeur, fracture invalidante, drainage d'abcès, obstruction ou infection digestive) [22,29]. Syndrome coronarien instable : angor instable (stade IV), angor de repos ou persistant, non-réactivité aux nitrés, modification récente de la symptomatologie angineuse, période précoce (6-12 semaines) après revascularisation. PCI : angioplastie coronarienne percutanée. BMS: stent passif. DES: stent actif. PAC: pontage aorto-coronarien chirurgical. Angioplastie: PCI + dilatation simple sans stent.
*: les nouveaux DES de type Biolimus A9 sans polymère sont compatibles avec une bithérapie de 4-6 semaines et peuvent remplacer les BMS dans ce cadre; on ne dispose pour l'instant que de données concernant les malades à haut risque hémorragique, mais non le périopératoire [20,59].
** : un anti-P2Y12 n’est pas nécessaire après des PAC sauf en cas de SCA; les PAC sont donc préférables lors d’intervention noncardiaque à haut risque hémorragique. Les médicaments de substitution (tirofiban, eptifibatide, cangrelor) en perfusion peuvent être requis en préopératoire si le risque hémorragique est élevé. Les délais s'entendent depuis la revascularisation jusqu'au jour opératoire.
- L'opération peut attendre au moins 3 mois. Les DES de nouvelles générations sont parfaitement envisageables avec 3 mois de bithérapie. Il est prudent de respecter un délai de quelques semaines entre l'arrêt de la bithérapie et l'intervention pour éviter la phase de l'effet rebond pendant laquelle le patient est hypercoagulable. L'aspirine est maintenue sans interruption.
- L’opération peut être renvoyée de 6-8 semaines. Ceci permet de procéder à une PCI avec pose de stents passifs (BMS) et à une bithérapie antiplaquettaire de 4 semaines, ou à des pontages aorto-coronariens (prescription d’aspirine mais non de bithérapie); l’opération est planifiée à > 6 semaines après la revascularisation. Cette attitude va se modifier au vu de résultats récents tendant à démontrer que les BMS ne semblent plus forcément préférables au DES dans ce contexte, car même avec une bithérapie raccourcie à 1 mois certains DES de nouvelles générations (Biolimus A9 sans polymère) offrent un avantage en terme de mortalité et de thrombose de stent par rapport aux BMS (HR 0.71) [4,26,58]. Cette attitude, adoptée dans les situations à très haut risque hémorragique, n'a pas encore été testée dans le périopératoire où la phase d'hypercoagulabilité peut poser un grave problème; elle est toutefois une potentielle solution d'avenir dans certains cas complexes, notamment pour la chirurgie intervenant entre 1 et 3 mois après la revascularisation.
- Le délai possible pour l’intervention non-cardiaque n’est que de 2-4 semaines. En cas de flux coronaire très instable, de sténose très proximale (tronc commun) ou de vaste zone de myocarde à risque, on peut envisager une angioplastie au ballon simple sans pose de stent. En effet, les données dont on dispose montrent que l’incidence de décès et d’infarctus liés à la chirurgie non-cardiaque pratiquée 2-4 semaines après angioplastie simple est la même que 3 mois plus tard [12]. Bien que de nombreux cardiologues y soient réticents à cause de l’imprévisibilité des résultats, cette attitude est une stratégie défendable pour revasculariser des patients qui doivent être opérés dans de brefs délais. La seule alternative est l’abstention de toute manoeuvre.
- Si l’opération doit avoir lieu dans les 24-72 heures, aucune revascularisation n’est souhaitable ; une coronarographie est inutile parce que ses conclusions ne modifieront pas le choix thérapeutique. Tout au plus, une échocardiographie transthoracique pourra déterminer la fonction ventriculaire et la présence d’éventuelles valvulopathies qui influenceront le choix de la technique d’anesthésie. Dans de rares cas de chirurgie vasculaire, on peut envisager une intervention combinant simultanément des PAC et la chirurgie non-cardiaque.
Dans toutes les circonstances urgentes ou semi-urgentes, il est recommandé d’opérer les malades sous traitement périopératoire continu de béta-bloqueur, aspirine, statine et clopidogrel (dose de charge 300 mg, puis 75 mg/j) ou ticagrelor (2 x 90 mg/j). Ces médicaments sont continués jusqu’à la prémédication et repris le plus tôt possible après l’intervention, pour autant que le risque hémorragique de la chirurgie le permette. Le prasugrel est déconseillé à cause de son risque hémorragique excessif au cours de la chirurgie. Dans la combinaison de patient à haut risque et d'opération hémorragique, le cangrelor en perfusion peut s'avérer une solution élégante en périopératoire vu la courte demi-vie de la substance (disparition de l'effet en 1 heure) [3]. Les stents actifs de 1ère génération ne sont pas une option dans ces circonstances, car l’intervention chirurgicale aurait lieu pendant la période de ré-endothélialisation, lorsque le risque de thombose est le plus élevé. Il est bon de se rappeler que le risque de thrombose de stent est le plus élevé pendant la phase précoce, alors que le risque hémorragique reste le même pendant toute la durée du traitement antiplaquettaire [20].
Stents et chirurgie : en guise de conclusion
Les nombreuses études analysant les résultats de la chirurgie non-cardiaque chez les porteurs de stents coronariens donnent des résultats très inhomogènes et mal comparables, parce qu’elles suivent des protocoles très différents et parce qu’elles mélangent divers types de stents et d’interventions chirurgicales. Le type de chirurgie, le risque propre des stents, la présence ou non de SCA, l’évolutivité de la maladie coronarienne et le traitement antiplaquettaire sont malheureusement très variables d’une publication à l’autre. Si bien que certaines peuvent paraître encourager un raccourcissement des délais et un assouplissement du traitement antiplaquettaire, notamment lorsque leurs collectifs contiennent une grande proportion de patients à bas risque subissant des interventions chirurgicales mineures. Néanmoins, toutes démontrent que le danger est d’autant plus grand que le délai entre la revascularisation et la chirurgie est plus court. Dans le présent document, l’idée centrale est de minimiser la prise de risque en proposant les solutions les plus sûres pour les situations les plus dangereuses, même si elles peuvent paraître excessivement prudentes dans d’autres circonstances. Le lecteur saura adapter ces recommendations lorsqu’elles peuvent être moins strictes, d’autant plus qu’elles sont essentiellement basées sur un consensus d’experts et manquent souvent de fondements objectifs solides (Classe IIa – IIb) et de fort degré d’évidence (évidence B ou C).
| Antiplaquettaires en périopératoire (chirurgie non-cardiaque) |
|
Substitution: indiquée dans la combinaison de patient à haut risque thrombotique et d'opération à haut risque hémorragique. Remplacement des antiplaquettaires oraux par des substances intraveineuses à courte demi-vie: tirofiban, eptifibatide, cangrelor. L'héparine n'est pas une substitution efficace.
Les antiplaquettaires sont repris le plus rapidement possible en fonction du risque hémorragique, dans les 24 heures postopératoires pour l'aspirine et dans les 48 heures pour la bithérapie. Les patients à risque doivent être opérés dans une institution disposant de toutes les facilités pour pratiquer une angioplastie coronarienne en urgence.
Stratégie en cas de coronaropathie instable et d'opération vitale ne souffrant pas de long délai:
- Délai possible 3 mois: DES de nouvelle génération
- Délai 6-8 semaines: PAC, BMS, DES 3ème génération
- Délai possible 2-4 semaines: angioplastie simple
- Délai < 2 semaines: pas de revascularisation
- Intervention sous bétabloqueur, statine, aspirine, clopidogrel/ticagrelor, éventuellement perfusion de cangrelor
|
© CHASSOT PG, DELABAYS A, SPAHN D Mars 2010, dernière mise à jour Novembre 2019
Références
- ALBALADEJO P, CHARBONNEAU H, SAMAMA CM, et al. Bleeding complications in patients with coronary stents during non-cardiac surgery. Thromb Res 2014; 134:268-72
- ALSHAWABKEH LI, PRASAD A, LENKOVSKY F, et al. Outcomes of a preoperative "bridging" strategy with glycoprotein IIb/IIIa inhibitors to prevent perioperative stent thrombosis in patients with drug-eluting stents who undergo surgery necessitating interruption of thienopyridine administration. EuroIntervention 2013; 9:204-11
- ANGIOLILLO DJ, FIRSTENBERG MS, PRICE MJ, et al. Bridging antiplatelet therapy with cangrelor in patients undergoing cardiac surgery. JAMA 2012; 307:265-74
- ARIOTTI S, ADAMO M, COSTA F, et al. Is bare-metal stent implantation still justifiable in high bleeding risk patients undergoing percutaneous coronary intervention ?: a pre-sèecified analysis from the ZEUX trial. JACC Cardiovasc Interv 2016; 9:426-36
- BARASH P, AKHTAR S. Coronary stents : factors contributing to perioperative major adverse cardiovascular events. Br J Anaesth 2010 ; 105 (S1) : i3-i15
- BERGER JS, ROE MT, GIBSON CM, et al. Safety and feasability of adjunctive antiplatelet therapy with intravenous elinogrel, before primary percutaneous intervention in patients with ST-elevation myocardial infarctions (ERASE MI pilot trial). Am Heart J 2009; 158:998-1004 e1
- BERGER PB, BELLOT V, BELL MR, et al. An immediate invasive strategy for the treatment of acute myocardial infarction early after noncardiac surgery. Am J Cardiol 2001; 87:1100-2
- BITTL JA, BABER U, BRADLEY SM, et al. Duration of dual antiplatelet therapy: A systematic review for the 2016 ACC/AHA Guideline focused update on duration of of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68:1116-39
- BONHOMME F, FONTANA P, RENY JL. How to manage prasugrel and ticagrelor in daily practice. Eur J Intern Med 2014; 25:213-20
- BRILAKIS ES, BANERJEE S, BERGER PB. Perioperative management of patients with coronary stents. J Am Coll Cardiol 2007; 49:2145-50
- BRILAKIS ES, COHEN DJ, KLEIMAN NS, et al. Incidence and clinical outcome of minor surgery in the year after drug-eluting stent implantation: results from the Evalvuation of Drug-Eluting Stents and Ischemic Events Registry. Am Heart J 2011; 161:360-6
- BRILAKIS ES, ORFORD JL, FASSEAS P, et al. Outcome of patients undergoing balloon angioplasty in the two months prior to noncardiac surgery. Am J Cardiol 2005, 96: 512-4
- BROAD L, LEE T. CONROY M, BOLSIN S, et al. Successful management of patients with a drug-eluting coronary stent presenting for elective, non-cardiac surgery. Br J Anaesth 2007; 98:19-22
- CATTANEO M. New P2Y12 inhibitors. Circulation 2010; 121:171-9
- CEPPA DP, WELSBY JJ, WANG TY, et al. Perioperative management of patients on clopidogrel (Plavix) undergoing major lung resection. Ann Thorac Surg 2011; 92:1971-6
- CHASSOT PG, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction. Br J Anaesth 2007; 99:316-28
- CHASSOT PG, MARCUCCI C, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy. Am Fam Physician 2010; 82:1484-9
- CHEN L, BRACEY AV, RADOVANCEVIC R, et al. Clopidogrel and bleeding in patients undergoing elective coronary artery bypass grafting. J Thorac Cardiovasc Surg 2004; 128:425-31
- COLLET JP. MONTALESCOT G, BLANCHET B, et al. Impact of prior use or recent withdrawal of oral antiplatelet agents on acute coronary syndromes. Circulation 2004; 110:2361-7
- COLOMBO A, GIANNINI F, BRIGUORI C. Should we still have bare-metal stents available in our catheterization laboratory ? J Am Coll Cardiol 2017; 70:607-19
- DARVISH-KAZEM S, GANDHI M, MARCUCCI M, DOUKETIS JD. Perioperative management of antiplatelet therapy in patients with a coronary stent who need noncardiac surgery. A systematic review of clinical practice guidelines. Chest 2013; 144:1848-56
- EBERLI D, CHASSOT PG, SULSER T et al. Urologic surgery and antiplatelet drugs after cardiac and cerebrovascular accidents. J Urol 2010; 183:2128-36
- EGHOLM G, KRISTENSEN SD, THIM T, et al. Risk associated with surgery within 12 months after coronary drug.eluting stent implantation. J Am Coll Cardiol 2016; 68:2622-32
- ESSANDOH M, DALIA AA; ALBAGHDADI M, et al. Perioperative management of dual-antiplatelet therapy in patients with new-generation drug-eluting metallic stents and bioresorbable vascular scaffolds undergoing elective noncardiac surgery. J Cardiothorac Vasc Anesth 2017; 31:1857-64
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GAROT P, MORICE C, TRESURKOSOL D, et al, for the LEADERS FREE Invsetigators. 2-year outcomes of high bleeding risk patients after polymer-free drug-coated stents. J Am Coll Cardiol 2017; 69:162-71
- GERSTEIN NS, GERSTEIN WH, CAREY MC, et al. The thrombotic and arrhythmogenic risks of perioperative NSAIDs. J Cardiothorac Vasc Anesth 2014; 28:369-78
- GODET G, RIOU B, BERTRAND M, et al. Does preoperative coronary angioplasty improve perioperative cardiac outcome ? Anesthesiology 2005; 102:739-46
- HALL R, MAZER CD. Antiplatelet drugs: A review of their pharmacology and management in the perioperative period. Anesth Analg 2011; 112:292-318
- HANSSON EC, JIDEUS L, ABERG B, et al. Coronary artery bypass grafting-related bleeding complications in patients treated with ticagrelor or clopidogrel: a nationwide study. Eur Heart J 2016; 37:189-97
- HARRINGTON RA, STONE GW, McNULTY S, et al. : Platelet inhibition with cangrelor in patients undergoing PCI. N Engl J Med 2009; 361:2318-29
- HAWN MT, GRAHAM LA; RICHMAN JS, et al. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013; 310:1462-72
- HUANG PH, CROCE KJ, BHATT DL, RESNIC FS. Recommendations for management of antiplatelet therapy in patients undergoing elective noncardiac surgery after coronary stent implantation. Crit Pathways Cardiol 2012; 11:177-85
- JAMBOR C, VON PAPE KW, SPANNAGL M, et al. Multiple Electrode whole blood Aggregometry, PFA-100, and in vivo Bleeding Time for the point-of-care assessment of aspirin-induced platelet dysfunction in the preoperative setting. Anesth Analg 2011; 113:31-9
- KALUZA GL, JOSEPH J, LEE JR, et al. Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000; 35:1288-94
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105:743-9
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- KWAK YL. KIM JC, CHOI YS, et al. Clopidogrel responsiveness regardless of the discontinuation date predicts increased blood loss and transfusion requirement after off-pump coronary artery bypass graft surgery. J Am Coll Cardiol 2010; 56:1994-2002
- LEE TH, MARCANTONIO ER, MANGIONE CM, ET AL. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LEVINE GN, BATES ER, BITTL JA, et al. 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68:1082-115
- MAHLA E, SUAREZ TA, BLIDEN KP, et al. Platelet function measurement-based strategy to reduce bleeding and waiting time in clopidogrel-treated patients undergoing coronary artery bypass graft surgery. Circ Cardiovasc Interv 2012; 5:261-9
- McFALLS EO, WARD HB, MORITZ TE, et al. Coronary artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351:2795-804
- MEHRAN R, BABER U, STEG PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary interventions. PARIS: 2 years results from a prospective observational study. Lancet 2013; 382:1714-22
- NEWSOME LT, WELLER RS, GERANCHER JC, et al. Coronary artery stents: II. Perioperative considerations and management. Anesth Analg 2008; 107:570-90
- PALAMARAS I, SEMKOVA K. Perioperative management of and recommendations for antithrombotic medications in dermatological surgery. Br J Dermatol 2015; 172:597-605
- PARK SJ, OH IY, KIM KH, et al. Minimal withdrawal of dual antiplatelet agents under the guidance of a point-of-care platelet activity assay early after drug eluting stent implantation for surgical removal of renal cell carcinoma. Int J Cardiol 2011; 149:e85-7
- RAHE-MEYER N, WINTERHALTER M, HARTMANNN J, et al. An evaluation of cyclooxygenase-1 inhibition before coronary artery surgery: Aggregometry versus patient self-reporting. Anesth Analg 2008; 107: 1791-7
- RAJAGOPALAN S, FORD I, BACHOO P, et al. Platelet activation, myocardial ischemic events and postoperative non-response to aspirin in patients undergoing major vascular surgery. J Thromb Haemost 2007; 5:2028-35
- ROSSINI R, MUSUMECI G, CAPODANNO D, et al. Perioperative management of oral antiplatelet therapy and clinical outcomes in coronary stent patients undergoing surgery. Results of a multicentre registry. Thromb Haemost 2015; 113:272-82
- ROSSINI R, MUSUMECI G, VISCONTI LO, et al. Perioperative management of antiplatelet therapy in patients with coronary stents undergoing cardiac and non-cardiac surgery: a consensus document from Italian cardiological, surgical and anaesthesiological societies. Eurointervention 2014; 10:38-46
- SAVONITTO S, CARACCIOLO M, CATTANEO M, DE SERVI S. Management of patients with recently implanted coronary stents on dual antiplatelet therapy who need to undergo major surgery. J Thromb Haemost 2011; 9:2133-42
- SAVONITTO S, D’URBANO M, CARACCIOLO M, et al. Urgent surgery in patients with a recently implanted coronary drug-eluting stent: a phase II study of “bridging” antiplatelet therapy with tirofiban during temporary withdrawal of clopidogrel. Br J Anaesth 2010; 104:285-91
- SCHOUTEN O, VON DOMBURG RT, BAX JJ, et al. Noncardiac surgery after coronary stenting: Early surgery and interruption of antiplatelet therapy are associated with an increase in major adverse cardiac events. J Am Coll Cardiol 2007; 49:122-4
- SHARMA AK, AJANI AE, HAMWI SM, et al. Major noncardiac surgery following coronary stenting: When is it safe to operate? Catheter Cardiovasc Interv 2004; 63:141-5
- SILLER-MATULA JM, PETRE A, DELLE-KARTH G, et al. Impact of preoperative use of P2Y12 receptor inhibitors on clinical outcomes in cardiac and non-cardiac surgery: A systematic review and meta-analysis. Eur Heart J Acute Cardiovasc Care 2015; 000:1-18
- SOUSA-UVA M, STOREY R, HUBER K, et al. Expert position paper on the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2014; 35:1510-4
- TOMSIC A, SCHOTBORGH MA, MANSHANDEN JSJ, et al. Coronary artery bypass grafting-related bleeding complications in patients treated with dual antiplatelet treatment. Eur J Cardio-Thorac Surg 2016; 50:849-56
- URBAN P, MEREDITH IT, ABIZAID A, et al for the LEADERS FREE Investigators. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med 2015; 373:2038-47
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Hesrt J 2018; 39:213-54
- VAN KUIJK JP, FLU WJ, SCHOUTEN O, et al. Timing of noncardiac surgery after coronary artery stenting with bare metal or drug-eluting stents. Am J Cardiol 2009; 104:1229-34
- WARSHAUER J, PATEL VG, CHRISTOPOULOS G, et al. Outcomes of preoperative bridging therapy for patients undergoing surgery after coronary stent implantation: a weighed meta-analysis of 280 patients from eight studies. Catheter Cardiovasc Interv 2015; 85:25-31
- WASOWICZ M, SYED A, WIJEYSUNDERA DN et al. Effectiveness of platelet inhibition on major adverse cardiac events in noncardiac surgery after percutaneous coronarxy intervention: a prospective cohort study. Br J Anaesth 2016; 116:493-500
- WEINTRAUB WS, SPERTUS JA, KOLM P, et al. Effect of PCI on quality of life in patients with stable coronary disease. N Engl J Med 2008; 359:677-87
- WIJEYSUNDERA DN, WIJEYSUNDERA HC, YUN L, et al. Risk of elective major noncardiac surgery after coronary stent insertion. A population-based study. Circulation 2012; 126:1355-62
- WIJNS W, KOHL P, DANCHIN N, et al. Guidelines on myocardial revascularization. The Task Force of the European Society of Cardiology and the European Association for Cardio-Thoracic Surgery. Eur Heart J 2010; 31:2501-55
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2014; 35:2541-619
