Plusieurs pathologies contribuent à la situation dans laquelle un seul ventricule assure la circulation (cœur univentriculaire), l’autre étant réduit à une chambre accessoire positionnée antérieurement en cas d'hypoplasie du VD ou postérieurement lors d'hypoplasie du VG. Fonctionnellement, cette situation se réduit à celle d'un ventricule unique (VU) (Figure 14.46).
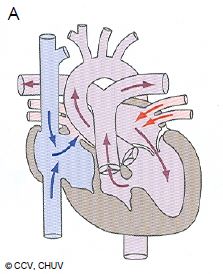
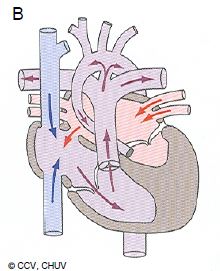
Figure 14.46 : Hypoplasie ventriculaire. A : hypoplasie du VD avec atrésie tricuspidienne ; le VD apparaît comme une chambre accessoire antérieure reliée au ventricule unique (VU) anatomiquement gauche par une CIV; il n’y a pas de communication entre l’OD et le VD, mais une CIA entre les deux oreillettes. B : hypoplasie du coeur gauche ; le VG est une petite chambre accessoire postérieure, l’aorte ascendante est hypotrophique; le VU est anatomiquement le VD, connecté à la valve tricuspide et à l’OD. L’OD reçoit le sang systémique par les veines caves, et le sang veineux pulmonaire par une CIA.
La valve AV du ventricule hypoplasique est souvent atrétique, mais l'unique ventricule fonctionnel peut recevoir le sang de deux valves auriculo-ventriculaires (double inlet ventricle). Le VU éjecte le volume systolique de sang mêlé dans l’aorte et dans l’AP, directement (double outlet ventricle) ou par le truchement d’une CIV ou d’un canal artériel. Cette physiologie particulière ne permet pas la survie pour trois raisons: la cyanose due au mélange des circulations, la surcharge de volume pour le ventricule qui doit assurer à lui seul le débit systémique et le débit pulmonaire, et l’impossibilité de maintenir un rapport Qp/Qs adéquat de manière constante [11].
Le syndrome du ventricule unique peut être divisé en trois entités.
- Atrésie tricuspidienne et hypoplasie du VD; le flux pulmonaire dépend du degré d’hypoplasie de la valve et de l’artère pulmonaire, et de la présence d’un canal artériel perméable.
- Hypoplasie du cœur gauche; quel que soit le degré d’involution des valves mitrale et aortique, le VG et l’aorte ascendante sont toujours hypoplasiques. Le flux systémique dépend du canal artériel, qui déverse dans l’aorte du sang en provenance de l’AP.
- Coexistence de plusieurs lésions (très large CIV, straddling massif) rendant une septation impossible, même s’il existe deux ventricules distincts et fonctionnels.
Le but de la chirurgie est de rétablir un rapport Qp/Qs voisin de 1:1, d’assurer un débit systémique satisfaisant, et d’établir des conditions qui permettent la baisse des RAP. Selon que le flux pulmonaire est insuffisant ou excessif, on pratique en premier lieu deux types d'intervention différentes.
- En cas d’hypoplasie du VG : un shunt systémique-pulmonaire (shunt de Blalock-Taussig ou shunt de Sano qui est un tube VU-AP) est mis en place pour augmenter le flux pulmonaire au moyen d'un greffon prothétique tubulaire; le rapport Qp/Qs dépend de la taille de ce shunt et des résistances artérielles et pulmonaires. En parallèle, l’aorte hypoplasique est également reconstruite, permettant d’augmenter le flux systémique. (1er Stade du Norwood = Procédure de Damus-Kaye-Stansel).
- En cas d’hypoplasie du VD : un rétrécissement de l’artère pulmonaire avec une bandelette de Teflon™ (banding ou FloWatch®) est effectué pour diminuer le flux pulmonaire si celui-ci n’est pas restrictif; le degré de serrage du banding est calibré en fonction de la SpO2.
Atrésie tricuspidienne et hypoplasie du VD
Dans cette cardiopathie cyanogène, la 3ème en fréquence dans la période néonatale après la tétralogie de Fallot (TdF) et la transposition des gros vaisseaux (TGV), l’OD ne communique pas avec le VD qui est hypoplasique puisque la tricuspide est imperforée. Le sang veineux central s’écoule dans l’OG par une CIA. Le cœur gauche est surchargé, car il doit propulser le volume systolique de la circulation systémique et celui de la circulation pulmonaire (Figure 14.47). Dans un tiers des cas, les gros vaisseaux sont transposés.
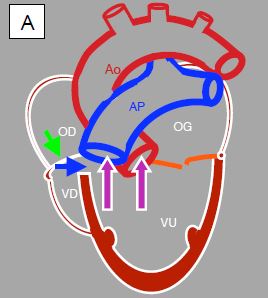
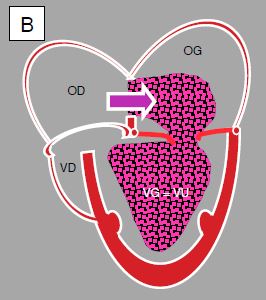
Figure 14.47 : Atrésie tricuspidienne et hypoplasie du VD. A : la valve tricuspide est une membrane fibro-musculaire (flèche verte), le VD est hypoplasique et communique avec le VG par une petite CIV (flèche bleue). Le VG est l'unique ventricule fonctionnel (VU); il reçoit le sang venant de l'OG par la valve mitrale et éjecte dans l'aorte et l'AP. B: le sang veineux passe de l'OD dans l'OG par une CIA, où il se mélange au sang artérialisé des veines pulmonaires. Ce mélange est expulsé dans l'aorte et l'AP par le ventricule unique.
Hypoplasie du coeur gauche
Cette dénomination recouvre un ensemble de pathologies qui sont plus ou moins l’inverse de la précédente : le VG est petit et non-fonctionnel, un degré variable d’hypoplasie ou une atrésie franche caractérise la valve mitrale, la valve aortique, l’aorte ascendante et la crosse; cette dernière peut même être interrompue. Les retours veineux systémique et pulmonaire se mêlent dans l’OD ; le VD alimente la circulation pulmonaire et la circulation systémique par l’intermédiaire du canal artériel (Figure 14.46B). Dès que le débit de ce dernier diminue, le flux systémique s’effondre et le bébé décède en 3-5 jours.
Figure 14.46B : Hypoplasie du coeur gauche ; le VG est une petite chambre accessoire postérieure, l’aorte ascendante est hypotrophique; le VU est anatomiquement le VD, connecté à la valve tricuspide et à l’OD. L’OD reçoit le sang systémique par les veines caves, et le sang veineux pulmonaire par une CIA.
Prise en charge physiologique du cœur univentriculaire
Le rapport des débits pulmonaire et systémique (Qp:Qs) est le point central dans la prise en charge des enfants souffrant de cœur univentriculaire. On recherche des flux aussi voisins que possible de l’équilibre (Qp:Qs = 1). Le but est de maintenir un apport systémique en O2 (DO2) satisfaisant. Comme les RAP baissent en-dessous des RAS pendant les premiers jours de vie, le circuit pulmonaire tend à "voler" le circuit systémique, surtout si l’on veut obtenir la meilleure SaO2 en hyperventilant les patients. Ceci se traduit par une hypoperfusion systémique, une hypotension artérielle, une baisse du débit coronarien et une acidose métabolique. La thérapeutique ne consiste pas à administrer un vasopresseur, mais à freiner le débit pulmonaire excessif en augmentant les RAP et en hypoventilant le malade. Une SaO2 de 75-80% est le marqueur d'un Qp:Qs équilibré, à la condition toutefois que la saturation veineuse pulmonaire (SvpO2) soit > 95% et que la saturation veineuse mélée centrale (SvO2) soit > 50% [26]. La première est mesurée par un cathéter placé chirurgicalement dans l'OG, la deuxième par une voie centrale dont l'extrémité est à la jonction VCS-OD.
Le rapport SaO2 / (SaO2 – SvO2), ou rapport Ω (oxygen excess factor), reflète l’excès d’O2 délivré par rapport à l’O2 réellement consommé. Il est l'inverse du rapport de l'extraction d'O2. Il permet de régler le rapport Qp/Qs de manière optimale chez ces bébés extrêmement délicats ; c’est le meilleur monitorage du DO2 [3,32]. Ce rapport Ω a une relation linéaire avec le DO2 pour une consommation donnée d’O2. Toute intervention qui l’augmente est bénéfique.
Actuellement, on estime que le transport d’O2 (DO2) dépend davantage des RAS et du taux d’hémoglobine que des RAP et du débit pulmonaire. D’autre part, il est plus facile de jouer sur les RAS que sur les RAP, car ces dernières sont toujours élevées chez le nouveau-né. Pour optimiser le rapport Qp:Qs, on tend donc à se concentrer principalement sur les RAS et sur la VO2 en cherchant à les abaisser [18,24]. Le DO2 est optimal lorsque le Qp/Qs est < 1, mais il baisse lorsque le Qp/Qs est > 1. La corrélation du DO2 est meilleure avec la SvO2 qu’avec la SaO2. Le métabolisme anaérobique et l'acidose systémique démarrent en général lorsque la SvO2 est < 35% [26]. Toute la réanimation consiste à adapter les résistances vasculaires, la fonction ventriculaire et le taux d’Hb de manière à assurer le meilleur transport d’O2 systémique. L'hémodynamique systémique est contrôlée en préopératoire par une perfusion de vasodilatateur (phénoxybenzamine, nitroprussiate) et une administration de béta-bloqueur (bisoprolol po) ou d'IEC (lisinopril po) [36]. En salle d'opération, l’enfant est ventilé avec une FiO2 basse (0.21-0.3) et en hypercarbie (PaCO2 45-50 mmHg) pour une SaO2 à 75-80%. Une meilleure oxygénation (SaO2 > 80%) correspondrait à un flux pulmonaire excessif et conduirait à un état de choc systémique. Un support inotrope (dobutamine, adrénaline, milrinone) est nécessaire [27].
Le ventricule fonctionnel est en surcharge de volume puisqu'il doit assurer à la fois la circulation systémique et la circulation pulmonaire; il se dilate et augmente son stress de paroi. D'autre part, la pression diastolique est basse à cause de la fuite constante de volume dans la circulation pulmonaire. Ces deux phénomènes se conjuguent pour accroître le risque d'ischémie sous-endocardique qui menace ces nourrissons dès qu'ils sont tachycardes ou hypervolémiques. A cet âge, l'ischémie aiguë entraine une fibrillation ventriculaire. Dans les cas d'hypoplasie de l'aorte, en outre, les coronaires sont perfusées de manière rétrograde par du sang en provenance du canal artériel qui doit cheminer dans une aorte ascendante mesurant parfois 1-2 mm de diamètre seulement.
Prise en charge physiologique du cœur univentriculaire
Le rapport des débits pulmonaire et systémique (Qp:Qs) est le point central dans la prise en charge des enfants souffrant de cœur univentriculaire. On recherche des flux aussi voisins que possible de l’équilibre (Qp:Qs = 1). Le but est de maintenir un apport systémique en O2 (DO2) satisfaisant. Comme les RAP baissent en-dessous des RAS pendant les premiers jours de vie, le circuit pulmonaire tend à "voler" le circuit systémique, surtout si l’on veut obtenir la meilleure SaO2 en hyperventilant les patients. Ceci se traduit par une hypoperfusion systémique, une hypotension artérielle, une baisse du débit coronarien et une acidose métabolique. La thérapeutique ne consiste pas à administrer un vasopresseur, mais à freiner le débit pulmonaire excessif en augmentant les RAP et en hypoventilant le malade. Une SaO2 de 75-80% est le marqueur d'un Qp:Qs équilibré, à la condition toutefois que la saturation veineuse pulmonaire (SvpO2) soit > 95% et que la saturation veineuse mélée centrale (SvO2) soit > 50% [26]. La première est mesurée par un cathéter placé chirurgicalement dans l'OG, la deuxième par une voie centrale dont l'extrémité est à la jonction VCS-OD.
Le rapport SaO2 / (SaO2 – SvO2), ou rapport Ω (oxygen excess factor), reflète l’excès d’O2 délivré par rapport à l’O2 réellement consommé. Il est l'inverse du rapport de l'extraction d'O2. Il permet de régler le rapport Qp/Qs de manière optimale chez ces bébés extrêmement délicats ; c’est le meilleur monitorage du DO2 [3,32]. Ce rapport Ω a une relation linéaire avec le DO2 pour une consommation donnée d’O2. Toute intervention qui l’augmente est bénéfique.
Actuellement, on estime que le transport d’O2 (DO2) dépend davantage des RAS et du taux d’hémoglobine que des RAP et du débit pulmonaire. D’autre part, il est plus facile de jouer sur les RAS que sur les RAP, car ces dernières sont toujours élevées chez le nouveau-né. Pour optimiser le rapport Qp:Qs, on tend donc à se concentrer principalement sur les RAS et sur la VO2 en cherchant à les abaisser [18,24]. Le DO2 est optimal lorsque le Qp/Qs est < 1, mais il baisse lorsque le Qp/Qs est > 1. La corrélation du DO2 est meilleure avec la SvO2 qu’avec la SaO2. Le métabolisme anaérobique et l'acidose systémique démarrent en général lorsque la SvO2 est < 35% [26]. Toute la réanimation consiste à adapter les résistances vasculaires, la fonction ventriculaire et le taux d’Hb de manière à assurer le meilleur transport d’O2 systémique. L'hémodynamique systémique est contrôlée en préopératoire par une perfusion de vasodilatateur (phénoxybenzamine, nitroprussiate) et une administration de béta-bloqueur (bisoprolol po) ou d'IEC (lisinopril po) [36]. En salle d'opération, l’enfant est ventilé avec une FiO2 basse (0.21-0.3) et en hypercarbie (PaCO2 45-50 mmHg) pour une SaO2 à 75-80%. Une meilleure oxygénation (SaO2 > 80%) correspondrait à un flux pulmonaire excessif et conduirait à un état de choc systémique. Un support inotrope (dobutamine, adrénaline, milrinone) est nécessaire [27].
Le ventricule fonctionnel est en surcharge de volume puisqu'il doit assurer à la fois la circulation systémique et la circulation pulmonaire; il se dilate et augmente son stress de paroi. D'autre part, la pression diastolique est basse à cause de la fuite constante de volume dans la circulation pulmonaire. Ces deux phénomènes se conjuguent pour accroître le risque d'ischémie sous-endocardique qui menace ces nourrissons dès qu'ils sont tachycardes ou hypervolémiques. A cet âge, l'ischémie aiguë entraine une fibrillation ventriculaire. Dans les cas d'hypoplasie de l'aorte, en outre, les coronaires sont perfusées de manière rétrograde par du sang en provenance du canal artériel qui doit cheminer dans une aorte ascendante mesurant parfois 1-2 mm de diamètre seulement.
Stratégies chirurgicales initiales
Comme le nouveau-né dépend du canal artériel (CA) pour la perfusion pulmonaire (atrésie tricuspidienne, hypoplasie du coeur droit) ou pour la perfusion systémique (hypoplasie du cœur gauche, interruption de l’arc aortique), l’administration continue de prostaglandine E1 (0.01-0.05 mcg/kg/min) dès la naissance permet de maintenir le CA ouvert jusqu’à une intervention chirurgicale en semi-urgence. Si le septum interauriculaire est intact ou si la CIA est trop restrictive, on procède à une septostomie de Rashkind à la naissance.
La première étape chirurgicale est une palliation initiale visant à assurer la survie du bébé pendant quelques mois. Selon que le flux pulmonaire est excessif ou insuffisant, on pratique en premier lieu [26]:
- Un rétrécissement de l’artère pulmonaire avec une bandelette de Teflon™ (banding) pour diminuer le flux pulmonaire si celui-ci supérieur au flux systémique. Le degré de serrage de ce cerclage est calibré en fonction de la SpO2 obtenue; la PAP est réduite au tiers de la PA systémique.
- Le cerclage pulmonaire est contre-indiqué lorsque le débit systémique dépend du flux en provenance de l'AP par le canal artériel, comme dans l'hypoplasie de l'aorte (voir Figure 14.46B); on procède alors à une opération de Damus-Kaye-Stansel (voir Figure 14.68).
- Un shunt systémique-pulmonaire (shunt de Blalock-Taussig modifié, SBTm) pour augmenter le flux pulmonaire; on relie l'artère sous-clavière à l'artère pulmonaire à droite ou à gauche selon la position de la crosse avec un greffon prothétique tubulaire de 3-4 mm de diamètre. Le rapport Qp/Qs dépend de la taille de ce shunt et des résistances artérielles et pulmonaires (Figure 14.48).
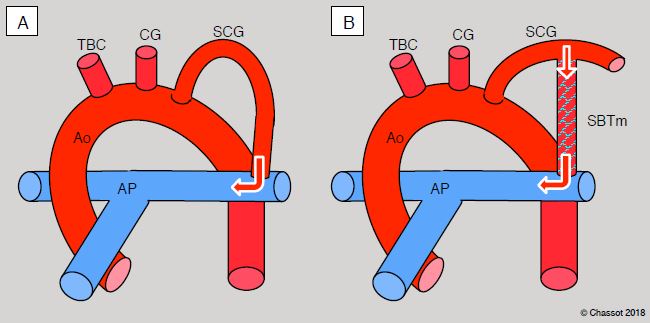
Figure 14.48: Shunt de Blalock-Taussig. A: shunt classique; l'artère sous-clavière gauche est sacrifiée et anastomosée de manière termino-latérale à la branche gauche de l'artère pulmonaire. B: shunt modifié; la connexion est réalisée au moyen d'un tube de GoreTex™ (diamètre 3-4 mm) entre la sous-clavière et l'AP droite ou gauche. Dans ce cas, le flux de la sous-clavière pour le bras est maintenu intact. CG: carotide gauche. SCG: sous-clabière gauche. TBC: tronc brachio-céphalique. SBTm. Shunt de Blalock-Taussig modifié.
Si le flux systémique est insuffisant (hypoplasie du cœur gauche et de l'aorte), on dispose de techniques de reconstruction en plusieurs étapes dont la première a lieu pendant les premiers jours ou semaines de vie.
- La procédure de Norwood stade I consiste en: septectomie interauriculaire, plastie d’élargissement de l’arc aortique, anastomose entre l’AP proximale et l’aorte, fermeture de l’AP distale et création d’un shunt de Blalock-Taussig distal (Figure 14.49A). La circulation systémique dépend du ventricule unique, mais non plus du CA qui est ligaturé; l’interruption du tronc de l’AP fait dépendre le flux pulmonaire d’un shunt distal dont le faible diamètre (3.0 mm) est le garant d’une PAP basse. L’intervention avait généralement lieu en CEC avec hypothermie profonde et arrêt circulatoire, ce qu'on ne pratique plus guère de nos jours.
- L’opération de Sano reprend la même plastie d’élargissement de l’arc aortique mais utilise un shunt entre le VD et l’AP (diamètre 5-6 mm) au lieu d’un shunt de Blalock pour assurer le débit pulmonaire (Figure 14.49B). Ses avantages sont une pression diastolique plus élevée, une absence de compétition avec le flux coronaire et un flux pulmonaire pulsatile. L’intervention présente davantage de complications immédiates mais de meilleurs résultats à 12 mois (74% sans complications) [30].
- Les procédures hybrides comme la technique de Giessen, sont des interventions extracardiaques comprenant un cathétérisme percutané et une intervention chirurgicale sans CEC (Figure 14.50) [1,36].
- Rétrécissement (banding) bilatéral de l’AP par sternotomie,
- Dilatation et stenting du canal artériel par cathétérisme,
- Septectomie interauriculaire (Rashkind) par cathétérisme.
Cette dernière intervention est plus simple que la première étape du Norwood; sa mortalité est < 1% [36].
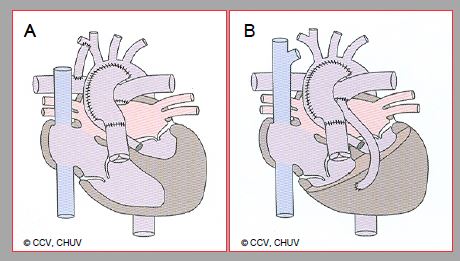
Figure 14.49 : Première étape chirurgicale en cas d'hypoplasie du cœur gauche. A : palliation selon Norwood (stade I). Elle consiste en : plastie d’élargissement de l’arc aortique, anastomose entre l’AP proximale et l’aorte, fermeture de l’AP distale, et création d’un shunt de Blalock-Taussig distal (sous-clavière droite→APD). B : Norwwod modifié selon Sano. Un conduit entre le VD et l’AP remplace le shunt de Blalock-Taussig.
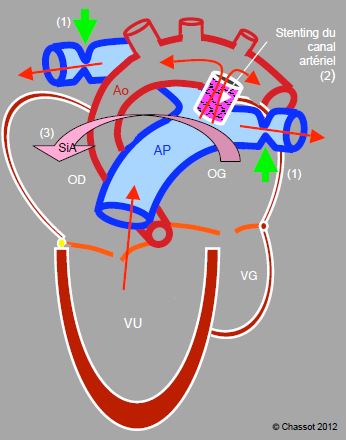
Figure 14.50 : Technique hybride (procédure de Giessen) dans une hypoplasie du cœur gauche et de l’aorte ascendante : 1) banding de les artères pulmonaires droite et gauche (flèches vertes), 2) maintien de la perméabilité du canal artériel par un sent, 3) septostomie interauriculaire (flèche SiA) pour faciliter le mélange des deux circulations. Le stenting du canal et la septostomie se font par cathétérisme percutané, alors que les deux banding sont réalisés chirurgicalement par une sternotomie médiane. Ces interventions restent extra-cardiaques et extra-péricardiques. Ainsi le ventricule unique assure le débit pulmonaire et le débit systémique via le canal artériel, mais la circulation pulmonaire est protégée de la surpression par les deux banding.
Chirurgie palliative "définitive"
Lorsque l’hypoplasie ventriculaire ne permet pas la reconstruction de deux cavités fonctionnelles, on est contraint à des interventions palliatives itératives (univentricular repair). L’unique ventricule fonctionnel est utilisé pour assurer la circulation systémique à haute pression. Le problème est alors de trouver un montage pour assurer la circulation pulmonaire à un régime de pression 5 fois plus faible. Il en existe plusieurs selon la pathologie de base; toutes visent à protéger le circuit pulmonaire et à améliorer la perfusion systémique [18,29].

Figure 14.49 : Première étape chirurgicale en cas d'hypoplasie du cœur gauche. A : palliation selon Norwood (stade I). Elle consiste en : plastie d’élargissement de l’arc aortique, anastomose entre l’AP proximale et l’aorte, fermeture de l’AP distale, et création d’un shunt de Blalock-Taussig distal (sous-clavière droite→APD). B : Norwwod modifié selon Sano. Un conduit entre le VD et l’AP remplace le shunt de Blalock-Taussig.

Figure 14.50 : Technique hybride (procédure de Giessen) dans une hypoplasie du cœur gauche et de l’aorte ascendante : 1) banding de les artères pulmonaires droite et gauche (flèches vertes), 2) maintien de la perméabilité du canal artériel par un sent, 3) septostomie interauriculaire (flèche SiA) pour faciliter le mélange des deux circulations. Le stenting du canal et la septostomie se font par cathétérisme percutané, alors que les deux banding sont réalisés chirurgicalement par une sternotomie médiane. Ces interventions restent extra-cardiaques et extra-péricardiques. Ainsi le ventricule unique assure le débit pulmonaire et le débit systémique via le canal artériel, mais la circulation pulmonaire est protégée de la surpression par les deux banding.
Chirurgie palliative "définitive"
Lorsque l’hypoplasie ventriculaire ne permet pas la reconstruction de deux cavités fonctionnelles, on est contraint à des interventions palliatives itératives (univentricular repair). L’unique ventricule fonctionnel est utilisé pour assurer la circulation systémique à haute pression. Le problème est alors de trouver un montage pour assurer la circulation pulmonaire à un régime de pression 5 fois plus faible. Il en existe plusieurs selon la pathologie de base; toutes visent à protéger le circuit pulmonaire et à améliorer la perfusion systémique [18,29].
- Lorsque le flux pulmonaire est insuffisant (Qp/Qs < 1), il s'agit d'améliorer le débit du sang veineux systémique dans l'AP. Cette reconstruction débute par une connexion entre la VCS et l'artère pulmonaire droite; c'est le shunt de Glenn (dérivation cavo-pulmonaire partielle). Cet apport est important puisque le débit de la VCS représente la moitié du retour veineux central chez le nourrisson (1/3 chez le grand enfant). Cette opération est réalisée à 3-6 mois d'âge par thoracotomie droite sans CEC ou par sternotomie en CEC. L'anastomose est réalisée entre la VCS et l'artère pulmonaire droite (APD) séparée du tronc de l'AP (shunt unidirectionnel), ou par l'abouchement latéral de la VCS près de la bifurcation pulmonaire (anastomose termino-latérale) en maintenant la continuité de l'AP (shunt bidirectionnel). La veine azygos est liée, le shunt de Blalock est interrompu et le cerclage de l'AP est défait. L'intérêt du Glenn est d'améliorer le flux pulmonaire, de baisser sa pression d'alimentation et de soulager le ventricule propulseur en diminuant sa surcharge de volume (Figure 14.51).
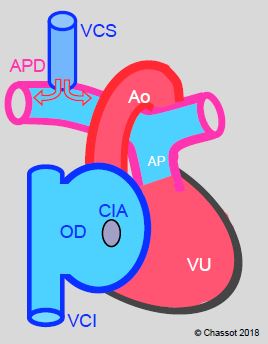
Figure 14.51 : Shunt de Glenn. Le sang de la veine cave supérieure (VCS) se draine dans l’artère pulmonaire droite (APD) par une anastomose termino-latérale (Glenn bidirectionnel). Le sang de la veine cave inférieure (VCI) continue à se drainer dans l'OD puis dans l'OG par la CIA.
- Le shunt de Glenn est complété secondairement par l’opération de Fontan (dérivation cavo-pulmonaire totale), qui consiste à dérouter la totalité du retour veineux vers l'AP en court-circuitant le VD: la VCI est reliée à l'AP droite par une prothèse tubulaire extracardiaque ou par une tunnélisation à l'intérieur de l'OD. Pour diminuer le risque de congestion veineuse, un petit orifice (4 mm) peut être réalisé entre le conduit et l'OD; le surplus de sang qui le traverse est dirigé directement vers l'OG par la CIA toujours présente. Ceci augmente la précharge du ventricule gauche systémique, mais au prix d'une désaturation artérielle (Figure 14.52) (voir ci-dessous Physiologie de Fontan). Le Fontan est pratiqué lorsque l'enfant est âgé de 2-3 ans.
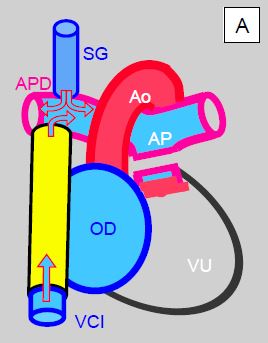
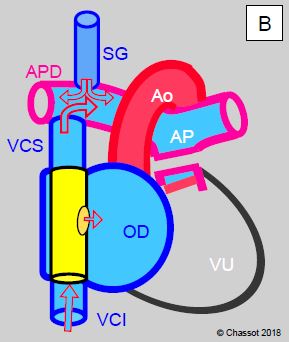
Figure 14.52 : Palliation selon Fontan après mise en place d'un shunt de Glenn (SG). A : conduit latéral extracardiaque (en jaune); le sang de la veine cave inférieure (VCI) se draine directement dans l'artère pulmonaire droite (APD). Les deux veines caves sont liées à leur entrée dans l'OD. B : tunnélisation d'un conduit (en jaune) à l'intérieur de l’OD; il relie l'entrée de la veine cave inférieure (VCI) à l'entrée de la veine cave supérieure (VCS); la partie proximale de celle-ci est anastomosée à l'APD. Cette tunnélisation est souvent fenestrée dans l’OD pour éviter une surcharge du retour veineux (soupape en cas de surpression); de l'OD le sang se draine dans l'OG par la CIA. Dans les deux cas, le tronc de l'artère pulmonaire est interrompu.
- Lorsque le flux systémique est insuffisant (Qp/Qs > 1), la reconstruction a lieu en plusieurs étapes [29].
- La première étape (procédures de Norwood I ou de Sano) a eu lieu dès la première semaine de vie (voir ci-dessus). Mais elle ne soulage pas le ventricule unique, qui doit toujours assurer le débit pulmonaire et le débit systémique.
- La deuxième étape a lieu entre 3 et 6 mois ; le shunt Ao-AP ou VD-AP est lié, et remplacé par une anastomose de Glenn bidirectionnelle entre la VCS et l’AP droite (Figure 14.51) ; le retour veineux qui dépend de la VCS court-circuite alors le VD, ce qui diminue sa surcharge de volume.
- La reconstruction est complétée 1-3 années plus tard par un Fontan complet pour assurer un débit pulmonaire compatible avec la croissance jusqu’à l’âge adulte (voir plus loin Physiologie de Fontan) (Figure 14.53).
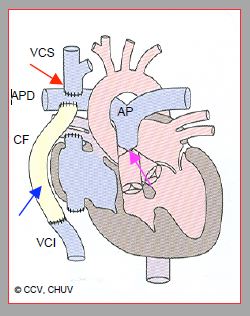
Figure 14.53 : Palliation de Fontan complète par une anastomose de Glenn (flèche rouge) entre la veine cave supérieure (VCS) et l’artère pulmonaire droite (APD) et par un conduit de Fontan (CF) extracardiaque (flèche bleue) entre la veine cave inférieure (VCI) et l’APD. Le tronc proximal de l’artère pulmonaire (AP) est ligaturé (flèche violette).
- Les procédures hybrides comme la technique de Giessen, sont complétées entre 3 et 6 mois: on reconstruit une néo-aorte, on défait les banding et on établit une connexion cavo-pulmonaire bidirectionnelle (Glenn); la mortalité opératoire est < 5%. Ce procédé permet d’éviter les effets délétères de la CEC chez le nouveau-né et de pratiquer les 2 premières étapes du Norwood en un seul temps. La survie à 10 ans est de 78% [1,12,36].
- Dans les situation trop complexes, seule une transplantation cardiaque néonatale peut assurer un avenir au bébé; elle permet de reconstruire l’arc aortique avec l’aorte du donneur (voir Transplantation cardiaque).
Dans le postopératoire de ces interventions, plusieurs complications menacent le petit enfant.
- Insuffisance ventriculaire : besoin d’un soutien inotrope (dobutamine, adrénaline, milrinone).
- Hypoxémie excessive : un flux pulmonaire insuffisant est amélioré par vasodilatation pulmonaire (NO) et vasoconstriction systémique (sans pour autant risquer une ischémie tissulaire et une acidose métabolique).
- Bas débit cardiaque : la baisse du Qs peut mimer un flux pulmonaire excessif (Qp/Qs > 1); elle se caractérise par une différentielle élargie et par une PAdiast abaissée; le maintien de la pression de perfusion par la noradrénaline est essentiel.
- Ischémie myocardique à cause de la combinaison d’une pression diastolique basse et d’une hypertrophie ventriculaire (HVG).
- Arythmies.
La survie à 1 an des ces différentes techniques oscillait entre 75% et 90% il y a 10-20 ans [4,16,43]. Elle est maintenant voisine de 95%, avec une espérance de vie à long terme (30 ans) de 85% [35].
| Hypoplasie ventriculaire |
|
Atrésie tricuspidienne et hypoplasie du VD ; l’unique ventricule fonctionnel est le VG
Hypoplasie du cœur gauche et de l’arc aortique : l’unique ventricule fonctionnel est le VD
Caractéristiques:
- Cyanose due au mélange des circulations
- Surcharge de volume pour le ventricule unique qui doit assurer le débit systémique et le débit pulmonaire
- Equilibre difficile à stabiliser, en jouant avec les RAS et les RAP afin d’obtenir un Qp/Qs adéquat (proche de 1); SpO2 recherchée: 75-80%
Stratégie chirurgicale: l’unique ventricule fonctionnel est utilisé pour assurer la circulation systémique à haute pression, un montage particulier assure la circulation pulmonaire à basse pression. Le but est d’assurer un rapport Qp/Qs normal, mais la SaO2 reste basse.
- Dérivation cavo-pulmonaire parteielle (Glenn) ou totale (Fontan)
- Reconstructions étagées de Norwood ou de Sano
- Interventions hybrides (chirurgie + cathétérisme)
La survie de l’enfant est assurée au prix d’une reconstruction non-anatomique et d’une hémodynamique non-physiologique
|
Le canal artériel de ces bébés est maintenu ouvert par une perfusion de prostaglandine qui n'est interrompue que lorsque débute la CEC car elle est nécessaire à assurer le débit systémique ou pulmonaire. Les points les plus importants pour l'anesthésiste sont les suivants [26].
- La SaO2 et la PaO2 visées sont respectivement 70-80% et 40-50 mmHg. Une meilleure oxygénation (SaO2 > 80%) correspond à un vol par l'élévation du flux pulmonaire et conduit à un état de choc systémique.
- Si le flux pulmonaire est excessif, l’enfant est ventilé avec une FiO2 basse (0.21-0.3) et en hypercarbie (PaCO2 45-50 mmHg). La PEEP (3-5 cm H2O) contribue à freiner le débit pulmonaire et prévient les atélectasies. L’addition de CO2 (2-4%) aux gaz inspirés pour contrôler la PaCO2 sans devoir hypoventiler avec un volume courant (VC) trop bas tend à augmenter également les RAS; elle est pratiquée surtout pendant la CEC [39]. Le VC peut être maintenu à 8-10 mL/kg si la fréquence respiratoire est basse (< 10 insuffl/min).
- Un support inotrope (dobutamine, adrénaline-milrinone) est nécessaire.
- La normothermie doit être strictement maintenue, car l’hypothermie abaisse la production de CO2 et déséquilibre le rapport Qp/Qs.
L’anesthésie est basée sur de hautes doses de fentanyl (50-100 mcg/kg), une sédation profonde (midazolam) pour la prévention des crises hypertensives pulmonaires (stress-free anaesthesia), et une diminution de la VO2 systémique (rocuronium). L'induction au masque avec du sevoflurane est en général mal tolérée; une induction intraveineuse est préférable. Le sommeil et la ventilation contrôlée abaissent parfois les RAP au point de comprommettre la circulation systémique.
Après l'intervention initiale, l'hémodynamique persiste sous forme d'une circulation à ventricule unique. Chez les nouveaux-nés, les RAP risquent d'être élevées après la CEC et nécessiter l'inhalation de NO pour améliorer la SaO2. Après un shunt de Blalock, la PA diastolique est basse (15-20 mmHg); ce phénomène est moins marqué après un conduit VD-AP de type Sano. La dysfonction ventriculaire et l'oedème myocardique peuvent rendre problématique la fermeture du thorax et obliger à laisser le sternum ouvert pour 24-48 heures. La mesure constante de la saturation cérébrale en O2 (ScO2) par NIRS (near infrared spectroscopy) est très utile pour apprécier l'apport effectif d'O2 aux tissus.
Anesthésie pour palliations secondaires
Par rapport à la situation précédente, l'enfant est plus grand (> 3 mois), son débit pulmonaire mieux contrôlé (Qp:Qs 1.0-1.5:1) et son risque d'hypoperfusion systémique très réduit. L'induction au masque (sevoflurane) est possible, mais l'induction intraveineuse reste plus stable (fentanyl ou sufentanil, étomidate). Le maintien est assuré par du sevoflurane et du fentanyl, plus rarement par une perfusion de propofol ou de midazolam [6]. Ayant souvent été opérés plusieurs fois sous de hautes doses de fentanyl, de sufentanil et de midazolam, les enfants risquent d'y être accoutumés et de réclamer des dosages importants. Pour la construction d'une anastomose de Glenn, la prise en charge est concentrée sur plusieurs points [15,26].
Après l'intervention initiale, l'hémodynamique persiste sous forme d'une circulation à ventricule unique. Chez les nouveaux-nés, les RAP risquent d'être élevées après la CEC et nécessiter l'inhalation de NO pour améliorer la SaO2. Après un shunt de Blalock, la PA diastolique est basse (15-20 mmHg); ce phénomène est moins marqué après un conduit VD-AP de type Sano. La dysfonction ventriculaire et l'oedème myocardique peuvent rendre problématique la fermeture du thorax et obliger à laisser le sternum ouvert pour 24-48 heures. La mesure constante de la saturation cérébrale en O2 (ScO2) par NIRS (near infrared spectroscopy) est très utile pour apprécier l'apport effectif d'O2 aux tissus.
Anesthésie pour palliations secondaires
Par rapport à la situation précédente, l'enfant est plus grand (> 3 mois), son débit pulmonaire mieux contrôlé (Qp:Qs 1.0-1.5:1) et son risque d'hypoperfusion systémique très réduit. L'induction au masque (sevoflurane) est possible, mais l'induction intraveineuse reste plus stable (fentanyl ou sufentanil, étomidate). Le maintien est assuré par du sevoflurane et du fentanyl, plus rarement par une perfusion de propofol ou de midazolam [6]. Ayant souvent été opérés plusieurs fois sous de hautes doses de fentanyl, de sufentanil et de midazolam, les enfants risquent d'y être accoutumés et de réclamer des dosages importants. Pour la construction d'une anastomose de Glenn, la prise en charge est concentrée sur plusieurs points [15,26].
- Maintien de la normothermie.
- Bonne analgésie et curarisation (baisse de la VO2).
- Ventilation protectrice en maintenant la pression moyenne endothoracique la plus faible possible (VC 8-10 mL/kg, fréquence 10-15 insuffl/min, rapport I:E de 1:3 à 1:4).
- L'hyperventilation et l'hypocapnie sont bénéfiques pour baisser les RAP, mais elles diminuent le flux sanguin cérébral; or le débit veineux jugulaire représente la majorité du flux de la VCS chez le petit enfant. De ce fait le débit de sang du Glenn vers l'AP diminue et le flux pulmonaire total est abaissé. La normocapnie est donc préférable [25].
- La PVC mesure la PAPmoy (12-18 mmHg); avec un cathéter placé chirurgicalement dans l'OG, on peut mesurer le gradient transpulmonaire (environ 10 mmHg).
- La SaO2 est 75-80% et le Qp:Qs inférieur à 1 (0.5-0.7:1).
- La cause la plus probable d'une hypoxémie est un bas débit cardiaque; la survie est meilleure si la SvO2 est > 30% [17].
- Stimulation inotrope (dobutamine, adrénaline – milrinone).
- Vasodilatation systémique (RAS abaissées mais sans excès), pression de perfusion assurée (noradrénaline).
- Suivi des lactates ; la survie est compromise si leur augmentation est ≥ 0.75 mmol/L par heure [5].
- Non-fermeture du sternum dans 50% des cas.
- La position assise de l’enfant améliore le retour veineux vers le poumon.
| Cœur univentriculaire |
|
Maintenir le rapport Qp/Qs le plus voisin de 1 (Qp = Qs), sans rechercher la meilleure SaO2 possible.
Maintenir prioritairement le transport d’O2 systémique.
Diminuer le flux pulmonaire excessif par hypoventilation et FiO2 0.21 (SaO2 75-80%) et augmenter le flux systémique en abaissant les RAS.
Augmenter le rapport Ω: SaO2 / (SaO2 – SvO2) (Ω > 2.5)
Soutien inotrope (adrénaline – milrinone), anesthésie profonde et curarisation (baisse de VO2)
|
Physiologie de Fontan
Il existe plusieurs types de palliation selon Fontan, qui consistent toutes à court-circuiter la valve tricuspide et le VD en déroutant le sang veineux directement dans l'artère pulmonaire; le ventricule unique fonctionne alors comme ventricule systémique. On obtient ainsi deux circulations en série (voir ci-dessus Figures 14.52 et 14.53) [33].
- Un ventricule unique qui pompe le sang oxygéné dans la circulation systémique. Ce VU ne souffre pas de surcharge de volume (le débit cardiaque est normal-bas), mais il doit fournir l'énergie cinétique pour un trajet plus long que le circuit systémique; sa postcharge est donc plus élevée (Figure 14.54). Cependant, il ne peut pas augmenter son débit à l'effort, d'autant moins que la structure d'un ventricule unique est anormale.
- Un système veineux central qui alimente la circulation pulmonaire sans l’aide d’une pompe (flux non-pulsatile) et qui doit se maintenir à une PVC élevée. Cette hypertension veineuse crée une stase systémique et donne une symptomatologie d'insuffisance cardiaque même lorsque la fonction systolique du VU est conservée.
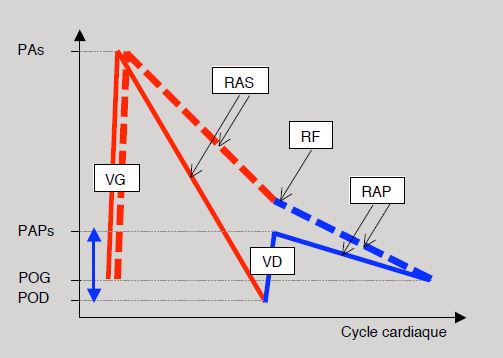
Figure 14.54: Représentation schématique de l'énergie hydraulique fournie par le ventricule unique dans la circulation de Fontan et représentée ici par la pression intravasculaire. Normalement (courbes pleines), le VG élève la pression depuis celle de l'OG (POG) jusqu'au pic artériel systolique (PAs). La pression redescend selon les résistances artérielles systémiques (RAS) au niveau de la pression de l'oreillette droite (POD). De là, le VD la remonte au niveau de la pression artérielle pulmonaire systolique (PAPs) d'où elle redescend selon les résistances artérielles pulmonaires (RAP) à la valeur de la pression auriculaire gauche. Dans la circulation de Fontan (courbe traitillée), l'énergie fournie par le VD (double fléche bleue) n'existe plus; elle est à la charge du VG qui doit propulser le sang au-delà du circuit veineux systémique dans la circulation pulmonaire. RF: résistance dans le conduit de Fontan. En rouge: circulation gauche. En bleu: circulation droite [26].
Comme la VCS draine la moitié du retour veineux systémique chez le petit enfant, le shunt de Glenn augmente de moitié le débit pulmonaire (Qp/Qs : 0.5). Mais avec la croissance, cette proportion diminue, et le l'apport au débit pulmonaire devient insuffisant. Vers 3 ans, il faut alors compléter l'intervention par détournement de la totalité du retour veineux vers l'AP. Depuis sa description originale en 1971 par F. Fontan et E. Baudet, la procédure de Fontan a subi plusieurs modifications: anastomose directe de l'OD à l'AP (abandonnée), tunnel latéral reliant la VCI à l'AP via la racine de la VCS, tunnélisation entre la VCI et VCS au sein de l'OG et anastomose de la VCS à l'APD, ou conduit externe prothétique de la VCI à l'AP (voir ci-dessus Figures 14.52 et 14.53) [2,21,25].
- Le tunnel latéral est constitué par un patch à l'intérieur de l’OD créant un conduit cylindrique entre la racine de la VCI et celle de la VCS, elle-même connectée à l’AP. Ce système VCI → conduit → VCS → AP a l’avantage de grandir avec l’enfant.
- Le conduit externe direct VCI → AP offre la meilleure hémodynamique et maintient la POD la plus basse, car celle-ci devient une simple extension de l’oreillette gauche par la CIA.
- Une fénestration (environ 4 mm de diamère) du conduit de Fontan dans l'oreillette permet de limiter le risque de surpression dans le circuit veineux central et de maintenir la précharge du ventricule systémique en cas d’augmentation des RAP et de baisse du débit pulmonaire, mais au prix d'une certaine désaturation artérielle (85-90%) [8]. Cette fénestration peut être réalisée dans un deuxième temps par voie percutanée ou être occluse par cathétérisme.
- L’anastomose OD-AP aboutit à une dilatation massive de l’OD, ce qui augmente le risque d'arythmie et de thrombose; elle n’est plus pratiquée.
- Seul le sinus coronaire et l’éventuel flux d’une fénestration arrivent encore dans l’OD; après un Fontan, le Qp/Qs est 0.9 - 1.0.
L’intervention se pratique dès l’âge de 18-24 mois. mais de préférence entre 2 et 4 ans [33]. La mortalité opératoire du Fontan est actuellement < 5% (idéalement 1%); la survie à 10 ans et 30 ans est respectivement de 90-95% et 60-85% [9,19,31,35,40]. La survie est meilleure en cas d'hypoplasie du VD, parce que dans ce cas le ventricule unique systémique est un ventricule anatomiquement gauche.
L'hémodynamique de la circulation de Fontan est caractérisée par un flux pulmonaire entièrement passif, dont le débit n’est assuré que par la pression veineuse centrale ; celle-ci doit donc rester élevée (≥ 15 mmHg). Certaines conditions sont requises pour le fonctionnement d’un Fontan [13].
- Un lit pulmonaire adéquat;
- Des résistances vasculaires pulmonaires (RAP) basses (< 3 unités Wood/m2);
- Une POG basse (≤ 8 mmHg);
- Une valve atrio-ventriculaire compétente;
- Un rythme sinusal;
- Un ventricule systémique ayant une bonne fonction systolique et diastolique (PtdVG < 12 mmHg).
Il faut un gradient transpulmonaire minimal de 6-8 mmHg pour assurer le flux entre l'OD et l'OG [7]. Toute augmentation des RAP (hypoxie, atélectasies, pneumonie), de la pression intrathoracique (Valsalva, IPPV) ou de la POG (défaillance gauche, insuffisance de la valve atrio-ventriculaire, rythme non-sinusal) diminue dramatiquement le débit pulmonaire et, de ce fait, la précharge du ventricule systémique. L’enfant devient cyanosé, hypotendu et acidotique. Les contre-indications à l'intervention de Fontan sont des RAP > 4 UI Wood, une hypoplasie pulmonaire, une FE du ventricule < 0.35, et une dysfonction diastolique (PtdVG > 20 mmHg).
Dans un conduit de Fontan, la vélocité du flux est de l'ordre de 0.2 – 0.5 m/s, comme dans les grandes veines centrales. En l’absence de pompe ventriculaire, le flux y est dépulsé. Il oscille au cours du cycle cardiaque avec une composante systolique et une composante diastolique. La perte de la pulsatilité diminue la production de NO, car celle-ci est liée au stress cyclique de la paroi vasculaire pulmonaire; ce phénomène contribue malheureusement à une augmentation des RAP [23]. Une vélocité élevée (> 1.5 m/s) signe une sténose, et la perte d'oscillation une obstruction [10]. Le débit pulmonaire moyen est en grande partie assuré par l'augmentation de flux qui a lieu à chaque inspirium grâce à l’effet aspiratif de la pression endothoracique sub-atmosphérique. En IPPV, par contre, le flux est diminué, voir interrompu, avec chaque inspirium du respirateur (Figure 14.55). L’idéal est donc de maintenir ces enfants en ventilation spontanée.
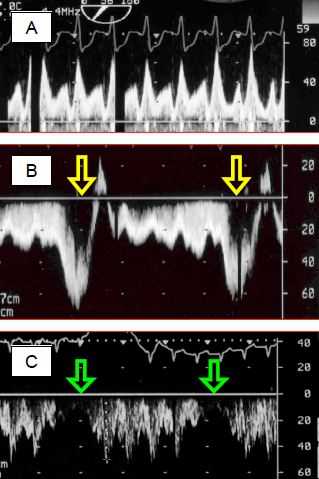
Figure 14.55 : Enregistrement Doppler spectral du flux dans un circuit de Fontan. A: flux pulmonaire dans une circulation de Fontan ; le flux est de type veineux central et non artériel, avec une composante systolique et une composante diastolique clairement séparées. La Vmax est normale pour une veine centrale (< 0.8 m/s). B: en respiration spontanée, le flux subit une accélération considérable pendant l'inspirium, lorsque la pression intrathoracique s'abaisse en dessous de la pression atmosphérique. C’est une aide précieuse au débit pulmonaire. C: en IPPV, le flux est au contraire interrompu pendant chaque inspirium en pression positive du ventilateur. En B et C, le flux est enregistré par voie transgastrique, raison pour laquelle le flux est en dessous de la ligne de base (il s'éloigne du capteur en allant de la VCI vers l'AP).
La circulation de Fontan élimine le mélange des sangs veineux et artérialisé. La saturation artérielle est normalement de 90 - 95% à l'air ambiant; une saturation inférieure à 90% signe un débit pulmonaire insuffisant. Elle élimine également la surcharge de volume pour le ventricule unique, puisqu’on reconstruit deux circulations en série, mais, en l’absence de ventricule pulmonaire, le ventricule unique doit fournir l’énergie nécessaire à maintenir une pression veineuse suffisante.
Malgré ses succès, le système de Fontan n’assure pas une survie normale à long terme: 47% des patients subissent des complications dans les 15 ans [35]. Sa défaillance se manifeste par une dyspnée, une cyanose, une rétention liquidienne, des palpitations et des syncopes. Les causes sont multiples [8,29,33,34].
Dans un conduit de Fontan, la vélocité du flux est de l'ordre de 0.2 – 0.5 m/s, comme dans les grandes veines centrales. En l’absence de pompe ventriculaire, le flux y est dépulsé. Il oscille au cours du cycle cardiaque avec une composante systolique et une composante diastolique. La perte de la pulsatilité diminue la production de NO, car celle-ci est liée au stress cyclique de la paroi vasculaire pulmonaire; ce phénomène contribue malheureusement à une augmentation des RAP [23]. Une vélocité élevée (> 1.5 m/s) signe une sténose, et la perte d'oscillation une obstruction [10]. Le débit pulmonaire moyen est en grande partie assuré par l'augmentation de flux qui a lieu à chaque inspirium grâce à l’effet aspiratif de la pression endothoracique sub-atmosphérique. En IPPV, par contre, le flux est diminué, voir interrompu, avec chaque inspirium du respirateur (Figure 14.55). L’idéal est donc de maintenir ces enfants en ventilation spontanée.

Figure 14.55 : Enregistrement Doppler spectral du flux dans un circuit de Fontan. A: flux pulmonaire dans une circulation de Fontan ; le flux est de type veineux central et non artériel, avec une composante systolique et une composante diastolique clairement séparées. La Vmax est normale pour une veine centrale (< 0.8 m/s). B: en respiration spontanée, le flux subit une accélération considérable pendant l'inspirium, lorsque la pression intrathoracique s'abaisse en dessous de la pression atmosphérique. C’est une aide précieuse au débit pulmonaire. C: en IPPV, le flux est au contraire interrompu pendant chaque inspirium en pression positive du ventilateur. En B et C, le flux est enregistré par voie transgastrique, raison pour laquelle le flux est en dessous de la ligne de base (il s'éloigne du capteur en allant de la VCI vers l'AP).
La circulation de Fontan élimine le mélange des sangs veineux et artérialisé. La saturation artérielle est normalement de 90 - 95% à l'air ambiant; une saturation inférieure à 90% signe un débit pulmonaire insuffisant. Elle élimine également la surcharge de volume pour le ventricule unique, puisqu’on reconstruit deux circulations en série, mais, en l’absence de ventricule pulmonaire, le ventricule unique doit fournir l’énergie nécessaire à maintenir une pression veineuse suffisante.
Malgré ses succès, le système de Fontan n’assure pas une survie normale à long terme: 47% des patients subissent des complications dans les 15 ans [35]. Sa défaillance se manifeste par une dyspnée, une cyanose, une rétention liquidienne, des palpitations et des syncopes. Les causes sont multiples [8,29,33,34].
- Les tachy-arythmies susjonctionnelles sont fréquentes (10% à 10 ans et 45% à 25 ans) et mal supportées car elles augmentent la pression d’aval du circuit pulmonaire. Elles sont fréquemment associées à la dilatation auriculaire. L'incidence des tachycardies ventriculaires est de 2-12% [22,33,38].
- Comme la saturation normale à l’air ambiant n’est que 90-95%, la moindre diminution du débit pulmonaire ou la moindre augmentation de la demande d'O2 provoque une hypoxémie (SaO2 < 90%). Cette cyanose induit une polycythémie.
- Le ventricule unique doit assurer la circulation systémique et fournir l’énergie nécessaire à maintenir une pression veineuse centrale suffisante pour la circulation pulmonaire. Lorsque sa fonction diminue, sa pression diastolique augmente, ce qui élève la pression d’aval du lit pulmonaire et freine immédiatement le débit pulmonaire. Une insuffisance ventriculaire est manifeste dans 50% des cas au-delà de 20 ans [28]. Comme la réserve de précharge est faible, le débit augmente essentiellement par la tachycardie. La défaillance ventriculaire est plus précoce et plus fréquente lorsque le ventricule unique est de morphologie droite.
- Comme la PVC doit rester élevée pour assurer le débit pulmonaire, la stase veineuse systémique est fréquente; 28% des enfants présentent une rétention liquidienne, une hépatomégalie, de l'ascite et une entéropathie exsudative [9]. Ces effets secondaires, qui peuvent être limités par une fénestration du conduit de Fontan, sont associés à des pertes protéiques et à une dysfonction hépatique à long terme, pouvant conduire à une cirrhose d’origine cardiaque; ils se soldent par une hypoprotéinémie et des modifications importantes dans la synthèse des facteurs de coagulation, conduisant à un risque hémorragique significatif [41]. A long terme, le taux de thrombo-embolie est en moyenne de 25% et celui de dysfonction rénale de 50% [42].
- La survenue d'une insuffisance de la valve auriculo-ventriculaire, plus fréquente lorsque celle-ci est une valve tricuspide, compromet gravement la circulation de Fontan car elle provoque une surcharge de volume pour le ventricule et une augmentation de la pression d'aval pour la circulation pulmonaire.
- La dépulsation du flux pulmonaire tend à remodeler les vaisseaux et à augmenter les RAP; les inhibiteurs des phosphodiestérases-5 (sildénafil, tadalafil) et les antagonistes de l'endothéline (bosentan, ambrisentan) améliore la capacité à l'effort des patients [14]. Il est capital de maintenir ces médications en périopératoire.
Lorsque survient la défaillance circulatoire irréversible, la seule thérapeutique envisageable est la greffe cardiaque. L'assistance circulatoire mécanique n'est pas performante parce qu'aucun dispositif actuel n'assure un débit satisfaisant dans un système à basse pression cavo-pulmonaire [33]. La survie à 1 an après transplantation est de 75-85% chez les enfants [37].
Anesthésie pour une intervention de Fontan
Avant l'intervention, la SaO2 est de 75-80%. L'induction au masque est difficile parce que la toux ou le Valsalva bloquent la circulation pulmonaire; elle est ralentie parce que le Qp:Qs est de 0.5-0.7. L'induction itraveineuse est préférable (fentanyl ou sufentanil, midazolam). Après la CEC, la pression intrathoracique moyenne doit rester minimale (volume courant 10 mL/kg, fréquence 10-15 respir/min, rapport I:E 1:3-4). La PVC évalue la PAPm (15-18 mmHg). Un cathéter placé chirurgicalement dans l'OG peut mesurer la POG et le gradient transpulmonaire (environ 10 mmHg). L'hémodynamique du Fontan est excessivement sensible à l'hypovolémie, notamment à la baisse du retour veineux central opéré par des agents comme le propofol [26].
Anesthésie pour une intervention de Fontan
Avant l'intervention, la SaO2 est de 75-80%. L'induction au masque est difficile parce que la toux ou le Valsalva bloquent la circulation pulmonaire; elle est ralentie parce que le Qp:Qs est de 0.5-0.7. L'induction itraveineuse est préférable (fentanyl ou sufentanil, midazolam). Après la CEC, la pression intrathoracique moyenne doit rester minimale (volume courant 10 mL/kg, fréquence 10-15 respir/min, rapport I:E 1:3-4). La PVC évalue la PAPm (15-18 mmHg). Un cathéter placé chirurgicalement dans l'OG peut mesurer la POG et le gradient transpulmonaire (environ 10 mmHg). L'hémodynamique du Fontan est excessivement sensible à l'hypovolémie, notamment à la baisse du retour veineux central opéré par des agents comme le propofol [26].
Anesthésie en présence d'une circulation de Fontan
La conduite de l’anesthésie vise à favoriser le flux pulmonaire, qui est passif, et à maintenir la fonction du ventricule systémique [8,20,22]. La baisse du débit cardiaque est due essentiellement à une chute de précharge (hypovolémie), à une élévation des RAP, à une dysfonction ventriculaire ou à des arythmies [44].
- Les RAP doivent rester basses pour maintenir le débit à travers les poumons; il faut donc éviter l'acidose, l'hypoxémie et l'hypercapnie. Il est impératif de maintenir une hypocarbie (PaCO2 35 mmHg, pH 7.45) par légère hyperventilation. La FiO2 est réglée à 0.5-0.8. Le bicarbonate ou le TRIS peuvent être nécessaires pour ramener le pH à la normalité.
- Les RAP peuvent être abaissées par hyperventilation hypobarique, par inhalation de NO (10-30 ppm), par des prostaglandines (inhalées ou intraveineuses) , du sildénafil (iv) ou du magnésium (iv), et par un inodilatateur comme la milrinone.
- L'inspirium en respiration spontanée assure un appel de sang qui augmente le débit pulmonaire. La ventilation contrôlée, au contraire, diminue ou interrompt le débit pulmonaire à chaque inspirium du respirateur (voir Figure 14.55). Il s'agit donc de laisser autant que possible ces patients en spontanée, à la condition qu'ils n'hypoventilent pas. Si l’IPPV est requise, la pression de ventilation moyenne doit être la plus faible possible. La meilleure technique de ventilation est celle qui évite l'hypoxie, l'hypercarbie et les atélectasies, et maintient la pression intrathoracique moyenne la plus basse possible (hyperventilation hypobarique, rapport I:E 1:3-4, pas de PEEP). L'ETO permet de surveiller l'adéquation du flux dans le circuit de Fontan.
- L’utilisation généreuse du NO limite les risques d’augmentation des RAP et de baisse du débit pulmonaire.
- L'hypovolémie est extrêmement mal tolérée, car la baisse de précharge diminue instantanément le débit pulmonaire (baisse de la PVC). Seule la tachycardie permet d'augmenter le débit cardiaque. L'induction doit s'accompagner d'un remplissage liquidien.
- Vu l'impossibilité d'augmenter le débit pulmonaire en cas d'anémie, le seuil de transfusion est élevé (Hb ≥ 100 g/L).
- La fonction ventriculaire est en général limitée, et demande le plus souvent une stimulation inotrope; la combinaison la plus efficace est une association de milrinone et d'adrénaline. Toute diminution de la fonction ventriculaire systémique augmente la pression dans l’OG et diminue le gradient transpulmonaire, donc le débit pulmonaire. Les agents d'anesthésie doivent être choisis en fonction de cette faible performance ventriculaire.
- La voie veineuse centrale (PVC) mesure en réalité la pression motrice de l'artère pulmonaire (PAP). Le monitorage de cette dernière est très utile, mais le risque de thrombose est élevé; le cathétérisme des veines jugulaires internes ou sous-clavières est vivement déconseillé chez les enfants porteurs d’un Glenn. Une technique moins dangereuse est de mesurer la pression veineuse en jugulaire externe (cathéter court type Venflon™) ou en veine fémorale (cathéter 10-15 cm). L'ETO est une manière moins invasive et plus sûre de surveiller la précharge. La PVC doit être maintenue à environ 15 mmHg.
- Monitorage recommandé: SpO2, ECG, cathéter artériel, pression veineuse, PetCO2, ScO2, ETO. L’ETO permet de juger si le remplissage du ventricule systémique est adéquat indépendamment de la valeur de la PVC. En fin d’intervention, un cathéter transthoracique dans l’OG permet de calculer le gradient transpulmonaire (PVC – POG).
- Pour l’induction, plusieurs possibilités se présentent.
- La kétamine (1-2 mg/kg iv) assure la stabilité hémodynamique grâce à sa stimulation sympathique centrale, mais elle a un effect cardiodépresseur direct sur le myocarde; chez l’enfant, elle n’augmente pas les RAP pour autant que la ventilation et l'oxygénation sont assurées.
- Le midazolam (0.1 mg/kg) baisse sensiblement la précharge, ce qui diminue le débit pulmonaire et approfondit la cyanose.
- Le propofol abaisse excessivement la précharge. Ce n'est pas un choix judicieux.
- Dans les cas très instables, l’etomidate (0.3 mg/kg) reste l’agent le plus sûr.
- Le fentanyl (10-25 mcg/kg) et le sufentanil (0.5-2.5 mcg/kg) tendent à bloquer l’augmentation des RAP et permettent de diminuer les doses d’agents d’induction, donc de restreindre leurs effets hémodynamiques.
- Le sevoflurane au masque est une technique adéquate en l’absence de voie veineuse.
- A l'induction, il est judicieux d'administrer un bolus de cristalloïde (10-15 mL/kg) pour prévenir toute baisse de précharge liée à l'anesthésie [26].
- Si un soutien inotrope est requis, le choix se porte de préférence sur la combinaison adrénaline – milrinone.
- Dans le postopératoire, la respiration spontanée doit reprendre le plus rapidement possible. Le malade est maintenu assis.
| Circulation de Fontan |
|
Caractéristiques :
- Court-circuit du VD par dérivation VCS + VCI directement dans l’AP
- Flux pulmonaire diminué (Qp ↓) ; pression motrice : PVC
- Pression de perfusion pulmonaire : PVC – POG (ΔP min : 8-10 mmHg)
- SpO2 normale : 90-95%
Conditions de fonctionnement :
- PVC ≥ 15 mmHg
- POG ≤ 8 mmHg
- RAP basses
- P intrathoracique basse
- Fonction VG et valve auriculo-ventriculaire normales
- Absence d’arythmie
Séquelles : arythmies, stase veineuse, ascite, thrombose, dysfonction VG
Recommandations pour l’anesthésie:
- Ventilation spontanée si possible; éviter toute hypoventilation
- Ventilation: FiO2 ↑, hypocarbie, alcalose, Pmoy intrathoracique basse, pas de PEEP, NO
- Hypovolémie mal tolérée (baisse du débit pulmonaire par baisse de la PVC)
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Décembre 2019
Références
- AKINTURK H, MICHEL-BEHNKE I, VALESKE K, et al. Hybrid transcatheter-surgical palliation : basis for univentricular or biventricular repair : the Giessen experience. Pediatr Cardiol 2007 ; 28 :79-87
- BALAJI S, GEWILLIG M, BULL C, et al. Arrhythmias after Fontan procedure: comparison of total cavopulmonary connection to atriopulmonary connection. Circulation 1991; 84(Suppl III):162-7
- BARNEA O, SANTAMORE WP, ROSSI A, et al. Estimation of oxygen delivery in newborns with a univentricular circulation, Circulation 1998; 98:1407-13
- CALDARONE CA, BENSON L, HOLTBY H, et al. Initial experience with hybrid palliation for neonates with single-ventricle physiology. Ann Thorac Surg 2007 ; 84 :1294-300
- CHARPIE JR, DEKEON MK, GOLDBERG CS, et al. Serial blood lactate measurements predict early outcome after neonatal repair or palliation for complex congenital heart disease J Thorac Cardiovasc Surg 2000; 120:73-80
- CHRISTENSEN RE, GHOLAMI AS, REYNOLDS PI, et al. Anaesthetic management and outcomes after noncardiac surgery in patients with hypoplastic left heart syndrome: a retrospective review. Eur J Anaesthesiol 2012; 29:425-30
- DISSESSA TG, CHILD JS, PERLOFF JK, et al. Systemic venous and pulmonary arterial flow patterns after Fontan’s procedure for tricuspid atresia or single ventricle. Circulation 1984; 70:898-902
- EAGLE SS, DAVES SM. The adult with Fontan physiology: systematic approach to perioperative management for noncardiac surgery. J Cardiothorac Vasc Anesth 2011; 25:320-34
- FONTAN F, KIRKLIN JW, FERNANDEZ G, et al. Outcome after a "perfect" Fontan operation. Circulation 1990; 81:1520-36
- FYFE DA, KLINE CH, SADE RM, GREENE CA, GILETTE PC. The utility of transesophageal echocardiography during and after Fontan operations in small children. Am Heart J 1991; 122:1403-15
- GACA JA, DOUGLAS WI, BARNES SD. Anesthetic implications of the Fontan procedure for single ventricle physiology. Sem Cardiothorac Vasc Anesth 2001 ; 5 :31-9
- GALANTOWICZ M, YATES AR. Improved outcomes with the comprehensive stage 2 procedure after an initial hybrid sate 1. J Thorac Cardiovasc Surg 2016; 151:424-9
- GENTLES TL, MAYER JE Jr, GAUVREAU K, et al. Fontan operation in five hundred consecutive patients: factors influencing early and late outcome. J Thorac Cardiovasc Surg 1997; 114:376-91
- GOLDBERG DJ, FRENCH B, McBRIDE MG, et al. Impact of oral sildenafil on exercise performance in children and young adults after the fontan operation: a randomized, double-blind, placebo-controlled, crossover trial. Circulation 2011; 123:1185-93
- GOTTLIEB EA, ANDROPOULOS D. Anesthesia for the patient with congenital heart disease presenting for noncardiac surgery. Curr Opin Anesthesiol 2013; 26:318-26
- HEHIR DA, DOMINGUEZ TE, BALLWEG JA, et al. Risk factors for interstage death after stage I reconstruction of hypoplastic left heart syndrome and variants. J Thorac Cardiovasc Surg 2008 ; 136 :94-9
- HOFFMAN GM, GHANAYEM NS, KAMPINE JM, et al. Venous saturation and the anaerobic threshold in neonates after Norwood procedure for hypoplastic left heart syndrome. Ann Thorac Surg 2000; 70:1515-20
- HONJO O, Van ARSDELL GS. Cardiovascular procedures : surgical considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1589-608
- HOSEIN RB, CLARK AJ, McGUIRK SP, et al. Factors influencing early and late outcome following the Fontan procedure in the current era. Eur J Cardiothorac Surg 2007; 31:344-53
- HOSKING MP, BEYNEN FM. The modified Fontan procedure: physiologic and anesthetic implications. J Cardiothorac Vasc Anesth 1992; 6:465-7
- KUMAR SP, RUBENSTEIN CS, SIMSIC JM, et al. Lateral tunnel versus extracardiac conduit Fontan procedure: a concurrent comparison. Ann Thorac Surg 2003; 76:1389-97
- LASA JJ, GLATZ AC, DAGA A; et al. Prevalence of arrhythmias late after the Fontan operation. Am J Cardiol 2014; 113:184-8
- LEYVI G, WASNICK JD. Single-ventricle patient: pathophysiology and anesthetic management. J Cardiothorac Vasc Anesth 2010; 24:121-30
- LI J, ZHANG G, McCRINDLE BW, et al. Profiles of hemodynamics and oxygen transport derived by using continuous measured oxygen consumption after the Norwood procedure. J Thorac Cardiovasc Surg 2007; 133:441-8
- MARCELETTI CF, HANLEY FL, MAVROUDIS C, et al. Revisions of previous Fontan connections to total extracardiac cavopulmonary anastomosis: A multicenter experience. J Thorac Cardiovasc Surg 2000; 119:340-6
- NASR VG, DINARDO JA. The pediatric cardiac anesthesia handbook. Oxford: Wiley-Blackwell, 2017, 161-85
- NICOLSON SC, STEVEN JM. Anesthesia for the patient with a single ventricle. In : ANDROPOULOS DA, et al, eds. Anesthesia for congenital heart disease. Oxford: Blackwell-Futura, 2005, 356-72
- NOROSI K, WESSEL A, ALPERS V, et al. Incidence and risk distribution of heart failure in adolescents and adults with congenital heart disease after cardiac surgery. Am J Cradiol 2006; 97:1238-43
- OHYE RG, SCHRANZ D, D'UDEKEM Y. Current therapy for hypoplastic left heart syndrome and related single ventricle lesions. Circulation 2016; 134:1265-79
- OHYE RG, SLEEPER LA, MAHONY L, et al. Comparison of shunt types in the Norwood procedure for single-ventricle lesions. N Engl J Med 2010 ; 362 :1980-92
- PUNDI KN, JOHNSON JN, DEARANI JA; et al. 40-year follow-up after the Fontan operation: long-term outcomes of 1'052 patients. J Am Coll Cardiol 2015; 66:621-2
- RIORDAN CJ, RANDSBAEK F, STOREY JH, et al. Inotropes in the hypoplastic left heart syndrome : effects in an animal model. Ann Thorac Surg 1996 ; 62 :83-90
- RYCHIK J, ATZ AM, CELERMAJER D, et al. Evaluation and management of the child and adult with Fontan circulation. A Scientific Statement of the American Heart Association. Circulation 2019; 140:e234-e284
- RYCHIK J, GOLDBERG DJ. Late consequences of the Fontan operation. Circulation 2014;130:1525-8
- SCHILLING C, DALZIEL K, NUNN R, et al. The Fontan epidemic: population projections from the Australia and New Zealand Fontan Registry. Int J Cardiol 2016; 219:14-9
- SCHRANZ D, BAUER A, REICH B, et al. Fifteen year single-center experience with the "Giessen hybrid" approach for hypoplastic left heart and variants: current strategies and outcomes. Pediatr Cardiol 2015; 36:365-73
- SIMPSON KE, PRUITT E, KIRKLIN JK, et al. Fontan patient survival after pediatric heart transplantation has improved in the current era. Ann Thorac Surg 2017; 103:1315-20
- STAMM C, FRIEHS I, MAYER JE, et al. Long-term results of the lateral tunnel Fontan operation. J Thorac Cardiovasc Surg 2000; 121:28-41
- TABBUTT S, RAMAMOORTHY C, MONTENEGRO LM, et al. Impact of inspired gaz mixtures on preoperative infants with hypoplastic left heart syndrome during controlled ventilation. Circulation 2001 ; 104 :1159-64
- D’UDEKEM Y, IYENGAR AJ, COCHRANE AD, et al. The Fontan procedure: contemporary techniques have improved long-term outcomes. Circulation 2007; 116:157-64
- VAN NIEUWENHUIZEN RC, PETERS M, LUBBERS TJ, ET AL. Abnormalities in liver function and coagulation profile following the Fontan procedure. Heart11999; 82:40-6
- VARMA C, WARR MR, HENDLER AL, et al. Prevalence of "silent" pulmonary emboli in adults after the Fontan operation. J Am Coll Cardiol 2003; 41:2252-8
- WEINSTEIN S, GAYNOR JW, BRIDGES ND, et al. Early survival of infants weighing 2.5 kilograms or less undergoing first-stage reconstruction for hypoplastic left heart syndrome. Circulation 1999; 100:II167-70
- WINDSOR J, TOWNSLEY MM, BRISTON D, et al. Fontan palliation for single-ventricle physiology: perioperative management for noncardiac surgery and analysis of outcomes. J Cardiothorac Vasc Anesth 2017; 31:2296-303
