Plastie aortique
La plastie est une option qui est de plus en plus partiquée dans les centres spécialisés lors d’insuffisance aortique due au prolapsus d’une cuspide ou à la dilatation de l’anneau par une maladie de la racine de l’aorte. Le but est de restaurer l’anatomie et la fonction de tous les composants de la racine aortique. L’examen ETO avant CEC doit évaluer la faisabilité de la plastie et le mécanisme de l’incompétence valvulaire. Par analogie à la classification des IM, on décrit 3 types d’IA qui définissent le type de reconstruction possible (Figure 11.59) [3,8,19,26].
- Type I : mouvement des cuspides normaux, dilatation de la racine aortique; jet central.
- Type IA : dilatation de la jonction sino-tubulaire;
- Type IB : dilatation des sinus de Valsalva, effacement de la jonction sino-tubulaire, écartement des commissures empêchant la coaptation des cuspides;
- Type IC : dilatation de l’anneau aortique;
- Type ID : perforation de cuspide (jet variable).
- Type II : excès de tissu et de mouvement d’une ou des cuspides, prolapsus; jet excentrique.
- Type III : mouvement restrictif des cuspides, rétraction, fibrose, calcifications; jet variable.
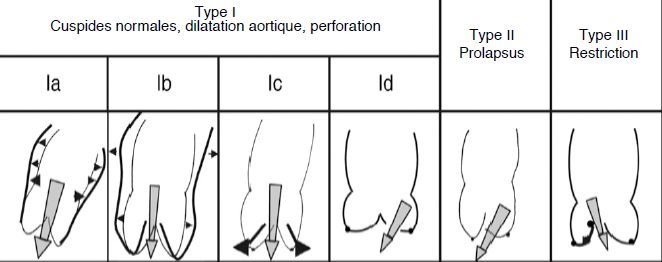
Figure 11.59: Les différents types anatomo-pathologiques d’insuffisance aortique classés selon le degré de mobilité des cuspides, avec l’illustration des mécanismes en cause [8].
Dans le Type I, le type de plastie diffère selon le niveau de l’atteinte anatomique.
- Type IA : remplacement de l’aorte ascendante par un tube de Dacron et remodelage de la jonction sino-tubulaire qui resuspend les commissures (voir Figure 11.143).
- Type IB : remplacement des sinus de Valsalva en épargnant la valve, qui est réimplantée dans la prothèse, réimplantation des coronaires; (voir Figure 11.144) [5].
- Type IC : annuloplastie sous-commissurale (sutures ou bande de Teflon), annuloplastie interne.
- Type ID : patch de la perforation avec du péricarde.
Dans le Type II, la partie prolabante des cuspides est réséquée et suturée ou plicaturée, les bords libres sont resuspendus par une suture au niveau de chaque commissure; l’intervention est en général accompagnée d’une annuloplastie au niveau de l’anneau et/ou de la jonction sino-tubulaire [4,26]. Le Type III, plus difficile, demande une décalcification et une reconstruction des cuspides avec un patch de péricarde ou de valve homologue.
Le taux d’échec de la plastie aortique est supérieur à celui de la plastie mitrale (14% versus 6%) [9,14], et le risque de complications de 12% à 10 ans [1]; le risque de reprise à 5 ans pour récidive de l'IA est de 11% [15]. Mais la mortalité opératoire est inférieure à celle du remplacement valvulaire : < 1% pour la plastie isolée d’une cuspide et 3.4% pour la plastie de la racine aortique [1]. La plastie n’est pas plus difficile dans les bicuspidies, sauf lorsque les cuspides sont fibrosées, calcifiées ou épaissies aux commissures [16] ; mais l’indication est importante parce que les patients sont plus jeunes (exemple vidéo de plastie en cas de bicuspidie).
Vidéo: Prolapsus de la cuspide antérieure dans un cas de bicuspidie aortique, entraînant une régurgitation sévère.
Vidéo: Image de la régurgitation au flux couleur dans le même cas.
Vidéo: Vue long-axe de la plastie aortique dans le cas précédent; absence de fuite résiduelle, affrontement satisfaisant des cuspides en diastole.
Vidéo: Prolapsus de la cuspide antérieure dans un cas de bicuspidie aortique, entraînant une régurgitation sévère.
Vidéo: Image de la régurgitation au flux couleur dans le même cas.
Vidéo: Vue long-axe de la plastie aortique dans le cas précédent; absence de fuite résiduelle, affrontement satisfaisant des cuspides en diastole.
Après correction, l’examen ETO permet de décider si la plastie est un succès ou si une intervention complémentaire est nécessaire. Un bon résultat est caractérisé par (Figure 11.60) [13] :
- Coaptation des cuspides au-dessus du plan de l’anneau aortique en vue long-axe 120°, mais non en-dessous; absence de prolapsus dans la CCVG.
- Hauteur de la zone de coaptation > 0.4 cm.
- Hauteur des cuspides > 0.8 cm (distance entre le point le plus haut de la coaptation et le point d’implantation des cuspides sur l’anneau) ; idéalement, le point le plus haut se situe à mi-hauteur des sinus de Valsalva.
- Mouvement libre des cuspides en systole, cuspides parallèles au flux.
- Insuffisance aortique < mineure.
- ΔPmax en systole < 30 mmHg, ΔPmoy ≤ 15 mmHg.
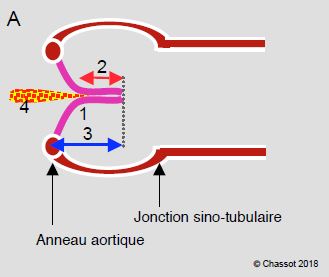
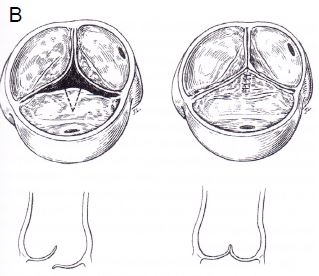
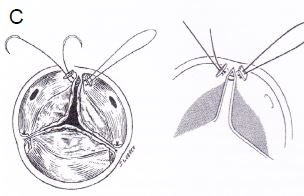
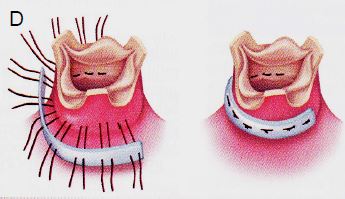
Figure 11.60 : Plastie aortique. A : schéma des conditions d’une plastie réussie ; pas de prolapsus, coaptation en aval (au-dessus) du plan de l’anneau aortique (1), hauteur de coaptation > 4 mm (2, flèche rouge), hauteur des cuspides > 8 mm (3, flèche bleue), IA résiduelle < mineure (4). B : résection triangulaire d’un prolapsus uni-cuspidien et suture de la cuspide. C : resuspension d’une commissure. D : annuloplastie aortique [Braunwald’s Heart Disease, 7th ed, Philadelphia:Elsevier 2005, 1601].
Les éléments suivants sont considérés comme un échec de la plastie et commandent un retour en pompe pour la perfectionner ou pour changer la valve [13].
- IA résiduelle plus que mineure;
- Niveau de coaptation des cuspides en dessous du plan de l’anneau aortique;
- Hauteur de coaptation du bord libre des cuspides de ≤ 0.4 cm;
- Gradient excessif : ΔPmax > 30 mmHg, ΔPmoy > 15 mmHg.
Lors de réimplantation des coronaires, il est important de contrôler la présence d’un flux dans la racine des deux troncs au Doppler couleur, et de rechercher une éventuelle altération de la cinétique segmentaire signant une ischémie tronculaire.
| Plastie valvulaire aortique (PVA) |
|
Une valvuloplastie, faisable dans 60% des insuffisances aortiques, est toujours préférable à un remplacement parce qu'elle rétablit l'anatomie normale. Avantages par rapport à une prothèse:
- Absence d’anticoagulation
- Très faibles risques mécaniques et infectieux
- Mortalité opératoire trois fois plus basse (1-2%) ; si plastie de la racine de l’aorte : 3-4%
- Reprise à 10 ans : 12%
La PVA consiste en réfection de la racine de l’aorte, annuloplastie externe, résection et resuspension des cuspides.
Critère de faisabilité d’une plastie aortique :
- Dilatation de l’anneau aortique ou de la racine de l’aorte mais cuspides normales
- Prolapsus d’une ou plusieurs cuspides
- Pas de restriction ni de calcifications
- La bicuspidie n’est pas une contre-indication
Critères de réussite d’une plastie aortique (examen post-CEC, taux d’échec moyen 14%) :
- IA résiduelle nulle ou mineure (PAM > 80 mmHg, fonction VG satisfaisante)
- Affrontement adéquat des feuillets en aval de l’anneau (hauteur de coaptation > 4 mm) pas de prolapsus, hauteur des cuspides > 8 mm
- Gradient antérograde moyen ≤ 10 mmHg
|
Plastie tricuspidienne
La présence d’une IT résiduelle modérée à sévère péjore le pronostic de toute intervention cardiaque et tend à s’aggraver ultérieurement malgré la correction des valvulopathies gauches [17,22]. De ce fait, les indications à la plastie tricuspidienne sont larges et souvent posées en fonction de l’examen ETO peropératoire (voir Pathologie tricuspidienne, Indications et résultats opératoires) [2,7,18,21,24,25].
- IT sévère symptomatique d’origine organique ou fonctionnelle ne répondant pas au traitement médical;
- IT primaire sévère même asymptomatique avec dilatation du VD et signes de dysfonction droite progressive;
- IT primaire ou secondaire sévère chez les malades requérant une chirurgie valvulaire gauche;
- IT modérée ou sévère avec dilatation annulaire importante (diamètre > 4.0 cm en 4-cavités ou > 7.0 cm dans le champ opératoire) chez les malades requérant une chirurgie sur le cœur gauche;
- IT sévère traumatique, même si asymptomatique (non en urgence).
Plusieurs techniques de correction sont à disposition de l’opérateur (VIdéo et Figure 11.61) (voir Figure 11.159) [24].
Vidéo: Plastie tricuspidienne d'une rupture traumatique de cordages du feuillet antérieur; absence de fuite résiduelle en systole et d'effet sténosant en diastole (pas d'aliasing au flux couleur).
Vidéo: Plastie tricuspidienne d'une rupture traumatique de cordages du feuillet antérieur; absence de fuite résiduelle en systole et d'effet sténosant en diastole (pas d'aliasing au flux couleur).
- Annuloplastie par sutures de rétrécissement le long de l'insertion des feuillets antérieur et postérieur (plastie selon DeVega).
- Plicature de l'anneau dans sa partie postérieure, qui oblitère complètement le feuillet postérieur et transforme la tricuspide en valve à deux feuillets (bicuspidisation selon Kay).
- Plastie par insertion d'un anneau semi-rigide (Carpentier) ou d'un anneau reproduisant la forme en selle (MC3); cet anneau est interrompu au niveau septal pour éviter les lésions du noeud auriculo-ventriculaire et du faisceau de His.
- Suture commune de l'extrémité des 3 feuillets transformant la valve en une forme de trèfle à 3 feuilles en diastole (analogue à la technique d'Alfieri pour la mitrale).
- Réimplantation de cordages en cas de rupture ; résection de prolapsus (Vidéo).
Vidéo: Image après plastie tricuspidienne pour prolapsus du feuillet postérieur; fuite résiduelle minime, absence d'effet sténosant (pas d'aliaising au flux couleur diastolique).
- Chez les malades qui ont un bloc de conduction, on implante une électrode épicardique en même temps que la prothèse tricuspidienne, car il sera ultérieurement impossible ou contre-indiqué de passer une électrode de pace-maker à travers celle-ci.
- En cas d'échec: remplacement de la valve par une prothèse. On implante une bioprothèses plutôt qu’une prothèse mécanique car leur survie est identique. En effet, le stress est moins important dans le cœur droit que dans le cœur gauche, raison pour laquelle les bioprothèses ont une durée de vie plus longue en position tricuspidienne qu’en position mitrale ou aortique [6,11]. D’autre part, les prothèses mécaniques ont un taux de thrombose beaucoup plus élevé parce que le flux est à un régime de pression très basse.
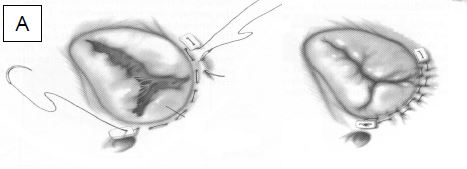
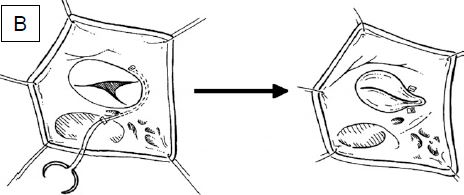
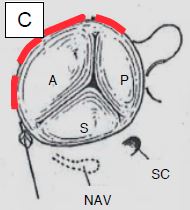
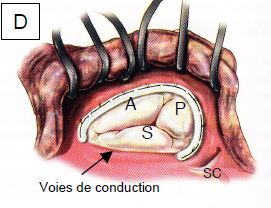
Figure 11.61 : Plastie tricuspidienne vue par une atriotomie de l’OD comme elle se présente dans le champ opératoire. A: annuloplastie postérieure. B: bicuspidalisation selon Kay. C : plastie selon De Vega ; des points coulissants sont disposés sur l’anneau, de la commissure antéro-septale à la commissure postéro-septale ; ils permettent de le rétrécir à volonté en le calibrant avec une jauge 27 [20]. D : anneau prothétique tricuspidien ; il est interrompu au niveau du septum pour éviter de léser les voies de conduction lors de sa mise en place [Savage RM, ed. Intraoperative transesophageal echocardiography. Philadelphia : Lippincott Williams & Wilkins, 2005, 440]. NAV : nœud atrio-ventriculaire. SC : sinus coronaire. A : feuillet antérieur. P : feuillet postérieur. S : feuillet septal.
Après correction, le gradient moyen à travers la tricuspide doit rester < 3 mmHg [10]. Le taux d’échec moyen des plasties est de 14% [20]. Les résultats fonctionnels sont meilleurs (85% des cas sans reprise à 10 ans) et la survie à 15 ans doublée avec une annuloplastie prothétique par rapport à une simple plastie selon De Vega [23]. Les conditions de réussite d’une plastie tricuspidienne sont [12,23]:
- IT résiduelle mineure;
- ΔPmoy < 3 mmHg;
- Vena contracta < 0.3 cm;
- Absence de PISA et de reflux systolique dans la VCI et les veines sus-hépatiques.
La plastie est toujours préférable au remplacement valvulaire, car les résultats de ce dernier sont inférieurs : taux d’insuffisance droite postopératoire plus élevé (28% versus 9%), mortalité augmentée (11% versus 4-7%), anticoagulation, risque de thrombose (1%/an) [22,23,27]. La prothèse représente un élément mécanique rigide qui bloque la contraction circulaire de la base du VD et limite sa contraction longitudinale [20]. Or la dysfonction ventriculaire droite est le déterminant majeur de la mortalité postopératoire ; elle a davantage de poids que l’hypertension pulmonaire [21].
| Plastie valvulaire tricuspidienne (PVT) |
|
En cas d’IT secondaire, la PVT consiste en sutures espacées restrictives de l’anneau (De Vega) ou en pose d’un anneau prothétique. En cas d’IT primaire : résection selon besoin, pose d’un anneau.
Indications à la PVT :
- IT sévère symptomatique (insuffisance droite)
- IT modérée-à-sévère si secondaire à une valvulopathie gauche corrigée chirurgicalement
- IT modérée-à-sévère si dilatation de l’anneau (> 2.8 cm en vue 4-cavités) au cours d'une opération sur le cœur gauche
- IT traumatique sévère, même si asymptomatique (pas en urgence)
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- AICHER D, FRIES R, RODIONYCHEVA S, et al. Aortic valve repair leads to a low incidence of valve-related comnplications. Eur J Cardiothorac Surg 2010; 37:127-32
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BOODHWANI MJ, DE KERCHOVE L, GLINEUR D, et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. J Thorac Cardiovasc Surg 2009; 137:286-94
- COSGROVE DM, ROSENKRANZ ER, HENDREN WG, et al. Valvuloplasty for aortic insufficiency. J Thorac Cardiovasc Surg 1991; 102:571-7
- DAVID TE. Aortic valve sparing in different aortic valve and aortic root conditions. J Am Coll Cardiol 2016; 68:654-64
- DEL CAMPO C, SHERMAN JR. Tricuspid valve replacement: Results conmparing mechanical and biological prostheses. Ann Thorac Surg 2000; 69:1295-303
- DREYFUS GD, CORBI PJ, CHAN KM, et al. Secondary tricuspid regurgitation or dilatation: which should be the criteria for surgical repair ? Ann THorac Surg 2005; 79:127-32
- EL KHOURY G, GLINEUR D, RUBAY J, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21
- GRIMM RA, STEWART WJ. The role of intraoperative echocardiography in valve surgery. Cardiol Clin 1998; 16:477-89
- HAHN RT. State-of-the-art review of echocardiographic imaging in the evaluation and treatment of functional tricuspid regurgitation. Circ Cardiovasc Imaging 2016; 9:e005332
- KUNADIAN B, VIJAYALAKSHMI K, BALASUBRAMANIAN S, et al. Should the tricuspid valve be replaced with a mechanical or biological valve ? Interact Cardiovasc Thorac Surg 2007; 6:551-7
- KUWAKI K, MORISHITA K, TSUKAMOTO M, et al. Tricuspid valve surgery for functional tricuspid valve regurgitation associated with left-sided valvular disease. Eur J Cardiothorac Surg 2001; 20:577-8
- LE POLAIN DE WAROUX JB, POULEUR AC, ROBERT A, et al. Mechanisms of recurrent aortic regurgitation after aortic valve repair. Predictive value of transesophageal echocardiography. JACC Cardiovasc Imaging 2009; 2:931-9
- MAZZUCOTELLI JP, DELEUZE PH, BEAUFRETON C, et al. Preservation of the aortic valve in acute aortic dissection: long-term echocardiographic assessment and clinical outcome. Ann Thorac Surg 1993; 55.1513-17
- MINAKATA K, SCHAFF HV, ZEHR KJ, et al. Is repair of aortic valve regurgitation a safe alternative to valve replacement ? J Thorac Cardiovasc Surg 2004; 127:645-53
- NASH PJ, VITVITSKY E, LI J, et al. Feasibility of valve repair for regurgitant bicuspid aortic valves – An echocardiographic study. Ann Thorac Surg 2005; 79:1473-9
- NATH J, FOSTER E, HEIDENREICH PA. Impact of tricuspid regurgitation on long-term survival. J Am Coll Cardiol 2004; 43:405-9
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- PRODROMO J, D'ANCONNA G, AMADUCCI A, et al. Aortic valve repair fort aortic insufficiency: a review. J Cardiothorac Vasc Anesth 2012; 26:923-32
- ROGERS JH, BOLLING SF. The tricuspid valve. Current perspective and evolving management of tricuspid regurgitation. Circulation 2009; 119:2718-25
- SHIRAN A, SAGIE A. Tricuspid regurgitation in mitral valve disease. J Am Coll Cardiol 2009; 53:401-8
- SINGH SK, TANG GH, MAGANTI MD, et al. Midterm outcomes of tricuspid valve repair versus replacement for organic tricuspid disease. Ann Thorac Surg 2006; 82:1735-41
- TANG GH, DAVID TE, SINGH SK, et al Tricuspid valve repair with an annuloplasty ring results in improved long-term outcomes. Circulation 2006; 114(suppl I):577-81
- TARAMASSO M, VANERMEN H, MAISANO F,et al. The growing clinical importance of secondary tricuspid regurgitation. J Am Coll Cardiol 2012; 59:703-10
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- VAN DYCK MJ, WATREMEZ C, BOODHWANI M, et al. Transesophageal echocardiography evaluation during aortic valve repair surgery. Anesth Analg 2010; 111:59-70
- ZACK CJ, FENDER EA, CHANDRARASHEKAR P, et al. National trends and outcomes in isolated tricuspid valve surgery. J Am Coll Cardiol 2017; 70:2953-60
